This study intends to provide a quick, easy, and inexpensive way to assess nuclear abnormalities such as micronuclei and bud frequencies; binucleated, karyorrhectic, karyolytic, pycnotic, and condensed chromatin cells in nasal scrapings of infants, which are particularly important for conducting genotoxic studies related to the inhaled atmosphere in pediatric populations.
MethodsNasal swab samples were collected from 40 infants under 12 months of age using a small cytobrush. 2,000 cells from each infant sample were analyzed and classified according to the frequency of nuclear abnormalities.
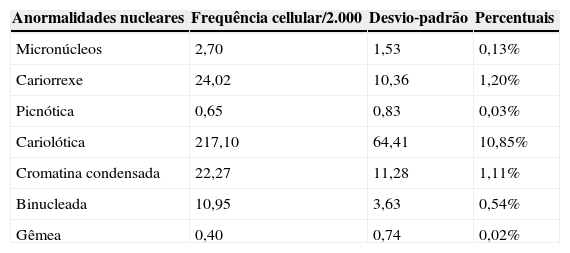
ResultsRates of nuclear abnormalities found agree with values reported in other studies of neonates and children. This study found 0.13% of cells with micronuclei; 1.20% karyorrhexis; 0.03% pyknosis; 10.85% karyolysis; 1.11% condensed chromatin; 0.54 binucleated cells; and 0.02% nuclear bud. Differences were not observed between genders or environmental passive smoking, nor was any age correlation found.
ConclusionThe assay proposed here is suitable for assessing the frequency of nuclear abnormalities from nasal cells in infants.
Este estudo pretendeu fornecer uma forma rápida, fácil e barata de avaliar anormalidades nucleares, como frequências de micronúcleos e gêmea, células binucleadas, cariorréticas, cariolíticas, picnóticas e com cromatina condensada, em esfregados nasais de neonatos, o que é particularmente importante para a realização de estudos genotóxicos relacionados ao ar inalado nas populações pediátricas.
MétodosForam coletadas amostras de esfregaço nasal de 40 neonatos com menos de 12 meses de idade, utilizando uma pequena escova citológica. Foram analisadas 2.000 células da amostra de cada neonato e classificadas de acordo com a frequência de anormalidades nucleares.
ResultadosAs taxas de anormalidades nucleares encontradas neste estudo são compatíveis com os valores relatados em outros estudos de neonatos e crianças. Encontramos 0,13% de células com micronúcleos, 1,20% com cariorrexe, 0,03% com picnose, 10,85% com cariólise, 1,11% com cromatina condensada, 0,54 com células binucleadas e 0,02% com células nucleares gêmeas. Não observamos diferenças entre os gêneros, tabagismo passivo e nenhuma correlação entre idades.
ConclusãoO ensaio proposto neste estudo é adequado para avaliar a frequência de anormalidades nucleares de células nasais em neonatos.
O estudo dos efeitos do impacto ambiental sobre exposições visa quantificar os agentes presentes no ambiente para investigar seu efeito sobre a ocorrência de doenças crônicas em indivíduos expostos e esclarecer os vários mecanismos pelos quais esses processos ocorrem. Nesse sentido, tem havido um esforço cada vez maior em todo o mundo para determinar o impacto dos fatores ambientais, genéticos e de estilo de vida sobre a estabilidade genômica.
Tanto em adultos quanto em crianças, os índices de avaliação que refletem danos no DNA, como a presença de micronúcleos (MN), têm se mostrado uma ferramenta útil e podem monitorar suas variações em mudanças acidentais cada vez maiores, relacionadas a fatores ambientais e de estilo de vida. É importante focar principalmente em crianças ou neonatos, porque eles podem ter uma maior sensibilidade a agentes genotóxicos em comparação aos adultos. Adicionalmente, danos genéticos em idades precoces podem afetar o risco, durante a vida, de resultados adversos à saúde. Consequentemente, o método de ensaio de micronúcleos tem sido amplamente utilizado para estudar os danos genéticos em crianças após exposições dentro do útero e pós‐natais em uma variedade de ambientes rurais e urbanos como resultado de tabagismo materno e superexposições industriais ou tecnológicas acidentais.1–3
Por meio de um levantamento da literatura atual, observamos que a frequência de anormalidades nucleares é muito baixa no nascimento. Contudo, em casos de exposição, o aumento é muito mais acentuado em comparação a adultos. Isso confirma a ideia de que há maior sensibilidade entre as crianças expostas. Os estudos mostraram aumentos significativos na frequência de MN e de outras anormalidades nucleares em casos de crianças expostas à fumaça de cigarro em ambientes fechados, residências próximas a depósitos de produtos químicos, água contaminada com arsênico e metais pesados, além de poluentes industriais. Apesar disso, a ação em longo prazo de determinadas doenças crônicas e tratamentos fortes, como a quimioterapia, ainda não foi conceituada.
O uso de MN como uma medida de danos cromossômicos foi proposto pela primeira vez por Countryman e Heddle (1976)4 em linfócitos de sangue, sendo o método de escolha para avaliação da genotoxicidade em populações humanas.5 Contudo, a maioria dos outros investigadores estava interessada nas análises de células esfoliadas da mucosa bucal ou nasal para coletar dados para pesquisas de exposição ocupacional.6 Os autores sugeriram a adequação desses lugares de coleta, porque os mesmos estão em contato direto com agentes ambientais nocivos e a coleta pode ser feita de forma não invasiva, o que é particularmente importante ao realizar estudos envolvendo crianças. Em células esfoliadas, a presença de MN indica corpos citoplasmáticos extranucleares associados a aberrações cromossômicas. Estas são induzidas por uma variedade de substâncias, inclusive compostos carcinogênicos presentes na fumaça de cigarro. A indução de células com MN por agentes cancerígenos e mutagênicos é um sinal do efeito genotóxico dessas substâncias.7
Por meio do ensaio de micronúcleos em células esfoliadas também é possível avaliar algumas anormalidades nucleares, como ruptura ou perda de material genético pela medição da presença de MB ou células nucleares gêmeas (também conhecidas como “ovos quebrados”), defeitos de citocinese representados por células binucleadas e morte celular quando apresentando pouquíssimos núcleos (picnose) ou cromatina condensada, ou mesmo perda total de seus materiais nucleares (chamados células cariorréticas e cariolíticas).8
Apesar de haver vários estudos a respeito dos efeitos ambientais sobre células esfoliadas, são raros aqueles que avaliam a presença de células com MN ou outras anormalidades nucleares no epitélio nasal, especificamente em crianças ou neonatos. Contudo, indivíduos nessas faixas etárias foram o alvo de vários estudos avaliando danos no DNA em células bucais esfoliadas e/ou linfócitos de sangue periférico em situações específicas de exposição, como radiação ionizante9 ou queima de biomassa,10 ou casos de síndrome de Down.11 Outros utilizaram coleta de sangue para avaliar os danos ao DNA em crianças saudáveis.12
Em um estudo recente, não foi observado aumento de anomalias que refletem dano cromossômico (micronúcleos, células binucleadas, células nucleares gêmeas), porém foram encontradas taxas significativamente maiores de aberrações nucleares que indicam citotoxicidade (cariólise, cariorrexe, cromatina condensada) nos trabalhadores que participaram desse estudo. Esses efeitos foram mais acentuados nas células nasais que nas células bucais.13
Atualmente, os poucos estudos existentes mostraram resultados inconclusivos sobre a toxicidade citogenética em humanos devido a diferentes níveis de exposição, fatores enganosos e diferenças de protocolo dentre os laboratórios. Assim, considerando a importância de avaliar os efeitos do ambiente sobre a saúde, focando principalmente na poluição do ar, com relação a crianças pequenas, e também na necessidade de padronizar um método viável para pesquisar a presença de anormalidades nucleares em células esfoliadas, este estudo pretendeu apresentar uma forma rápida, fácil e barata de avaliar anormalidades nucleares em esfregaços nasais de neonatos.
MétodosApós aprovação do Comitê de Ética (CEP/UFCSPA), foram coletadas amostras de esfregaço nasal de 43 neonatos com menos de 12 meses de idade internados por outras condições não afetando as vias aéreas. Excluímos crianças com doenças associadas subjacentes, como doença cardíaca congênita, imunodeficiência, doença pulmonar crônica, doenças neuromusculares, síndromes citogenéticas, ou que necessitaram de ventilação mecânica.
Foi aplicado um questionário aos pais que acompanharam o neonato no momento da coleta da amostra. As perguntas foram desenvolvidas com base no “Relatório sobre a Epidemia Global de Tabagismo (Global Adult Tobacco Survey – GATS): Questionário com Perguntas Opcionais”,14 criado pela Organização Mundial de Saúde (OMS), validado em 2010, e com mudanças relacionadas à gravidez e exposição infantil à fumaça de cigarro.
A ferramenta de escolha para coleta das amostras foi uma pequena escova citológica, fabricada comercialmente para práticas odontológicas. Esta foi utilizada especificamente devido às suas cerdas de náilon (importante para que a célula se rompa com facilidade) e tamanho adequado para ser inserido nas narinas dessas crianças pequenas, e também para encaixar totalmente em um microtubo. A coleta de células foi feita por residentes em pediatria, sob supervisão de um médico preceptor. As cerdas foram inseridas nas narinas dos neonatos até atingir a concha média, de modo que as cerdas voltadas para o septo nasal dobrassem e as do outro lado ficassem em contato com a asa do nariz. Nessa posição, as cerdas foram giradas na cavidade nasal, a fim de se obter a maior quantidade possível de material celular do referido epitélio. Depois disso, as escovas citológicas foram armazenadas em microtubos contendo 1,0mL de soro fisiológico (0,08 NaCl) e adequadamente identificadas. Os materiais foram mantidos em refrigeração (4° C) por um período máximo de 12 horas.
No laboratório, os microtubos foram centrifugados por 10 minutos a 1.500 rotações por minuto (RPM), passando, a seguir, por três lavagens dos materiais com 1,5mL de solução fixadora de Carnoy (metanol 3:1 ácido acético), mantendo o material sempre suspenso. Na última lavagem, a suspensão do material foi feita com apenas 1,0mL de solução fixadora de Carnoy para concentrar ainda mais as células. No final do processo, foram feitas três lâminas para cada paciente, cada um com aproximadamente 0,3mL do material de suspensão das células. As lâminas foram pré‐lavadas e armazenadas em etanol a 70% para obter melhor aderência. Quando utilizadas, as lâminas foram lavadas novamente com água encanada e depois com água destilada. Enquanto ainda úmidas com água destilada, 0,3mL da solução contendo células em suspensão foi pingado nas lâminas. Após, as mesmas secaram em temperatura ambiente e, mais tarde, foram coradas com solução de Giemsa a 10% em tampão fosfato‐salino (PBS) pH 7,0. Por fim, as lâminas foram lavadas com água encanada e secadas ao ar.
As análises das lâminas foram feitas com um microscópio óptico com magnificação de 400X e 1.000X com a adição de óleo mineral. Apenas as lâminas com células basais e diferenciadas foram consideradas na análise. Foram analisadas 2.000 (duas mil) células basais e diferenciadas da amostra de cada neonato e classificadas de acordo com a frequência de micronúcleos, células nucleares gêmeas, células binucleadas, picnóticas, cariorréticas, cariolíticas e com cromatina condensada, seguindo os critérios de avaliação sugeridos por Knasmueller et al.,8 e Thomas et al.15
A variável estudada afastou‐se significativamente da normalidade, e, portanto, o teste U de Mann–Whitney U não paramétrico foi aplicado aos dados. As associações entre duas variáveis foram analisadas pela correlação de Spearman. O nível de relevância foi considerado em p ≤ 0,05. Todas as análises foram feitas utilizando o pacote estatístico de ciências sociais (SPSS) para Windows (IBM Corp, Armonk, EUA), versão 17.0.
ResultadosA idade dos neonatos variou de 14 dias a 12 meses (média 4,28±3,14 meses). Desses, 28 (70,0%) eram homens. Não foram observadas reações dos neonatos aos procedimentos. Não foram observados casos de irritação. Observamos apenas desconforto no momento da coleta devido ao estranhamento das crianças e, na maior parte dos casos, choro.
A frequência média de anormalidades nucleares é apresentada na tabela 1. Apenas três lâminas foram descartadas por sua baixa celularidade (< 2.000.); então, a análise seguiu com 40 neonatos. Não houve correlação significativa entre anormalidades nucleares e idade (em meses; correlação de Spearman) nem diferenças entre gêneros (teste U de Mann‐Whitney).
Frequência de anormalidades nucleares nas células nasais de neonato
| Anormalidades nucleares | Frequência cellular/2.000 | Desvio‐padrão | Percentuais |
|---|---|---|---|
| Micronúcleos | 2,70 | 1,53 | 0,13% |
| Cariorrexe | 24,02 | 10,36 | 1,20% |
| Picnótica | 0,65 | 0,83 | 0,03% |
| Cariolótica | 217,10 | 64,41 | 10,85% |
| Cromatina condensada | 22,27 | 11,28 | 1,11% |
| Binucleada | 10,95 | 3,63 | 0,54% |
| Gêmea | 0,40 | 0,74 | 0,02% |
Com relação à exposição a tabagismo passivo, de acordo com os dados do questionário, apenas 11 mães relataram tabagismo antes e depois da gravidez, inclusive nove admitiram ter fumado durante a gravidez. Em termos de família, 20 mães relataram haver outros moradores na casa que fumam. A análise estatística (teste U de Mann‐Whitney) também não apresentou diferenças com relação a anormalidades nucleares entre os neonatos que foram expostos passivamente à fumaça de cigarro e aqueles que não foram expostos.
DiscussãoNo contexto da análise de genotoxicidade em humanos, a maior parte dos estudos utiliza análises dos linfócitos de sangue periférico e do epitélio bucal. Reticulócitos ou células nasais raramente são utilizados.1 Em vez disso, avaliamos as células esfoliadas, porque as mesmas têm sido mais utilizadas devido aos métodos de coleta não invasivos e ao fato de que as frequências de anormalidade nucleares refletem diretamente a taxa de danos nos tecidos estudados.15,16 A análise das células nasais por meio do ensaio de micronúcleos mostrou‐se adequada, uma vez que se tornou possível a visualização de todas as células, refletindo, assim, as alterações nucleares.
No presente estudo, as anormalidades nucleares foram facilmente vistas nas células a partir de esfregaços corados com solução de Giemsa a 10% em PBS pH 7,0. Contudo, restos bacterianos e celulares são fatores enganosos que podem mascarar o efeito dos micronúcleos ou das células gêmeas, em comparação a outros testes de coloração, como Papanicolau, Feulgen ou corante de Wright.6,17–19 Contudo, essa dificuldade pode ser resolvida utilizando um microscópio. As bactérias coradas com Giemsa e vistas pela luz do microscópio diferem dos micronúcleos ou das células gêmeas porque parecem mais brilhantes, são menores e ficam agrupadas com uma cor mais forte. Da mesma forma, os restos celulares podem ser diferenciados dos micronúcleos ou das células gêmeas adicionando PBS, que fornece um pH neutro, e também porque os restos reagem de maneira diferente quando corados, em comparação ao núcleo principal.
A frequência das anormalidades nucleares foi de 2.000 células como outros estudos, que analisaram 2.000 células ou mais.19 Apenas três lâminas foram descartadas por sua baixa celularidade (< 2.000). Apesar do menor número de células, este trabalho conseguiu avaliar a presença de anormalidades nucleares em células das cavidades nasais de neonatos, que são menores que as de indivíduos adultos e também porque é mais difícil coletar células em neonatos, pois a escova pode ser inconveniente para as crianças, e as mesmas talvez precisem ser imobilizadas por seus pais.
Vários outros estudos utilizam o ensaio de micronúcleos em populações infantis por meio de métodos invasivos, como amostras de sangue,1,20,21 ou em recém‐nascidos, utilizando sangue do cordão umbilical.22 Apesar de utilizar Giemsa como corante, os achados apresentados neste trabalho correspondem a outros na literatura, considerando comparações com outras crianças mais velhas que já foram expostas de forma mais significativa a fatores ambientais, porque, no momento, nenhum dos estudos associou a presença de MN ou outras anormalidades nucleares no primeiro ano de vida a fatores ambientais.
Hoje, é difícil definir a real relevância biológica das frequências das anormalidades nucleares em neonatos. Comparações a respeito do sexo apenas enfatizam a ausência de diferenças entre homens e mulheres, principalmente entre crianças tão novas e que ainda não são afetadas pela ação de fatores hormonais. Contudo, seu valor preditivo para doença exige estudos que combinem dados de diferentes exposições, como fatores ambientais e estilo de vida dos neonatos e de suas mães.1 Portanto, as frequências das anormalidades nucleares em células nasais de neonatos ainda não foram relacionadas a hábitos de fumo dos moradores de uma mesma residência.
Não existem estudos de células nasais de neonatos, apesar de as taxas de anormalidades nucleares encontradas neste trabalho serem compatíveis com os valores relatados em outros estudos19 de neonatos e crianças (0,13% micronúcleos; 1,20% cariorrexe; 0,03% picnose; 10,85% cariólise; 1,11% cromatina condensada; 0,54 células binucleadas; 0,02% células nucleares gêmeas). Outros autores sugeriram, ao avaliar linfócitos e células bucais, que a frequência de micronúcleos foi baixa no nascimento e aumentou em crianças com 1‐4 anos de idade.23 Segundo os dados da literatura, ainda há controvérsia a respeito da frequência basal de micronúcleos e outras anormalidades nucleares, e a mesma é ainda menos clara quando diz respeito à avaliação em células epiteliais esfoliadas, principalmente com relação à idade e sexo.24
Os níveis médios de micronúcleos em células bucais esfoliadas relatados por dois outros estudos,25,26 em crianças entre 0 a 6 anos de idade, diferiram em mais de 0,2 vezes, sugerindo um importante impacto dos fatores ambientais e da variabilidade técnica sobre a frequência de micronúcleos em células bucais em estudos em humanos. Em outro estudo que envolveu linfócitos e células bucais de crianças e suas mães, nenhuma diferença estatisticamente significativa de idade foi observada devido a uma ampla gama de variabilidade interindividual.15
Os efeitos da poluição no ar atmosférico parecem ser significativos principalmente em crianças, que são mais sensíveis que os adultos, devido ao fato de seus corpos ainda estarem em fase de desenvolvimento.27 Curiosamente, em um estudo com crianças de várias idades, o efeito mais forte da poluição do ar sobre a frequência de micronúcleos foi observado em indivíduos mais jovens.28 Essa observação é compatível com a sensibilidade possivelmente maior das crianças a exposições ambientais.29
Este estudo é o primeiro biomonitoramento infantil para identificar e quantificar anormalidades nucleares em células nasais de neonatos. Os resultados apresentados neste trabalho podem ser precursores de novas perspectivas no entendimento dos efeitos ambientais sobre as células nasais e seus efeitos relacionados a doenças respiratórias na população pediátrica. Apesar de não termos encontrado diferenças nas frequências de anormalidades nucleares entre neonatos expostos à fumaça de cigarro, o ensaio de micronúcleos em células nasais também conseguiu detectar outras anormalidades nucleares.
O ensaio proposto neste estudo é adequado para avaliar a frequência de anormalidades nucleares em neonatos. Portanto, sugerimos a realização de estudos adicionais nesse campo de avaliação para ajudar a estabelecer o valor preditivo das alterações nucleares na elucidação de processos patológicos e monitoramento da população, proporcionando melhores condições de saúde para neonatos e idosos.
Conflitos de interesseOs autores declaram não haver conflitos de interesse.
Como citar este artigo: Mergener M, Rhoden CR, Amantéa SL. Nuclear abnormalities in cells from nasal epithelium: a promising assay to evaluate DNA damage related to air pollution in infants. J Pediatr (Rio J). 2014;90:632–6.
Estudo vinculado à Universidade Federal de Ciências da Saúde de Porto Alegre (UFCSPA), Porto Alegre, RS, Brasil.