To analyze the effects of treatment approach on the outcomes of newborns (birth weight [BW] < 1,000g) with patent ductus arteriosus (PDA), from the Brazilian Neonatal Research Network (BNRN) on: death, bronchopulmonary dysplasia (BPD), severe intraventricular hemorrhage (IVH III/IV), retinopathy of prematurity requiring surgical (ROPsur), necrotizing enterocolitis requiring surgery (NECsur), and death/BPD.
MethodsThis was a multicentric, cohort study, retrospective data collection, including newborns (BW < 1000g) with gestational age (GA) < 33 weeks and echocardiographic diagnosis of PDA, from 16 neonatal units of the BNRN from January 1, 2010 to Dec 31, 2011. Newborns who died or were transferred until the third day of life, and those with presence of congenital malformation or infection were excluded. Groups: G1 – conservative approach (without treatment), G2 – pharmacologic (indomethacin or ibuprofen), G3 – surgical ligation (independent of previous treatment). Factors analyzed: antenatal corticosteroid, cesarean section, BW, GA, 5min. Apgar score < 4, male gender, Score for Neonatal Acute Physiology Perinatal Extension (SNAPPE II), respiratory distress syndrome (RDS), late sepsis (LS), mechanical ventilation (MV), surfactant (< 2h of life), and time of MV. Outcomes: death, O2 dependence at 36 weeks (BPD36wks), IVH III/IV, ROPsur, NECsur, and death/BPD36wks. Statistics: Student's t‐test, chi‐squared test, or Fisher's exact test; Odds ratio (95% CI); logistic binary regression and backward stepwise multiple regression. Software: MedCalc (Medical Calculator) software, version 12.1.4.0. p‐values < 0.05 were considered statistically significant.
Results1,097 newborns were selected and 494 newborns were included: G1 ‐ 187 (37.8%), G2 ‐ 205 (41.5%), and G3 ‐ 102 (20.6%). The highest mortality was observed in G1 (51.3%) and the lowest in G3 (14.7%). The highest frequencies of BPD36wks (70.6%) and ROPsur were observed in G3 (23.5%). The lowest occurrence of death/BPD36wks occurred in G2 (58.0%). Pharmacological (OR 0.29; 95% CI: 0.14‐0.62) and conservative (OR 0.34; 95% CI: 0.14‐0.79) treatments were protective for the outcome death/BPD36wks.
ConclusionThe conservative approach of PDA was associated to high mortality, the surgical approach to the occurrence of BPD36wks and ROPsur, and the pharmacological treatment was protective for the outcome death/BPD36wks.
Analisar os efeitos da terapêutica adotada para o canal arterial (CA) em recém‐nascidos (RN) < 1.000gadmitidos em unidades neonatais (UN) da Rede Brasileira de Pesquisas Neonatais (RBPN), sobre os desfechos: óbito, displasia broncopulmonar (DBP), hemorragia intraventricular grave (HIVIII/IV), retinopatia da prematuridade cirúrgica (ROPcir), enterocolite necrosante cirúrgica (ECNcir) e o desfecho combinado óbito e DBP.
MétodosEstudo multicêntrico, de coorte, coleta de dados retrospectiva, incluindo RN de 16 UN da RBPN de 01/01/2010 a 31/12/2011, PN < 1.000g, idade gestacional (IG) < 33 semanas e diagnóstico ecocardiográfico de PCA. Excluídos: óbitos ou transferências até o terceiro dia de vida, infecções congênitas ou malformações. Grupos:G1 – conservadora (sem intervenção medicamentosa ou cirúrgica), G2 – farmacológica (indometacina ou ibuprofeno) e G3 – cirúrgico (com ou sem tratamento farmacológico anterior). Analisou‐se: uso de esteroide antenatal, parto cesárea, PN, IG, Apgar5’ < 4, sexo masculino, SNAPPE II, síndrome do dDesconforto respiratório (SDR), sepse tardia, ventilação mecânica (VM), surfactante < 2 horas de vida, tempo de VM e os desfechos: óbito, dependência de oxigênio com 36 semanas (DBP36s), HIV III/IV, ROPcir, ECNcir e óbito/DBP36s. Estatística: Teste t‐Student, Qui‐Quadrado ou teste Exato de Fisher. Testes de Regressão Binária Logística e Regressão Múltipla Stepwise Backward. MedCalc (Medical Calculator) software, versão 12.1.4.0.p < 0,05.
ResultadosForam selecionados 1.097 RN e 494 foram incluídos: G1‐187 (37,8%), G2‐205 (41,5%) e G3‐102 (20,6%). Verificou‐se: maior mortalidade (51,3%) no G1 e menor no G3(14,7%); maior frequência DBP36s (70,6%) e ROPcir (23,5%) no G3; maior frequência de óbito/DBP36s no G2 (58,0%). As abordagens farmacológica (OR‐0,29; 95%, IC‐0,14‐0,62) e conservadora (OR‐0,34; 95%, IC‐ 0,14‐0,79) foram protetoras somente para o desfecho óbito/DBP36sem.
ConclusãoEm RN com PCA, a abordagem conservadora relacionou‐se à maior mortalidade, a cirúrgica à ocorrência de DBP36s e ROPcir., enquanto o tratamento farmacológico mostrou‐se protetor para o desfecho óbito/DBP36sem.
A abordagem do canal arterial (CA) no período neonatal tem sido amplamente discutida na literatura, tanto no que se refere ao melhor momento para sua detecção quanto à conduta a ser tomada na presença deste, particularmente em recém‐nascidos pré‐termo (RNPT) de menores pesos de nascimento, tendo em vista suas repercussões sobre a evolução desses recém‐nascidos.
Enquanto no período intrauterino o CA constitui uma estrutura essencial, sendo responsável pelo desvio da circulação pulmonar para a aorta, mantendo o fluxo sanguíneo sistêmico fetal, sua persistência após o nascimento poderá desencadear uma série de eventos, culminando com insuficiência cardíaca.1 Particularmente em RN com peso de nascimento abaixo de 1.000g, a persistência do canal arterial (PCA) com repercussões hemodinâmicas poderá associar‐se a maior morbimortalidade,2 ocasionando maiores riscos de ocorrência de insuficiência cardíaca, tempo de ventilação mecânica, displasia broncopulmonar (DBP),3 hemorragia intraventricular (HIV)4 e enterocolite necrosante (ECN).5
Por outro lado, uma percentagem substancial de CA fechará espontaneamente,6,7 ou poderá permanecer patente sem produzir sintomas significativos.7 Portanto, iniciar o tratamento de forma precoce poderá expor, desnecessariamente, muitos RN aos inibidores de prostaglandinas ou à ligadura cirúrgica de canal, os quais estão associados a efeitos adversos.8 Essa situação poderá ser evitada se for possível identificar os RNPT que apresentam maiores chances de fechar o canal arterial espontaneamente.
As condutas relativas ao manejo do canal arterial em recém‐nascidos prematuros (RNPT) têm sido muito variáveis na literatura, sendo motivo de vários estudos, especialmente naqueles com peso de nascimento (PN) menor do que 1.000 gramas.8
No presente momento, não se dispõe de evidências suficientes para definir qual a melhor abordagem para a PCA em prematuros.9–11 Embora o tratamento medicamentoso, com indometacina ou ibuprofeno, tenha se mostrado eficaz no fechamento do canal arterial, não foi observada uma melhora na evolução quando analisados os eventos óbito, displasia broncopulmonar e enterocolite necrosante. A maioria dos ensaios clínicos publicados enfoca o fechamento do CA com a abordagem medicamentosa ou cirúrgica.12
Tendo em vista o conhecimento atual e as dúvidas existentes em função da opção terapêutica a ser adotada na presença de CA, se conservadora, farmacológica ou cirúrgica, foi realizado este estudo, com o objetivo de analisar os efeitos desta abordagem em RN menores de 1.000g admitidos em unidades neonatais (UN) da Rede Brasileira de Pesquisas Neonatais, em 2010 e 2011, sobre a ocorrência dos seguintes desfechos: óbito, DBP, hemorragia intraventricular grave (HIV III/IV), retinopatia da prematuridade com necessidade de cirurgia (ROPcir), enterocolite necrosante que realizou cirurgia (ECNcir) e o desfecho combinado de óbito e DBP.
MétodosFoi desenvolvido um estudo multicêntrico, de coorte, com levantamento retrospectivo de dados da RBPN, que incluiu RN admitidos nas16 UN da RBPN de 01/01/2010 a 31/12/2011.
Os RN foram selecionados de acordo com os seguintes critérios de inclusão: PN de 400 a 999 gramas, idade gestacional (IG) < 33 semanas e diagnóstico ecocardiográfico de PCA, independentemente de repercussões hemodinâmicas. Foram excluídos os RN que morreram ou foram transferidos até o terceiro dia de vida e os com diagnóstico de infecções congênitas ou malformações.
Os RN incluídos foram subdivididos em grupos de estudo de acordo com a abordagem terapêutica do CA: G1 – abordagem conservadora (sem intervenção medicamentosa ou cirúrgica); G2 – abordagem farmacológica (apenas tratamento com indometacina ou ibuprofeno); e G3 – abordagem cirúrgica (ligadura cirúrgica, independentemente de ter ou não recebido inibidor de prostaglandina previamente).
As variáveis analisadas foram: condições perinatais: uso de esteroide antenatal e parto cesárea; condições de nascimento: peso de nascimento, idade gestacional, adequação do peso de nascimento para a idade gestacional, considerando‐se pequeno para idade gestacional (PIG) os com PN abaixo do percentil 5% da curva de Alexander et al.,13 Apgar 5’ < 4, sexo masculino; evolução neonatal: escore de risco SNAPPE II, síndrome do desconforto respiratório (SDR), sepse neonatal tardia (SNNT) (hemocultura positiva), necessidade de ventilação mecânica, tempo de ventilação mecânica em dias e administração de surfactante até 2 horas de vida; e os desfechos primários: óbito, dependência de oxigênio com 36 semanas (DBP36sem), HIV III/IV segundo a classificação de Papille, ROPcir, ECNcir e o desfecho combinado óbito/DBP36sem.
O projeto de pesquisa foi aprovado pelo Comitê de Ética da Instituição principal (Comitê de Ética para Análise de Projetos de Pesquisa – CAPPesq da Diretoria Clínica do Hospital das Clínicas e da Faculdade de Medicina da Universidade de São Paulo) pelo protocolo de pesquisa n° 1383/09 e, posteriormente, aprovado pelas demais instituições.
Análise estatísticaOs dados categóricos foram apresentados usando a distribuição por frequências, e os dados contínuos por meio de média e desvio‐padrão, quando indicado. Na análise univariada das variáveis categóricas foram utilizados os testes de Qui‐Quadrado ou teste Exato de Fisher, quando indicado, e, para as variáveis contínuas, o Teste t‐Student. Para o cálculo do risco, determinando o odds ratio (95%IC), foram realizados os Testes de Regressão Binária Logística e Regressão Múltipla Stepwise Backward, MedCalc (Medical Calculator) software, versão 12.1.4.0. O nível de significância estatística estabelecido foi de 5% (p < 0,05).
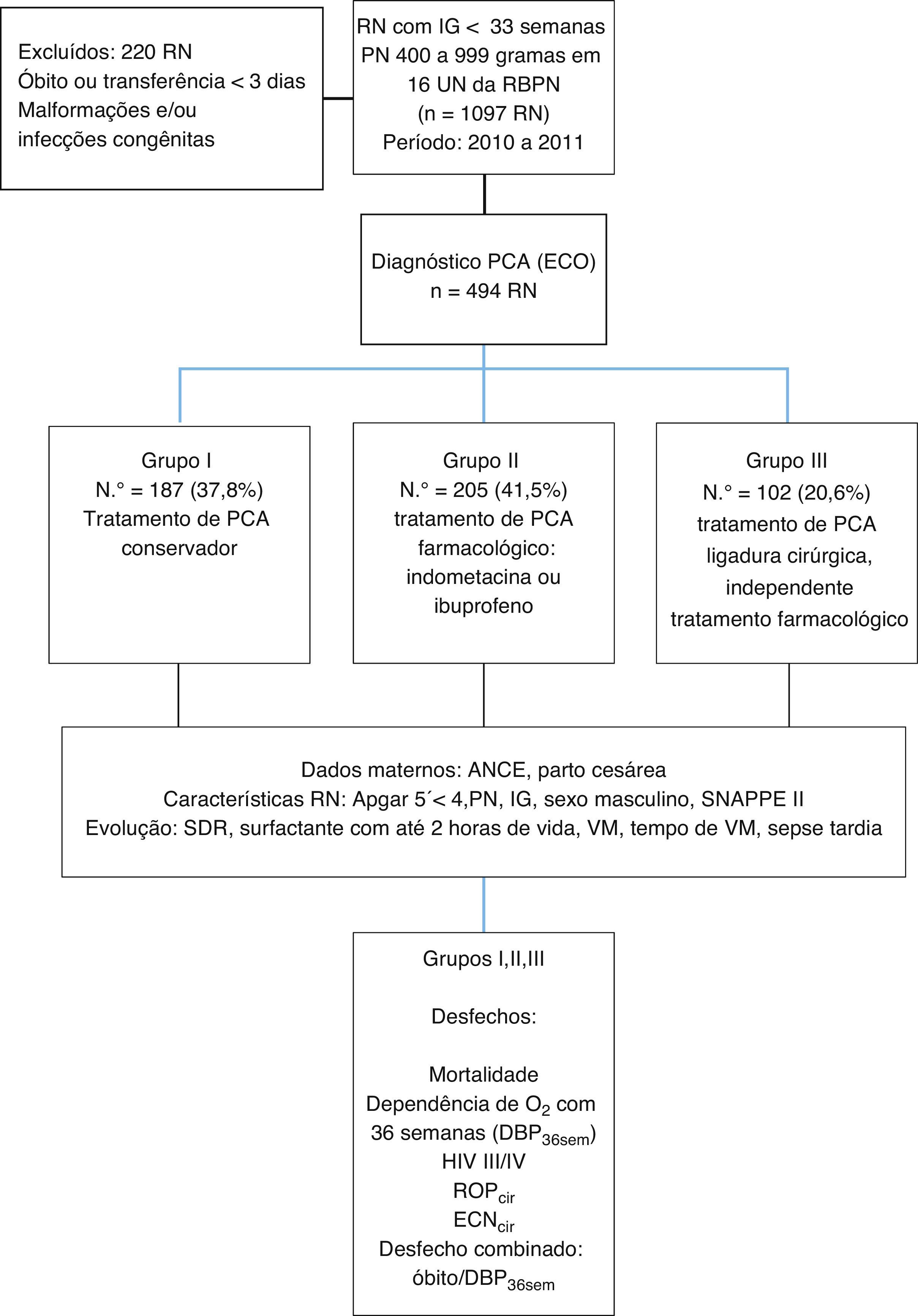
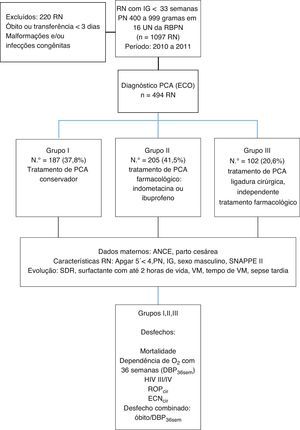
ResultadosForam admitidos, no período de estudo, 1.097 RN com PN 400 a 999g e IG < 33semanas, nas 16 UN da RBPN. Desses, foram excluídos 220 por óbito ou transferência nos primeiros três dias de vida, malformações e infecções congênitas, sendo que 494 RN preencheram os critérios de inclusão, com diagnóstico ecocardiográfico de PCA, sem informações quanto à presença de sintomas.
Os RN foram subdivididos, de acordo com a abordagem terapêutica, em: G1‐187(37,8%), G2‐205(41,5%) e G3‐102(20,6%) (fig. 1).
Desenho do estudo.
RBPN, Rede Brasileira de Pesquisas Neonatais; PCA (ECO), persistência de canal arterial diagnosticado por ecocardiograma; ANCE, uso materno de corticoide antenatal; PN, peso de nascimento; IG, idade gestacional; SNAPPE II, Score for Neonatal Acute Physiology Perinatal Extension; SDR, síndrome do desconforto respiratório; VM, ventilação mecânica; DBP, displasia broncopulmonar; HIV III/IV, hemorragia intraventricular grau III/IV; ROPcir, retinopatia da prematuridade com realização de procedimento cirúrgico; ECNcir, enterocolite necrosante com necessidade de cirurgia.
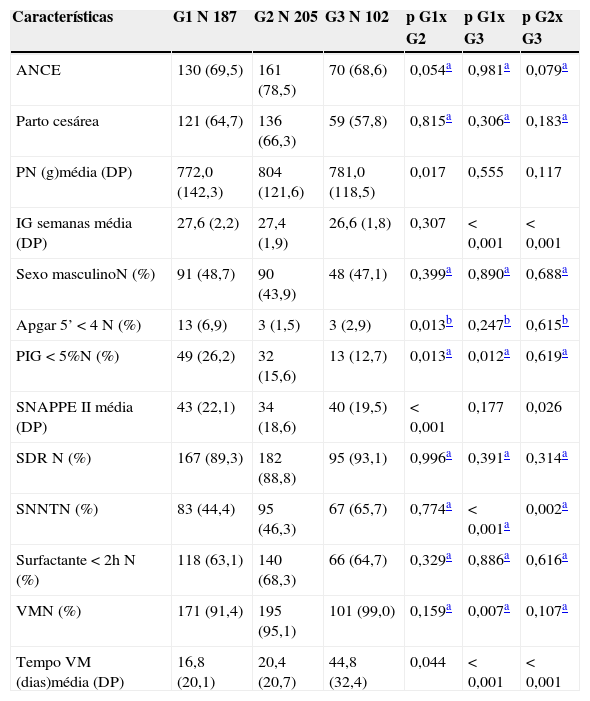
A apresentação das características da população de acordo com cada grupo de estudo encontra‐se na tabela 1, onde se pode observar que houve diferenças entre os grupos em relação à IG, média SNAPPE II, frequência e tempo de ventilação mecânica e ocorrência de SNNT.
Condições de nascimento e evolução intra‐hospitalar da população, de acordo com os grupos de estudo, no período de 2010 e 2011
| Características | G1N 187 | G2N 205 | G3N 102 | p G1x G2 | p G1x G3 | p G2x G3 |
|---|---|---|---|---|---|---|
| ANCE | 130 (69,5) | 161 (78,5) | 70 (68,6) | 0,054a | 0,981a | 0,079a |
| Parto cesárea | 121 (64,7) | 136 (66,3) | 59 (57,8) | 0,815a | 0,306a | 0,183a |
| PN (g)média (DP) | 772,0 (142,3) | 804 (121,6) | 781,0 (118,5) | 0,017 | 0,555 | 0,117 |
| IG semanas média (DP) | 27,6 (2,2) | 27,4 (1,9) | 26,6 (1,8) | 0,307 | < 0,001 | < 0,001 |
| Sexo masculinoN (%) | 91 (48,7) | 90 (43,9) | 48 (47,1) | 0,399a | 0,890a | 0,688a |
| Apgar 5’ < 4N (%) | 13 (6,9) | 3 (1,5) | 3 (2,9) | 0,013b | 0,247b | 0,615b |
| PIG < 5%N (%) | 49 (26,2) | 32 (15,6) | 13 (12,7) | 0,013a | 0,012a | 0,619a |
| SNAPPE II média (DP) | 43 (22,1) | 34 (18,6) | 40 (19,5) | < 0,001 | 0,177 | 0,026 |
| SDR N (%) | 167 (89,3) | 182 (88,8) | 95 (93,1) | 0,996a | 0,391a | 0,314a |
| SNNTN (%) | 83 (44,4) | 95 (46,3) | 67 (65,7) | 0,774a | < 0,001a | 0,002a |
| Surfactante < 2h N (%) | 118 (63,1) | 140 (68,3) | 66 (64,7) | 0,329a | 0,886a | 0,616a |
| VMN (%) | 171 (91,4) | 195 (95,1) | 101 (99,0) | 0,159a | 0,007a | 0,107a |
| Tempo VM (dias)média (DP) | 16,8 (20,1) | 20,4 (20,7) | 44,8 (32,4) | 0,044 | < 0,001 | < 0,001 |
ANCE, uso materno de corticoide antenatal; PN, peso de nascimento; IG, idade gestacional; PIG < 5%, peso de nascimento abaixo do percentil 5% na curva de Alexander et al.13; SNAPPE II, Score for Neonatal Acute Physiology Perinatal Extension; DP, desvio‐padrão; SDR, síndrome do desconforto respiratório; SNNT, sepse neonatal tardia confirmada por hemocultura positiva; surfactante < 2h, administração de surfactante até 2 horas de vida; VM, necessidade de ventilação mecânica.
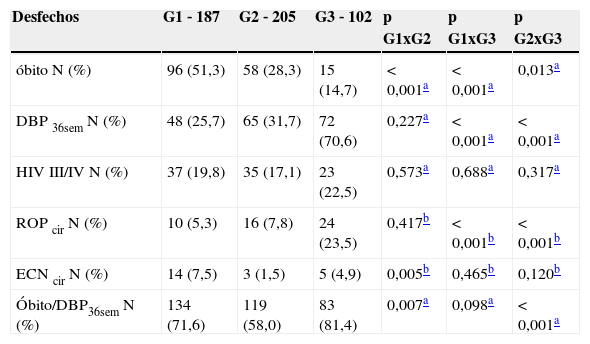
Em relação aos desfechos analisados, verificou‐se que a mortalidade foi mais elevada no G1(51,3%), e menor no G3(14,7%). Já a maior presença de DBP36sem (70,6%) e ROPcir (23,5%) foi observada no G3, enquanto o desfecho combinado óbito/DBP36sem foi menos frequente no G2 (58,0%). Não foi possível analisar os efeitos da terapêutica utilizada sobre a ocorrência de ECNcir, pelo número muito reduzido de casos, embora tenha sido verificada diferença estatisticamente significante entre G1 e G2 (tabela 2).
Análise univariada dos desfechos analisados, de acordo com os grupos estudados
| Desfechos | G1 ‐ 187 | G2 ‐ 205 | G3 ‐ 102 | p G1xG2 | p G1xG3 | p G2xG3 |
|---|---|---|---|---|---|---|
| óbito N (%) | 96 (51,3) | 58 (28,3) | 15 (14,7) | < 0,001a | < 0,001a | 0,013a |
| DBP 36sem N (%) | 48 (25,7) | 65 (31,7) | 72 (70,6) | 0,227a | < 0,001a | < 0,001a |
| HIV III/IV N (%) | 37 (19,8) | 35 (17,1) | 23 (22,5) | 0,573a | 0,688a | 0,317a |
| ROP cir N (%) | 10 (5,3) | 16 (7,8) | 24 (23,5) | 0,417b | < 0,001b | < 0,001b |
| ECN cir N (%) | 14 (7,5) | 3 (1,5) | 5 (4,9) | 0,005b | 0,465b | 0,120b |
| Óbito/DBP36sem N (%) | 134 (71,6) | 119 (58,0) | 83 (81,4) | 0,007a | 0,098a | < 0,001a |
DBP 36sem, displasia broncopulmonar com dependência de oxigênio com 36 semanas de idade gestacional corrigida; HIV III/IV, hemorragia intraventricular grau III e IV; ROPcir, retinopatia da prematuridade que necessitou de intervenção cirúrgica; ECN cir, enterocolite necrosante que necessitou de intervenção cirúrgica; Óbito/DBP36sem, desfecho combinado óbito e DBP36sem.
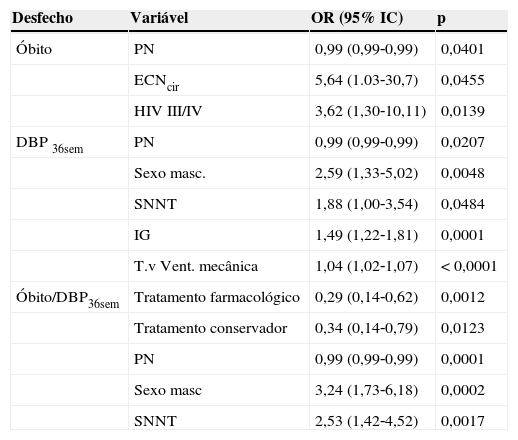
Pela análise de regressão multivariada, não foi detectada influência do tipo de abordagem terapêutica sobre a evolução para óbito ou a ocorrência de DBP36sem isoladamente, mas somente para o desfecho combinado óbito/DBP36sem. No entanto, foram identificados como fatores de risco para o desfecho óbito a ECNcir (OR 5,64; 95%IC 1,03‐30,7) e a HIV‐III/IV (OR 3,62; 95%IC 1,30‐10,11). Já o sexo masculino (OR 2,59; 95%IC 1,33‐5,02), SNNT (OR 1,88; 95%IC 1,00‐3,54), IG (OR 1,49; 95%IC 1,22‐1,81) e T. Vent. Mec. (OR1,04; 95%IC 1,02‐ 1,07) foram os fatores relacionados à presença de DBP36sem. O PN foi protetor para os desfechos óbito e DBP36sem (OR 0,99; 95%IC 0,99‐0,99), isoladamente (tabela 3).
Fatores de risco identificados para os desfechos analisados por Regressão Múltipla Stepwise Backword
| Desfecho | Variável | OR (95% IC) | p |
|---|---|---|---|
| Óbito | PN | 0,99 (0,99‐0,99) | 0,0401 |
| ECNcir | 5,64 (1.03‐30,7) | 0,0455 | |
| HIV III/IV | 3,62 (1,30‐10,11) | 0,0139 | |
| DBP 36sem | PN | 0,99 (0,99‐0,99) | 0,0207 |
| Sexo masc. | 2,59 (1,33‐5,02) | 0,0048 | |
| SNNT | 1,88 (1,00‐3,54) | 0,0484 | |
| IG | 1,49 (1,22‐1,81) | 0,0001 | |
| T.v Vent. mecânica | 1,04 (1,02‐1,07) | < 0,0001 | |
| Óbito/DBP36sem | Tratamento farmacológico | 0,29 (0,14‐0,62) | 0,0012 |
| Tratamento conservador | 0,34 (0,14‐0,79) | 0,0123 | |
| PN | 0,99 (0,99‐0,99) | 0,0001 | |
| Sexo masc | 3,24 (1,73‐6,18) | 0,0002 | |
| SNNT | 2,53 (1,42‐4,52) | 0,0017 |
ECNcir, enterocolite necrosante que necessitou de intervenção cirúrgica; HIV III/IV, hemorragia intraventricular graus III e IV; DBP36sem, displasia broncopulmonar com dependência de oxigênio com 36 semanas de idade gestacional corrigida; PN, peso de nascimento; sexo masc, sexo masculino; IG, idade gestacional ao nascer; Tempo VM, tempo de ventilação mecânica; óbito/DBP36sem, desfecho combinado de óbito ou displasia broncopulmonar com dependência de oxigênio com 36 semanas de idade gestacional corrigida; SNNT, sepse neonatal tardia; OR, odds ratio; IC, intervalo de confiança.
Em relação ao desfecho combinado ÓBITO/DBP36sem, foram detectados como fatores de risco o sexo masculino (OR 3,24; 95% IC 1,73‐6,18) e a SNNT (OR 2,53; 95% IC 1,42‐4,52), enquanto os fatores protetores foram o tratamento farmacológico (OR 0,29; 95% IC 0,14‐0,62), a abordagem conservadora (OR 0,34; 95% IC 0,14‐0,79) e o PN (OR 0,99; 95% IC 0,99‐0,99).
DiscussãoA sobrevida de RNPT sem sequelas tem sido o objetivo da assistência perinatal a esses recém‐nascidos de risco. Dentre os fatores que podem influenciar essa evolução, a PCA tem sido considerada um fator de risco com importantes repercussões. Por esse motivo, tem crescido a necessidade de definição de uma conduta terapêutica na presença de CA que garanta um maior controle dessas complicações, particularmente nos RN de menores pesos ao nascer.
Neste estudo, realizado com RN menores de 1.000 gramas ao nascimento e com PCA, foi evidenciada proteção dos tratamentos conservador e farmacológico para o desfecho combinado óbito/DBP36sem, embora o tratamento conservador tenha se associado a maior mortalidade. Foram identificados, também, o sexo masculino, seguido pela SNNT, IG e o tempo de ventilação mecânica como fatores associados à presença de DBP36sem. Já a evolução para óbito relacionou‐se à presença de ECNcir e HIC III/IV.
Os RN incluídos nesta pesquisa, embora constituam um grupo de alto risco para os eventos aqui analisados, por terem, em média, IG menores do que 28 semanas e PN menores do que 800 gramas, tiveram esse risco atenuado, pois dois terços deles receberam corticoide antenatal e nasceram com boas condições de vitalidade. No período pós‐natal, embora mais de 90% tenham desenvolvido SDR e tenham sido submetidos à ventilação mecânica, aproximadamente 70% receberam surfactante até 2 horas de vida. No entanto, a ocorrência de SNNT em aproximadamente metade dos RN pode ter contribuído para as maiores frequências de DBP36sem, especialmente no G3, onde correspondeu a 65,7% dos RN.
Pela elevada frequência do uso de esteroide antenatal nos grupos analisados, sem diferença entre eles, não foi possível avaliar a influência do uso desta prática sobre os desfechos analisados.
Considerando os grupos de estudo, verificou‐se que diferiram entre si em relação à IG, que era menor no grupo que evoluiu para ligadura cirúrgica de CA, que também apresentou maior frequência de sepse tardia, caracterizando um maior risco de DBP36sem e ROPcir, conforme os resultados aqui obtidos. Apesar disso, a maior mortalidade foi observada no grupo que recebeu tratamento conservador, o que provavelmente justifica a menor frequência das demais intercorrências neste e a opção pelo não tratamento farmacológico ou cirúrgico, devido às condições clínicas dos RN. Já o grupo com tratamento farmacológico teve a menor pontuação pelo SNAPPE II, o que caracteriza um menor risco de morbimortalidade e, possivelmente, também de ocorrência dos desfechos avaliados.
De uma maneira geral, a terapêutica para PCA tem sido muito variável entre os serviços, especialmente pela falta de dados consistentes sobre qual a melhor abordagem clínica a ser seguida. Ainda permanece obscuro se existem vantagens entre as várias propostas vigentes na literatura: tratamento profilático em crianças menores de determinada idade gestacional; tratamento precoce, no início de sintomas, ou mais tarde quando o PCA apresenta repercussões hemodinâmicas significativas, em relação às consequências clínicas imediatas e resultados em longo prazo, particularmente no que se refere à DBP.8,14–17 Por outro lado, existem potenciais complicações da terapia farmacológica do PCA, tais como disfunção renal e perfuração intestinal, como também as decorrentes de ligadura cirúrgica, como disfunção cardiopulmonar.
Nesse estudo, comparando as três formas de abordagem terapêutica, pode‐se observar que os RN tratados com inibidores de prostaglandinas (indometacina ou ibuprofeno) apresentaram menos DBP, ROPcir, ECNcir e óbito/DBP, especialmente quando comparados aos submetidos à ligadura cirúrgica. Quando foram considerados os desfechos óbito e DBP36sem separadamente, o tipo de abordagem clínica ou cirúrgica não teve influência, enquanto o tratamento conservador associou‐se à maior mortalidade. Mas, na análise dos desfechos combinados (óbito/DBP36sem), o tratamento farmacológico e o conservador foram protetores.
Esses achados concordam com os de Mirea et al.16 que, usando análises multivariáveis, que tentam ajustar para o viés de seleção do tratamento, forneceu evidências de uma associação entre a ligadura cirúrgica de PCA e o aumento da mortalidade neonatal ou morbidade grave, mas, por outro lado, não encontraram nenhum impacto do tratamento com indometacina quando comparado ao conservador.
Com base nas considerações acima, os resultados aqui obtidos sugerem uma maior proteção para os desfechos analisados no grupo tratado farmacologicamente, embora haja limitações nesta análise, principalmente em relação ao número de casos excluídos e à distribuição não homogênea dos fatores de risco entre os grupos, o que não permitiu atribuir os resultados apenas à opção terapêutica. Outro aspecto a ser considerado é a falta de informações relativas às manifestações clínicas da PCA e a idade em que foram realizados os tratamentos, bem como a possíveis diferenças relativas às indicações de tratamento entre as UN. Quanto à proteção decorrente do peso de nascimento, por ter sido próxima de 1, teve um impacto mínimo sobre os desfechos avaliados.
Mesmo com as limitações já citadas, estas constatações sinalizam a necessidade de realização de novos estudos controlados e randomizados que permitam avaliar a possível proteção decorrente do tratamento farmacológico em RN de alto risco, com persistência do canal arterial.
ColaboradoresOs seguintes pesquisadores das Unidades Neonatais da Rede Brasileira de Pesquisas Neonatais foram responsáveis pela coleta de dados desta pesquisa.
Vera Lúcia Jornada Krebs e Werther Brunow Carvalho, Faculdade de Medicina, Universidade de São Paulo, São Paulo, SP, Brasil. Rita de Cássia Silveira, Departamento de Pediatria e Puericultura, Faculdade de Medicina, Universidade Federal do Rio Grande do Sul, Porto Alegre, RS, Brasil. Maria Fernanda Branco de Almeida, Junia S Castro, Simone NA Figueira, Departamento de Pediatria, Faculdade de Medicina, Universidade Federal de São Paulo, São Paulo, SP, Brasil. José Maria Lopes e Olga Bonfim, Instituto Fernandes Figueira, Rio de Janeiro, RJ, Brasil. Ana Luiza Macedo, Geisy MS Lima e Tereza Carvalho, Instituto de Medicina Integral Prof Fernando Figueira (IMIP), Recife, PE, Brasil. Adriana Saito e Alice M. Kiy, Departamento de Pediatria, Faculdade de Medicina de Botucatu, Universidade Estadual Paulista, Botucatu, SP, Brasil. Walusa Assad Goncalvez Ferri, Departamento de Pediatria, Faculdade de Medicina de Ribeirão Preto, Universidade de São Paulo, Ribeirão Preto, SP, Brasil. Maria Regina Bentlin, Departamento de Pediatria, Faculdade de Medicina de Botucatu, Universidade Estadual Paulista, Botucatu, SP, Brasil. Regina Vieira Cavalcante da Silva, Departamento de Pediatria, Universidade Federal do Paraná, Curitiba, PR, Brasil. Ângela Sara Jamusse de Brito, Maria Rafaela Conde Gonzalez e Ana Berenice Ribeiro de Carvalho, Faculdade de Medicina, Universidade Estadual de Londrina, Londrina, PR, Brasil.
Conflitos de interesseOs autores declaram não haver conflitos de interesse.
Como citar este artigo: Sadeck LS, Leone CR, Procianoy RS, Guinsburg R, Marba ST, Martinez FE, et al. Effects of therapeutic approach on the neonatal evolution of very low birth weight infants with patent ductus arteriosus. J Pediatr (Rio J). 2014;90:616–23.
Estudo vinculado a 16 unidades da Rede Brasileira de Pesquisas Neonatais: Universidade de São Paulo (USP); FIOCRUZ/ Instituto Fernandes Figueira (IFF); Pontifícia Universidade Católica do Rio Grande do Sul (PUC‐RS)/Hospital São Lucas (HSL); Universidade Estadual Paulista (UNESP) / Faculdade de Medicina de Botucatu (FMB); Universidade Federal do Rio Grande do Sul (UFRGS)/ Hospital de Clínicas de Porto Alegre (HCPA); Universidade Federal de São Paulo (UNIFESP)/ Escola Paulista de Medicina (EPM); Universidade de São Paulo (USP), Ribeirão Preto; Universidade Estadual de Campinas (UNICAMP) / Hospital da Mulher Prof. Dr. José Aristodemo Pinotti (CAISM); Universidade Estadual do Rio de Janeiro (UERJ)/ Hospital Universitário Pedro Ernesto (HUPE); Universidade Federal de Minas Gerais (UFMG)/ Hospital de Clínicas (HC); Universidade Federal do Paraná (UFPR)/ Hospital de Clínicas (HC); Faculdade de Ciências Médicas de Minas Gerais (FCMMG)/ Maternidade Hilda Brandão (MHB); Universidade Federal de Uberlândia (UFU)/Hospital de Clínicas (HC); Universidade Estadual de Londrina (UEL)/Hospital Universitário (HU); Instituto de Medicina Integral Professor Fernando Figueira (IMIP); Universidade Federal do Maranhão (UFMA)/ Hospital de Clínicas (HU).