To determine the main indications and assess the most common adverse events with the administration of hypnotic propofol in most pediatric clinical scenarios.
SourcesA systematic review of PubMed, SciELO, Cochrane, and EMBASE was performed, using filters such as a maximum of five years post‐publication, and/or references or articles of importance, with emphasis on clinical trials using propofol. All articles of major relevance were blind‐reviewed by both authors according to the PRISMA statement, looking for possible bias and limitations or the quality of the articles.
Summary of the findingsThrough the search criterion applied, 417 articles were found, and their abstracts evaluated. A total of 69 papers were thoroughly studied. Articles about propofol use in children are increasing, including in neonates, with the majority being cohort studies and clinical trials in two main scenarios: upper digestive endoscopy and magnetic resonance imaging. A huge list of adverse events has been published, but most articles considered them of low risk.
ConclusionsPropofol is a hypnotic drug with a safe profile of efficacy and adverse events. Indeed, when administered by non‐anesthesiologists, quick access to emergency care must be provided, especially in airway events. The use of propofol in other scenarios must be better studied, aiming to reduce the limitations of its administration by general pediatricians.
Determinar as principais indicações e examinar os eventos adversos mais comuns com uso do hipnótico propofol na maioria dos cenários clínicos pediátricos.
FontesRealizada revisão sistemática da literatura nas bases de dados PubMed, Scielo, Cochrane e EMBASE, aplicando‐se filtros como máximo de cinco anos de publicação e/ou referências ou publicações relevantes em outras hipóteses com enfoque em ensaios clínicos envolvendo o propofol. Todos os artigos de maior relevância foram avaliados cegamente pelos dois autores, de acordo com o PRISMA Statement, observando os riscos de vieses e qualidades ou limitações dos estudos.
Resumo dos achadosAtravés dos mecanismos de pesquisa, 417 artigos foram encontrados e separados logo após, de acordo com os critérios de inclusão. Um total de 69 artigos foram estudados. Destacam‐se a produção científica crescente sobre o propofol em crianças, incluindo recém‐nascidos, sendo a grande maioria dos trabalhos coortes retrospectivos ou prospectivos, bem como ensaios clínicos com o propofol nos principais cenários: endoscopia digestiva alta e ressonância magnética. Ampla gama de eventos adversos foi citada, mas a maioria dos trabalhos não as consideraram significativas.
ConclusõesO propofol apresenta um seguro perfil de eficácia e segurança. Quando administrado por médicos não anestesistas, deve‐se redobrar o cuidado para ação rápida em emergências, especialmente de vias aéreas. A aplicação do fármaco em outros contextos deve ser estudada em maior profundidade, a fim de dirimir a dificuldade do uso por pediatras.
O propofol (2‐6‐diisopropilfenol) é um dos fármacos anestésicos de maior uso para diversos procedimentos. Suas propriedades anestésicas, primeiramente descritas em 1973, envolvem primariamente o aumento da tônus inibitório mediado pelo ácido gamaaminobutírico (GABA) em seus receptores GABA‐A, causa aumento de influxo de cloreto nos neurônios pós‐sinápticos e, desse modo, inibe a transmissão do impulso elétrico e níveis variados de sedação.1 Em pacientes adultos, o uso do propofol é rotineiro e baseado em evidências mais sólidas no que tange à segurança e eficácia.2 Desde o início da década de 1990, uma grande quantidade de publicações avaliou o uso em diversas doses do propofol em crianças de todas as idades, com uma ampla gama de resultados, inclusive potenciais eventos adversos graves ou grandes coortes de pacientes sem eventos adversos de importância, o que gerou desconfiança e dificuldade no uso do fármaco, principalmente entre pediatras não intensivistas.
Seu rápido início e término de ação, justificado pela alta lipossolubilidade e livre passagem pela barreira hematoencefálica, revestem o fármaco de grande interesse. Entretanto, seu grande volume de distribuição e potencial depósito no tecido adiposo podem prolongar o tempo de ação e eventos adversos, bem como em pacientes com disfunção hepática e/ou renal.3 Em pediatria, a diferença no clareamento (clearence) do propofol é extremamente importante na limitação da prescrição. Em recém‐nascidos prematuros e de termo, o clareamento é de apenas 10 a 38% do fármaco em sua forma ativa, quando comparados aos valores em adultos. Esse fato também restringe muito a prescrição de propofol, particularmente em recém‐nascidos4 (RNs).
Liberado para o uso em crianças pela Food and Drug Administration (FDA) nos Estados Unidos em 1989, a infusão do propofol em nosso meio é quase exclusivamente limitada à manutenção de anestesia geral intravenosa ou mista, é raro o uso contínuo dentro das Unidades de Terapia Intensiva pelos potenciais eventos adversos graves, como hipotensão, depressão miocárdica, anafilaxia e a síndrome da infusão do propofol (SIP), cujos sinais e sintomas podem ser de extrema gravidade.5 Assim, a quantidade de estudos que atestam a segurança do propofol em crianças, principalmente em RNs, é pequena, tendo em vista a dificuldade de fazer ensaios clínicos nessa população.
Assim, o objetivo deste artigo é avaliar as principais indicações para a prescrição de propofol em todas as faixas etárias pediátricas e avaliar a hipótese que o uso adequado do propofol em crianças é seguro, bem como verificar, como desfecho principal, os principais eventos adversos (EAs) relacionados em diversos cenários para sedação pediátrica, através de metodologia de revisão sistemática da literatura.
MétodosUsamos o checklist do Preferred Reporting Items for Systematic Reviews and Meta‐Analyses (PRISMA)6 para a obtenção e análise dos artigos avaliados. Adotamos o método de revisão sistemática da literatura, através das bases de dados do PubMed, Scielo (descritores da Biblioteca Virtual em Saúde), Embase e Cochrane, com os seguintes descritores, respectivamente, no PubMed (Medical Subject Headings – MeSH): propofol, child, pediatrics, neonatology, drug‐related side effects e adverse reactions; na BVS, propofol, pediatria, neonatologia e efeitos colaterais e reações adversas relacionadas a medicamentos; na Cochrane: propofol, children e adverse reactions. Além disso, tendo em vista que a SIP é evento adverso grave, porém pouco descrito em crianças, usamos uma pesquisa paralela com os descritores propofol, propofol infusion syndrome e children, ambos listados de maneira idêntica nas duas bases de dados. Para o melhor entendimento dos eventos adversos do propofol em RNs, da mesma maneira fizemos uma pesquisa paralela com os descritores, respectivamente do MeSH: propofol e neonatology.
Critérios de inclusão e exclusãoForam incluídos na revisão artigos que descreveram as principais indicações do propofol e/ou seus eventos adversos em pacientes até 20 anos incompletos, bem como referências importantes dos artigos revisados. Referências bibliográficas relevantes encontradas em revisões clássicas ou sistemáticas, bem como ensaios clínicos e estudos somente feitos em humanos, também foram consideradas. Como critérios de exclusão, retiramos editoriais, cartas ao editor, relatos de casos, artigos em idioma diferente de português, inglês ou espanhol e artigos apresentados após a pesquisa, mas que não guardavam relação com o escopo do trabalho e/ou não puderam ser recuperados em sua totalidade. No momento da pesquisa, foram aplicados como filtros no PubMed para obtenção de dados mais atuais e aplicáveis: data de publicação até 5 anos, clinical trials, clinical conferences, comparative studies, congress, guideline, historical article, journal article, meta‐analyses, multicenter study, observational study, practice guideline, todos os artigos com financiamento americano governamental ou não, review, humans e sistematic review. A última busca foi feita em 25 de março em 2019.
Dessa maneira, obtivemos os seguintes resultados:
- ‐
Critério A – propofol e children, aplicados os filtros, apresentaram os seguintes detalhes de pesquisa: ((“propofol”[MeSH Terms] OR “propofol”[All Fields]) AND (“child”[MeSH Terms] OR “child”[All Fields] OR “children”[All Fields])) AND (“2014/03/25”[PDat]: “2019/03/25”[PDat] AND “humans”[MeSH Terms]) – 346 artigos
- ‐
Critério B – propofol e drug‐related side effects and adverse reactions – detalhes de pesquisa: ((“propofol”[MeSH Terms] OR “propofol”[All Fields]) AND (“drug‐related side effects and adverse reactions”[MeSH Terms] OR (“drug‐related”[All Fields] AND “side”[All Fields] AND “effects”[All Fields] AND “adverse”[All Fields] AND “reactions”[All Fields]) OR “drug‐related side effects and adverse reactions”[All Fields] OR (“drug”[All Fields] AND “related”[All Fields] AND “side”[All Fields] AND “effects”[All Fields] AND “adverse”[All Fields] AND “reactions”[All Fields]) OR “drug related side effects and adverse reactions”[All Fields])) AND (“2014/03/25”[PDat]: “2019/03/25”[PDat] AND “humans”[MeSH Terms]) – 30 artigos
- ‐
Critério C – propofol e neonatology – ((“propofol”[MeSH Terms] OR “propofol”[All Fields]) AND (“neonatology”[MeSH Terms] OR “neonatology”[All Fields])) AND (“2014/03/27”[PDat]: “2019/03/25”[PDat]) – 15 artigos
- ‐
Critério D – propofol, children e propofol infusion syndrome – ((“propofol infusion syndrome”[MeSH Terms] OR (“propofol”[All Fields] AND “infusion”[All Fields] AND “syndrome”[All Fields]) OR “propofol infusion syndrome”[All Fields]) AND (“child”[MeSH Terms] OR “child”[All Fields] OR “children”[All Fields])) AND (“2014/03/27”[PDat]: “2019/03/25”[PDat]) – 18 artigos
- ‐
Critério E (Scielo) – propofol infusion syndrome – um artigo; propofol infusion syndrome e children; bem como quaisquer das combinações acima com os descritores da BVS: não encontrados artigos.
- ‐
Critério F (Cochrane) – propofol, children e Cochrane evidence – 4 artigos.
Usamos o PRISMA Statement como checklist para os itens obrigatórios e, dentro desses, aqueles plausíveis para aplicar ao trabalho. O item 4 do PRISMA individualiza o acrônimo PICOS, que será, abaixo, individualizado para nossa revisão:
- ‐
Participantes do estudo: faixa etária pediátrica, dos recém‐nascidos ao término da adolescência (20 anos), de acordo com a definição da Organização Mundial de Saúde;
- ‐
Intervenção: uso do propofol na maioria dos contextos pediátricos de sedação, sem intuito de comparação em relação à segurança e eficácia com outros fármacos hipnóticos;
- ‐
Comparações com os demais estudos: as tabelas 1‐3 demonstram todos os estudos encontrados. Durante a discussão, tópicos mais relevantes em cenários diferentes de sedação foram comparados entre um ou mais autores;
- ‐
Outcomes (desfechos): eficácia (com ênfase na porcentagem de sedações bem sucedidas com o propofol), segurança (com ênfase no relato de eventos adversos) e avaliação das situações clínicas nas quais o propofol foi usado;
- ‐
Study designs (tipos de estudo): colocados individualmente em cada tabela.
Para bem definir os níveis de evidência de cada artigo, adaptamos a classificação de acordo com o artigo de Burns et al.,7 mais precisamente o que se encontra na tabela 1 deste artigo. Descrevemos no corpo do artigo a definição de cada grau e, assim, acrescentamos uma coluna adicional em cada tabela com o devido grau de evidência. Assim, propomos recomendações de maneira mais científica.
Níveis de evidência para estudos prognósticos7
| Nível | Tipo de evidência |
|---|---|
| I | Estudos de coorte prospectivo de alta qualidade e com alto poder ou revisão sistemática e/ou metanálise desses trabalhos; ensaios clínicos randomizados e cegos de boa qualidade |
| II | Estudos de coorte prospectivo/ensaios clínicos de menor qualidade; pacientes controle de ensaios clínicos não tratados; revisões sistemáticas desses trabalhos |
| III | Estudos de caso‐controle ou revisões sistemáticas; estudos prospectivos sem grupo controle (quando aplicável); coortes retrospectivos |
| IV | Séries de casos |
| V | Opiniões de especialistas; relatos de casos ou evidências baseadas em fisiologia |
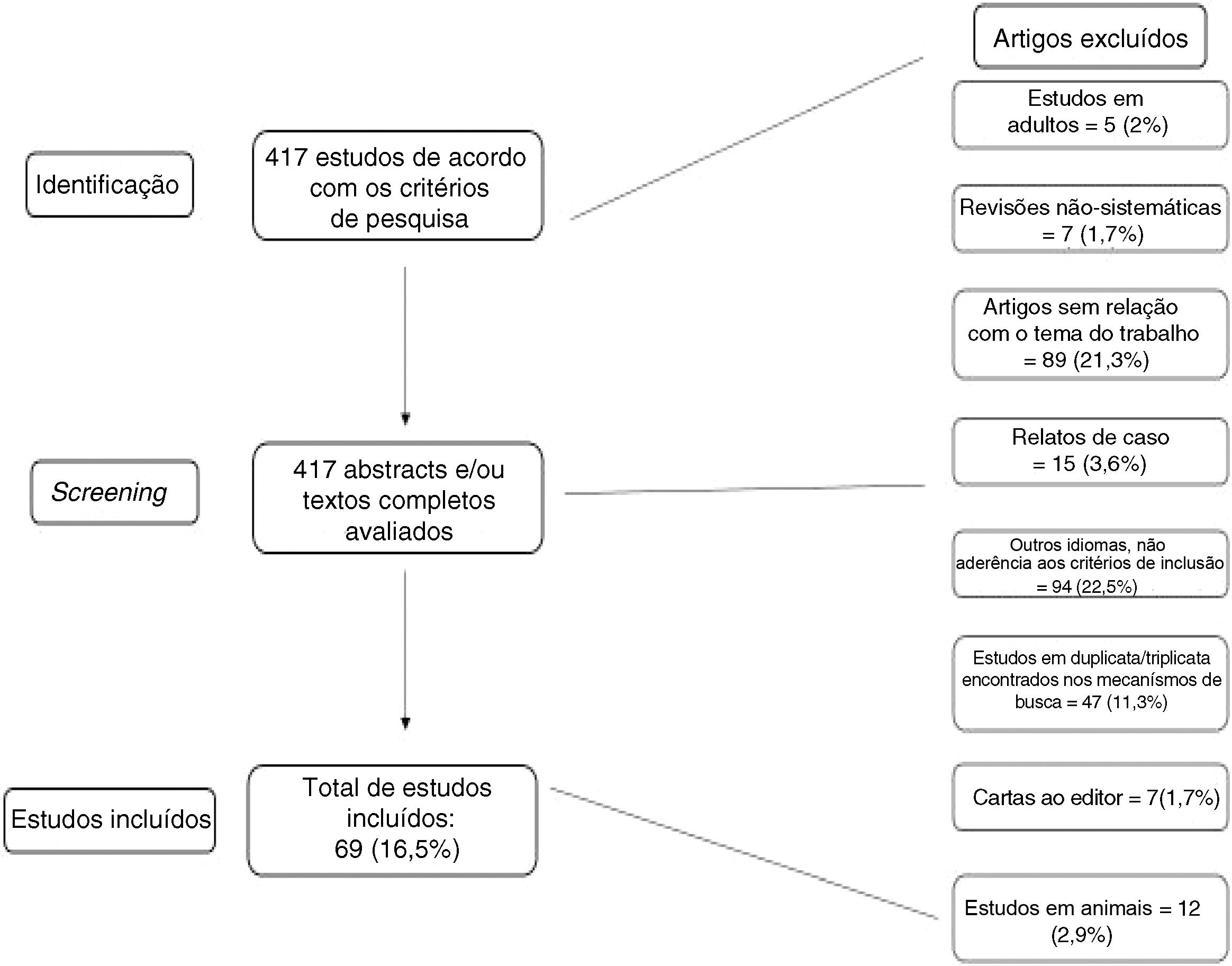
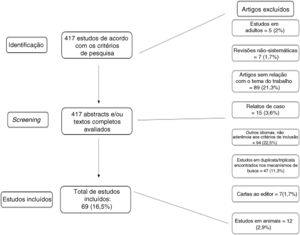
De acordo com os mecanismos de busca acima descritos, foram identificados 417 possíveis publicações. Cada uma foi separadamente analisada pelos dois autores através de seus resumos. Após aplicados os critérios de exclusão acima explicitados, 69 artigos (16,5% do total inicial) foram vistos em sua totalidade e incluídos nas tabelas ou em outras partes do artigo. Muitos artigos foram encontrados em duplicata e/ou triplicata de acordo com os mecanismos de busca, motivo pelo qual estão incluídos nas tabelas apenas artigos que guardavam direta relação com os objetivos do estudo. Essa redundância nos achados foi quase total quando verificamos os artigos citados pela Embase.
O processo de seleção dos artigos, bem como a leitura de todos os resumos e a inclusão nos resultados, foi feito de maneira independente e separada entre os dois autores. Do mesmo modo, ambos os autores avaliaram juntamente os níveis de evidência apresentados nos artigos para os quais eles se aplicam, de acordo com a tabela 1. A metodologia para a seleção dos artigos está resumida na figura 1.
A grande maioria dos artigos avaliou o uso do propofol em procedimentos fora do centro cirúrgico, especialmente endoscopias digestivas altas e ressonâncias magnéticas, ou incluíram o propofol como braços de ensaios clínicos com outros hipnóticos e/ou sedativos para avaliação de segurança e eficácia.
Devido ao grande número de artigos encontrados, optamos por dividir o conteúdo dos resultados da pesquisa em três grandes tabelas, que abordam diferentes aspectos do uso do propofol em pediatria. As tabelas foram divididas em colunas de acordo com o PRISMA Statement, observaram‐se os tipos de estudos, bem como seus resultados, implicações clínicas e para pesquisa futura, além de possíveis vieses encontrados.
DiscussãoAté o presente momento, de acordo com nosso conhecimento, não encontramos uma revisão sistemática que aborde o uso do propofol em diversos cenários pediátricos. Outras revisões ou metanálises abordaram aspectos específicos, como uso em endoscopia digestiva ou exames de imagem, com uma quantidade muito menor de artigos a serem examinados.
Chama a atenção a quantidade de trabalhos publicados nos últimos anos sobre o tema, o que reflete a “universalização” do uso do propofol, como acima demonstrado, principalmente fora do centro cirúrgico e por profissionais não anestesistas. Acreditamos que se trata de um ganho enorme pela eficácia e segurança desse hipnótico, atestado nas mais variadas situações de acordo com as tabelas. Após a descontinuidade de hipnóticos como o hidrato de cloral e a pequena disponibilidade da dexmedetomidina (opções eficazes de sedação não parenteral),8 o uso da via parenteral tem aumentado, o que leva à necessidade de maior conhecimento de manejo emergencial dos potenciais eventos adversos associados ao propofol e que aparecem em menor quantidade com outros fármacos hipnóticos ou sedativos.
Recomendações baseadas em evidênciasApesar de o escopo deste trabalho ser apenas uma revisão sistemática com análise crítica dos textos selecionados, através da avaliação dos graus de evidência de cada artigo, elaboramos conclusões abaixo relacionadas.
Uso em neonatologiaSumário das recomendações
- ‐
Não há recomendações para o uso rotineiro de propofol para instilação rápida de surfactante na sala de parto. O único estudo encontrado não contém grupo controle (Nível II);
- ‐
Não há dose ideal recomendada de propofol na sala de parto para o mesmo objetivo acima, altas doses são correlacionadas a piores desfechos clínicos. Do mesmo modo, doses muito heterogêneas foram usadas também em pequenos procedimentos cirúrgicos, o que limita sua prescrição (Nível II/III);
- ‐
O propofol, em combinação com a cetamina, está relacionado a um menor número de intubações pós‐cirurgias de pequeno porte quando comparado aos anestésicos inalatórios (Nível II);
- ‐
Não é recomendado o uso rotineiro de propofol como hipnótico pré‐eletroencefalograma, bem como não há definição em relação à dose adequada (Nível I);
- ‐
O uso de propofol em RNs, de maneira geral, deve ser cuidadosamente avaliado, a equipe tem de ser treinada adequadamente para manejar os eventos adversos, principalmente respiratórios, que podem chegar a 50% das sedações (Nível I).
A sedação em recém‐nascidos (RNs), historicamente, é um paradigma a ser quebrado. Felizmente, vivemos em uma época de transição na qual é mais evidente a necessidade de sedoanalgesia em RNs, por questões humanitárias e para garantir segurança e eficácia de diversos procedimentos.
Em relação aos 11 artigos citados no campo da neonatologia, as indicações, doses e EAs causados pelo propofol foram muito diversos. Doses de 1mg/kg foram mais encontradas; entretanto, doses até 4,5mg/kg foram relatadas (tabela 2). A prática do uso do propofol para RNs fora do centro cirúrgico é muito rara, dado o temor relacionado à SIP e à baixa experiência em geral dos neonatologistas com o fármaco; de fato, há relatos de SIP com única dose de propofol em RNs.9 A maioria dos estudos apresentou como limitação o pequeno tamanho amostral, bem como a ausência de dose pré‐estabelecida para uso nessas faixas etárias; do mesmo modo, os estudos versaram sobre sedação para IOT, cirurgias para correção de retinopatia da prematuridade ou pequenos procedimentos dentro da UTI neonatal. Com as técnicas de administração de surfactante para RNs prematuros, alguns grupos questionam a necessidade de sedoanalgesia nesse grupo de pacientes. Isso foi observado em importante artigo de Dekker et al.,10 em que um grupo controle não recebeu medicação para a administração de surfactante via sonda e os dois grupos (o outro grupo recebeu propofol em dose mínima de 1mg/kg) não apresentaram morbidade estatisticamente significativa. Anos antes, o mesmo grupo holandês liderado por Dekker et al.11 demonstrou que a técnica de instilação rápida de surfactante foi mais fácil em crianças que receberam propofol.12 Apesar desses resultados, é altamente questionável o uso de um grupo controle em um procedimento como o citado.
Sumário dos artigos que envolvem o uso de propofol em recém‐nascidos
| Autor | Pacientes e faixa etária | Desenho do estudo | Intervenções | Resultados | ComentáriosRiscos de vieses | Nível de evidência |
|---|---|---|---|---|---|---|
| Ulgey et al. (2015)12 | 60 RNs | Coorte prospectivo | Cirurgia para ROP 20 RNs – cetamina (1 mg/kg) + propofol (1 mg/kg) 30 RNs – sevoflurano1 mg/kg | O grupo que usou sevoflurano apresentou cinco vezes mais episódios de ventilação mecânica pós‐operatória (p=0,01) | Neste pequeno grupo de pacientes, a anestesia inalatória trouxe significativa morbidade adicional. Poucos RNs alocados | II |
| Dekker et al. (2016)11 | 38 RNs para sedação para administração minimamente invasiva de surfactante; 23 usaram propofol e15 não foram sedadosIG média de 29 semanas nos RNs sedados | Ensaio clínico não randomizado | 1 mg/kg ou a critério do neonatologista | Hipotensão e bradicardia ocorreram nos dois grupos sem diferença estatística. Hipoxemia (saturação <80% ocorreu 3 vezes mais no grupo intervenção) e CPAP intermitente também (ambos com p <0,05) | ‐ Questões éticas em relação ao grupo controle | II |
| ‐ Resultado esperado de eventos adversos em pacientes sedados | ||||||
| Smits et al. (2016)20 | 50 RNs alocados | Coorte prospectivo | Definir a dose efetiva de propofol para sedação – administração de propofol – surfactante e extubaçãoA dose efetiva variou entre 0,71 e 1,35 mg/kg | 28,5 a 39,1% apresentaram hipotensão arterial independentemente da IG, com discreta hipóxia sanguínea e cerebral | Grande vantagem de um estudo farmacocinético indicar doses menores que as previamente citadas para uso de propofol em RNs | II |
| Grunwell et al. (2017)21 | ‐ 3.660 crianças submetidas à sedoanalgesia com cetamina + propofol fora do centro cirúrgico | Estudo prospectivo observacional | ‐ Avaliação de eventos adversos da misturaO texto e as tabelas não demonstram as doses usadas de ambos os fármacos | 9,8% eventos adversos (dessaturação, tosse, apneia na maioria dos casos) | Não houve, para a maioria dos casos, levantamento do tempo e dose da mistura | III |
| ‐ Apenas 1,5% menores de 3 meses (RNs não especificados) | ‐ Coorte retrospectivo do Pediatric Sedation Consortium | |||||
| Piersigilli et al. (2017)22 | 13 RNs alocados para terapia com laser para retinopatia da prematuridade (ROP) graus III‐IV, com média de idade gestacional de 26 semanas | Coorte retrospectivo | ‐ Bolus lento de 2‐4 mg/kg, sucedido por infusão contínua de 4‐6 mg/kg/h‐ Máscara laríngea em todos os pacientes | Nenhum caso de intubação, hipotensão e bradicardia significativa foi reportado | Altas doses de indução e manutenção geraram viés de resultados, uma vez que todos foram ventilados com máscara laríngea | III |
| Durrmeyer et al. (2018)23 | 173 RNs com idade gestacional média de 30,6 semanas e peso de nascimento (PN) médio de 1502g | Ensaio clínico | Dois grupos: atropina + propofol (15 mcg/kg e 1‐2,5 mg/kg) versus atropina + atracúrio (0,3‐0,4 mg/kg) + sufentanil (0,2 mg/kg) em diversos tipos de cirurgias | Eventos adversos graves ocorreram em 11% do grupo atropina + propofol e em 20% do outro grupo, sem relevância estatística e sem óbitos | O poder do estudo pode ter sido pequeno suficiente para subestimar o resultado | II |
| Dekker et al. (2019)10 | 78 RNs entre 26‐36 semanas de idade gestacional (IG) | Ensaio clínico | Sedação durante terapia de infusão de surfactante minimamente invasiva com propofol (1 mg/kg) ou sem sedação | ‐ Grupo de sedação apresentou maior conforto durante a terapia (Escala de Comfort‐Neo <14 ‐ 76% vs. 22% no grupo placebo; p <0,001) e maior necessidade de ventilação não invasiva transitória (93% vs. 47% no grupo controle; p <0,001) | ‐ Baixo número de pacientes | II |
| Thewissen et al. (2018)24 | 22 RNs com IG entre 28 e 37 semanas e PN variando entre 990 gramas e 1415 gramas | Coorte prospectivo unicêntrico | Infusão de 0,5‐4,5 mg/kg de propofol pré‐IOT e avaliação da pressão de perfusão cerebral, sinais vitais e oxigenação cerebral por espectrofotometria quase infravermelha (NIRS) e EEG | 50% dos pacientes apresentaram hipotensão, porém 95% não tiveram alterações na PPC nem na oxigenação cerebral | ‐ A variação grande da dose de propofol limita a avaliação da hipotensão e da PPC como marcadores da oxigenação cerebral | III |
| ‐ Pouco alcance (material pouco disponível) | ||||||
| de Kort et al. (2019)27 | 115 RNs, com mediana de IG de 27,7 semanas e PN mediano de 1,005 g | Coorte prospectivo em 2 diferentes centros | Infusão de 1‐2 mg/kg de propofol pré‐intubação orotraqueal (IOT) | 85% dos RNs atingiram escore de sedação suficiente para proceder a IOT Sem eventos adversos importantes | ‐ Alto índice de falha de sedação‐ Escore usado (IRS ‐ Intubation Readiness Score) pode ser muito subjetivo (viés de avaliação) | III |
CPAP, continuous positive airway pressure; EEG, eletroencefalograma; IG, idade gestacional; PN, peso ao nascimento; PPC, pressão de perfusão cerebral; ROP, retinopatia da prematuridade.
Outros estudos, entretanto, e com a mesma finalidade, apresentaram números referentes aos EAs relacionados ao propofol que preocupam. Destacam‐se a hipotensão (até 50%), hipoxemia transitória (10‐11%), além de condições desfavoráveis para IOT quando foi usado o propofol como hipnótico único para IOT de RNs prematuros em doses de até 2mg/kg na indução.11,12 Entre os estudos revisados, não houve evento sentinela decorrente do uso do propofol.
Propofol e neurotoxicidadeDurante muito tempo, uma certa “resistência” ao uso do propofol em RNs foi oriunda de estudos feitos em animais, nos quais a toxicidade cerebral, principalmente por benzodiazepínicos, vigorou por muito tempo. Jia, um dos maiores autores no assunto, usou o propofol em diferentes modelos. Em um estudo de monócitos e macrófagos de ratos submetidos in vitro ao uso do propofol, houve redução da proporção de citocinas pró‐inflamatórias, como interleucinas 6 e 8, além do fator de necrose tumoral.13 Em publicação posterior, Tu et al. demonstraram que o estresse oxidativo celular, bem como a lesão mitocondrial induzida por citocinas, como as acima citadas, diminuiu com a exposição ao propofol.14 Neste artigo, a apoptose de neurônios hipocampais foi reduzida in vitro com a exposição simultânea à dexmetomidina, fato já descrito por outros autores. Em outros grupos específicos, como adultos com encefalopatia hepática em hemodiafiltração, bem como RNs com disfunção renal aguda e o efeito de bolus de propofol maternos durante partos cesáreos de emergência, não houve ocorrência de EAs nos pacientes.15–17 Em artigo mais recente, Olutoye et al.18 colocam que a real incidência de dano neuronal com qualquer tipo de sedoanalgésico em seres humanos ainda é desconhecida. De acordo com a Food and Drug Administration (FDA), os principais agentes envolvidos nesse tópico são os gases inalatórios, como o sevoflurano e o isoflurano, e os benzodiazepínicos com ou sem propofol.
Os autores sugerem que outras opções, como opioides, alfa‐2 agonistas (clonidina ou dexmedetomidina) e a minimização da exposição em gestantes no terceiro trimestre de gestação ou em crianças abaixo de 3 anos. Outro artigo que versa sobre o assunto foi publicado por Jiang et al.19 em uma revisão que abordou diversos mecanismos pelos quais o propofol pode levar à neurotoxicidade. A indução de fatores geradores de hipóxia tecidual (RNA de cadeias longas) e a imunomodulação que ocorre pelo propofol pode até reduzir a resposta quimioterápica de pacientes com expressão de alguns genes e/ou proteínas de supressão tumoral.
A tabela com os principais textos sobre o propofol em neonatos, e não detalhados na discussão, encontra‐se na tabela 2,10–12,20–27 alguns já foram aqui descritos.
Na tabela 2 está o sumário dos artigos que envolvem o uso de propofol em recém‐nascidos.
Principais indicações clínicas do propofol em criançasSumário das recomendações:
- ‐
O propofol, em doses de 1‐2mg/kg para procedimentos fora do centro cirúrgico, é seguro e bem tolerado para a maioria das situações clínicas (Nível II);
- ‐
A equipe que usa o propofol deve ter material necessário e experiência para lidar com emergências cardiopulmonares, após compararem‐se as taxas de EAs com propofol em relação aos demais hipnóticos e sedativos (Nível I);
- ‐
O propofol demonstrou, em diversos estudos, ser o fármaco mais indicado para controle da agitação de emergência (AE) pós‐sevoflurano e deve ser fortemente considerado nessas situações (Nível II);
- ‐
De acordo com metanálise publicada pelo Cochrane em 2013,25 em mais de 14.045 crianças, o propofol foi confirmadamente indicado para a prevenção da AE acima mencionada;
- ‐
O uso de propofol em infusão contínua fora do centro cirúrgico é contraindicado, tendo em vista os potenciais graves EAs mostrados em estudos citados na tabela 3 (Nível I);
Tabela 3.Sumário dos artigos que envolveram o uso de propofol em pediatria
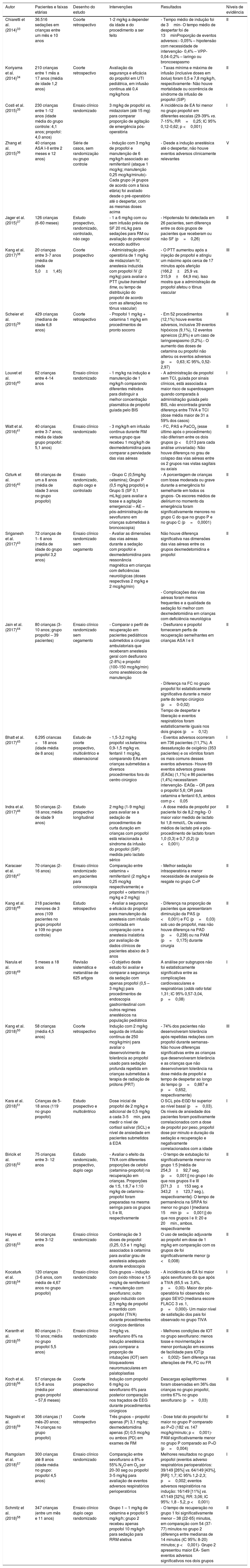
Autor Pacientes e faixas etárias Desenho do estudo Intervenções Resultados Níveis de evidência Chiaretti et al.(2014)33 36.516 sedações em crianças entre um mês e 10 anos Coorte retrospectivo 1‐2 mg/kg a depender da idade e do procedimento a ser feito ‐ Tempo médio de indução foi de 3min‐ O tempo médio de despertar foi de 13minProporção de eventos adversos:‐ 0,05% – hipotensão com necessidade de intervenção‐ 0,4% – VPP‐ 0,04‐0,2% – laringo ou broncoespasmo II Koriyama et al. (2014)34 210 crianças entre 1 mês a 17 anos (média de idade 1,2 anos) Coorte retrospectivo Avaliação da segurança e eficácia do propofol em UTI pediátrica, em infusão contínua até 0,4 mg/kg/hora ‐ Taxas mínima e máxima de infusão (inclusive doses em bolus) foram 0,5 e 7,8 mg/kg/h, respectivamente‐ Não houve mortalidade ou ocorrência de síndrome da infusão de propofol (SIP) II Costi et al. (2015)35 230 crianças entre 1‐12 anos (idade média do grupo controle: 4,1 anos; propofol: 4,0 anos) Ensaio clínico randomizado 3 mg/kg de propofol vs. midazolam (até 15 mg) para comparar proporção de agitação de emergência pós‐operatória A incidência de EA foi menor no grupo propofol em diferentes escalas (29‐39% vs. 7‐15%; RR=0,25; IC 95% 0,12‐0,62; p <0,001) I Zhang et al. (2015)36 40 crianças ASA I‐II entre 2 meses e 12 anos) Série de casos, sem randomização ou grupo controle ‐ Indução com 3 mg/kg de propofol e manutenção de 6 mg/kg/h associado ao remifentanil (ataque 1 mcg/kg; manutenção 0,25 mcg/kg/minuto)‐ Cada grupo (4 grupos de acordo com a faixa etária) foi avaliado desde o pré‐operatório até o despertar, com as mesmas doses acima ‐ Desde a indução anestésica até o despertar, não houve eventos adversos clinicamente relevantes V Jager et al. (2015)37 126 crianças (6‐60 meses) Estudo prospectivo, randomizado, controlado, não cego ‐ 1 a 6 mg/kg com ou sem infusão prévia de SF 20 mL/kg para sedações para RM ou avaliação do potencial evocado auditivo ‐ Hipotensão foi detectada em 26 pacientes, sem diferença entre os dois grupos de pacientes que receberam ou não SF (p=0,26) II Kang et al. (2017)38 20 crianças entre 3‐7 anos (média de idade 5,0±1,45) Coorte prospectivo ‐ Administração pré‐operatória de 1 mg/kg de midazolam IV; anestesia induzida com propofol IV (2 mg/kg) para avaliar o PTT (pulse transited time, ou tempo de distribuição do propofol de acordo com as alterações no tônus vascular) ‐ O PTT aumentou após a injeção de propofol e atingiu um máximo após cerca de 17 minutos após aferição (166,2±25,9 vs. 315,9±64,9 ms). Isso mostra que a administração de propofol afetou o tônus vascular III Scheier et al. (2015)39 429 crianças (mediana de idade 6,8 anos) Coorte retrospectivo ‐ Propofol 1 mg/kg + cetamina 1 mg/kg em procedimentos de pronto socorro ‐ Em 52 procedimentos (12,1%) houve eventos adversos, inclusive 39 eventos hipóxicos (9,1%), 12 eventos apneicos (2,8%) e um caso de laringoespasmo (0,2%).‐ O aumento das doses de cetamina ou propofol não alterou os eventos adversos (p=0,63; IC 95%, 0,52‐2,97) II Louvet et al. (2016)40 62 crianças entre 4‐14 anos Ensaio clínico randomizado ‐ 1 mg/kg na indução e manutenção de 1 mg/kg/h comparando diferentes métodos para distinguir a melhor concentração plasmática de propofol guiada pelo BIS ‐ A administração de propofol sem TCI, guiada por sinais clínicos, está associada a maior risco de superdosagem quando comparada à administração guiada pelo BIS, não encontrada grande diferença entre TIVA e TCI (dose média maior de 31 a 59% dos casos) I Watt et al. (2016)41 40 crianças entre 3‐7 anos; média de idade grupo propofol: 5,1 anos) Ensaio clínico randomizado ‐ 3 mg/kg/h em infusão contínua durante RM versus grupo que recebeu 1 mcg/kg/h de dexmedetomidina para comparar a perviedade das vias aéreas ‐ FC, PAS e PaCO2 (esse último após o procedimento) não diferiram entre os dois grupos (p <0,013 para cada análise univariada)‐ Não houve diferença no grau de colapso das vias aéreas entre os 2 grupos nas vistas sagitais ou axiais II Ozturk et al. (2016)42 68 crianças de um a 8 anos (média de idade 3 anos no grupo propofol) Ensaio randomizado, duplo cego e controlado ‐ Grupo C (0,5mg/kg cetamina); Grupo P (0,5 mg/kg propofol) e Grupo S (SF 0,1 mL/kg) para avaliar a tosse e a agitação emergencial – AE – pós‐administração de sevoflurano em crianças submetidas à broncoscopia) ‐ A porcentagem de crianças com tosse moderada ou grave durante a emergência foi semelhante em todos os grupos‐ Os escores médios de delirium no momento da emergência foram significativamente menores no grupo C do que no grupo P e no grupo C (p=0,0001) II Sriganesh et al. (2017)43 72 crianças de 1‐ 6 anos (média de idade do grupo propofol 3,2 anos) Ensaio clínico randomizado sem cegamento ‐ Avaliar as dimensões das vias aéreas durante a sedação com propofol e dexmedetomidina para ressonância magnética em crianças com deficiências neurológicas (doses respectivas 2 mg/kg e 2 mcg/kg/min) Não houve diferença significativa nas dimensões das vias aéreas entre os grupos dexmedetomidina e propofol II ‐ Complicações das vias aéreas foram menos frequentes e a qualidade da sedação foi melhor com dexmedetomidina em crianças com deficiência neurológica Jain et al. (2017)44 80 crianças (3‐ 10 anos; grupo propofol – 39 pacientes) Ensaio clínico randomizado sem cegamento ‐ Comparar o perfil de recuperação em pacientes pediátricos submetidos a cirurgias ambulatoriais que receberam anestesia geral com desflurano (2‐8%) e propofol (100‐150 mcg/kg/min) como anestésicos de manutenção ‐ Desflurano e propofol forneceram perfis de recuperação semelhantes em crianças ASA I e II II ‐ Diferença na FC no grupo propofol foi estatisticamente significativa durante a maior parte do tempo cirúrgico (p=0‐0,02) Tempo de despertar e liberação e eventos respiratórios foram estatisticamente iguais nos dois grupos (p=0,12) Bhatt et al. (2017)45 6.295 criancas <18 anos (idade média de 8 anos) Estudo de coorte prospectivo, multicêntrico e observacional ‐ 1,5‐3,2 mg/kg propofol vs.ketamina 0,9‐1,5 mg/kg vs. fentanil 1 mcg/kg, comparando EAs em crianças submetidas a diversos procedimentos fora do centro cirúrgico ‐ Eventos adversos ocorreram em 736 pacientes (11,7%). A dessaturação de oxigênio (353 pacientes) e os vômitos foram os mais comuns desses eventos adversos‐ Houve 69 eventos adversos graves (EAGs) (1,1%) e 86 pacientes (1,4%) necessitaram intervenção‐ EAGs – OR para o propofol 5,6; OR para cetamina e fentanil 6,5, ambos com p <0,05 I Indra et al. (2017)46 50 crianças (2‐18 anos; média de idade 9 anos) Estudo prospectivo longitudinal 2 mg/kg (1‐9 mg/kg) para avaliar se a sedação de procedimentos de curta duração em crianças com propofol está relacionada à síndrome da infusão do propofol (SIP) medida pelo lactato sérico ‐ A dose média de propofol por paciente foi de 8,2 mg/kg‐ O maior valor medido de lactato foi 1,8 mmol/L. Os valores médios de lactato pré e pós‐procedimento de lactato foram 1,0 (0,3) e 0,7 (0,2) (p <0,001) II Karacaer et al. (2018)47 70 crianças (2‐16 anos) Ensaio clínico randomizado em pacientes para colonoscopia Comparação entre cetamina + remifentanil (2 mg/kg e 0,25 mcg/kg respectivamente) e propofol + cetamina (1 mg/kg e 2 mg/kg) ‐ Melhor sedação intraoperatória e menor necessidade de analgesia de resgate no grupo C+P II Kang et al. (2018)48 218 pacientes menores de 3 anos (109 pacientes no grupo propofol e 109 no grupo controle) Estudo retrospectivo ‐ Avaliar a segurança e eficácia do propofol para manutenção da anestesia com infusão controlada em comparação com a anestesia inalatória por avaliação de dados clínicos de pacientes abaixo de 3 anos ‐ Diferença na proporção de pacientes que apresentaram diminuição da PAS (p <0,001) e FC (p=0,03) sob uso de propofol, mas não houve diferença na PAD (p=0,238) ou na PAM (p=0,175) durante cirurgia II Narula et al. (2018)49 5 meses a 18 anos Revisão sistemática e metanálise de 625 artigos ‐ O objetivo deste estudo foi avaliar e comparar a segurança da sedação com apenas propofol (0,5 – 3 mg/kg) para procedimentos de endoscopia gastrointestinal com outros regimes anestésicos na população pediátrica A análise por subgrupos não foi estatisticamente significativa entre as complicações cardiovasculares e respiratórias (odds ratio total 1,31; IC 95% 0,57‐3,04, p=0,08) I Kang et al. (2018)50 58 crianças (média 4,5 anos) Coorte retrospectivo Indução com 2 mg/kg seguida de infusão contínua de 250 mcg/kg/min) para avaliar o desenvolvimento de tolerância ao propofol usado para sedação profunda repetida em crianças submetidas à terapia de radiação de prótons (PRT) ‐ 74% dos pacientes não desenvolveram tolerância após repetidas redações com propofol durante semanas‐ Não houve diferenças significativas entre as crianças que desenvolveram tolerância e as crianças que não desenvolveram tolerância na dose média de propofol e tempo de despertar ao longo do tempo (p=0,887 e p=0,652, respectivamente) III Kara et al. (2018)51 Crianças de 5‐ 18 anos (119 no grupo propofol) Estudo prospectivo e multicêntrico Dose inicial de propofol de 2 mg/kg e adicional de 0,5 mg/kg a cada 3‐5min, para medir o nível de cortisol salivar (SCL) e nível de ansiedade em pacientes submetidos à EDA O SCL pós‐EGD foi superior ao nível basal (p=0,03). Os níveis de ansiedade dos pacientes foram positivamente correlacionados com a dose de propofol por peso, propofol dose por minuto e duração da sedação e recuperação e negativamente correlacionados com a idade I Biricik et al. (2018)52 75 crianças entre 3‐ 12 anos Estudo randomizado, prospectivo, duplo cego ‐ Avaliar o efeito da TIVA com diferentes proporções de cetofol (cetamina‐propofol) na recuperação em crianças. Proporções de 1:5, 1:6,7 e 1:10 mg/kg de cetamina‐propofol foram preparadas na mesma seringa para os grupos I, II e III, respectivamente ‐ O tempo de extubação foi significativamente menor no grupo 1:5 [média de 254,3±92,7 seg. (p=0,001)] no grupo I do que nos grupos II e III [371,3±153 seg. e 343,2±123,7 seg.), respectivamente]‐ O tempo de permanência na SRPA foi menor no grupo I [mediana 15min (p=0,001)] do que nos grupos I e II: 20 e 20min., ambos. respectivamente II Hayes et al. (2018)53 56 crianças entre 3‐12 anos Ensaio clínico randomizado Combinação de 3 doses de propofol (0,25, 0,5 e 1 mg/kg) associados à cetamina para avaliar grau de anestesia adequado durante endoscopia O uso de sedação adjuvante ao propofol em dose de 1 mg/kg em comparação com os grupos de foi significativamente menor (p <0,008) II Kocaturk et al. (2018)54 120 crianças (3‐6 anos, com média de 4,67 anos no grupo propofol) Ensaio clínico randomizado Dois grupos – indução com óxido nitroso e 1,5 mcg/kg de remifentanil + manutenção com sevoflurano; outro grupo induzido com 2,5 mg/kg de propofol e mantido com propofol (TIVA) durante procedimentos cirúrgicos dentários ‐ A incidência de EA foi maior após sevoflurano do que após a TIVA (65,5 vs. 3,4%, p=0,00)‐ Maior dor pós‐operatória foi observada no grupo SEVO (mediana escore FLACC 3 vs. 1, p=0,000)‐ Um maior nível de satisfação dos pais foi observado no grupo TIVA I Karanth et al. (2018)55 80 crianças (1‐ 10 anos; média no grupo propofol 5,5 anos) Ensaio clínico randomizado 3 mg/kg vs. sevoflurano 8% na indução anestésica para comparar a proporção de intubações (IOT) sem bloqueadores neuromusculares em palatoplastias ‐ Melhores condições de IOT no grupo sevoflurano: menos tosse e movimentação e menor pontuação em escores de facilidade para IOT(p <0,002)‐ Sem diferença nas alterações de PA, FC ou FR II Koch et al. (2018)56 57 crianças de 0,5‐8 anos (média por grupo propofol – 57,6 meses) Coorte prospectivo observacional Indução com propofol 6 mg/kg ou sevoflurano 6% para posterior comparação nos traçados de EEG durante procedimentos cirúrgicos Descargas epileptiformes foram observadas em 36% das crianças no grupo propofol, contra 67% no grupo sevoflurano (p=0,03) II Nagoshi et al. (2018)59 306 crianças (1 mês‐20 anos; 74 crianças no grupo propofol) Coorte retrospectivo Três grupos – propofol apenas (P) 3,1 mg/kg; dexmedetomidina apenas (D) 0,5 mcg/kg ou ambos (PD) em exames de RM ‐ Dose total do propofol foi maior no grupo P comparado ao P+D (182 vs. 147 mcg/kg/minuto; p <0,001)‐ PAM significativamente menor no grupo P comparado ao P+D (p=0,004) II Ramgolam et al. (2018)57 300 crianças até 8 anos (idade média no grupo: propofol 4,5 anos) Ensaio clínico randomizado Comparação entre sevoflurano a 8% e 55% N2O em O2 por 20‐30 seg ou propofol 3‐5 mg/kg para avaliação de eventos adversos respiratórios perioperatórios Melhores resultados no grupo propofol (eventos adverso respiratórios perioperatórios: 39/149 [26%] vs. 64/149 [43%], [RR]: 1,7; IC 95% 1,2‐2,3; p=0,002; eventos adversos respiratórios na indução: 16/149 [11%] vs. 47/149 [32%], RR: 3,06; IC 95%: 1,8 ‐ 5,2, p <0,001) I Schmitz et al. (2018)58 347 crianças (entre um mês e 11 anos) Ensaio clínico duplo cego randomizado Grupo 1 – 1 mg/kg de cetamina e propofol 5 mg/kg/h; grupo 2 recebeu apenas propofol 10 mg/kg/h para sedação para RRM eletiva ‐ O tempo de recuperação no grupo 1 foi significativamente menor – 38 (22‐65) minutos, em comparação com 54 (37‐77) minutos no grupo 2 (diferença entre medianas de 14 minutos (IC 95%: 8‐20) minutos; p <0,001)‐ Grupo 2 apresentou maior EA‐ Sem eventos adversos significativos nos dois grupos II ASA, Sociedade Americana de Anestesiologia; BIS, índice bispectral; EDA, endoscopia digestiva alta; EEG, eletroencefalograma; FC, frequência cardíaca; PAS, pressão arterial sistêmica; PRT, terapia de irradiação de prótons; PTT, tempo de transição do pulso; SEVO, sevoflurano; SIP, síndrome de infusão do propofol; SLC, cortisol salivar; TCI, infusão de controle; TIVA, anestesia intravenosa total; UTI, unidade de terapia intensiva.
- ‐
A dexmedetomidina parece ser mais segura e protetora do tônus das vias aéreas quando comparada ao propofol, especialmente para procedimentos que requerem apenas sedação, como em ressonância magnética (Nível II);
- ‐
Devido à alta heterogeneidade das doses usadas de propofol com ou sem outros agentes indutores concomitantes em procedimentos de emergência, não é possível atestar o benefício da administração conjunta de propofol com midazolam ou cetamina, com mais de 11% de EAs com as misturas (Nível I);
- ‐
O propofol como adjuvante na sedação pré‐operatória parece seguro nas doses de 1‐2mg/kg, facilita a indução anestésica e a manutenção da anestesia intraoperatória (Nível II).
Não há dúvidas que um dos maiores representantes da medicina translacional encontra‐se aqui: a grande maioria dos trabalhos apresentados nas tabelas acima versa sobre o uso do propofol como adjuvante para endoscopia e broncoscopia, a exemplo do que acontece há anos com adultos. Com grande número de trabalhos, esses pacientes já foram avaliados em metanálises, com resultados bem determinados. A revisão mais recente, datada de julho de 2018,26 demonstrou em seis estudos com 273 crianças que receberam propofol que a odds ratio para EAs cardiopulmonares demonstrou ser maior nos pacientes que usaram propofol (1,87; IC 95% 1,09‐3,20; p=0,02). Em 2012, um grupo de Amsterdã27 revisou 182 artigos em busca da melhor opção para sedação para EDA, inclusive 11 ensaios clínicos, com a conclusão de que o propofol era o agente padrão‐ouro para EDA, comparado a todos os demais.
A necessidade de discussão sobre o melhor sedativo veio da inconclusiva metanálise de 2016 publicada pela Cochrane,28 cujo objetivo era avaliar o midazolam como sedativo para procedimentos, concluiu que não era superior em relação à eficácia e segurança após análise de todos os artigos. Juntamente, como já colocado anteriormente, a retirada do hidrato de cloral, importante hipnótico, aumentou a necessidade da substituição da sedação com segurança. Hong et al.29 publicaram em abril desse ano uma metanálise que comparou o propofol a diversos outros regimes de sedação para procedimentos em 249 crianças oriundas de seis metanálises. Apesar de ter provocado maior proporção de hipotensão, sem necessidade de intervenções além de infusão de pequenas alíquotas de solução cristaloide, gerou a mesma proporção de EAs e foi tão eficaz quanto procedimentos feitos com outros fármacos.
O propofol foi examinado pela Cochrane pela última vez em 2011,30 mais especificamente em RNs. Como visto na tabela 2, a grande maioria dos trabalhos é posterior a essa data. Essa metanálise envolveu apenas um ensaio clínico com 66 RNs e na época os autores concluíram que não havia recomendação para o uso rotineiro do propofol nessa população.
Scheiermann et al.31 publicaram metanálise que comparou anestésicos inalatórios com intravenosos para cirurgias pediátricas. Os autores colocam que os resultados podem ter sido enviesados pela heterogeneidade dos artigos selecionados e que a ocorrência de náuseas e vômitos no período pós‐operatório foi menor no grupo que recebeu anestesia intravenosa (OR 0,68; IC 95% 0,48‐0,98, com p=0,04). Schaefer et al.32 avaliaram igualmente 558 pacientes com náuseas e vômitos nesse contexto (devido a reflexos oculovagais) durante cirurgias para estrabismo, em dois grupos – um recebeu propofol como único sedativo – e em pacientes que apenas receberam profilaxia antiemética no período pré‐operatório. Não houve diferença nos EAs em ambos os grupos.
Na tabela 3 está o sumário dos artigos que envolvem o uso de propofol em crianças.33–59
Sumário das recomendações para exames de imagem- ‐
Em pacientes pediátricos submetidos à RM com propofol e sevoflurano, a incidência de agitação de emergência é significativamente menor e deve ser fortemente encorajada (Nível I);
- ‐
Não há evidências de que o propofol, quando comparado ao midazolam, tem menor incidência de EAs respiratórios baseado na medição dos diâmetros das vias aéreas (Nível II);
- ‐
O uso de propofol, em doses de 1‐2mg/kg, demonstrou ser seguro para exames de imagem como RM e EDA, deve ser fortemente considerado pelo seu curto tempo de duração e baixa prevalência de EAs (Nível I);
- ‐
O uso de propofol em infusão contínua para procedimentos fora do centro cirúrgico deve ser limitado aos médicos anestesiologistas; em infusões em bolus, apenas por pessoal treinado e com equipamento para emergências prontamente disponível (Nível I);
- ‐
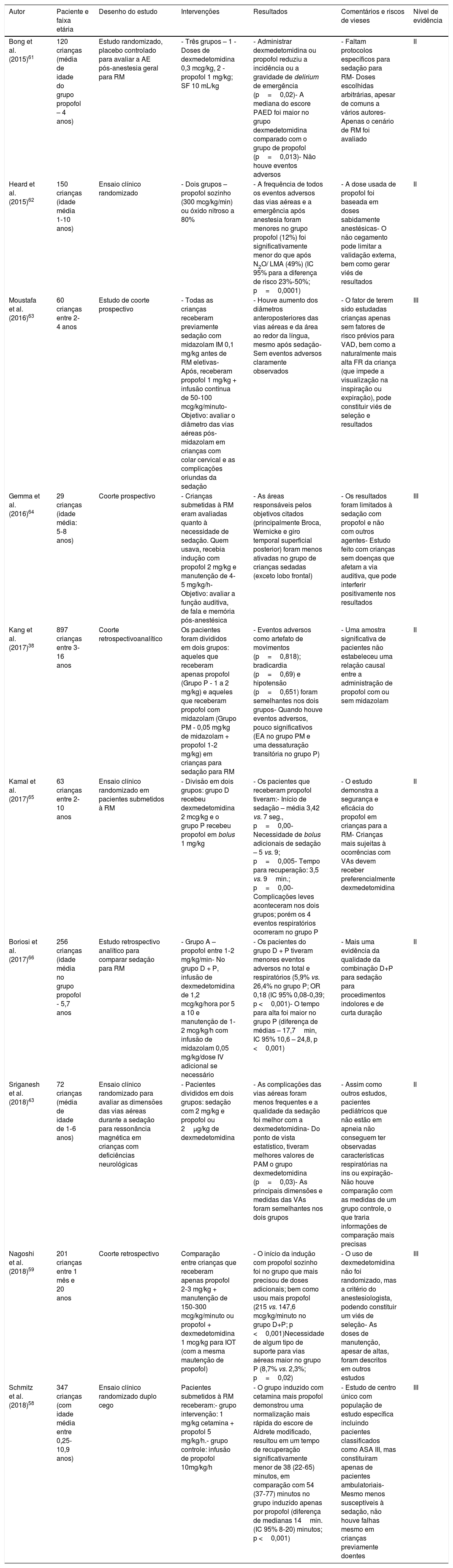
Na tabela 4 estão as principais indicações do uso de propofol de crianças, com ênfase em exames de imagem.38,43,58–66
Tabela 4.Principais indicações do uso de propofol de crianças, com ênfase em exames de imagem
Autor Paciente e faixa etária Desenho do estudo Intervenções Resultados Comentários e riscos de vieses Nível de evidência Bong et al. (2015)61 120 crianças (média de idade do grupo propofol – 4 anos) Estudo randomizado, placebo controlado para avaliar a AE pós‐anestesia geral para RM ‐ Três grupos – 1 ‐ Doses de dexmedetomidina 0,3 mcg/kg, 2 ‐ propofol 1 mg/kg; SF 10 mL/kg ‐ Administrar dexmedetomidina ou propofol reduziu a incidência ou a gravidade de delirium de emergência (p=0,02)‐ A mediana do escore PAED foi maior no grupo dexmedetomidina comparado com o grupo de propofol (p=0,013)‐ Não houve eventos adversos ‐ Faltam protocolos específicos para sedação para RM‐ Doses escolhidas arbitrárias, apesar de comuns a vários autores‐ Apenas o cenário de RM foi avaliado II Heard et al. (2015)62 150 crianças (idade média 1‐10 anos) Ensaio clínico randomizado ‐ Dois grupos – propofol sozinho (300 mcg/kg/min) ou óxido nitroso a 80% ‐ A frequência de todos os eventos adversos das vias aéreas e a emergência após anestesia foram menores no grupo propofol (12%) foi significativamente menor do que após N2O/ LMA (49%) (IC 95% para a diferença de risco 23%‐50%; p=0,0001) ‐ A dose usada de propofol foi baseada em doses sabidamente anestésicas‐ O não cegamento pode limitar a validação externa, bem como gerar viés de resultados II Moustafa et al.(2016)63 60 crianças entre 2‐4 anos Estudo de coorte prospectivo ‐ Todas as crianças receberam previamente sedação com midazolam IM 0,1 mg/kg antes de RM eletivas‐ Após, receberam propofol 1 mg/kg + infusão contínua de 50‐100 mcg/kg/minuto‐ Objetivo: avaliar o diâmetro das vias aéreas pós‐midazolam em crianças com colar cervical e as complicações oriundas da sedação ‐ Houve aumento dos diâmetros anteroposteriores das vias aéreas e da área ao redor da língua, mesmo após sedação‐ Sem eventos adversos claramente observados ‐ O fator de terem sido estudadas crianças apenas sem fatores de risco prévios para VAD, bem como a naturalmente mais alta FR da criança (que impede a visualização na inspiração ou expiração), pode constituir viés de seleção e resultados III Gemma et al. (2016)64 29 crianças (idade média: 5‐8 anos) Coorte prospectivo ‐ Crianças submetidas à RM eram avaliadas quanto à necessidade de sedação. Quem usava, recebia indução com propofol 2 mg/kg e manutenção de 4‐5 mg/kg/h‐ Objetivo: avaliar a função auditiva, de fala e memória pós‐anestésica ‐ As áreas responsáveis pelos objetivos citados (principalmente Broca, Wernicke e giro temporal superficial posterior) foram menos ativadas no grupo de crianças sedadas (exceto lobo frontal) ‐ Os resultados foram limitados à sedação com propofol e não com outros agentes‐ Estudo feito com crianças sem doenças que afetam a via auditiva, que pode interferir positivamente nos resultados III Kang et al. (2017)38 897 crianças entre 3‐16 anos Coorte retrospectivoanalítico Os pacientes foram divididos em dois grupos: aqueles que receberam apenas propofol (Grupo P ‐ 1 a 2 mg/kg) e aqueles que receberam propofol com midazolam (Grupo PM ‐ 0,05 mg/kg de midazolam + propofol 1‐2 mg/kg) em crianças para sedação para RM ‐ Eventos adversos como artefato de movimentos (p=0,818); bradicardia (p=0,69) e hipotensão (p=0,651) foram semelhantes nos dois grupos‐ Quando houve eventos adversos, pouco significativos (EA no grupo PM e uma dessaturação transitória no grupo P) ‐ Uma amostra significativa de pacientes não estabeleceu uma relação causal entre a administração de propofol com ou sem midazolam II Kamal et al. (2017)65 63 crianças entre 2‐10 anos Ensaio clínico randomizado em pacientes submetidos à RM ‐ Divisão em dois grupos: grupo D recebeu dexmedetomidina 2 mcg/kg e o grupo P recebeu propofol em bolus 1 mg/kg ‐ Os pacientes que receberam propofol tiveram:‐ Início de sedação – média 3,42 vs. 7 seg., p=0,00‐ Necessidade de bolus adicionais de sedação – 5 vs. 9; p=0,005‐ Tempo para recuperação: 3,5 vs. 9min.; p=0,00‐ Complicações leves aconteceram nos dois grupos; porém os 4 eventos respiratórios ocorreram no grupo P ‐ O estudo demonstra a segurança e eficácia do propofol em crianças para a RM‐ Crianças mais sujeitas à ocorrências com VAs devem receber preferencialmente dexmedetomidina II Boriosi et al. (2017)66 256 crianças (idade média no grupo propofol ‐ 5,7 anos Estudo retrospectivo analítico para comparar sedação para RM ‐ Grupo A – propofol entre 1‐2 mg/kg/min‐ No grupo D + P, infusão de dexmedetomidina de 1,2 mcg/kg/hora por 5 a 10 e manutenção de 1‐2 mcg/kg/h com infusão de midazolam 0,05 mg/kg/dose IV adicional se necessário ‐ Os pacientes do grupo D + P tiveram menores eventos adversos no total e respiratórios (5,9% vs. 26,4% no grupo P; OR 0,18 (IC 95% 0,08‐0,39; p <0,001)‐ O tempo para alta foi maior no grupo P (diferença de médias – 17,7min, IC 95% 10,6 – 24,8, p <0,001) ‐ Mais uma evidência da qualidade da combinação D+P para sedação para procedimentos indolores e de curta duração II Sriganesh et al. (2018)43 72 crianças (média de idade de 1‐6 anos) Ensaio clínico randomizado para avaliar as dimensões das vias aéreas durante a sedação para ressonância magnética em crianças com deficiências neurológicas ‐ Pacientes divididos em dois grupos: sedação com 2 mg/kg e propofol ou 2μg/kg de dexmedetomidina ‐ As complicações das vias aéreas foram menos frequentes e a qualidade da sedação foi melhor com a dexmedetomidina‐ Do ponto de vista estatístico, tiveram melhores valores de PAM o grupo dexmedetomidina (p=0,03)‐ As principais dimensões e medidas das VAs foram semelhantes nos dois grupos ‐ Assim como outros estudos, pacientes pediátricos que não estão em apneia não conseguem ter observadas características respiratórias na ins ou expiração‐ Não houve comparação com as medidas de um grupo controle, o que traria informações de comparação mais precisas II Nagoshi et al. (2018)59 201 crianças entre 1 mês e 20 anos Coorte retrospectivo Comparação entre crianças que receberam apenas propofol 2‐3 mg/kg + manutenção de 150‐300 mcg/kg/minuto ou propofol + dexmedetomidina 1 mcg/kg para IOT (com a mesma mautenção de propofol) ‐ O início da indução com propofol sozinho foi no grupo que mais precisou de doses adicionais; bem como usou mais propofol (215 vs. 147,6 mcg/kg/minuto no grupo D+P; p <0,001)Necessidade de algum tipo de suporte para vias aéreas maior no grupo P (8,7% vs. 2,3%; p=0,02) ‐ O uso de dexmedetomidina não foi randomizado, mas a critério do anestesiologista, podendo constituir um viés de seleção‐ As doses de manutenção, apesar de altas, foram descritos em outros estudos III Schmitz et al. (2018)58 347 crianças (com idade média entre 0,25-10,9 anos) Ensaio clínico randomizado duplo cego Pacientes submetidos à RM receberam:‐ grupo intervenção: 1 mg/kg cetamina + propofol 5 mg/kg/h.‐ grupo controle: infusão de propofol 10mg/kg/h ‐ O grupo induzido com cetamina mais propofol demonstrou uma normalização mais rápida do escore de Aldrete modificado, resultou em um tempo de recuperação significativamente menor de 38 (22‐65) minutos, em comparação com 54 (37‐77) minutos no grupo induzido apenas por propofol (diferença de medianas 14min. (IC 95% 8‐20) minutos; p <0,001) ‐ Estudo de centro único com população de estudo específica incluindo pacientes classificados como ASA III, mas constituíram apenas de pacientes ambulatoriais‐ Mesmo menos susceptíveis à sedação, não houve falhas mesmo em crianças previamente doentes III ASF, soro fisiológico; EA, agitação de emergência; FR, frequência respiratória; IOT, intubação orotraqueal; PAM, pressão arterial média; RM, ressonância magnética; VAs, vias aéreas.
Este artigo tem algumas limitações. A principal delas é a enorme abrangência do assunto, com muitas publicações. Seria mais conciso separar um cenário clínico, como EDAs, por exemplo, para reduzir o número de artigos analisados. Entretanto, revisões sistemáticas de qualidade em cada um dos cenários analisados já foram publicadas em grande número. Além disso, mesmo com a leitura independente dos resumos dos artigos pelos dois autores, estabelece‐se possível viés de seleção do artigo, o que pode tornar os achados e as conclusões finais incompletos.
ConclusãoO propofol, apesar de antigo hipnótico, tem sido estudado com interesse cada vez maior em crianças, diversos artigos atestam sua eficácia e segurança, especialmente para sedações de curta duração e cujo nível de consciência do paciente não possa deixar de ser avaliado por um tempo curto. Entretanto, recomendamos o uso por equipe pronta e treinada para atender aos diversos eventos adversos de potencial gravidade, principalmente as emergências de vias aéreas. Sua dose ideal, bem como as diversas aplicações, ainda é motivo de estudo e campo a ser explorado.
Conflitos de interesseOs autores declaram não haver conflitos de interesse.
Como citar este artigo: Mekitarian Filho E, Riechelmann MB. Propofol use in newborns and children: is it safe? A systematic review. J Pediatr (Rio J). 2020;96:289–309.
Estudo vinculado a Universidade Cidade de São Paulo (Unicid), São Paulo, SP, Brasil.