Evaluate the effect of probiotics on the symptoms, duration of disease, and the occurrence of new episodes of upper and lower respiratory infections in healthy children.
SourcesIn order to identify eligible randomized controlled trials, two reviewers accessed four electronic databases [Medline/PubMed, Scopus (Elsevier), Web of Science, and Cochrane (Cochrane VHL)], as well as ClinicalTrials.gov until January of 2015. Descriptors were determined by using the Medical Subject Headings tool, following the same search protocol.
Summary of the findingsStudies showed to be heterogeneous regarding strains of probiotics, the mode of administration, the time of use, and outcomes. The present review identified 11 peer‐reviewed, randomized clinical trials, which analyzed a total of 2,417 children up to 10 incomplete years of age. In the analysis of the studies, reduction in new episodes of disease was a favorable outcome for the use of probiotics in the treatment of respiratory infections in children. It is noteworthy that most of these studies were conducted in developed countries, with basic sanitation, health care, and strict, well‐established and well‐organized guidelines on the use of probiotics. Adverse effects were rarely reported, demonstrating probiotics to be safe.
ConclusionsDespite the encouraging results reducing new episodes of respiratory infections, the authors emphasize the need for further research, especially in developing countries, where rates of respiratory infections in children are higher when compared to the high per capita‐income countries identified in this review.
Avaliar o efeito do uso de probióticos na redução dos sintomas, da duração da doença e da ocorrência de novos episódios de infecções respiratórias superior e inferior em crianças saudáveis.
Fontes de dadosCom a finalidade de identificar ensaios clínicos randomizados elegíveis, dois revisores acessaram quatro bases de dados eletrônicas (Medline/PubMed, Scopus [Elsevier], Web of Science e Cochrane [The Cochrane Library]), além do ClinicalTrials.gov, até janeiro de 2015. Foram usados descritores, por meio da ferramenta Medical Subject Headings, e foi seguido um mesmo protocolo de busca.
Síntese dos dadosOs estudos apresentaram grande heterogeneidade em relação às cepas de probióticos, à forma de administração, ao tempo de uso e aos desfechos. Identificamos 11 ensaios clínicos randomizados, revisados por pares, que analisaram 2.417 crianças até 10 anos incompletos. Na análise dos estudos, redução de novos episódios de doença foi o desfecho favorável ao uso dos probióticos no tratamento das infecções respiratórias na criança. Importante salientar que essas pesquisas foram feitas, em sua maioria, em países desenvolvidos, com condições de saneamento, de assistência à saúde e de regulamentação rigorosa ao uso de probióticos bem estabelecidos e organizados. Quanto aos efeitos adversos, pouco relatados, configuram os probióticos como seguros.
ConclusõesApesar do resultado encorajador – redução de novos episódios de infecções respiratórias – destacamos a necessidade de pesquisas futuras, principalmente em países em desenvolvimento, onde as taxas de infecções respiratórias na criança são maiores quando comparadas com as dos países de elevada renda per capita identificados nesta revisão.
As infecções do trato respiratório são comuns na infância e contribuem substancialmente para a morbidade pediátrica e mortalidade em todo o mundo.1 O impacto econômico e social dessas infecções é expressivo e constitui importante desafio na saúde pública, devido aos altos custos para o tratamento, hospitalizações, absenteísmo escolar e perda de dias de trabalho pelos pais e cuidadores.2
A grande variedade de agentes etiológicos, o uso inadequado e em larga escala dos antibióticos, o aumento da resistência bacteriana e a disponibilidade reduzida de vacinas para a maioria dos vírus e bactérias desafiam o surgimento de terapias eficientes e adequadas para o tratamento desse agravo.3
Desde sua apresentação, por Eli Metchnikoff em 1907,4 os probióticos” são cada vez mais usados com o objetivo de beneficiar o sistema imune do hospedeiro humano.5 Definidos pela Organização Mundial de Saúde (OMS) e pela Organização das Nações Unidas para Alimentação e Agricultura (FAO) como “microrganismos vivos que, quando administrados em quantidades adequadas como parte de alimento, conferem efeitos benéficos ao hospedeiro por meio da sua microbiota intestinal”,6 os probióticos encontram uso em ampla escala nos tratos respiratório, gastrointestinal, urogenital, nas doenças alérgicas, autoimunes e cânceres.7–11
Recentes revisões sistemáticas e metanálises têm relatado um positivo, embora modesto, efeito dos probióticos em termos de prevenção das infecções do trato respiratório,12–17 somente uma metanálise avaliou a efetividade dos probióticos na duração das condições respiratórias na criança e no adulto e restringiu‐se aos ensaios clínicos randomizados que usaram apenas os probióticos do gênero Lactobacillus e Bifidobacterium.18
Dessa forma, o objetivo da presente revisão sistemática é explorar e descrever ensaios clínicos que apresentam como desfecho primário o efeito dos probióticos sobre a redução, duração e ocorrência de novos episódios de infecções respiratórias superior e inferior e como desfecho secundário os possíveis eventos adversos do uso desses suplementos em crianças saudáveis, com diferentes cepas de probióticos.
MétodosProtocolo de pesquisaConduzimos nossa revisão sistemática, por meio de um protocolo de pesquisa que foi redigido para guiar a execução de todas as etapas, com o uso de abordagens metodológicas descritas no Manual Cochrane para Revisões Sistemáticas (Cochrane Handbook for Systematic Reviewers)19 e relatados de acordo com os itens de informação para revisões sistemáticas e metanálises.20
Critérios de elegibilidadeEstudos elegíveis para inclusão nesta revisão sistemática foram ensaios clínicos randomizados controlados (ECR) de qualquer duração (estudos fase III) que comparassem cepas de probióticos, únicas ou combinadas, consumidas por qualquer forma de administração, com placebo ou “não tratamento” em crianças aparentemente saudáveis (do nascimento até 10 anos incompletos), que desenvolveram infecção respiratória superior ou inferior aguda em algum momento durante o estudo. Estudos abertos ou cegos foram elegíveis, desde que os pacientes fossem randomizados. As cepas dos probióticos poderiam ser administradas em qualquer dose e associadas ou não com outros ingredientes funcionais (como prebióticos e vitaminas) ou antibióticos, desde que o comparador incluísse os mesmos produtos, de modo que o efeito global poderia ser atribuído ao probiótico usado. Para serem elegíveis para inclusão, os estudos teriam de estar publicados nas línguas portuguesa, inglesa ou espanhola e os resultados deveriam apresentar um ou mais de um dos objetivos do estudo: redução dos sintomas da doença, redução da duração, redução ou não da ocorrência de novos episódios e presença de algum evento adverso.
Os critérios de exclusão foram: ensaios clínicos com perdas de seguimento maiores do que 20%; estudos em animais; estudos sobre prevenção de infecções respiratórias; estudos em crianças que apresentassem alguma imunodeficiência adquirida, congênita ou doença crônica; publicações tipo comentários, editoriais ou cartas; estudos com resultados de outros órgãos acometidos que não fosse o trato respiratório; estudos com busca duplicada, anais de congressos, desenhos de estudos inapropriados (exemplos: estudos observacionais, estudos não randomizados) e estudos em outras línguas que não as mencionadas previamente. Cada artigo identificado foi inicialmente analisado pelo título e resumo e os artigos elegíveis foram selecionados para leitura completa.
Definições dos termos de buscaUsamos inicialmente os seguintes termos e palavras‐chave: (probiotics) AND (respiratory tract infections) AND (infant) AND (children), com as seguintes definições: probiotics – incluiu todas as cepas de bactérias e/ou leveduras potencialmente benéficas ao hospedeiro, administrados por qualquer veículo; respiratory tract infections: superior (resfriado comum, otites média, faringites e sinusites) e inferior (bronquites e pneumonias); infant AND children: todas as crianças do nascimento até 10 anos incompletos.
Estratégia de pesquisa dos estudosA busca eletrônica foi conduzida até janeiro de 2015 nas bases de dados: Medline/PubMed, Scopus (Elsevier), Web of Science (Thomson Reuters Scientific) e Cochrane BVS (The Cochrane Library), com estratégias de busca adaptadas para cada base de dados:
Medline/PubMed(“probiotics”[MeSH Terms] OR “probiotics”[All Fields]) AND (“respiratory tract infections”[MeSH Terms] OR (“respiratory”[All Fields] AND “tract”[All Fields] AND “infections”[All Fields]) OR “respiratory tract infections”[All Fields]) AND (“infant”[MeSH Terms] OR “infant”[All Fields]) AND (“child”[MeSH Terms] OR “child”[All Fields] OR “children”[All Fields]).
Seguindo para detalhar as infecções do trato respiratório: (“probiotics”[MeSH Terms] OR “probiotics”[All Fields]) AND (“common cold”[MeSH Terms] OR (“common”[All Fields] AND “cold”[All Fields]) OR “common cold”[All Fields]) AND (“child”[MeSH Terms] OR “child”[All Fields] OR “children”[All Fields]). A condução dos demais termos foi feita com a substituição da palavra “common cold” por “otitis media”, “sinusitis”, “pharyngitis”, “bronchitis” e “pneumonia” de forma sequencial.
Scopus (Elsevier)(“Probiotics” AND “respiratory tract infections” AND “infant” AND “children”), seguindo a substituição do “respiratory tract infections” por “common cold”, “otitis media”, “sinusitis”, “pharyngitis”, “bronchitis” e “pneumonia” de forma sequencial.
Web of Science (Thomson Reuters Scientific)Com artigos capturados de 1945 até janeiro de 2015 e com a seguinte estratégia de busca: (Probiotics* AND respiratory tract infections* AND infant* AND Children*), seguindo a substituição do respiratory tract infections* por common cold*, otitis media*, sinusites*, pharyngitis*, bronchitis* e pneumonia* de forma sequencial.
Cochrane BVS (Biblioteca Virtual de Saúde)(Probiotics and respiratory tract infections and infant AND children) seguindo a substituição do respiratory tract infections por common cold, otitis media, sinusitis, pharyngitis, bronchitis e pneumonia de forma sequencial.
Foram 52 buscas nas bases de dados, 13 em cada, com o uso dos termos de forma separada e sequencial, para melhor acurácia e precisão.
Extração dos dadosUsamos duas etapas do processo para identificar e selecionar os estudos: primeiro, dois revisores (GVA e MHO) identificaram, de forma independente os títulos e resumos de cada estudo para avaliar se correspondiam aos critérios de inclusão. Segundo, os artigos selecionados foram obtidos na versão texto completo, em seguida foram revisados independentemente, para determinar os critérios de inclusão e exclusão. Quaisquer discrepâncias foram resolvidas por meio de um consenso e/ou consultando um terceiro revisor. Quando possível, autores foram contactados, por e‐mail, em caso de dúvidas, na ausência de dados específicos ou informação adicional.
Informações sobre estudos em curso ou recentemente concluídos, investigação e pesquisa inédita relatada na literatura cinzenta foram obtidos por meio de pesquisa em registros de ensaios (ClinicalTrials.gov) e selecionados os principais procedimentos de conferências (três anos antes da data da pesquisa).
Ainda fez‐se busca manual por meio das referências dos estudos pré‐selecionados e de revisões publicadas sobre o tema.
Os seguintes itens foram coletados: características dos estudos incluídos, como condição clínica, detalhes da intervenção e comparação; avaliação de risco de viés e critério de qualidade dos estudos selecionados. A redução dos sintomas, da duração dos episódios de doença e da possibilidade de reduzir novos episódios das afecções do trato respiratório foi analisada como desfecho primário e se o uso dos probióticos desencadeou algum evento adverso como desfecho secundário.
Avaliação da qualidade e risco de viésNós também avaliamos os estudos pelo risco global de viés (baixo, alto ou indefinido) com base na ferramenta de risco de viés da Cochrane (Cochrane Collaboration's risk of bias tool).21 Para os fins desta revisão, um estudo foi considerado ter um “baixo risco de viés” quando todos os principais critérios de qualidade (ou seja, método de randomização, ocultação da alocação e mascaramento/cegamento), bem como mais outros critérios adicionais (semelhança entre os grupos intervenção e comparação, desistência dos pacientes dos estudos e análise da intenção de tratar) foram adequadamente cumpridos; um “risco indefinido de viés” quando a maioria dos critérios‐chave não foram relatados ou não foram claros; e um “risco elevado de viés” quando um ou mais dos principais critérios não se encontravam de forma adequada. A categoria “algum risco de viés” foi atribuída quando todos os aspectos dos critérios‐chave foram adequados, mas que (1) uma análise de intenção de tratar não foi feita e quando um critério não foi cumprido ou (2) quando dois critérios fundamentais foram adequados, mas uma análise de intenção de tratar não foi feita.
Na análise da qualidade dos estudos randomizados, usamos as recomendações Grade (Grading of Recommendations Assessment, Development, and Evaluation).22 Devido à grande heterogeneidade dos ensaios clínicos, os dados dos estudos foram avaliados qualitativamente, sem emprego de metanálise, seguindo as diretrizes Prisma (Preferred Reporting Items for Systematic Reviews and Meta‐Analyses).23 Para evitar o viés de publicação, estudos não publicados foram identificados, mas não obedeceram aos critérios de inclusão da presente revisão sistemática.
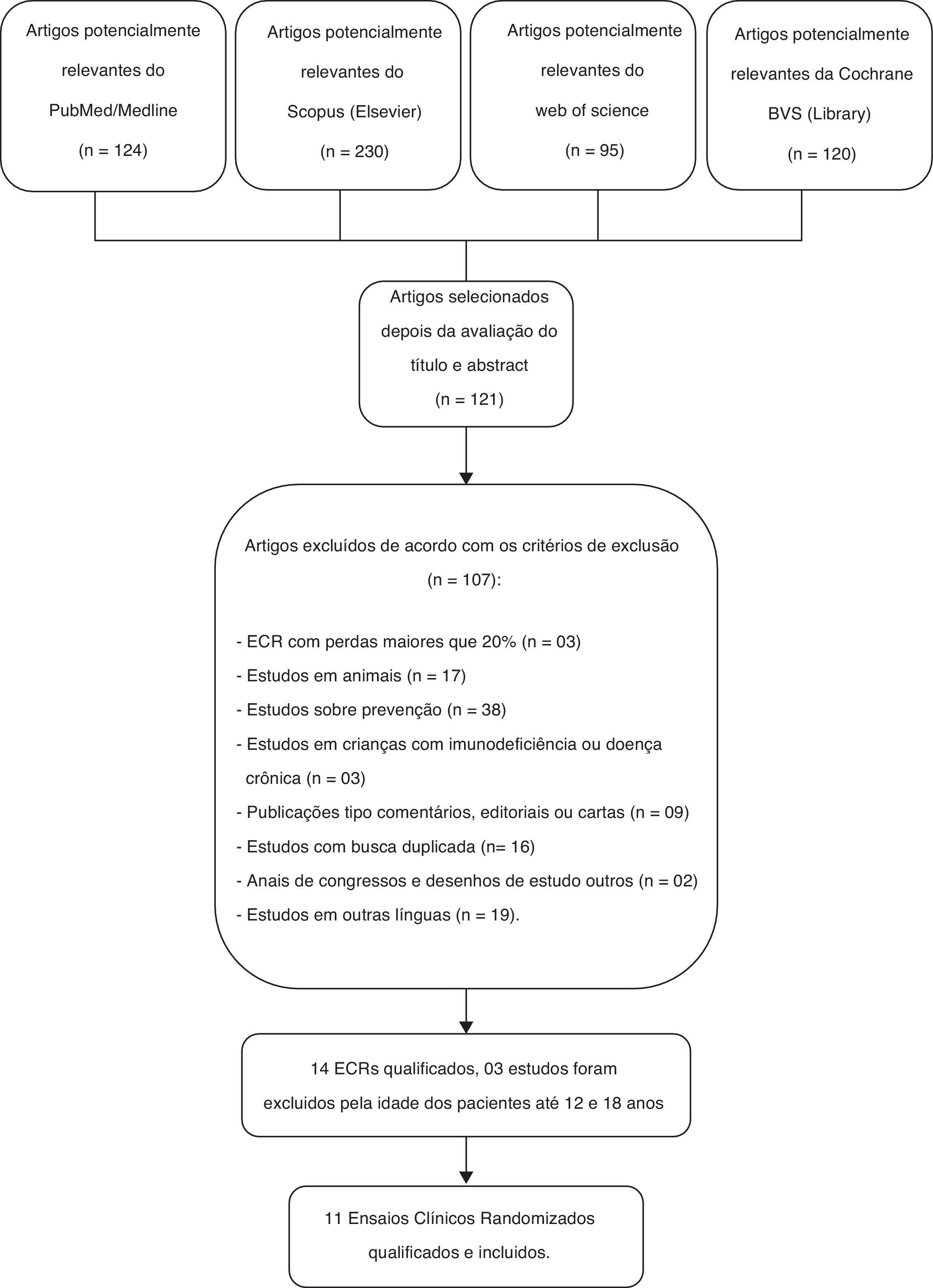
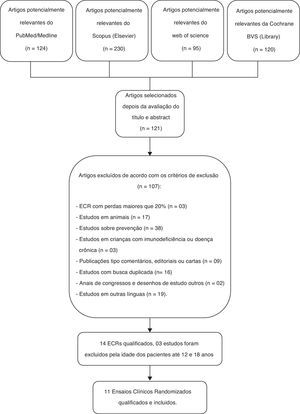
ResultadosDe 569 citações identificadas nas quatro principais bases de dados eletrônicas (PubMed/Medline, Scopus [Elsevier], Web of Science e Cochrane BVS Library), incluímos 11 ensaios clínicos randomizados (ECRs), revisados por pares, que analisaram 2.417 crianças do nascimento até 10 anos incompletos. Os critérios de inclusão foram preenchidos por 11 ECRs, que serviram para identificação dos desfechos primário e secundário da presente revisão sistemática. O processo de seleção dos estudos pode ser visualizado na figura 1.
Diagrama de fluxo do processo de seleção dos ensaios clínicos randomizados para inclusão na revisão sistemática.23
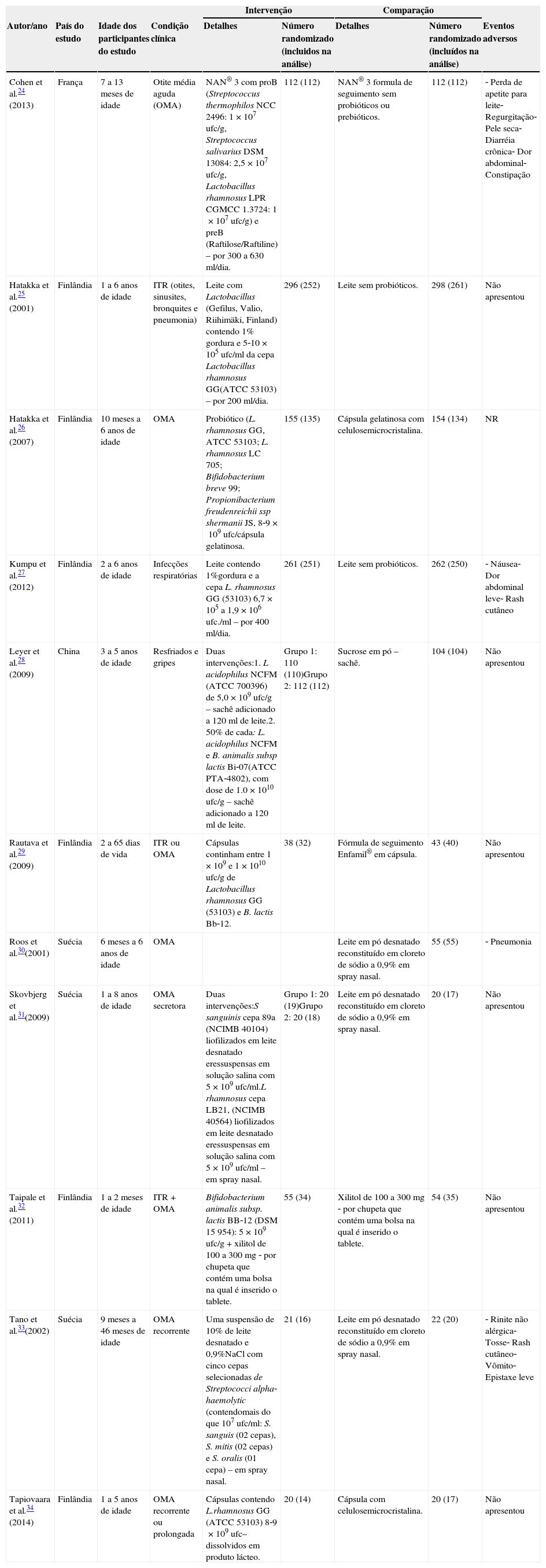
Onze ECRs foram analisados quanto a autor/ano, país do estudo, idade dos participantes, condição clínica, detalhes da intervenção e comparação e números randomizados e incluídos na análise e nos eventos adversos, como descrito na tabela 1. Foram incluídos nesta revisão sistemática os seguintes ensaios clínicos: Cohen et al.;24 Hatakka et al.;25 Hatakka et al.;26 Kumpu et al.;27 Leyer et al.;28 Rautava et al.;29 Roos et al.;30 Skovbjerg et al.;31 Taipale et al.;32 Tano et al.;33 e Tapiovaara et al.,34 que foram feitos na sua grande totalidade em dois países: Finlândia e Suécia. Os demais foram feitos em outros dois países: China e França. A duração do tratamento com probióticos variou de 10 dias a 12 meses, embora a maioria dos ensaios tenha sido feita por cerca de seis a sete meses, durante os meses de inverno.
Características dos ensaios clínicos randomizados e eventos adversos
| Intervenção | Comparação | |||||||
|---|---|---|---|---|---|---|---|---|
| Autor/ano | País do estudo | Idade dos participantes do estudo | Condição clínica | Detalhes | Número randomizado (incluidos na análise) | Detalhes | Número randomizado (incluídos na análise) | Eventos adversos |
| Cohen et al.24 (2013) | França | 7 a 13 meses de idade | Otite média aguda (OMA) | NAN® 3 com proB (Streptococcus thermophilos NCC 2496: 1×107 ufc/g, Streptococcus salivarius DSM 13084: 2,5×107 ufc/g, Lactobacillus rhamnosus LPR CGMCC 1.3724: 1×107 ufc/g) e preB (Raftilose/Raftiline) – por 300 a 630ml/dia. | 112 (112) | NAN® 3 formula de seguimento sem probióticos ou prebióticos. | 112 (112) | ‐ Perda de apetite para leite‐ Regurgitação‐ Pele seca‐ Diarréia crônica‐ Dor abdominal‐ Constipação |
| Hatakka et al.25 (2001) | Finlândia | 1 a 6 anos de idade | ITR (otites, sinusites, bronquites e pneumonia) | Leite com Lactobacillus (Gefilus, Valio, Riihimäki, Finland) contendo 1% gordura e 5‐10×105 ufc/ml da cepa Lactobacillus rhamnosus GG(ATCC 53103) – por 200ml/dia. | 296 (252) | Leite sem probióticos. | 298 (261) | Não apresentou |
| Hatakka et al.26 (2007) | Finlândia | 10 meses a 6 anos de idade | OMA | Probiótico (L. rhamnosus GG, ATCC 53103; L. rhamnosus LC 705; Bifidobacterium breve 99; Propionibacterium freudenreichii ssp shermanii JS, 8‐9×109 ufc/cápsula gelatinosa. | 155 (135) | Cápsula gelatinosa com celulosemicrocristalina. | 154 (134) | NR |
| Kumpu et al.27 (2012) | Finlândia | 2 a 6 anos de idade | Infecções respiratórias | Leite contendo 1%gordura e a cepa L. rhamnosus GG (53103) 6,7×105 a 1,9×106 ufc./ml – por 400ml/dia. | 261 (251) | Leite sem probióticos. | 262 (250) | ‐ Náusea‐ Dor abdominal leve‐ Rash cutâneo |
| Leyer et al.28 (2009) | China | 3 a 5 anos de idade | Resfriados e gripes | Duas intervenções:1. L acidophilus NCFM (ATCC 700396) de 5,0×109 ufc/g – sachê adicionado a 120ml de leite.2. 50% de cada: L. acidophilus NCFM e B. animalis subsp lactis Bi‐07(ATCC PTA‐4802), com dose de 1.0×1010 ufc/g – sachê adicionado a 120ml de leite. | Grupo 1: 110 (110)Grupo 2: 112 (112) | Sucrose em pó – sachê. | 104 (104) | Não apresentou |
| Rautava et al.29 (2009) | Finlândia | 2 a 65 dias de vida | ITR ou OMA | Cápsulas continham entre 1×109 e 1×1010 ufc/g de Lactobacillus rhamnosus GG (53103) e B. lactis Bb‐12. | 38 (32) | Fórmula de seguimento Enfamil® em cápsula. | 43 (40) | Não apresentou |
| Roos et al.30(2001) | Suécia | 6 meses a 6 anos de idade | OMA | Leite em pó desnatado reconstituído em cloreto de sódio a 0,9% em spray nasal. | 55 (55) | ‐ Pneumonia | ||
| Skovbjerg et al.31(2009) | Suécia | 1 a 8 anos de idade | OMA secretora | Duas intervenções:S sanguinis cepa 89a (NCIMB 40104) liofilizados em leite desnatado eressuspensas em solução salina com 5×109 ufc/ml.L rhamnosus cepa LB21, (NCIMB 40564) liofilizados em leite desnatado eressuspensas em solução salina com 5×109 ufc/ml – em spray nasal. | Grupo 1: 20 (19)Grupo 2: 20 (18) | Leite em pó desnatado reconstituído em cloreto de sódio a 0,9% em spray nasal. | 20 (17) | Não apresentou |
| Taipale et al.32 (2011) | Finlândia | 1 a 2 meses de idade | ITR+OMA | Bifidobacterium animalis subsp. lactis BB‐12 (DSM 15 954): 5×109 ufc/g+xilitol de 100 a 300mg ‐ por chupeta que contém uma bolsa na qual é inserido o tablete. | 55 (34) | Xilitol de 100 a 300mg ‐ por chupeta que contém uma bolsa na qual é inserido o tablete. | 54 (35) | Não apresentou |
| Tano et al.33(2002) | Suécia | 9 meses a 46 meses de idade | OMA recorrente | Uma suspensão de 10% de leite desnatado e 0,9%NaCl com cinco cepas selecionadas de Streptococci alpha‐haemolytic (contendomais do que 107 ufc/ml: S. sanguis (02 cepas), S. mitis (02 cepas) e S. oralis (01 cepa) – em spray nasal. | 21 (16) | Leite em pó desnatado reconstituído em cloreto de sódio a 0,9% em spray nasal. | 22 (20) | ‐ Rinite não alérgica‐ Tosse‐ Rash cutâneo‐ Vômito‐ Epistaxe leve |
| Tapiovaara et al.34 (2014) | Finlândia | 1 a 5 anos de idade | OMA recorrente ou prolongada | Cápsulas contendo L.rhamnosus GG (ATCC 53103) 8‐9×109 ufc–dissolvidos em produto lácteo. | 20 (14) | Cápsula com celulosemicrocristalina. | 20 (17) | Não apresentou |
ITR, infecção do trato respiratório; NR, não relatado; OMA, otite média aguda; ufc, unidades formadoras de colônias.
NAN 3®, Enfamil® são leites adequados para crianças.
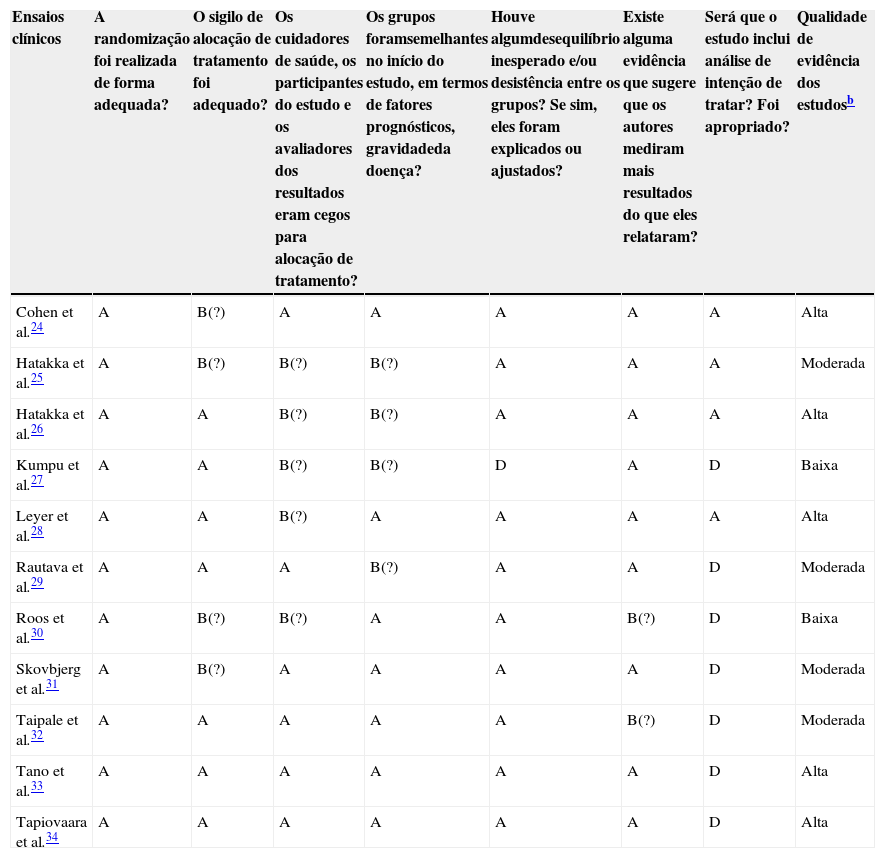
A avaliação da qualidade dos estudos está resumida na tabela 2, em que todos os ensaios usaram métodos corretos de aleatorização, como uma lista de randomização gerada por computador ou por um número aleatório. Apropriado sigilo da alocação foi relatado na maioria dos estudos, incluindo o uso de envelopes fechados24,25,27,30,31,33 e/ou o uso de recipientes/embalagens codificadas que eram idênticos na aparência.26,28,29,32,34 Os indivíduos foram incluídos sequencialmente, de acordo com a lista de randomização, a ocultação foi corretamente feita em sete estudos.26–29,32–34 Entre os 11 ensaios que foram identificados como duplo‐cego, descrições detalhadas dos métodos de cegamento foram fornecidas em seis ECRs.24,29,31–34
Avaliação do risco de viésa e critério de qualidade nos estudos selecionados
| Ensaios clínicos | A randomização foi realizada de forma adequada? | O sigilo de alocação de tratamento foi adequado? | Os cuidadores de saúde, os participantes do estudo e os avaliadores dos resultados eram cegos para alocação de tratamento? | Os grupos foramsemelhantes no início do estudo, em termos de fatores prognósticos, gravidadeda doença? | Houve algumdesequilíbrio inesperado e/ou desistência entre os grupos? Se sim, eles foram explicados ou ajustados? | Existe alguma evidência que sugere que os autores mediram mais resultados do que eles relataram? | Será que o estudo inclui análise de intenção de tratar? Foi apropriado? | Qualidade de evidência dos estudosb |
|---|---|---|---|---|---|---|---|---|
| Cohen et al.24 | A | B(?) | A | A | A | A | A | Alta |
| Hatakka et al.25 | A | B(?) | B(?) | B(?) | A | A | A | Moderada |
| Hatakka et al.26 | A | A | B(?) | B(?) | A | A | A | Alta |
| Kumpu et al.27 | A | A | B(?) | B(?) | D | A | D | Baixa |
| Leyer et al.28 | A | A | B(?) | A | A | A | A | Alta |
| Rautava et al.29 | A | A | A | B(?) | A | A | D | Moderada |
| Roos et al.30 | A | B(?) | B(?) | A | A | B(?) | D | Baixa |
| Skovbjerg et al.31 | A | B(?) | A | A | A | A | D | Moderada |
| Taipale et al.32 | A | A | A | A | A | B(?) | D | Moderada |
| Tano et al.33 | A | A | A | A | A | A | D | Alta |
| Tapiovaara et al.34 | A | A | A | A | A | A | D | Alta |
Cochrane risk‐of‐bias tool foi usada para avaliar o risco de viés para cada estudo ‐ A, baixo risco; B, baixo risco com algumas áreas de incerteza; C, alto risco; D, risco indefinido.
Grade – Alta qualidade, é muito improvável que mude a nossa confiança na estimativa; Moderada, mais pesquisas são susceptíveis de ter um impacto importante sobre a confiança do efeito; Baixa, mais pesquisas são propensas a ter um impacto importante sobre a nossa confiança na estimativa do efeito e é provável que mude a estimativa; Muito baixa, estamos muito incertos sobre a estimativa.
Em geral, os 11 ensaios clínicos foram considerados como tendo um risco “baixo” de viés, com poucos estudos que mostrassem o sigilo de alocação e o cegamento com “baixo” risco com algumas áreas de incerteza. Como todos os critérios de qualidade foram bem indicados, alguns estudos mostraram que a análise de intenção de tratar apresenta um risco indefinido, ou por não ter sido conduzido ou por não ter sido citado em mais da metade dos ensaios.27,29–34 Nenhum estudo mostrou “alto” risco de viés nos principais critérios analisados.
Nos ensaios clínicos que incluíram “resfriados”, “gripes”, “infecções do trato respiratório” e “otite média aguda”, todos os autores dos estudos relataram descrições claras dos sinais, sintomas e diagnósticos dessas condições. Em seis dos ensaios,24–26,28,32,34 um médico confirmou o diagnóstico da infecção e em cinco ensaios27,29–31,33 os sinais e/ou sintomas foram relatadas pelos participantes em um diário. O diagnóstico foi confirmado pelo julgamento de um investigador do estudo.
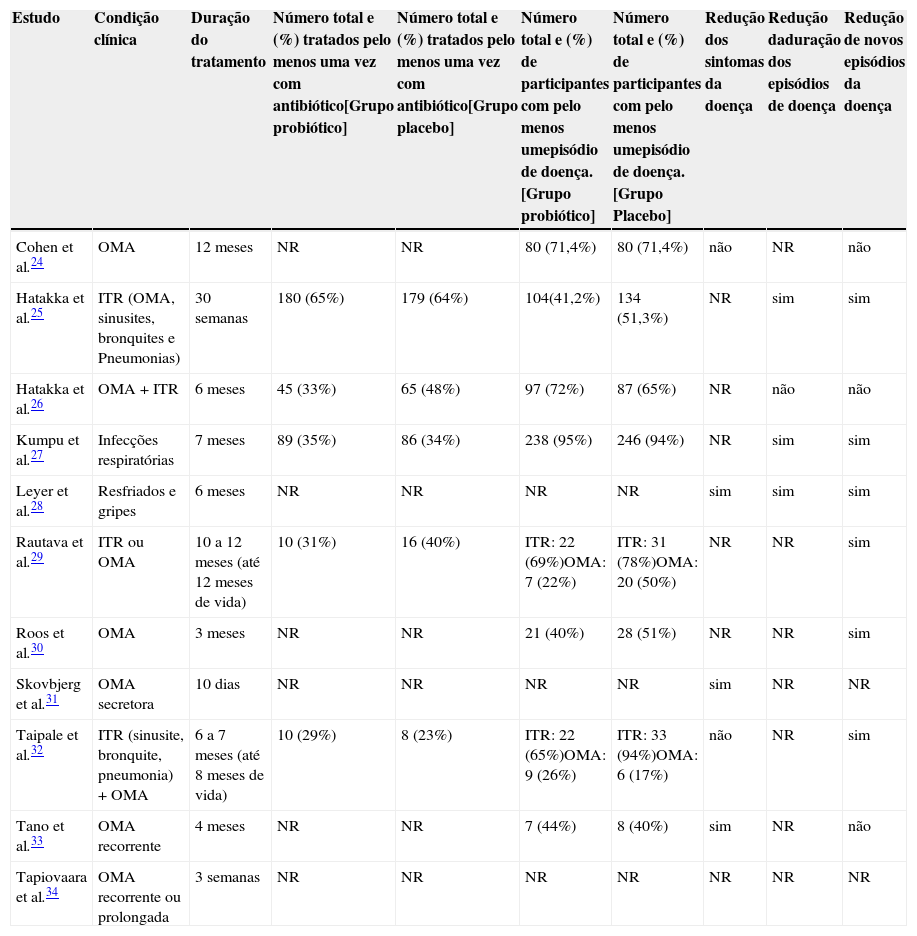
Nos ensaios incluídos, três desfechos principais foram relatados: redução dos sintomas da doença; redução da duração dos episódios de doença; redução de novos episódios da doença. Os resultados dos estudos feitos em crianças são relatados na tabela 3, que mostra também o número total e a percentagem de pacientes que fizeram uso de antibiótico durante o estudo, tanto no grupo probiótico quanto no grupo placebo, e o número total e a percentagem de pacientes que tiveram pelo menos um episódio da doença.
Resultados dos desfechos primários dos estudos
| Estudo | Condição clínica | Duração do tratamento | Número total e (%) tratados pelo menos uma vez com antibiótico[Grupo probiótico] | Número total e (%) tratados pelo menos uma vez com antibiótico[Grupo placebo] | Número total e (%) de participantes com pelo menos umepisódio de doença.[Grupo probiótico] | Número total e (%) de participantes com pelo menos umepisódio de doença.[Grupo Placebo] | Redução dos sintomas da doença | Redução daduração dos episódios de doença | Redução de novos episódios da doença |
|---|---|---|---|---|---|---|---|---|---|
| Cohen et al.24 | OMA | 12 meses | NR | NR | 80 (71,4%) | 80 (71,4%) | não | NR | não |
| Hatakka et al.25 | ITR (OMA, sinusites, bronquites e Pneumonias) | 30 semanas | 180 (65%) | 179 (64%) | 104(41,2%) | 134 (51,3%) | NR | sim | sim |
| Hatakka et al.26 | OMA+ITR | 6 meses | 45 (33%) | 65 (48%) | 97 (72%) | 87 (65%) | NR | não | não |
| Kumpu et al.27 | Infecções respiratórias | 7 meses | 89 (35%) | 86 (34%) | 238 (95%) | 246 (94%) | NR | sim | sim |
| Leyer et al.28 | Resfriados e gripes | 6 meses | NR | NR | NR | NR | sim | sim | sim |
| Rautava et al.29 | ITR ou OMA | 10 a 12 meses (até 12 meses de vida) | 10 (31%) | 16 (40%) | ITR: 22 (69%)OMA: 7 (22%) | ITR: 31 (78%)OMA: 20 (50%) | NR | NR | sim |
| Roos et al.30 | OMA | 3 meses | NR | NR | 21 (40%) | 28 (51%) | NR | NR | sim |
| Skovbjerg et al.31 | OMA secretora | 10 dias | NR | NR | NR | NR | sim | NR | NR |
| Taipale et al.32 | ITR (sinusite, bronquite, pneumonia)+OMA | 6 a 7 meses (até 8 meses de vida) | 10 (29%) | 8 (23%) | ITR: 22 (65%)OMA: 9 (26%) | ITR: 33 (94%)OMA: 6 (17%) | não | NR | sim |
| Tano et al.33 | OMA recorrente | 4 meses | NR | NR | 7 (44%) | 8 (40%) | sim | NR | não |
| Tapiovaara et al.34 | OMA recorrente ou prolongada | 3 semanas | NR | NR | NR | NR | NR | NR | NR |
ITR, infecção do trato respiratório; NR, não relatado; OMA, otite média aguda.
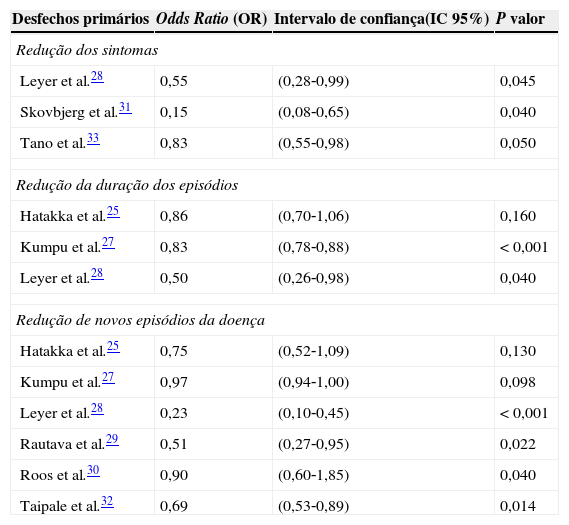
Para melhor avaliação dos desfechos primários, a tabela 4 acrescenta os valores: odds ratio (OR), intervalo de confiança (IC 95%) e valores de p extraídos dos artigos selecionados e que refletem os resultados positivos dos grupos probióticos em relação aos grupos placebos nos ensaios clínicos randomizados.
Valores das medidas de associação dos desfechos primários positivos nos grupos probióticos dos estudos selecionados
| Desfechos primários | Odds Ratio (OR) | Intervalo de confiança(IC 95%) | P valor |
|---|---|---|---|
| Redução dos sintomas | |||
| Leyer et al.28 | 0,55 | (0,28‐0,99) | 0,045 |
| Skovbjerg et al.31 | 0,15 | (0,08‐0,65) | 0,040 |
| Tano et al.33 | 0,83 | (0,55‐0,98) | 0,050 |
| Redução da duração dos episódios | |||
| Hatakka et al.25 | 0,86 | (0,70‐1,06) | 0,160 |
| Kumpu et al.27 | 0,83 | (0,78‐0,88) | < 0,001 |
| Leyer et al.28 | 0,50 | (0,26‐0,98) | 0,040 |
| Redução de novos episódios da doença | |||
| Hatakka et al.25 | 0,75 | (0,52‐1,09) | 0,130 |
| Kumpu et al.27 | 0,97 | (0,94‐1,00) | 0,098 |
| Leyer et al.28 | 0,23 | (0,10‐0,45) | < 0,001 |
| Rautava et al.29 | 0,51 | (0,27‐0,95) | 0,022 |
| Roos et al.30 | 0,90 | (0,60‐1,85) | 0,040 |
| Taipale et al.32 | 0,69 | (0,53‐0,89) | 0,014 |
Entre os estudos incluídos, cinco ECRs24,28,31–33 informaram sobre ter ocorrido ou não a redução dos sintomas da doença, definido como a redução dos sinais e sintomas ou persistência sem melhoria da doença, observados pelo médico envolvido na pesquisa ou de outro médico solicitado nos cuidados da criança e pelo diário de saúde do paciente preenchido pelos pais ou cuidadores. Os dados foram categorizados em “sim” se houve redução dos sinais e sintomas, geralmente apresentados em percentagens nos estudos, “não” quando a percepção dos médicos ou pais e cuidadores não identificou melhoria do padrão de apresentação da doença e “não relatado (NR)” quando o estudo não descrevia esse resultado.
Tendo em conta que todos os estudos foram randomizados em 1:1 no grupo probiótico e placebo, os números de participantes são aproximadamente os mesmos e, portanto, a percepção de melhoria ou não dos sintomas reflete de forma aproximada as diferenças dos resultados em cada grupo, tendo em vista que todos apresentavam os mesmos critérios de elegibilidade definidos em cada estudo. A revisão sistemática revelou que o grupo probiótico de três ECRs teve redução dos sintomas de sua doença.28,31,33 No estudo de Leyer et al.,28 nos grupos de probióticos, único ou combinado, houve redução da febre de 53% e 72,7%, redução da tosse de 41,4% e 62,1% e de rinorreia de 28,2% e 58,8%, respectivamente, em relação ao grupo placebo. No estudo de Skovbjerg et al.,31 com o uso de probiótico em spray, o grupo probiótico teve menos fluido e mais ar no ouvido médio, ou seja, sinais de melhoria ou cura em 36,8% versus 5,8% em relação ao grupo placebo. No estudo de Tano et al.,33 que também usou probiótico em spray, houve redução da otalgia de 10% e da secreção do ouvido médio de 12% do grupo probiótico em relação ao placebo.
Na avaliação do critério duração dos sintomas a maioria dos ECRs25–27,29,30,34 não relatou dados que pudessem ser usados na presente revisão e dois estudos (Cohen et al. e Taipale et al.)24,32 não evidenciaram diferença da redução dos sintomas no grupo probiótico e placebo.
Avaliação da duração dos episódios de doençaDefinida como a soma total de duração dos episódios de doença (em dias) dividida pelo número total de episódios de doença experimentados pelos participantes do estudo. Os resultados mostram que somente três estudos25,27,28 foram incluídos na análise, com sete ECRs que não relataram esse desfecho.24,29–34 No estudo de Hatakka et al.,25 a duração dos episódios foi de 4,9 dias (95% de IC, 4,4‐5,5) versus 5,8 dias (95% de IC, 5,3‐6,4) no grupo probiótico e placebo, respectivamente; no estudo de Kumpu et al.,27 foi de 4,7 dias (95% de IC, 4,5‐4,9) versus 5,6 dias (95% IC, 5,4‐5,9), respectivamente; e no estudo de Leyer et al.,28 a redução foi de 32% no grupo de probiótico com cepa única e de 48% no grupo de probiótico com cepas combinadas, em relação ao grupo placebo. Somente um estudo, Hatakka et al.,26 mostrou que a diferença em relação à duração dos episódios de OMA (otite média aguda) de 5,6 dias (95% de IC, 3,5‐9,4) versus 6,0 dias (95% de IC, 4,0‐10,5) no grupo probiótico e placebo, respectivamente, não alcançou significância estatística.
Avaliação da redução de novos episódios da doençaCaracterizada como “sim” quando houve redução de novos episódios de doença ou redução na incidência da doença e “não” quando não houve significância estatística. Entre os estudos incluídos para esse desfecho, seis ECRs25,27–30,32 apresentaram em seus resultados que o grupo probiótico favorece a redução de novos episódios da doença quando comparado estatisticamente com o grupo placebo. Dois estudos (Skovbjerg et al. e Tapiovaara et al.)31,34 não relataram esses dados em suas conclusões e três estudos24,26,33 mostraram que os grupos probiótico e placebo não diferiram na redução da ocorrência de novos episódios da doença.
Na análise da necessidade do uso do antibiótico nas ocorrências bacterianas das doenças estudadas, cinco ECRs25–27,29,32 descreveram o número total e a percentagem de pacientes tratados pelo menos uma vez com antibiótico nos grupos probiótico e placebo. Em dois estudos (Hatakka et al. e Kumpu et al.)25,27 não houve diferença entre os grupos, em outros dois (Hatakka et al. e Rautava et al.)26,29 a prescrição de antibióticos foi mais evidenciada no grupo placebo e seis estudos não relataram esse desfecho.24,26,30,31,33,34
Para além dos cinco ensaios clínicos que evidenciaram o uso mais frequente de antibiótico no grupo placebo, um estudo32 que comparou Bifidobacterium animalis subsp. lactis BB‐12, em tabletes inseridos na chupeta, com um placebo, em 69 crianças de um a dois meses de idade, na Finlândia, mostrou que o uso do antibiótico foi maior no grupo probiótico, 10 (29%), do que no grupo placebo, oito (23%). Os autores relataram que essa diferença pode ser atribuída ao fato de a amamentação exclusiva ter sido maior no grupo placebo do que no grupo probiótico e conferido maior proteção quanto ao risco de infecções respiratórias. No entanto, há uma incerteza em relação a esse resultado.
Eventos adversosA administração de probióticos parece ter um bom perfil de segurança, pois a maioria dos ECRs25,28,29,31,32,34 não identificou eventos adversos e houve somente um estudo sem relato.26 Dois ensaios clínicos24,27 mostraram eventos adversos leves, como: perda de apetite para leite, regurgitação, pele seca, dor abdominal esporádica, diarreia, náusea, rash cutâneo e constipação. Em dois estudos30,33 que usaram a intervenção e comparação em spray nasal, houve uma criança que teve pneumonia no grupo placebo e foi encorajada a parar o tratamento;30 e no outro estudo os grupos placebo e tratamento foram acometidos de forma leve por rinite, tosse, rash cutâneo, vômito e epistaxe, o que pode ser inerente à forma e técnica de uso do dispositivo.33
DiscussãoIdentificamos uma série de ensaios clínicos randomizados (ECRs), de moderada a alta qualidade em sua maioria, que avaliaram o uso dos probióticos nas infecções do trato respiratório superior e inferior na criança. A forma de apresentação, as doses, as diferentes cepas, os diferentes mecanismos e o tempo de administração dos probióticos fizeram com que esses estudos apresentassem grande heterogeneidade e alterações na análise de sensibilidade, o que dificultou a feitura de uma concomitante metanálise. Na análise dos desfechos primários desta revisão, quanto à redução dos sintomas, da duração do tempo da afecção e de novos episódios da doença, esse último se destacou por ter sido o objetivo da grande maioria dos ECRs. Em seis estudos houve redução de novos episódios de infecções respiratórias, três outros não observaram diferença em seus resultados e dois não relataram este desfecho. Encontramos também um número reduzido de ensaios clínicos que apresentaram eventos adversos com o uso dos probióticos, com quadros leves que não necessitaram de cuidados hospitalares.
Considerando os valores das medidas de associação dos desfechos primários positivos, a presente revisão mostra que na redução dos sintomas os três ensaios clínicos28,31,33 apresentaram tendência a significância estatística, com p‐valores próximos a 0,05, apesar de uma maior amplitude do intervalo de confiança (IC 95%) observada nos estudos de Leyer et al.28 e Skovbjerg et al.31 Na análise da redução da duração dos episódios de doença, somente o estudo de Kumpu et al.27 apresentou significância estatística, o estudo de Leyer et al.,28 apesar de o p‐valor 0,04 ter nível de significância, mostra um amplo intervalo de confiança; e na redução de novos episódios da doença, dos seis ensaios clínicos,25,27–30,32 os estudos de Leyer et al.28 e Taipale et al.32 apresentaram p‐valores e intervalos de confiança significativos. Dois outros estudos25,27 não mostraram dados significativos e os estudos de Rautava et al.29 e Roos et al.30 apresentaram maior amplitude do intervalo de confiança, apesar do p‐valores com significância estatística.
No que concerne ao entendimento do termo – infecções respiratórias – essas são geralmente consideradas infecções dos tratos respiratórios superior e inferior. No entanto, as definições dos termos apresentaram variações entre os estudos. No julgamento por Hatakka et al.,25 otite média aguda e sinusite foram relatados como infecções respiratórias superiores e bronquite aguda e pneumonia como infecções respiratórias inferiores. Em outro estudo, Kumpu et al.27 consideraram infecções respiratórias como sinusite, otite, resfriado comum, pneumonia e bronquite, sem esclarecer a frequência de cada ocorrência em separado.
Em muitos países, as crianças experimentam de três a seis episódios de infecções respiratórias por ano e 40% delas poderiam até sofrer de pelo menos um episódio de otite média aguda, que é uma das mais comuns infecções e complicações bacterianas e uma das principais razões para o tratamento com antibióticos na infância.35,36 Assim, uma redução de novos episódios de infecções respiratórias, com menor tempo de duração e redução dos sintomas, poderia ter grande importância clínica, maior impacto na saúde pública e consequências econômicas positivas, principalmente nos países em desenvolvimento.
Probióticos são microrganismos vivos oferecidos como suplemento alimentar que atuam no intestino do organismo hospedeiro, regulam a microbiota intestinal ou modulam a microbiota em outros segmentos do corpo humano.37 Dessa forma, melhoram a imunidade local e sistêmica, competem com patógenos invasores da integridade local e restauram os microrganismos que conferem segurança e manutenção da saúde do indivíduo. Muitos estudos vêm mostrando o real benefício e a segurança dos probióticos na infância,38–40 atualmente elevados à categoria de Geralmente Reconhecidos como Seguros (Gras) para consumo, conforme compilado pela Food and Drug Administration (FDA) e com inclusão rotineira às fórmulas infantis em alguns países desenvolvidos.41
Neste complexo entendimento dos resultados dos probióticos apontados na literatura científica, destacamos os diversos mecanismos de ação que são esperados no organismo humano: a) funcionalidade microbiológica (por exclusão competitiva ou redução ativa de patógenos por meio da produção de ácidos graxos de cadeia curta e ácidos orgânicos; produção de bacteriocinas e produção de espécies reativas de oxigênio, como o peróxido de hidrogênio) com o objetivo de estabilizar ou melhorar a homeostase microbiana em uma área do corpo e reduzir a invasão e colonização por patógenos; b) funcionalidade nutricional (com produção de vitaminas que agem em todo o organismo do hospedeiro humano); c) funcionalidade fisiológica (com melhoria do trânsito intestinal e das propriedades reológicas das secreções respiratórias) e d) funcionalidade imunológica (com produção de citocinas‐interleucinas (IL)‐10 e interferon (INF)‐¿ que modulam beneficamente a imunidade da mucosa respiratória).42,43 Por meio dos receptores padrões de reconhecimento (PRRs), tais como receptores Toll‐like (TLRs) e receptores NOD‐like (NLDs), os padrões moleculares associados aos patógenos (PAMPs) geram nas células dendríticas respostas imunes, principalmente nas células Th1 ou Tregulatória (Treg), com produção de IL‐12 e IL‐10, respectivamente, com funções de proteção imune contra vírus e bactérias e com funções tolerogênicas para que não haja agressão ao próprio hospedeiro humano.44–46
Recentemente, os membros do Comitê da European Society for Paediatric Gastroenterology Hepatology and Nutrition (ESPGHAN)47 e a Academia Americana de Pediatria (AAP)48 revisaram as evidências para o uso de probióticos em lactentes e crianças e concluíram que as fórmulas probióticas suplementadas para lactentes saudáveis não levantaram preocupações de segurança em relação ao crescimento em estatura e aos efeitos adversos. Por outro lado, não observaram dados relacionados com a segurança do uso de probióticos em longo prazo, assim como não identificaram uniformidade de doses, de cepas e do tempo de uso nos ensaios clínicos randomizados.
Em uma busca de todas as revisões sistemáticas e metanálises na literatura relacionada com o uso de probióticos e infecções do trato respiratório, encontramos que existem seis revisões sistemáticas direcionadas para a prevenção,12–17 bastante heterogêneas, tanto na população estudada, crianças e adultos, como no segmento respiratório avaliado, infecções de vias aéreas superiores e inferiores, quanto ao tipo e às cepas de probióticos analisados. Dessas revisões, o estudo de Saeterdal et al.16 é um sumário dos achados da revisão de Hao et al.,15 detalha as tabelas do artigo que não foram devidamente analisadas. Três fizeram metanálises12,13,15 e identificaram os efeitos benéficos dos probióticos exclusivamente na prevenção das infecções respiratórias. Nas revisões sobre prevenção, Kang et al.12 concluíram, com base na avaliação de dez ensaios clínicos em indivíduos de todas as idades, que há modesto efeito dos probióticos na prevenção dos resfriados comuns; Liu et al.,13 na análise de quatro ECRs com uso apenas de uma cepa de probiótico, concluíram que a administração de Lactobacillus rhamnosus GG tem o potencial de reduzir a incidência de otite média aguda, de infecções respiratórias superiores e do uso de antibiótico; na revisão de Vouloumanou et al.,14 que avaliou 14 ECRs, concluiu‐se que os probióticos podem ter um efeito benéfico na gravidade e na duração dos sintomas, mas não parecem reduzir a incidência de infecções respiratórias; na metanálise de Hao et al.,15 com também 14 ECRs que avaliaram indivíduos de todas as idades, concluiu‐se que probióticos foram melhores do que placebo na redução de episódios de infecções respiratórias superiores e no uso de antibiótico. No recente estudo de Ozen et al.,17 que analisou 14 ECRs conduzidos na população pediátrica, concluiu‐se que uma redução mínima de 5‐10% na incidência de infecções das vias aéreas superiores teria um importante impacto clínico e econômico.
Na única metanálise que avaliou os probióticos exclusivamente no tratamento de infecções respiratórias, King et al.18 incluíram crianças de um a 12 anos, além de adultos e idosos, e analisaram estudos com somente duas cepas de probióticos. Foram 20 ECRs, dez com crianças, e os resultados foram avaliados de forma generalizada, com redução de um dia na duração das doenças. Nenhum comentário de revisões sistemáticas anteriores – relacionadas com o tratamento das infecções respiratórias exclusivamente na criança – nos forneceram dados resumidos sobre a redução dos sintomas da doença, redução da duração dos episódios e de novos episódios de infecções respiratórias e esta revisão fornece novas evidências para esses desfechos.
Esta revisão teve como princípio avaliar a melhor evidência atual disponível na literatura a fim de elucidar os benefícios dos probióticos no tratamento das infecções respiratórias em crianças saudáveis. Foram incluídos ensaios clínicos controlados e randomizados com protocolos bem definidos. Tentou‐se, ao máximo, controlar os possíveis vieses. Tivemos a preocupação de avaliar a qualidade dos estudos pela ferramenta de risco de viés da Cochrane (Cochrane Collaboration's risk of bias tool) e pelo Grade (Grading of Recommendations Assessment, Development, and Evaluation),21,22 atualmente considerado um instrumento mais adequado e preciso do que os critérios Jadad.49
Mesmo com todos os cuidados em produzir esta revisão sistemática, algumas limitações puderam ser identificadas: em primeiro lugar, três ensaios clínicos registrados no ClinicalTrials.gov, incluindo cerca de 650 pacientes, estão em fase de andamento e não puderam ser incluídos na avaliação por falta de dados conclusivos. Futuramente devem ser analisados em uma atualização e poderão, assim, contribuir para identificar os reais benefícios obtidos até o momento; em segundo, enquanto a maioria dos autores dos estudos relatou descrições claras dos sinais e sintomas, o diagnóstico confirmado por um médico foi feito em somente metade dos ensaios. É possível que as infecções agudas possam ter sido subdiagnosticadas ou mais diagnosticadas em alguns desses ensaios clínicos, ou seja, tal como acontece com todos os comentários das revisões sistemáticas, é possível que a adição de publicações no futuro possa alterar os resultados; o terceiro aspecto a ser considerado é que os ECRs divergiram em relação às doses, ao tempo de uso e às formas de administração. Encontramos respostas clínicas em tempos curtos, assim como em tempos prolongados do uso dos probióticos, o que nos faz inferir que o efeito desejado depende da complexidade da infecção, do sítio ativado, das cepas de probióticos usadas e das concentrações administradas em unidades formadoras de colônias (UFC) dos probióticos.
Embora alguns estudos publicados tenham mostrado que a administração de probióticos promove um efeito benéfico em reduzir a ocorrência de novos episódios de infecções respiratórias, principalmente naqueles pacientes com história clínica de infecções repetidas, percebe‐se que ainda há muitas lacunas na nossa compreensão e, portanto, muitas perguntas ainda não respondidas no que concerne à cepa ou às cepas do probiótico mais indicado, às doses necessárias, aos regimes de administração, ao tempo de uso ideal e à segurança do uso prolongado. Há uma necessidade, no exercício da prática pediátrica, de se estabelecer, pelos guidelines e comitês científicos, protocolos padronizados de uso dos probióticos para tratamento das principais infecções respiratórias na criança. Destacamos, também, a necessidade de pesquisas futuras, principalmente em países em desenvolvimento, onde as taxas de infecções respiratórias na infância são maiores quando comparadas com as dos países de elevada renda per capita identificados nesta revisão.
Conflitos de interesseOs autores declaram não haver conflitos de interesse.
Como citar este artigo: de Araujo GV, de Oliveira Junior MH, Peixoto DM, Sarinho ES. Probiotics for the treatment of upper and lower respiratory‐tract infections in children: systematic review based on randomized clinical trials. J Pediatr (Rio J). 2015;91:413–27.