To assess the prevalence of metabolic syndrome‐like symptoms in a population of preterm infants with very low birth weight (<1500g) at 2 years of corrected age and identify the occurrence of associated risk factors.
MethodsCross‐sectional study during a five‐year period, including preterm infants born with very low birth weight evaluated at 2 years of corrected age. Metabolic syndrome‐like symptoms was defined by the presence of three or more of these criteria: abdominal circumference≥90th percentile, fasting blood glucose≥100mg/dL, triglycerides≥110mg/dL, HDL cholesterol≤40mg/dL, and blood pressure≥90th percentile.
ResultsA total of 214 preterm infants with birth weight<1500g were evaluated. The prevalence of metabolic syndrome‐like symptoms at 2 years of corrected age was 15.1%. Arterial hypertension was present in 57.5%, HDL≤40mg/dL in 29.2%, hypertriglyceridemia in 22.6%, and abdominal circumference above the 90th percentile in 18.8%. Only 3.7% had hyperglycemia. The presence of periventricular leukomalacia was an independent risk factor for arterial hypertension at this age (OR 2.34, 95% CI: 0.079–0.69, p=0.008). Overweight and obesity at 2 years of corrected age were independently associated with metabolic syndrome‐like symptoms (OR 2.75, 95% CI: 1.19–6.36, p=0.018).
ConclusionMetabolic syndrome‐like symptoms can be observed in very low birth weight preterm infants as early as 2 years of corrected age. Overweight and early‐onset obesity are significant risk factors for metabolic syndrome‐like symptoms, which deserves appropriate intervention for this high‐risk population.
Avaliar a prevalência de síndrome metabólica “like” em população de crianças prematuras com muito baixo peso de nascimento (< 1500 gramas) aos dois anos de idade corrigida e identificar a ocorrência de fatores de risco associados.
MétodosEstudo transversal que incluiu prematuros nascidos durante um período de cinco anos com muito baixo peso de nascimento, avaliados aos dois anos de idade corrigida. A síndrome metabólica “like” foi definida pela presença de três ou mais desses critérios: circunferência abdominal ≥ percentil 90, glicemia de jejum ≥ 100mg/dL, triglicerídeos ≥ 110mg/dL, colesterol HDL ≤ 40mg/dL e pressão arterial ≥ percentil 90.
ResultadosForam avaliados 214 prematuros abaixo de 1.500 gramas. A prevalência de síndrome metabólica “like” aos dois anos de idade corrigida foi 15,1%. Hipertensão arterial esteve presente em 57,5%, HDL ≤ 40mg/dL em 29,2%, hipertrigliceridemia em 22,6% e aumento da circunferência abdominal acima do percentil 90 em 18,8%. Apenas 3,7% apresentaram hiperglicemia. A presença de leucomalácia periventricular foi um fator de risco independente para hipertensão arterial nessa idade (OR 2,34; IC 95% 0,079‐0,69; p=0,008); sobrepeso e obesidade aos dois anos de idade corrigida foram independentemente associados com síndrome metabólica “like” (OR 2,75, IC 95% CI 1,19‐6,36; p=0,018).
ConclusãoSíndrome metabólica “like” ocorre em prematuros de muito baixo peso tão precocemente quanto dois anos de idade corrigida. Sobrepeso e obesidade de início precoce são fatores de risco significativos para síndrome metabólica “like”, merecem intervenção apropriada para essa população de alto risco.
A prevenção da síndrome metabólica é um desafio na prática clínica do pediatra, associada com um aumento na mortalidade global de 1,5 vezes e mortalidade por doença cardiovascular 2,5 vezes maior.1,2 Em adultos a síndrome metabólica é definida como um grupo de achados que incluem obesidade, resistência insulínica, dislipidemia e hipertensão arterial associados com subsequente desenvolvimento de doença cardiovascular e diabete.2 No entanto, em crianças há falta de valores de referência para seus componentes o que dificulta o diagnóstico de síndrome metabólica. Dessa forma, pontos de corte arbitrários e adaptados de curvas‐padrão para antropometria e para diagnóstico de hipertensão a alterações laboratoriais são alternativamente usados.3
Em adultos jovens nascidos com menos de 34 semanas de gestação o risco cardiometabólico foi 3,7 vezes maior e nos prematuros tardios 2,5 vezes maior quando comparado com aqueles adultos nascidos a termo.4 Singhal et al. investigaram os efeitos da promoção de crescimento precoce na composição corporal em dois estudos com crianças nascidas pequenas para a idade gestacional (PIG) (peso abaixo do percentil 10 no estudo 1 e abaixo do percentil 20 no estudo 2), encontraram uma relação causal entre ganho de peso rápido e precoce com risco para obesidade mais tarde na vida.5 Crianças nascidas prematuramente parecem evidenciar um perfil metabólico semelhante àquelas nascidas PIG ao termo, possivelmente com risco semelhante para síndrome metabólica.5,6
Diversos estudos sugerem relação entre baixo peso de nascimento e síndrome metabólica na idade adulta, mas há escassez de dados que avaliem a prematuridade. Estudos com adolescentes e adultos nascidos prematuros avaliaram componentes isolados da síndrome metabólica, como obesidade ou hipertensão arterial ou resistência insulínica.6–12
Em função da prevalência de síndrome metabólica em fases precoces da vida de população de prematuros de muito baixo peso ainda não ser conhecida, nosso estudo tem o objetivo de avaliar a prevalência de síndrome metabólica “like” em prematuros de muito baixo peso aos dois anos de idade corrigida e identificar a sua associação com fatores de risco perinatais e/ou neonatais.
MétodosEstudo transversal que incluiu prematuros de muito baixo peso (peso de nascimento de 500‐1.499 gramas) nascidos durante um período de cinco anos em um hospital público universitário terciário que receberam alta da neonatologia para o ambulatório de seguimento da instituição. Foram critérios de exclusão: presença de malformações congênitas maiores e erros inatos do metabolismo ou anormalidades cromossômicas, infecções congênitas do grupo STORCH (sífilis, toxoplasmose, rubéola, citomegalovírus, herpes e HIV); comparecimento a menos de três consultas no seguimento após a alta ou óbito no período. No momento da alta hospitalar, os pacientes elegíveis tiveram uma ficha‐protocolo preenchida com todos os dados perinatais e morbidades da internação neonatal por um dos pesquisadores.
Desfechos e variáveisAs variáveis maternas foram: tipo de parto, uso de corticoesteroide antenatal, pré‐eclâmpsia materna, corioamnionite (presença de sinais clínicos como febre materna, hipertonia uterina, líquido amniótico purulento ou com odor fétido, leucocitose materna ou ainda taquicardia fetal) ou presença de infecção urinária (urocultura positiva). Renda familiar (em salários mínimos, convertidos a dólares no momento da coleta do dado, em função de oscilações no poder aquisitivo da moeda do país) e a escolaridade do cuidador principal também foram analisadas.
As variáveis neonatais foram peso de nascimento, idade gestacional (determinada pela melhor estimativa obstétrica com ultrassonografia obstétrica precoce e/ou data da última menstruação e confirmada pelo exame físico pediátrico imediatamente pós‐nascimento), ser pequeno para idade gestacional (abaixo do percentil 10), uso de aminoácidos nas primeiras 24 horas de vida, presença de displasia broncopulmonar (necessidade de oxigênio suplementar com 36 semanas de idade pós‐concepcional) e leucomalácia periventricular (diagnosticada por ultrassonografia cerebral e confirmada pela ressonância magnética do encéfalo).13
A avaliação no seguimento ambulatorial foi feita de acordo com a rotina assistencial do ambulatório da instituição: mensalmente até os seis meses de idade corrigida (IC), a cada dois meses entre sete e 12 meses de IC e após trimestralmente até completar 24 meses de IC. Registrados prospectivamente taxas de aleitamento materno exclusivo e aleitamento materno complementado aos seis meses de idade corrigida; medidas antropométricas de acordo com idade corrigida e gênero, com o uso das curvas da Organização Mundial da Saúde, assim como o IMC calculado para cada criança aos dois anos de idade corrigida, o que definiu sobrepeso/obesidade, quando acima do percentil de cada idade referência.
Todas as amostras de sangue foram coletadas por punção venosa, após 12 horas de jejum, como parte da rotina assistencial do seguimento ambulatorial, que faz exames aos 24 meses de idade corrigida. Os exames de laboratório obtidos foram: triglicerídeos (mg/dL), HDL (mg/dL) e glicose (mg/dL).
As medidas da pressão arterial (PA) foram aferidas no membro superior direito, com manguito de tamanho adequado e com a criança na posição sentada. Após pelo menos meia hora de consulta e quando a criança já estava mais tranquila e brincando, era colocada sentada para aferição da PA; foram três aferições e a média dessas foi usada na análise (mmHg) e comparada com valores de tabela conforme percentil de estatura, idade e gênero, de acordo com diretrizes do Grupo de Trabalho de Hipertensão em Crianças e Adolescentes NHBPEP (National High Blood Pressure Education Program).14 A PA foi aferida de forma não invasiva com o monitor Mindray VS‐800 oscilométrico automático, com uma capacidade de variação de 10‐200mmHg e resolução de 1mmHg (Seattle, WA, USA).
A circunferência abdominal (CA) foi aferida em duplicata com uma fita milimetrada não distensível (aferida em cm) colocada no nível da cicatriz umbilical, no fim da expiração da criança e na posição de ortostatismo. A medida da CA foi feita em todas as crianças aos dois anos de idade corrigida de acordo e o valor de ponto de corte maior ou igual ao percentil 90 para o gênero e a idade foi considerado alterado.15
A fim de determinar a prevalência de síndrome metabólica na nossa população, foi proposto o novo termo para este estudo: síndrome metabólica “like” (SML). A SML foi definida pela presença de alteração em três ou mais dos seguintes critérios propostos por Cook et al: circunferência abdominal ≥ percentil 90, glicemia de jejum ≥ 110mg/dL, triglicerídeos ≥ 110mg/dL, HDL colesterol ≤ 40mg/dL e pressão arterial ≥ percentil 90.16 Em 2003 a Associação Americana de Diabetes reduziu o valor da glicose para ≥100, esse último foi o critério usado no nosso estudo.17
Considerações éticasO projeto de pesquisa e o protocolo de coleta de dados foram aprovados pelo Comitê de Ética e de Pesquisa da nossa instituição. Não houve recusa em assinar o TCLE.
Análise estatísticaO tamanho da amostra foi calculado com base em dois estudos prévios complementares; o primeiro com crianças nascidas a termo e estimado para o grau prematuridade e o segundo uma metanálise que permitiu o cálculo da prevalência na idade adulta relativa ao mais baixo peso de nascimento, permitiu assumir uma estimativa de prevalência de SML de 9% em crianças nascidas de muito baixo peso e detectar 0,5 desvio‐padrão nessas crianças quando comparadas com prematuros com dois anos de idade corrigida.7,18 Para um nível de confiança de 95% e um erro de 5%, um número de 126 crianças foi estimado como necessário.
O programa estatístico empregado foi SPSS (Statistical Package for the Social Sciences) versão 18.0. Foram usados frequências e percentuais para variáveis categóricas; média e desvio‐padrão (média ± DP) ou mediana e amplitude interquartil (p25‐p75). Testes de Mann‐Whitney, qui‐quadrado e t de Student; regressão linear múltipla (cálculo do risco relativo [RR] e intervalo de confiança) e o teste de Hosmer‐Lemeshow. As variáveis com relevância clínica e p < 0,20 na análise univariada foram incluídas no modelo da regressão linear múltipla, quais sejam: corioamnionite materna ou infecção urinária materna, leucomalácia periventricular, alimentação com leite materno complementado (mista) aos seis meses de IC, peso com dois anos de IC e sobrepeso ou obesidade presentes aos dois anos de IC. O modelo foi ajustado para o peso de nascimento e idade gestacional e gênero. O nível de significância foi p < 0,05.
ResultadosNo período do estudo nasceram na instituição 446 prematuros com peso menor ou igual a 1.500 gramas, ocorreram 133 (29,8%) óbitos durante a internação na UTI neonatal e foram excluídos 78 prematuros (24,9%): seis malformações congênitas maiores, duas devido a erros inatos do metabolismo, cinco com toxoplasmose congênita, dois com citomegalovírus, um com herpes, sete com sífilis, seis HIV positivos e 10 óbitos durante o seguimento ambulatorial; 39 outras crianças compareceram a menos de três consultas. Considerados elegíveis para o seguimento ambulatorial 235 prematuros de muito baixo peso, dentre os quais 23 não tiveram dados para definição de SML (9,4%).
Foram estudados 212 (90,6%) dentre os prematuros de muito baixo peso de nascimento elegíveis, cuja média de peso ao nascimento foi de 1.170 ± 232 gramas e idade gestacional 30 ± 2 semanas; 48,9% das crianças eram pequenas para idade gestacional (PIG). Considerando a presença de alteração em três ou mais dos critérios propostos por Cook et al., a prevalência de síndrome metabólica “like” foi 15,1% (32 crianças); 51 crianças apresentaram dois critérios alterados (21,7%); 80 apenas um critério (34%) e 49 (20,8%) apresentaram ausência de qualquer componente proposto para o diagnóstico de SML.
Presença de hipertensão arterial foi o achado isolado mais frequente, em 57,5% da população estudada, seguida por níveis baixos de HDL (29,2%) e hipertrigliceridemia (22,6%). O diagnóstico de obesidade abdominal ocorreu em 18,8% e apenas 3,7% da população apresentaram hiperglicemia.
A análise individualizada de cada critério para SML ajustado para peso de nascimento e idade gestacional mostrou que a presença de leucomalácia periventricular foi um fator de risco independente para hipertensão arterial (OR 2,34; 95% IC 0,079‐0,69; p = 0,008); displasia broncopulmonar foi fator de risco independente para níveis de colesterol HDL ≤ 40mg/dL (OR 2,1; 95% IC 0,063‐0,7; p = 0,012); gênero masculino e muito baixo peso de nascimento (OR 2,48, 95% IC 1,09‐5,61, p = 0,03) foram fatores de risco independentes para presença de hipertrigliceridemia (triglicerídeos ≥ 110mg/dL). Presença de leucomalácia periventricular (OR 1,9, 95% IC 1,59‐6,12; p = 0,05), sobrepeso ou obesidade (OR 2,3, 95% IC 1,38‐2,95; p = 0,04), e baixo nível de educação materna (OR 1,27, 95% IC 1,062‐1,56; p = 0,09) foram fatores de risco independentes para circunferência abdominal ≥ percentil 90. Apesar do número pequeno de crianças com hiperglicemia, sobrepeso ou obesidade foi fator de risco independentemente associado (OR 2,4, 95% IC 1,22‐4,84; p = 0,04) e nascer adequado para idade gestacional teve um efeito protetor contra glicemia de jejum ≥ 100mg/dL (OR 0,063, 95% IC 0,003‐0,82; p = 0,046).
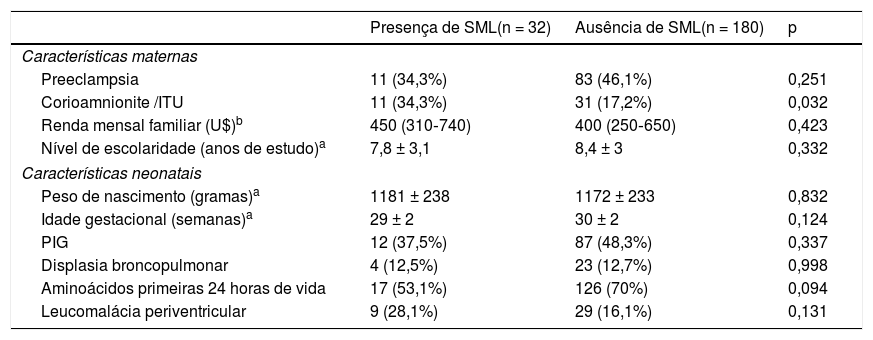
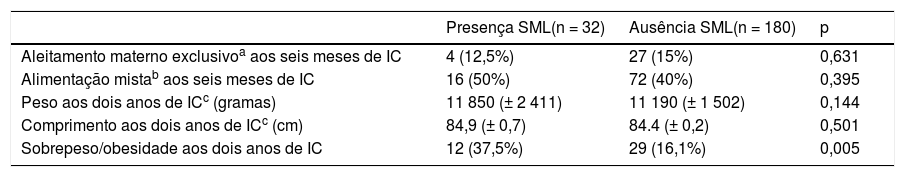
As características dos prematuros de muito baixo peso que se associam com SML são descritas nas tabelas 1 e 2. As crianças com sobrepeso ou obesas aos dois anos de IC e cujas mães tiveram corioamnionite clínica ou infecção urinária na gestação evidenciaram uma prevalência mais elevada de SML na análise univariada. Tal associação não foi observada em relação ao padrão alimentar aos seis meses de IC, peso e comprimento aos dois anos de IC (tabela 2).
Características perinatais dos prematuros de muito baixo peso de acordo com a presença da síndrome metabólica “like” (SML)
| Presença de SML(n = 32) | Ausência de SML(n = 180) | p | |
|---|---|---|---|
| Características maternas | |||
| Preeclampsia | 11 (34,3%) | 83 (46,1%) | 0,251 |
| Corioamnionite /ITU | 11 (34,3%) | 31 (17,2%) | 0,032 |
| Renda mensal familiar (U$)b | 450 (310‐740) | 400 (250‐650) | 0,423 |
| Nível de escolaridade (anos de estudo)a | 7,8 ± 3,1 | 8,4 ± 3 | 0,332 |
| Características neonatais | |||
| Peso de nascimento (gramas)a | 1181 ± 238 | 1172 ± 233 | 0,832 |
| Idade gestacional (semanas)a | 29 ± 2 | 30 ± 2 | 0,124 |
| PIG | 12 (37,5%) | 87 (48,3%) | 0,337 |
| Displasia broncopulmonar | 4 (12,5%) | 23 (12,7%) | 0,998 |
| Aminoácidos primeiras 24 horas de vida | 17 (53,1%) | 126 (70%) | 0,094 |
| Leucomalácia periventricular | 9 (28,1%) | 29 (16,1%) | 0,131 |
ITU, infecção do trato urinário.
Dados apresentados em média ± desvio‐padrão a ou mediana (amplitude interquartil), qui‐quadrado.
Seguimento das crianças prematuras de muito baixo peso aos dois anos de idade corrigida (IC)
| Presença SML(n = 32) | Ausência SML(n = 180) | p | |
|---|---|---|---|
| Aleitamento materno exclusivoa aos seis meses de IC | 4 (12,5%) | 27 (15%) | 0,631 |
| Alimentação mistab aos seis meses de IC | 16 (50%) | 72 (40%) | 0,395 |
| Peso aos dois anos de ICc (gramas) | 11 850 (± 2 411) | 11 190 (± 1 502) | 0,144 |
| Comprimento aos dois anos de ICc (cm) | 84,9 (± 0,7) | 84.4 (± 0,2) | 0,501 |
| Sobrepeso/obesidade aos dois anos de IC | 12 (37,5%) | 29 (16,1%) | 0,005 |
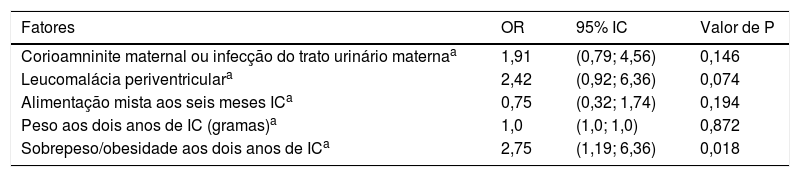
A presença de sobrepeso ou obesidade aos dois anos de IC foi um fator de risco independente para SML, foi observado um risco 2,75 vezes maior de SML em prematuros de muito baixo peso (tabela 3).
Fatores associados com a presença precoce de síndrome metabólica “like” em prematuros de muito baixo peso
| Fatores | OR | 95% IC | Valor de P |
|---|---|---|---|
| Corioamninite maternal ou infecção do trato urinário maternaa | 1,91 | (0,79; 4,56) | 0,146 |
| Leucomalácia periventriculara | 2,42 | (0,92; 6,36) | 0,074 |
| Alimentação mista aos seis meses ICa | 0,75 | (0,32; 1,74) | 0,194 |
| Peso aos dois anos de IC (gramas)a | 1,0 | (1,0; 1,0) | 0,872 |
| Sobrepeso/obesidade aos dois anos de ICa | 2,75 | (1,19; 6,36) | 0,018 |
Análises de regressão logística.
No presente no estudo, síndrome metabólica “like” é um novo termo proposto e que encerra um alerta para os preditores de risco, os quais se encontram em uma escala contínua e interagem entre si de forma complexa na síndrome metabólica na infância, consequentemente a sua própria definição na infância precoce é um desafio, especialmente em população de crianças nascidas prematuras de muito baixo peso de nascimento. Nosso estudo obteve prevalência de 15,1% aos dois de idade corrigida entre crianças prematuras de muito baixo peso, quatro vezes superior a estudo feito com crianças de seis a 16 anos de idade, no qual a prevalência de síndrome metabólica foi de apenas 3,6%,18 e em outra amostra de adolescentes dos Estados Unidos, que obteve prevalência de 4,2% com os mesmos critérios que empregamos.19
A síndrome metabólica tende a ser mais prevalente entre as crianças com mais alto risco, como os nascimentos prematuros e/ou crescimento intrauterino restrito.20 É pertinente a busca por determinar a prevalência dessa condição em fases precoces na vida. Associação entre baixo peso de nascimento ou obesidade precoce e mais tarde doença coronariana, diabete ou diagnóstico de síndrome metabólica tem sido demonstrada em estudos prévios, além da associação desses fatores com anormalidades metabólicas isoladas.20,21 No entanto, até o presente estudo, o reconhecimento precoce dos componentes individuais da síndrome metabólica e a associação desses com fatores de risco perinatais e pós‐natais haviam sido pouco explorados. Revisão sistemática e metanálise de 27 estudos que incluíram prematuros avaliou desfechos associados à síndrome metabólica, mas não foram considerados todos os componentes individuais da síndrome metabólica precocemente como delineado neste estudo.22
A síndrome metabólica não é uma doença, mas um cluster de distúrbios metabólicos, por essa razão até os dias atuais não se conseguiu determinar se ela se associa a prognóstico mais pobre do que os seus componentes de forma individual. No presente estudo, 76,9% das crianças nascidas prematuras tiveram pelo menos um dos componentes individuais que caracterizam a síndrome metabólica alterados; hipertensão arterial foi a alteração mais frequente (57,5%), seguida por baixo HDL (29,2%) e hipertrigliceridemia (22,6%), o que pode ter superestimado o diagnóstico da SM “like”, apesar de que, ao avaliar esses componentes de forma individual, estudos encontraram resultados comparáveis, principalmente considerando que não tenham sido desenhados para essa população de prematuros de muito baixo peso. Além disso, em coorte de pacientes masculinos acompanhados em longo prazo, a presença de síndrome metabólica não foi capaz de predizer mortalidade cardiovascular melhor do que a soma de seus componentes individuais, o que reforça a importância dessa avaliação individual.6,23,24
A prevalência de SML entre nascimentos pequenos para idade gestacional e adequados foi similar. A prematuridade independente da restrição de crescimento intrauterino presente é fator de risco para hipertensão arterial e dislipidemia, os dois mais prevalentes componentes individuais nesse estudo.6 As crianças nascidas PIG e prematuras não sofrem insulto necessariamente similar àquelas nascidas PIG sem a marca da prematuridade; o nascimento com restrição de crescimento intrauterino reflete uma exposição adversa in útero, enquanto a prematuridade é multifatorial e envolve insultos ambientais e extrauterinos, além da exposição adversa intrauterina. Ambas as situações, nascer muito prematuro ou sofrer privação de nutrientes em um período crítico intrauterino, promovem mudanças epigenéticas e resultam em dislipidemia, obesidade e resistência insulínica, os principais componentes da síndrome metabólica.4,12,20,21
A presença de sobrepeso/obesidade aos dois anos de idade corrigida foi independentemente associada com SML. Achado muito significativo para a prevenção, pois, na medida em que há aumento da prevalência de obesidade infantil, o mesmo ocorrerá com a SML. As crianças obesas atualmente estão associadas com maior ocorrência para síndrome metabólica, o que reforça a importância de uma programação metabólica adicional originada pela prematuridade.3,4,20,25 Em prematuros com peso de nascimento abaixo de 1.000 gramas a prevalência de hipertensão e obesidade aos três anos de idade foi elevada, obesidade foi mais prevalente entre as crianças hipertensas.26 Assim, há uma relação previamente descrita entre elevada hipertensão arterial e sobrepeso/obesidade para essa população.
A elevada prevalência de sobrepeso/obesidade pode ser explicada, em parte, pelo fato de a resistência à insulina ser o mecanismo fisiopatológico comum entre a síndrome metabólica e a obesidade em crianças e adolescentes brasileiros.27 Estudo prévio com crianças brasileiras na idade escolar que foram nascidas ao termo reportou taxa de síndrome metabólica de apenas 0,3% quando o peso era normal, 10,7% no sobrepeso e 34,5% nas crianças obesas.18 Nossos achados são similares àqueles do estudo NHANES, cuja prevalência de SM foi 14,5% em adolescentes com sobrepeso e apenas 0,9% quando o peso era normal.28
Associação da presença de hipertensão arterial na infância ou adolescência com a prematuridade é um achado previamente descrito: aos 16 anos, 13,5% dos adolescentes que tiveram peso de nascimento de 600 gramas a 1.250 gramas já estavam hipertensos comparados com apenas 4% dos adolescentes nascidos com peso adequado e ao termo.10 Hack et al. encontraram taxas mais elevadas de hipertensão arterial entre os prematuros de muito baixo peso comparados com seus pares a termo na idade adulta.11 Em coorte de prematuros extremos (idade gestacional abaixo de 28 semanas), as pressões sistólica e diastólica foram significativamente mais elevadas do que nos controles, esse resultado se manteve dos oito anos até os 18 anos e da mesma forma que nosso estudo esses autores encontraram associação com sobrepeso aos dois anos.29 Posod et al. encontraram hipertensão sistólica e diastólica, hipercolesterolemia, hiperglicemia de jejum e indicadores de resistência à insulina em crianças nascidas prematuras. Isso permite concluir que prematuros têm um risco de doença cardiovascular tão precoce quanto a idade escolar.30
A presença de leucomalácia periventricular foi fator de risco independente para hipertensão arterial, reforçou a conhecida hipótese de que experiências que envolvem uma resposta inflamatória fetal e stress intrauterino, como a corioamnionite materna e/ou infecção materna envolvidas na patogênese da leucomalácia, estão presentes muito precocemente na vida e avançam ao período pós‐natal de forma sustentada com um pacote de morbidades, inclusive a leucomalácia periventricular, com consequências duradouras para o prematuro, como a hipertensão arterial na infância, adolescência ou idade adulta.20,31,32
A despeito da importância de nossos dados, algumas limitações devem ser consideradas, particularmente quanto ao diagnóstico precoce de síndrome metabólica em prematuros, uma vez que não há uma referência na literatura que ampare esse diagnóstico tão precocemente na vida quanto dois anos de idade corrigida.20 Por essa razão, desenvolvemos uma definição para síndrome metabólica “like” a partir de critérios práticos, acessíveis e com reprodutibilidade empregados em adultos e adolescentes, já que o diagnóstico de síndrome metabólica permanece controverso.3,24 Apesar da presença de diversas combinações dos cinco componentes para definição da síndrome metabólica entre os adultos, nas crianças é diferente; presença de obesidade é o principal componente.23,32 Não estudamos resistência à insulina, uma anormalidade detectável em indivíduos com baixo peso. Entretanto, os níveis de ponto de glicemia recomendados pela American Diabetes Association foi o que usamos por serem facilmente aplicáveis e reprodutíveis em estudos e na prática clínica.14,17,33
Os hábitos alimentares e a história familiar alimentar, dois fatores importantes relacionados ao perfil metabólico, não puderam ser adequadamente avaliados após os seis meses de idade corrigida devido a limitações de questionários com recordatórios alimentares com mães ou cuidadores após os seis meses de idade, da mesma forma que em coorte prévia que avaliou a pressão arterial de prematuros de muito baixo peso sem correlacionar com o consumo alimentar.11 Ainda assim, a amostra foi homogênea para esses fatores. Todos os cuidadores receberam a mesma orientação dietética (inclusive orientação sobre o momento da introdução de alimentos complementares) e as crianças receberam o mesmo acompanhamento e a mesma orientação nutricional conforme rotina do seguimento ambulatorial, razão pela qual o critério de exclusão das avaliações foi o comparecimento a menos de três consultas no seguimento após a alta.
Foi possível estabelecer o diagnóstico e a prevalência de SML de forma confiável em prematuros de muito baixo peso tão cedo quanto aos dois anos de idade corrigida, nessa idade já foi elevada. Da mesma forma, seus componentes individuais, dos quais a hipertensão arterial foi o mais prevalente em prematuros de muito baixo peso aos dois anos. A presença de sobrepeso e obesidade aos dois anos de idade corrigida é importante sinal de alerta para presença precoce de síndrome metabólica “like” e deve ser continuadamente prevenida.
FinanciamentoO estudo recebeu apoio da Fundação Instituto de Pesquisas Econômicas (Fipe)‐Hospital de Clínicas de Porto Alegre (HCPA) e do Programa de Pós‐Graduação em Saúde da Criança e do Adolescente da Universidade Federal do Rio Grande do Sul (UFRGS).
Conflitos de interesseOs autores declaram não haver conflitos de interesse.
Vania Naomi Hirakata e Luciano SP Guimarães pela assistência com a análise estatística, equipe multiprofissional do Ambulatório da Neonatologia do HCPA, pacientes e suas famílias.
Como citar este artigo: Heidemann LA, Procianoy RS, Silveira RC. Prevalence of metabolic syndrome-like at 2 years of corrected age in very low birth weight preterm infants and associated factors. J Pediatr (Rio J). 2019;95:291–7.