Mold exposure in early life may be associated with development of atopic dermatitis; however, studies of this link are inconclusive and evidence for the underlying mechanism(s) is lacking. This study identified the association between the time of mold exposure and development of atopic dermatitis and investigated the underlying mechanisms.
MethodThe association between atopic dermatitis and mold exposure was examined in the Cohort for Childhood Origin of Asthma and Allergic Diseases birth cohort study (n=1446). Atopic dermatitis was diagnosed at 1 year of age by pediatric allergists. Exposure to mold was assessed by questionnaire. The Illumina MiSeq platform was used to examine the environmental mycobiome in 20 randomly selected healthy infants and 20 infants with atopic dermatitis at 36 weeks of gestation.
ResultsPrenatal, but not postnatal, mold exposure was significantly associated with atopic dermatitis (adjusted odds ratio, 1.36; 95% confidence interval, 1.01-1.83). Levels of total serum IgE at 1 year of age were higher in infants with atopic dermatitis exposed to mold during pregnancy than in healthy infants not exposed to mold during pregnancy (p=0.021). The relative abundance of uncultured Ascomycota was higher in infants with atopic dermatitis than in healthy infants. The relative abundance of uncultured Ascomycota correlated with total serum IgE levels at 1 year of age (r=0.613, p<0.001).
ConclusionIndoor mold exposure during the fetal period is associated with development of atopic dermatitis via IgE‐mediated allergic inflammation. Avoidance of mold exposure during this critical period might prevent the development of atopic dermatitis.
A exposição ao mofo no início da vida pode estar associada ao desenvolvimento de dermatite atópica; contudo, os estudos sobre esse vínculo são inconclusivos e faltam evidências dos mecanismos subjacentes. Identificamos a associação entre o momento da exposição ao mofo e o desenvolvimento de dermatite atópica e investigamos os mecanismos subjacentes.
MétodoA associação entre dermatite atópica e exposição a mofo foi examinada em um estudo de coorte de nascimento da Origem da Asma e de Doenças Alérgicas em Crianças (COCOA) (n=1446). A dermatite atópica foi diagnosticada em pacientes com um ano de vida por pediatras alergistas. A exposição ao mofo foi avaliada por um questionário. A plataforma Illumina MiSeq foi utilizada para examinar o microbioma ambiental em 20 neonatos saudáveis escolhidos aleatoriamente e 20 com dermatite atópica a 36 semanas de gestação.
ResultadosA exposição pré‐natal, porém não pós‐natal, ao mofo foi significativamente associada à dermatite atópica (razão de chances ajustada, 1,36; intervalo de confiança de 95%, 1,01-1,83). Os níveis séricos totais de Imunoglobulina E (IgE) no primeiro ano de vida foram maiores em neonatos com dermatite atópica expostos a mofo durante a gravidez do que em neonatos não expostos a mofo durante a gravidez (p=0,021). A abundância relativa de Ascomycota não cultivado foi maior em neonatos com dermatite atópica do que em neonatos saudáveis. A abundância relativa de Ascomycota não cultivado correlacionou‐se com os níveis séricos totais de IgE no primeiro ano de vida (r=0,613, p<0,001).
ConclusãoA exposição ao mofo no ambiente domiciliar durante a gravidez está associada ao desenvolvimento de dermatite atópica por meio de reação alérgica mediada por IgE. A prevenção à exposição ao mofo durante o período crítico da gravidez pode prevenir o desenvolvimento de dermatite atópica.
A prevalência de dermatite atópica (DA) apresentou aumento de acordo com a região e a situação socioeconômica.1–3 Inúmeros fatores ambientais podem contribuir para o aumento de DA, ao passo que uma dieta saudável e a aplicação de emolientes podem desempenhar um papel na prevenção.4
Entre diversos fatores ambientais, a exposição ao mofo durante o início da vida é um fator de risco potencial para o desenvolvimento de doenças alérgicas, inclusive a DA, embora os estudos sejam inconclusivos.5,6 Os resultados inconsistentes podem ser atribuídos ao menos em parte a diferenças no momento da exposição ao mofo. Semelhantemente à exposição a bactérias,7 a exposição ao mofo, especialmente durante períodos críticos da gestação, pode desempenhar um papel na formação do sistema imunológico, afeta, assim, o desenvolvimento da DA. Estudos anteriores da associação entre a exposição ao mofo e o desenvolvimento de DA tiveram como foco o efeito do microbioma da pele, inclusive de espécies Malassezia, na DA.8 Entretanto, não existem muitos estudos da associação entre a exposição ao mofo ambiental e a DA e os efeitos imunomodulatórios da exposição ao mofo continuam pouco conhecidos.
Portanto, o objetivo deste estudo foi examinar a associação entre o momento da exposição ao mofo e o desenvolvimento de DA e investigar os mecanismos subjacentes à relação entre a exposição ao mofo no ambiente domiciliar, especialmente nos períodos críticos da gestação, e o desenvolvimento de DA.
Material e métodosPopulação estudadaO estudo foi feito de novembro de 2008 a dezembro de 2015 como parte do estudo de coorte de nascimento prospectivo da Origem da Asma e de Doenças Alérgicas em Crianças (Cocoa) (tabela 1).9 A DA em neonatos com um ano de vida foi diagnosticada por pediatras alergistas com os critérios de Hanifin e Rajka.10 O Índice da Pontuação de Dermatite Atópica (Scorad), que é um índice combinado que reflete a extensão, a gravidade e os sintomas da AD, foi avaliado em recém‐nascidos com DA.11 O protocolo do estudo foi aprovado pelo Conselho de Revisão Institucional (IRB) do Centro Médico de Asan. O consentimento informado foi fornecido pelos pais de cada neonato e confirmado pelo IRB.
Características demográficas da população estudada
| Variável | N (%) ou média±DP |
|---|---|
| Número | 1446 |
| Idade da mãe (anos) | 33,04±3,54 |
| Histórico de doenças alérgicas dos pais | |
| Não | 1160 (70,2) |
| Sim | 492 (29,8) |
| Estação do nascimento | |
| Primavera | 314 (21,7) |
| Verão | 327 (22,6) |
| Outono | 360 (24,9) |
| Inverno | 445 (30,8) |
| Nível de escolaridade da mãe | |
| ≤ Ensino Médio | 76 (5,3) |
| ≤ Universidade | 1053 (72,8) |
| ≥ Pós‐Graduação | 316 (21,9) |
| Gênero da criança | |
| Menino | 685 (47,4) |
| Menina | 761 (52,6) |
| Idade gestacional (semanas) | 39,18±1,20 |
DP, desvio padrão.
Para investigar a presença de manchas úmidas visíveis e mofo nas casas dos participantes, pedimos aos pais que preenchessem um questionário com 36 semanas de gestão e aos seis meses. A cada visita de acompanhamento, os pais eram perguntados “Vocês encontraram manchas úmidas e mofos na casa de vocês?”12,13
Amostragem e análise de mofo dentro das casasCom 36 semanas de gestão, foram coletadas, de todos os participantes do estudo de coorte de nascimento Cocoa, amostras de poeira do quarto em que a mulher grávida passava a maior parte do tempo, por meio de um aspirador de pó (Electrolux®, Estocolmo, Suécia). As amostras foram colhidas no mesmo horário do dia e congeladas imediatamente a ‐70°C. Foi analisado o microbioma de 20 neonatos saudáveis escolhidos aleatoriamente e 20 neonatos com DA que participavam do estudo prospectivo Cocoa. O DNA do fungo foi extraído por meio do kit para solo FastDNA SPIN (Qbiogene, MP Biomedicals, Illkirch, França). A análise dos microbiomas ambientais na 36ª semana de gestão foi feita por meio da plataforma Illumina MiSeq (Illumina®, CA, EUA). A diversidade e a composição do microbioma dos dois grupos foram então comparadas.
Medição dos níveis séricos totais de IgEA IgE sérica total a um ano de idade foi medida em todos os participantes por meio de amostras de sangue, com o sistema ImmunoCAP (ThermoFisher, Uppsala, Suécia). O menor limite de detecção foi de 2 kU/L.14
Análise de dadosForam avaliadas relações significativas por meio de um modelo de regressão logística ajustado à idade da mãe, ao índice de massa corporal da mãe, ao nível de escolaridade materna, ao sexo, ao histórico de doenças alérgicas dos pais e à estação do nascimento. Para identificar o efeito da exposição ao mofo na gravidez, os dados foram ajustados à exposição ao mofo na infância e para identificar o efeito da exposição na infância os dados foram ajustados à exposição ao mofo na gravidez. As relações entre os biomarcadores e a abundância relativa de um mofo específico foram analisadas por meio de testes de correlação Pearson. Os dados foram analisados com o software SPSS versão 21.0 (SPSS Inc., Chicago, IL, EUA). Um valor de P de 0,05 ou menos foi considerado significativo.
ResultadosAssociação entre exposição a mofo e desenvolvimento de DA, de acordo com o momento da exposiçãoA exposição pré‐natal a mofo foi associada a um risco mais elevado de DA no primeiro ano de vida (razão de chances ajustada [aOR], 1,36; intervalo de confiança de [IC de 95%], 1,01-1,83), mesmo quando os dados foram ajustados à exposição pós‐natal a mofo (tabela 2). Não houve associação entre o risco de DA e a exposição a mofo durante o primeiro ano de vida (aOR, 0,83; IC de 95%, 0,61‐1,13), mesmo após o ajuste para exposição a mofo durante o período pré‐natal.
Associação entre a exposição a mofo e a DA relatada pelos pais e diagnosticada por um médico no primeiro ano de vida, de acordo com o momento da exposição
| Momento da exposição ao mofo | DA, n (%) | Razão de chances (OR)(Intervalo de confiança de 95%) | DA, n (%) | Razão de chances ajustada (aOR)a(Intervalo de confiança de 95%) | DA, n (%) | aORb | |
|---|---|---|---|---|---|---|---|
| Durante a gravidez | (‐) | 186/1065 (17,5) | 1 | 179/1016 (17,6) | 1 | 179/1016 (17,6) | 1 (ref.) |
| (+) | 85/381 (22,3) | 1,36 (1,02–1,81) | 83/369 (22,5) | 1,36 (1,01–1,83) | 83/369 (22,5) | 1,36 (1,01–1,83) | |
| Durante os primeiros 6 meses de vida | (‐) | 187/921 (20,3) | 1 | 178/871 (20,4) | 1 | 178/871 (20,4) | 1 (ref.) |
| (+) | 73/421 (17,3) | 0,82 (0,61–1,11) | 72/407 (17,7) | 0,83 (0,61–1,13) | 72/407 (17,7) | 0,83 (0,61–1,13) |
Os dados são apresentados em “n” ou “%”.DA, dermatite atópica.
A significância em negrito significa que o risco de DA estava aumentado em lactentes com exposição ao mofo durante o período pré‐natal, em comparação com aqueles sem exposição ao mofo durante o mesmo período, utilizando‐se um modelo de regressão logística.
As características dos neonatos e os dados do microbioma ambiental durante a gravidez são apresentados na tabela 3. Com relação aos 20 recém‐nascidos com DA, o índice Scorad no primeiro ano de vida foi de 14,37±18,91. O percentual de eosinófilos no sangue do cordão umbilical foi significativamente maior em recém‐nascidos com DA do que em neonatos saudáveis. Não houve diferença significativa entre os grupos em termos de histórico familiar de doenças alérgicas.
Características dos dados da população estudada e do microbioma
| Variável | Neonatos saudáveis(n=20) | Neonatos com DA(n=20) | P valora |
|---|---|---|---|
| Idade gestacional (semanas) | 39,18±1,22 | 39,53±1,06 | 0,339 |
| Sexo masculino, n (%) | 10/20 (50,0) | 12/20 (60,0) | 0,525 |
| Peso ao nascer, media±DP (g) | 3088,33±264,63 | 3043,58±849,39 | 0,832 |
| Índice Scorad | NA | 14,37±18,91 | NA |
| Histórico de doenças alérgicas dos pais [sim, n (%)] | 12/20 (60,0) | 12/19 (63,2) | 0,839 |
| Eosinófilos no sangue do cordão umbilical (%) | 2,53±1,60 | 4,20±1,32 | 0,011 |
| Nível sérico total de IgE no sangue do cordão umbilical transformado em logaritmo, média±DP (kUA/L) | ‐2,02±0,34 | ‐1,24±0,89 | 0,012 |
| Nível sérico total de IgE no primeiro ano de vida transformado em logaritmo, média±DP (kUA/L) | 1,11±0,51 | 1,43±0,56 | 0,077 |
DA, dermatite atópica; DP, desvio padrão; n, número; NA, não aplicável; Scorad, Pontuação da Dermatite Atópica.
Os níveis de eosinófilos no sangue do cordão umbilical (%) e os níveis séricos log‐transformados de IgE total no sangue do cordão umbilical estavam aumentados significativamente em lactentes com DA em comparação com lactentes saudáveis e são indicados em negrito.
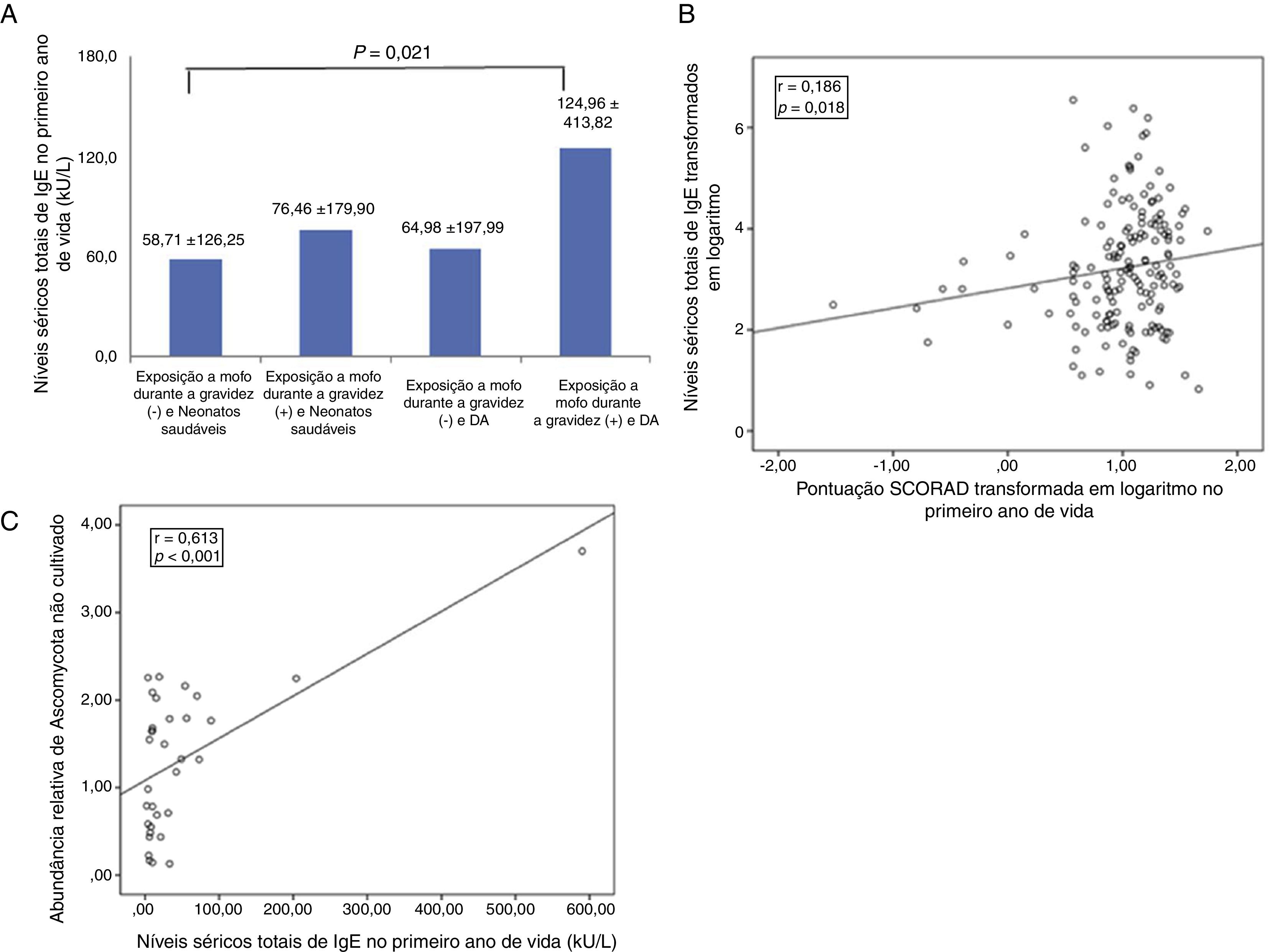
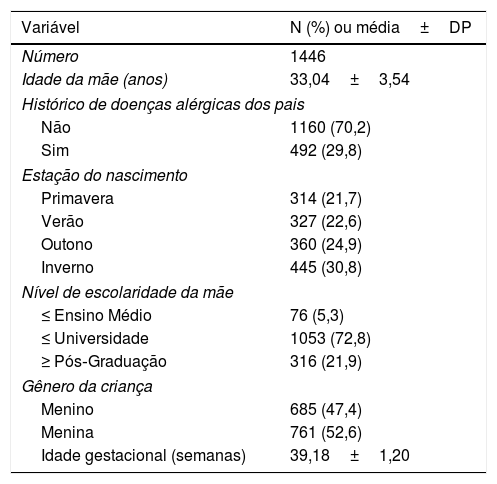
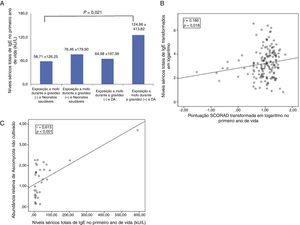
Os níveis séricos totais de IgE foram significativamente maior em neonatos com DA expostos a mofo durante a gravidez do que em recém‐nascidos saudáveis não expostos a mofo (média±desvio padrão, 124,96±413,82 kU/L em comparação com 58,71±126,25 kU/L; p=0,021) (fig. 1A). Mesmo em neonatos com DA, a IgE sérica total estava menor nos recém‐nascidos que não foram expostos a mofo durante a gravidez (64,98±197,99 kU/L em comparação com 124,96±413,82 kU/L), embora a diferença não seja significativa. Os níveis séricos totais de IgE transformados em logaritmo no primeiro ano de vida de neonatos com DA correlacionam‐se com o índice Scorad no primeiro ano de vida (r=0,186, p=0,018) (fig. 1B).
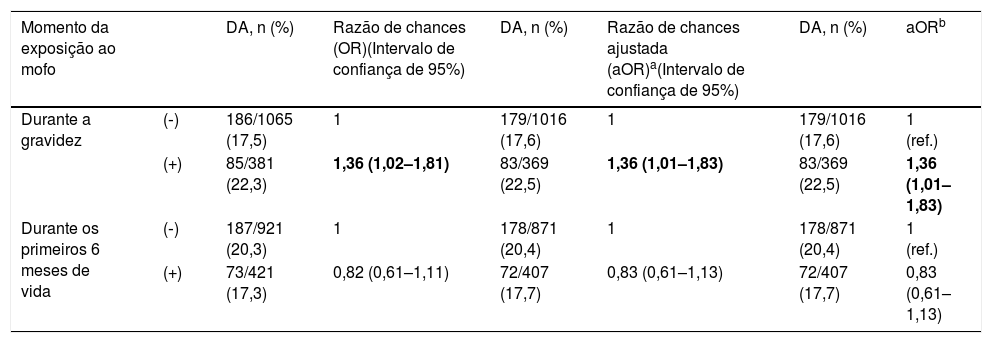
A, associação entre os níveis séricos totais de IgE, de acordo com a exposição a mofo durante a gravidez, e a dermatite atópica. Os dados são expressos como a média±desvio padrão; B, correlação entre o índice de Scorad transformado em logaritmo no primeiro ano de vida e os níveis séricos totais de IgE transformados em logaritmo; C, correlação entre a abundância relativa de espécies do filo Ascomycota não cultivadas encontradas no ambiente com 36 semanas de gestação e os níveis séricos totais de IgE no primeiro ano de vida.
Não houve diferenças significativas na diversidade e no nível de abundância (Chao1, unidades taxonômicas operacionais) com relação ao microbioma nas 36 semanas de gestação entre os 20 neonatos saudáveis e os com DA (não constam os dados). A abundância relativa das espécies de Ascomycota não cultivadas foi maior em neonatos com DA (149,75%±506,51%) do que em recém‐nascidos saudáveis (60,82%±81,83%).
A abundância relativa das espécies de Ascomycota não cultivadas correlaciona‐se com os níveis séricos totais de IgE no primeiro ano de vida (r=0,613, P <0,001, figura 1C), porém não com o índice Scorad, em todos os participantes e em neonatos com DA.
DiscussãoNeste artigo, demonstramos que a exposição a mofo durante o período pré‐natal está associada a um risco maior de DA em neonatos que participavamdo de um estudo de coorte de nascimento prospectivo (Cocoa); a exposição ao mofo durante o período pós‐natal não foi associada ao desenvolvimento de DA. Os níveis séricos totais de IgE em neonatos com DA expostos a mofo durante o período pré‐natal foram maiores do que nos recém‐nascidos saudáveis que não foram expostos a mofo durante o período de gestação; esse fato foi verificado mesmo em neonatos com DA que não foram expostos a mofo. A abundância relativa no ambiente domiciliar e durante a gravidez de espécies de Ascomycota não cultivadas foi maior nos casos de neonatos com DA do que nas casas de neonatos saudáveis e correlacionou‐se com os níveis séricos totais de IgE no primeiro ano de vida. Esse fato sugere que a exposição a níveis mais altos de Ascomycota no ambiente domiciliar durante o período pré‐natal pode contribuir para o desenvolvimento de DA no início da vida por meio de reação alérgica mediada por IgE. Assim, evitar ou limitar a exposição ao microbioma ambiental durante períodos críticos do desenvolvimento pode ajudar a prevenir o desenvolvimento de DA no início da vida.
Embora a fisiopatologia da DA não seja completamente entendida, defeitos na barreira cutânea, respostas imunológicas disfuncionais e fatores ambientais são considerados as principais causas.15 A disbiose, a colonização da pele por microbiomas específicos, a inflamação por fungos associada à DA16 e a interação entre o hospedeiro e o microbioma podem agir como um imunomodulador.17 Os resultados deste estudo sugerem que a exposição ao microbioma ambiental, especialmente durante os períodos críticos de desenvolvimento, afeta o desenvolvimento de DA.
Poucos estudos examinaram os mecanismos subjacentes à associação entre o microbioma ambiental e a DA, ou o efeito dos componentes específicos do microbioma na patogênese da DA, embora o microbioma seja um importante componente do ambiente humano.12,18 Estudos anteriores em pacientes com DA tiveram como foco principal o mofo agindo como um aeroalérgeno durante o desenvolvimento de doenças alérgicas respiratórias e a inflamação da pele relacionada à colonização por fungos específicos, como as espécies Malassezia.8,19 Os mecanismos subjacentes à indução da DA por mofo podem incluir a sensibilização ao mofo ou o encadeamento de respostas imunológicas direcionadas contra componentes específicos do microbioma. Entretanto, poucos estudos, especialmente os estratificados de acordo com o momento da exposição, examinaram a associação entre a exposição ao mofo ambiental e a DA; assim, os mecanismos subjacentes permanecem desconhecidos.
O resultado deste estudo sugere que a exposição ao mofo encontrado no ambiente domiciliar durante o período pré‐natal pode afetar o desenvolvimento de DA por imunomodulação, possivelmente por meio de uma reação alérgica relacionada à IgE. Essa hipótese é embasada na constatação de níveis séricos totais de IgE mais elevados em neonatos com DA expostos a mofo durante o período pré‐natal do que em recém‐nascidos com DA que não foram expostos. Além disso, relatamos anteriormente que a exposição a mofo durante a infância está associada a maiores níveis séricos totais de IgE,13 embora os mecanismos subjacentes não tenham sido identificados. Os resultados de nosso estudo e de estudos anteriores sugerem que a exposição a mofo no início da vida pode induzir a reação alérgica mediada por IgE; contudo, não encontramos correlação significativa entre a gravidade da DA e a abundância relativa de Ascomycota não cultivado (r=0,347, p=0,399, não constam os dados). Esse fato sugere uma função dos componentes específicos do microbioma como indutores de reação alérgica por IgE no desenvolvimento de DA. São necessários estudos adicionais a fim de identificar os mecanismos subjacentes à associação entre a exposição ao mofo durante o período da gestação e o desenvolvimento de DA no início da vida.
A exposição a fatores ambientais durante o período pré‐natal pode afetar o desenvolvimento do sistema imunológico.20 O estresse pré‐natal da mãe e vários fatores ambientais podem causar mudanças na expressão genética por meio de mecanismos epigenéticos, especialmente durante períodos críticos do desenvolvimento, e afetar, assim, o desenvolvimento e a diferenciação do sistema imunológico.20–22 A própria exposição ao mofo pode causar respostas imunológicas alérgicas e os componentes do mofo, como as proteases, podem irritar a pele ou agir como indutores de reação alérgica por via aérea.23,24 Com base nas constatações acima, a alteração da resposta imunológica materna devido à exposição a mofo durante a gravidez pode afetar o desenvolvimento do sistema imunológico dos filhos e, assim, pode estar relacionada ao desenvolvimento de DA em neonatos.25 Neste estudo, não encontramos diferenças significativas na diversidade do microbioma entre neonatos saudáveis e com DA durante o período pré‐natal; contudo, essa abundância relativa de fungos específicos, como do Ascomycota não cultivado, no ambiente domiciliar durante os períodos pré‐natais foi maior em recém‐nascidos com DA do que em neonatos saudáveis. Os resultados deste estudo sugerem que a exposição a componentes específicos do microbioma, em vez do próprio mofo, especialmente durante períodos críticos do desenvolvimento, pode estar associada ao desenvolvimento de DA durante a infância. São necessários estudos adicionais em grande escala a fim de confirmar esses resultados.
Um componente proteico do Ascomycota pode se ligar aos ARNm e modulá‐los.26 Além disso, polissacarídeos fúngicos, inclusive os provenientes do filo Ascomycota, podem induzir a produção de radicais livres e a produção de citocinas associadas à inflamação.27 Em um estudo anterior, demonstramos que a exposição a mofo estava associada ao desenvolvimento de DA pela produção, por meio da citocina Th2, de espécies reativas de oxigênio (ERO).12 Desequilíbrios na produção de ERO também podem afetar a expressão genética.28 Em conjunto, esses resultados sugerem que a exposição a mofo em ambiente domiciliar, inclusive o Ascomycota, durante o período pré‐natal pode afetar o desenvolvimento de DA por meio de efeitos imunomodeladores.13
Este estudo tem algumas limitações. Primeiramente, a exposição a mofo foi determinada por meio de um questionário do estudo de coorte de nascimento prospectivo (Cocoa). Entretanto, um estudo anterior demonstrou que determinar a exposição ao mofo por meio de um questionário ou pela medição do total de esporos encontrados no ar gera resultados semelhantes.29 Em segundo, as análises de microbiomas encontrados em ambiente domiciliar foram limitadas pelo pequeno tamanho da amostra; contudo, foi possível identificar uma associação entre componentes específicos do microbioma e reação alérgica. O ponto forte do estudo é sua qualificação como estudo de coorte de nascimento prospectivo geral de base populacional. Os dados ajudarão a determinar o papel da exposição ao mofo no ambiente domiciliar durante períodos críticos no desenvolvimento de doenças alérgicas, inclusive a DA. Por fim, a exposição a mofo em ambiente domiciliar durante o período da gestação está associada ao desenvolvimento de DA no início da vida, possivelmente por meio da reação alérgica mediada por IgE. Portanto, evitar ou limitar a exposição ao mofo durante o período pré‐natal pode ajudar a prevenir a DA na infância.
FinanciamentoEste estudo foi financiado pelo projeto coreano de P&D de tecnologia na área da saúde do Ministério da Saúde e Bem‐Estar, Coreia do Sul (bolsa n° HI13C16740000), e pela Pesquisa do Centro de Controle e Prevenção de Doenças da Coreia do Sul (2008‐E33030‐00, 2009‐E33033‐00, 2011‐E33021‐00, 2012‐E33012‐00, 2013‐E51003‐00, e 2014‐E51004‐00).
Conflitos de interesseOs autores declaram não haver conflitos de interesse.
Como citar este artigo: Lee E, Choi KY, Kang M‐J, Lee S‐Y, Yoon J, Cho H‐J, et al. Prenatal mold exposure is associated with development of atopic dermatitis in infants through allergic inflammation. J Pediatr (Rio J). 2020;96:125–31.