To evaluate the possible effects of the introduction of the pneumococcal conjugate 10‐valent vaccine schedule in the state of Parana on pneumococcal meningitis cases and to assess the distribution of serotypes among cases.
MethodCross‐sectional study with retrospective data collection of cases of pneumococcal meningitis in the state of Paraná reported to Sistema de Informação de Agravos de Notificação (SINAN), from 1998 to 2011. A total of 1,339 cases of pneumococcal meningitis were analyzed; 1,205 cases from the pre‐vaccine period (1998‐2009) were compared to 134 cases from the post‐vaccine period (2010‐2011). Descriptive and comparative statistical analyses (chi‐squared test and prevalence ratio) were performed using JMP 5.1.2 statistical software (JMP Statistical Discovery, North Carolina, USA) and EPI INFO 6 (Centers for Disease Control and Prevention, Georgia, EUA).
ResultsThere was a significant reduction in the mean rates of incidence and mortality in the general population. The analysis of cases in the pre‐ and post‐vaccination periods in the age groups covered by vaccination (younger than 2 years) showed significant reductions in incidence rates (6.01 cases/100,000 to 2.49 cases/100,000 individuals) and mortality (1.85 cases/100,000 population to 0.47 cases/100,000 population), while the mean lethality rate did not change significantly. There was a significant reduction in cases whose serotypes are included in the vaccine (80.7% to 53.3%).
ConclusionEven after a short time of use, the 10‐valent pneumococcal conjugate vaccine has already had a significant impact in reducing the incidence and mortality of meningitis cases among infants, as well as the reduction of cases whose serotypes are included in the vaccine.
Avaliar os possíveis efeitos da introdução da vacina pneumocócica conjugada 10 valente no calendário vacinal no Paraná sobre os casos de meningite pneumocócica; avaliar a distribuição dos sorotipos dentre os casos.
MétodoEstudo observacional, transversal, com coleta de dados retrospectiva dos casos de meningite pneumocócica no Estado do Paraná, notificados ao SINAN, no período de 1998 a 2011. Foram analisados 1339 casos de meningite pneumocócica e comparados os 1205 casos do período pré‐vacina (1998 a 2009) com os 134 do período pós‐vacina (2010 a 2011). A análise estatística descritiva e comparativa (teste qui‐quadrado e razão de prevalência) foi realizada no software de estatística JMP 5.1.2 (JMP Statistical Discovery, Carolina do Norte, EUA) e no Programa EPI INFO 6.
ResultadosObservou‐se redução significativa das taxas médias de incidência e mortalidade na população geral. A análise dos casos nos períodos pré e pós‐vacina nas faixas etárias contempladas pela vacinação (menores de 2 anos) mostrou reduções significativas das taxas de incidência (6,01 casos/100.000 para 2,49 casos/100.000 habitantes), mortalidade (1,85 casos/100.000 habitantes para 0,47 casos/100.000 habitantes), enquanto que a letalidade média não apresentou variação significativa. Houve redução significativa dos casos cujos sorotipos estão incluídos na vacina (80,7% para 53,3%).
ConclusãoMesmo com um tempo reduzido de uso, a vacina pneumocócica conjugada 10 valente já apresentou um impacto relevante na diminuição dos coeficientes de incidência e mortalidade dos casos de meningite entre os lactentes, além de redução de casos cujos sorotipos estão incluídos na vacina.
O Streptococcus pneumoniae (pneumococo) pode ser encontrado na mucosa da nasofaringe e orofaringe de seres humanos sadios e tem importância por sua morbidade e mortalidade relacionada a doenças como meningite, pneumonia, septicemia, entre outras.1 No Brasil é considerado o segundo agente causador de meningites bacterianas, após a Neisseria meningitidis.2
A prevenção da doença pneumocócica baseia‐se principalmente na imunização ativa. São identificados 93 sorotipos do pneumococo,3 de acordo com a antigenicidade e imunogenicidade da cápsula polissacarídica, principal fator de virulência da bactéria. Os antígenos polissacarídeos induzem resposta imunológica sorotipo‐específica, tendo grande utilidade para composição das vacinas pneumocócicas. A vacina 23 valente constitui‐se de polissacarídeos capsulares purificados de 23 sorotipos do Streptococcus pneumoniae, produz resposta imunológica timo‐independente e por isso é indicada apenas para maiores de 2 anos de idade. Quando os polissacarídeos são conjugados individualmente a carreadores proteicos há melhora na imunogenicidade, pois são capazes de desencadear resposta imunológica de memória (timo‐dependente), podendo ser administradas para crianças menores de 2 anos de idade, principal faixa etária acometida por doença pneumocócica invasiva.1,4,5
As vacinas pneumocócicas conjugadas liberadas por agências reguladoras e atualmente comercializadas no Brasil são a 10 valente e a 13 valente, que protegem contra 10 e 13 sorotipos de pneumococo, respectivamente. A vacina pneumocócica conjugada 10 valente passou a fazer parte do calendário do Programa Nacional de Imunização (PNI) a partir de 2010 para crianças menores de 24 meses. A vacina pneumocócica polissacarídica 23 valente é disponibilizada pelos Centros de Referências de Imunobiológicos Especiais (CRIE) para pacientes acima de dois anos de idade que apresentem condições de risco para doença pneumocócica invasiva e para idosos acima de 60 anos institucionalizados.6
O objetivo do presente trabalho foi avaliar o efeito da introdução da vacina pneumocócica conjugada 10 valente no calendário do PNI, sobre os indicadores epidemiológicos e sorotipos das meningites pneumocócicas no Estado do Paraná.
MétodosEstudo observacional, transversal, com coleta de dados retrospectiva dos casos de meningite causadas pelo Streptococcus pneumoniae, comprovados laboratorialmente, ocorridos no Estado do Paraná e notificados ao Sistema de Informação de Agravos de Notificação (SINAN), no período de janeiro de 1998 a dezembro de 2011.
A análise dos casos de meningite pneumocócica foi realizada comparando‐se os períodos de acordo com a introdução da vacina pneumocócica conjugada 10 valente no PNI. O período pré‐vacina contemplou os anos de 1998 a 2009 e o período pós‐vacina, os anos de 2010 e 2011.
Os indicadores utilizados para a análise dos casos ao longo dos anos ou nos períodos pré e pós‐vacina, baseados nos dados populacionais do Instituto Brasileiro de Geografia e Estatística (IBGE) foram os seguintes:
- •
Taxa de incidência média: (média do número de casos de meningite no período/ população média do período) * 100.000
- •
Taxa de mortalidade média: (média do número de óbitos por meningite pneumocócica no período/ população média do período) * 100.000
- •
Letalidade média: (média do número de óbitos por meningite pneumocócica no período/média do número de casos de meningite pneumocócica no período) * 100
Utilizou‐se o termo cobertura vacinal para a frequência dos sorotipos disponibilizados nas vacinas conjugadas na amostra estudada.
Os dados foram registrados em planilha do Microsoft Excel® 2010 (Microsoft, Nova York, EUA), conferidos e exportados para os softwares de estatística JMP Statistical Discovery Software 5.1.2 (JMP Statistical Discovery, Carolina do Norte, EUA) e Programa EPI INFO 6 (Centers for Disease Control and Prevention, Georgia, EUA). A estimativa de diferença entre variáveis categóricas foi realizada pelo teste de qui‐quadrado, com um nível mínimo de significância de 5%. Foi utilizada a razão de prevalência na comparação dos casos em menores de 1 ano entre os períodos pré e pós vacina, com intervalo de confiança de 95%.
O estudo foi aprovado pelo Comitê de Ética em Pesquisa da Secretaria de Saúde do Estado do Paraná/ Hospital do Trabalhador em 26 de agosto de 2010, processo N° 218/2010.
ResultadosEntre janeiro de 1998 e dezembro de 2011 foram notificados ao SINAN 1354 casos de meningite pneumocócica no estado do Paraná. Desta população foram excluídos 15 casos devido à incoerência de informações e duplicidade de notificações, totalizando 1339 casos, sendo 1205 no período pré‐vacina e 134 no pós‐vacina.
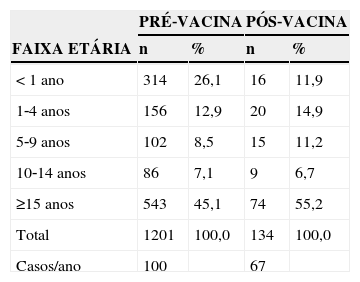
A distribuição dos casos de acordo com a faixa etária nos dois períodos encontra‐se na tabela 1. Analisando os períodos pré‐vacina e pós‐vacina, percebe‐se uma redução de 54% na frequência dos casos na faixa etária menor de 1 ano (de 26,1% para 11,9%, respectivamente). A razão de prevalência entre os casos de meningite pneumocócica em menores de 1 ano entre os períodos pré e pós vacina foi de 2,68 (IC 95% 1,62 ‐ 4,44 / p<0,01).
Distribuição dos casos de meningite pneumocócica entre os períodos pré (1998‐2009) e pós‐vacina (2010‐2011) segundo faixa etária. Paraná, 1998‐2011
| PRÉ‐VACINA | PÓS‐VACINA | |||
|---|---|---|---|---|
| FAIXA ETÁRIA | n | % | n | % |
| < 1 ano | 314 | 26,1 | 16 | 11,9 |
| 1‐4 anos | 156 | 12,9 | 20 | 14,9 |
| 5‐9 anos | 102 | 8,5 | 15 | 11,2 |
| 10‐14 anos | 86 | 7,1 | 9 | 6,7 |
| ≥15 anos | 543 | 45,1 | 74 | 55,2 |
| Total | 1201 | 100,0 | 134 | 100,0 |
| Casos/ano | 100 | 67 | ||
Obs: 4 casos sem dados de idade no período pré‐vacina.
1. Avaliação dos indicadores epidemiológicos nos períodos pré e pós‐vacina
Comparando os indicadores epidemiológicos entre os dois períodos estudados na população geral, encontrou‐se diminuição significativa dos mesmos. A taxa de incidência média apresentou redução de 36,0% (1,00 caso/100.000 habitantes para 0,64 casos/100.000 habitantes) (p<0,001) e a taxa de mortalidade média reduziu 65,5%, de 0,29 casos/100.000 habitantes para 0,10 casos/100.000 habitantes (p<0,001).
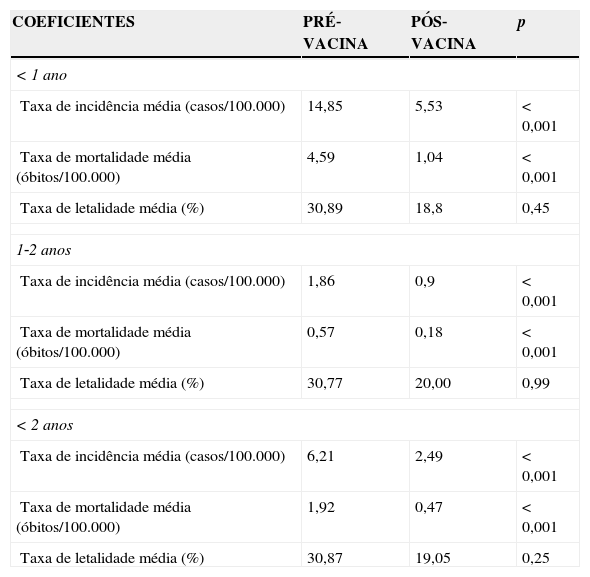
Analisando o perfil dos indicadores entre os períodos pré e pós‐vacina especificamente na população de menores de 2 anos, observaram‐se reduções significativas nas taxas de incidência e taxas de mortalidade médias (tabela 2). A taxa de incidência média reduziu 59,9% (6,21 casos/100.000 para 2,49 casos/100.000 habitantes) (p<0,01), e taxa de mortalidade média reduziu 75,5% (1,92 óbitos/100.000 habitantes para 0,47 óbitos/100.000 habitantes) (p<0,01). Resultados semelhantes foram obtidos na análise realizada na faixa etária de menores de 1 ano e entre 1 e 2 anos. Embora as taxas de letalidade também tenham sofrido reduções entre os dois períodos, as diferenças observadas não foram estatisticamente significativas.
Indicadores epidemiológicos para meningite pneumocócica em menores de 2 anos. Paraná, 1998‐2011
| COEFICIENTES | PRÉ‐VACINA | PÓS‐VACINA | p |
|---|---|---|---|
| < 1 ano | |||
| Taxa de incidência média (casos/100.000) | 14,85 | 5,53 | < 0,001 |
| Taxa de mortalidade média (óbitos/100.000) | 4,59 | 1,04 | < 0,001 |
| Taxa de letalidade média (%) | 30,89 | 18,8 | 0,45 |
| 1‐2 anos | |||
| Taxa de incidência média (casos/100.000) | 1,86 | 0,9 | < 0,001 |
| Taxa de mortalidade média (óbitos/100.000) | 0,57 | 0,18 | < 0,001 |
| Taxa de letalidade média (%) | 30,77 | 20,00 | 0,99 |
| < 2 anos | |||
| Taxa de incidência média (casos/100.000) | 6,21 | 2,49 | < 0,001 |
| Taxa de mortalidade média (óbitos/100.000) | 1,92 | 0,47 | < 0,001 |
| Taxa de letalidade média (%) | 30,87 | 19,05 | 0,25 |
2. Distribuição dos sorotipos identificados nos períodos pré e pós‐vacina
No período pré‐vacina, 46,3% (558/1205) dos casos foram sorotipados. Destes, 58,1% correspondiam a casos cujo sorotipo do pneumococo estava incluído na vacina conjugada 10 valente (1, 4, 5, 6B, 7F, 9V, 14, 18C, 19F, 23F). No período pós‐vacina, 45,5% (61/134) dos casos foram sorotipados, dentre os quais 47,5% foram causados por sorotipos incluídos na vacina. Quando se considera a possível proteção cruzada entre os sorotipos 6A e 6B, encontramos nos períodos pré e pós‐vacina a identificação de 62,2% e 52,5%, respectivamente, dos sorotipos incluídos na vacina 10 valente.
Na análise dos sorotipos mais frequentes entre os períodos, na população geral, percebeu‐se aumento da frequência dos casos com sorotipo 3, 10A e 4 no período pós vacina, sendo que os dois primeiros sorotipos não estão incluídos na vacina conjugada 10 valente.
3. Distribuição dos sorotipos na faixa etária menor que 2 anos
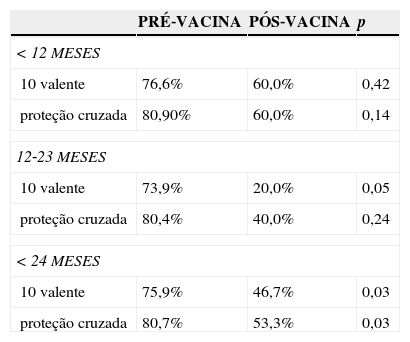
A análise dos casos sorotipados na faixa etária menor de 2 anos (contemplada pela vacina distribuída pelo PNI), demonstrou que dentre os 202 casos avaliados (187 no pré‐vacina e 15 no pós‐vacina), o percentual de casos sorotipados causados por sorotipos incluídos na vacina conjugada 10 valente reduziu de 75,9% para 46,7% entre os períodos pré e pós vacina. Considerando apenas a faixa etária de 12‐23 meses, a redução foi mais importante (de 73,9% para 20%). A comparação entre os períodos pré e pós‐vacina nos menores de 2 anos, com a ampliação da proteção cruzada do sorotipo 6A, mostra redução significativa dos casos cujos sorotipos estão incluídos na vacina (de 80,7% para 53,3%, p=0,030) (tabela 3).
Cobertura da vacina pneumocócica conjugada 10 valente nos períodos pré e pós‐vacina segundo idade. Paraná, 1998‐2011
| PRÉ‐VACINA | PÓS‐VACINA | p | |
|---|---|---|---|
| < 12 MESES | |||
| 10 valente | 76,6% | 60,0% | 0,42 |
| proteção cruzada | 80,90% | 60,0% | 0,14 |
| 12‐23 MESES | |||
| 10 valente | 73,9% | 20,0% | 0,05 |
| proteção cruzada | 80,4% | 40,0% | 0,24 |
| < 24 MESES | |||
| 10 valente | 75,9% | 46,7% | 0,03 |
| proteção cruzada | 80,7% | 53,3% | 0,03 |
Obs: Proteção cruzada com sorotipo 6 A.
A análise dos efeitos da introdução da vacina conjugada 10 valente no calendário vacinal do Brasil deve ser feita de forma criteriosa. A vacina pneumocócica conjugada 10 valente foi introduzida na imunização de rotina no Brasil de março a setembro de 2010.7
No presente estudo, comparando o período pré‐vacinal (1998‐2009) com o pós‐vacinal (2010 e 2011), mesmo incluindo o ano de 2010, período ainda de transição no qual os municípios foram implantando a vacina pneumocócica progressivamente nas unidades de saúde, encontrou‐se redução de 54% de casos de meningite em menores de 1 ano, com maior prevalência de casos nessa faixa etária no período pré‐vacina. Ao analisar a população geral, as taxas de incidência e de mortalidade médias apresentaram redução de 36,0% e 65,5%, respectivamente. Para a faixa etária contemplada pela vacina, ou seja, menores de 2 anos, também foram observadas reduções significativas das taxas de incidência e de mortalidade médias (redução de 59,9% e 75,5%, respectivamente).
Desde o Kaiser Permanent Study Center,8 estudos têm demonstrado os benefícios do uso de vacinas pneumocócicas conjugadas.9,10
Para a vacina pneumocócica conjugada 7 valente (não mais comercializada) observou‐se eficácia de 97% contra doenças pneumocócicas invasivas causadas por sorotipos vacinais e de 89% contra as doenças pneumocócicas invasivas no geral. O impacto desta vacina foi evidenciado pela redução das doenças invasivas de 79% a 100% e nos casos de visitas médicas por otite média aguda, com impacto de 13% a 43%.11 Com relação à vacina pneumocócica conjugada 10 valente, Afonso et al. encontraram reduções significativas nas hospitalizações por pneumonia em Belo Horizonte, Curitiba e Recife, após sua introdução no calendário vacinal brasileiro.12 Tal vacina também se mostrou efetiva em estudos da Finlândia13 e de Quebec,14 com reduções das taxas de incidência de doenças pneumocócicas invasivas. Embora o período pós‐vacinal no Brasil compreenda um intervalo de tempo ainda pequeno, com cobertura vacinal para 3 doses no 1° ano de vida de 35,36% em 2010, chegando a 94,19% em 2011,15 pode‐se observar redução dos indicadores epidemiológicos, fato que vem ao encontro aos estudos que apontam benefícios com uso de vacinas pneumocócicas conjugadas em até 15 meses após sua introdução.14 O impacto do uso da vacina e benefícios indiretos com o “efeito de rebanho”, ou seja, diminuição de casos em não vacinados pela redução de colonização nasofaringea e transmissão de sorotipos vacinais por crianças vacinadas,16 seriam muito precoces nessa fase da análise. Esperam‐se dados compatíveis aos encontrados nos estudos de efetividade com a introdução da vacina pneumocócica conjugada 7 valente, em que os efeitos indiretos foram responsáveis por redução de 19% a 62% na incidência geral de casos de doença pneumocócica invasiva em maiores de 18 anos, e de 81% a 92% de casos relacionados a sorotipos vacinais na mesma faixa etária.11
Quando foram comparados os principais sorotipos de pneumococos identificados nos casos de meningite desta pesquisa com os sorotipos incluídos nas vacinas conjugadas 10 valente, observou‐se uma taxa mais baixa (pré‐vacina 58,1%) com relação a outros estudos relatados. No entanto, considerando‐se a possível proteção cruzada entre os sorotipos 6A e 6B, teríamos nos períodos pré‐vacina a identificação de 62,2%.
Taxas encontradas no Brasil foram de 77,6% para a vacina conjugada 10 valente e de 86% para a vacina conjugada 13 valente para doenças pneumocócicas invasivas;17,18 dados da África apontam taxas de 70% a 84% para a vacina conjugada 10 valente e de 79% a 88% para a vacina conjugada 13 valente.19 Para meningite, as coberturas das vacinas conjugadas 10 e 13 valente seriam de 82,8% e 94,2%, respectivamente.2
Neste estudo, comparando os períodos pré e pós a introdução da vacina conjugada 10 valente no calendário de imunizações brasileiro, observou‐se uma redução significativa das taxas de sorotipos incluídos na vacina como causadores de doenças na faixa etária abaixo de 2 anos (80,7% para 53,3%), o que poderia ser justificado pela utilização de rotina de tal imunobiológico.
Fazendo uma projeção comparando a cobertura das vacinas pneumocócicas conjugadas disponíveis no Brasil, observa‐se melhor cobertura (sorotipos incluídos nas vacinas coincidentes com os isolados no Estado) com a 13 valente em relação a 10 valente, tanto no período pré‐vacina (69,2% e 58,1%, respectivamente, p<0,01) quanto no pós‐vacina (68,9% e 47,5%, respectivamente, p=0,017). Se a cobertura da vacina 10 valente fosse estendida com a proteção cruzada do sorotipo 6A, essa diferença não se manteria no período pós‐vacina (13 valente: 68,9% e 10 valente: 52,5%, p=0,064), apenas no pré‐vacina (13 valente: 69,2% e 10 valente: 62,2%, p=0,014).
O efeito de substituição de sorotipos, conhecido como replacement, ou seja, aumento de casos por sorotipos não incluídos nas vacinas conjugadas por redução da circulação dos sorotipos vacinais em uma população vacinada20 parece ser muito precoce, além do fato de que flutuações na frequência dos sorotipos podem acontecer sem a necessidade de pressão seletiva de vacinas.21 No presente estudo, observou‐se um aumento do número de casos no período pós‐vacina pelos sorotipos 3 e 10A, não incluídos na vacina conjugada 10 valente. Na Europa e Estados Unidos, após a utilização da vacina pneumocócica conjugada 7 valente, os principais sorotipos não vacinais encontrados em doenças pneumocócicas invasivas foram 1, 3, 7F, 15, 19A, 27F e 33F.22
A análise dos casos de meningite pneumocócica nos períodos pré e pós‐vacina mostrou redução dos casos na faixa etária menor de 1 ano, reduções significativas dos coeficientes de incidência e mortalidade gerais e dos mesmos coeficientes nas faixas etárias contempladas pela vacina. As coberturas das vacinas pneumocócicas nos casos de meningite mostraram‐se menores que a descrita na literatura, mas com redução dos sorotipos vacinais no período pós‐ vacina.
O estudo apresenta como limitação a fonte de dados para análise, baseada em dados de notificações. Embora a notificação de meningites seja compulsória no Brasil, a ausência de algumas informações, a discordância de dados e a falta de preenchimento correto por vezes impediram uma análise mais completa dos dados disponíveis, informações estas que não puderam ser incluídas nesta pesquisa. No entanto, estimula‐se o desenvolvimento de novos estudos que acompanhem o cenário das doenças pneumocócicas invasivas no Estado (não só das meningites), os efeitos da introdução da vacina pneumocócica conjugada ao calendário vacinal e a manutenção da vigilância sobre os sorotipos circulantes na população.
A vigilância permanente dos casos de meningite pneumocócica, bem como dos sorotipos mais prevalentes permite a escolha das vacinas conjugadas mais adaptadas à região geográfica e sua população.
Conflitos de interesseOs autores declaram não haver conflitos de interesse.
Nossos agradecimentos à equipe de funcionários do Departamento de Vigilância Epidemiológica (DEVE), Divisão de Vigilância de Doenças Transmissíveis (DVVTR) da Secretaria de Estado da Saúde do Paraná, em particular a Sra. Marlene Sera Wille pela colaboração com os dados disponíveis.
Como citar este artigo: Hirose TE, Maluf EM, Rodrigues CO. Pneumococcal meningitis: epidemiological profile pre‐ and post‐introduction of the pneumococcal 10‐valent conjugate vaccine. J Pediatr (Rio J). 2015;91:130–5.
Estudo vinculado à Universidade Federal do Paraná (UFPR), Curitiba, PR, Brasil.