The modified shuttle test is a field test that avoids the ceiling effect, and there are no reports of a multidimensional assessment concerning physical activity in asthmatic patients. Thus, the aim was to evaluate functional capacity, physical activity in daily life, muscle strength, and cytokine levels in children and adolescents with asthma, and to correlate these variables.
MethodThis cross‐sectional study included volunteers aged between 6 and 18 years who were divided into two groups: asthma group (n=43) that received regular treatment and control group (n=24). Functional capacity was evaluated by distance walked during the MST; physical activity in daily life was evaluated using an accelerometer by the number of steps. Quadriceps femoris strength was evaluated by load cell.
ResultsDistance walked was lower for the asthma group (790m [222m]) when compared with the control group (950m [240m]; p=0.007); however, the number of steps was similar between the two groups (asthma group: 7743 [3075]; control group: 7181 [3040]; p=0.41), and both groups were classified as sedentary behavior. There was no difference in muscle strength. Tumor necrosis factor‐α differed, but interleukin levels were similar between groups. Quadriceps strength was correlated to distance walked (r=0.62; p<0.001) and tumor necrosis factor‐α to the number of steps taken (r=−0.54, p=0.005).
ConclusionChildren and adolescents undergoing regular asthma treatment showed reduced functional capacity and sedentary behavior. The lower the quadriceps strength, the shorter the distance walked; the higher the tumor necrosis factor‐α levels, the lower their daily physical activity levels.
O Teste Shuttle Modificado é um teste clínico de campo que evita o efeito‐teto e não existem relatos de avaliação multidimensional com relação à atividade física em pacientes com asma. Assim, o objetivo era avaliar a capacidade funcional, a atividade física na vida cotidiana, a força muscular e os níveis de citocina em crianças e adolescentes com asma, a fim de correlacionar essas variáveis.
MétodoEste estudo transversal incluiu voluntários entre seis e 18 anos, os quais foram divididos em dois grupos: o grupo com asma (n=43), que recebeu tratamento regular, e o grupo de controle (n=24). A capacidade funcional foi avaliada pela distância percorrida durante o Teste Shuttle Modificado, ao passo que a atividade física na vida cotidiana foi avaliada utilizando um acelerômetro pelo número de passos. A força muscular do quadríceps femoral foi avaliada por uma célula de carga.
ResultadosA distância percorrida foi menor no grupo com asma (790m [222 m]) em comparação com o grupo de controle (950 m [240 m]; p=0,007), contudo o número de passos foi semelhante nos dois grupos (grupo com asma: 7.743 [3.075]; grupo de controle: 7.181 [3.040]; p=0,41) e ambos os grupos foram classificados como sedentários. Não houve diferença na avaliação da força muscular. O fator de necrose tumoral‐α apresentou divergências, porém os níveis de interleucina foram semelhantes entre os grupos. A força muscular do quadríceps foi correlacionada com a distância percorrida (r: 0,62; p<0,001) e o fator de necrose tumoral‐α, ao número de passos dados (r=−0,54, p=0,005).
ConclusãoCrianças e adolescentes que recebem tratamento regular de asma apresentaram redução da capacidade funcional e comportamento sedentário. Quanto menor a força muscular do quadríceps, menor a distância percorrida; quanto maiores os níveis de fator de necrose tumoral‐α, menores seus níveis diários de atividade física.
A principal característica da asma é a inflamação crônica dos pulmões. Em pacientes com asma, o aumento da resistência das vias respiratórias e da retração elástica do pulmão aumenta a demanda ventilatória e a dispneia de esforço, o que pode possivelmente gerar intolerância a exercícios.1,2 Contudo, alguns estudos não apontaram diferenças, com base no consumo de oxigênio, na capacidade de os pacientes com asma e o grupo de pessoas saudáveis praticarem exercícios, o que foi justificado pela adequação nutricional,3 pela manutenção de atividades diárias, pelo tipo de tratamento4,5 e pela gravidade da doença.6 Entretanto, outros estudos mostraram redução da capacidade aeróbica não apenas entre crianças com asma não controlada,7,8 mas também entre crianças submetidas a tratamentos regulares que apresentam sintomas controlados.9
A avaliação da capacidade funcional é de grande interesse, uma vez que representa a capacidade de praticar atividades físicas que são parte da vida cotidiana. Nesse contexto, o Teste Shuttle Modificado (MST)10 é adequado para avaliar pacientes pediátricos, porque é feito em várias velocidades, o que impede o efeito mínimo ou o efeito‐teto.11 Embora a capacidade funcional entre pacientes com asma tenha sido avaliada em pesquisas anteriores, o MST raramente foi usado. Ahmaidi et al.12 fizeram um teste de desempenho em corrida (shuttle runtest) com crianças asmáticas, o qual exige uma velocidade inicial maior (8,0km/h), cria uma dificuldade de execução para pacientes gravemente afetados. Em contrapartida, Augusto et al.13 usaram um teste adicional de desempenho com velocidades semelhantes ao MST, apesar de ser um teste com menor duração, o que pode resultar em um efeito‐teto. Por fim, Gomes et al.14 usaram o MST, mas não permitiram que os voluntários corressem. Esses estudos levantaram a pergunta da pesquisa: Com base no MST, qual é o status da capacidade funcional das crianças com asma que recebem tratamento regular?
A doença crônica pulmonar também está associada à menor quantidade de atividade física na vida cotidiana (PADL),15,16 à redução da força muscular17 e a um perfil inflamatório mais precário.18 Entretanto, até onde sabemos, uma avaliação multidimensional que inclui avaliações de capacidade funcional, PADL, força muscular e perfil inflamatório não foi feita em crianças e adolescentes com asma em tratamento regular. Assim, as perguntas de pesquisa para este estudo são as seguintes: A doença crônica reduz as atividades físicas de pacientes com asma? Existem associações entre capacidade funcional, atividade física, força muscular e citocinas séricas? Assim, o objetivo deste estudo foi avaliar a capacidade funcional, a atividade física na vida cotidiana, a força muscular e o perfil inflamatório em crianças e adolescentes com asma que estavam em acompanhamento regular da doença. Além disso, também tentamos examinar a correlação entre força muscular periférica, citocinas, PADL e capacidade funcional.
Pacientes e métodosParticipantesParticiparam deste estudo transversal indivíduos de seis a 18 anos. Os participantes foram divididos em: grupo com asma (AG) e grupo de controle (CG). Os participantes do AG foram selecionados a partir de um centro de encaminhamento terciário de um Departamento de Pediatria. Os critérios de inclusão foram: pessoas que tinham sido diagnosticadas com asma havia pelo menos seis meses (na etapa 1 a 5da Gina)19 e que tomavam regularmente medicação controlada no mínimo nos três meses anteriores. As pessoas que não usavam medicamento controlado para asma, ou não o usavam regularmente, ou que apresentavam qualquer quadro de exacerbação da doença nas últimas quatro semanas, foram excluídas do estudo. O CG foi equiparado com relação a idade e sexo ao AG; o CG incluiu as crianças dos funcionários da Universidade. Os participantes foram excluídos do CG caso tivessem manifestado doença crônica ou doença pulmonar aguda nas últimas quatro semanas antes do estudo ou apresentassem anomalias no teste de funcionamento dos pulmões (< 80% do valor preditivo). Os participantes foram inscritos no estudo após a autorização por escrito dos responsáveis legais e a assinatura do formulário de consentimento informado e após os próprios participantes terem assinado o formulário de avaliação informada. Este estudo foi aprovado pelo Comitê de Ética, #738192/2014.
Projeto do estudo e protocoloEste estudo foi feito no laboratório de reabilitação pulmonar. O protocolo envolveu dois dias de avaliação. No primeiro dia, foram feitos os seguintes procedimentos: amostra de citocina sérica, questionário de controle de asma, espirometria (pré e pós‐broncodilatador) e o Teste Shuttle Modificado (MST). No segundo dia, foi medida a força muscular periférica. Nesse dia, os participantes receberam o acelerômetro, que foi devolvido após sete dias.
O período do estudo foi entre abril de 2014 e novembro de 2015.
Questionário de controle da asmaO Teste de Controle de Asma (ACT) é um questionário de avaliação do controle da asma com base no paciente: o ACT é usado para pessoas acima de 12 anos, ao passo que o ACT de crianças (C‐ACT) é usado para crianças entre quatro e 11 anos.20 O ACT avalia a limitação das atividades, a falta de ar e os sintomas noturnos nas próximas quatro semanas. As opções de resposta variam de 1 (pior condição) a 5 (melhor condição). A maior pontuação possível era 25 no ACT e 27 no C‐ACT. A asma foi considerada controlada quando a pontuação estava acima de 20, parcialmente controlada entre 16‐19 e não controlada ≤ 15.20
Avaliação das citocinasAs interceulinas (IL) 4, 5, 10, 13 e 17, bem como o TNFα, foram analisadas e avaliadas com a tecnologia Milliplex® MAP (#MMHMAG‐44K, Merck Millipore Corporation, Darmstadt, Alemanha). Os dados foram interpretados por meio do software XPONENT® (Luminex, IL, EUA) e as amostras foram expressas em pg/mL.
Função respiratóriaA espirometria foi feita com os equipamentos Ultima CPX (MedGraphics Corporation®, MN, EUA). O procedimento técnico, os critérios de aceitação e a reprodutibilidade estavam de acordo com a declaração da Sociedade Torácica Americana (ATS) e a Sociedade Respiratória Europeia (ERS).21 Os participantes do AG repetiram o teste após a broncodilatação (salbutamol 400μg). Foram registrados a capacidade vital forçada (CVF), o volume expiratório forçado no primeiro segundo (VEF1), o VEF1/CVF e o fluxo expiratório forçado a 25‐75% da CVF (FEF25‐75).22
Teste Shuttle Modificado (MST)O MST foi feito em um corredor de 10 metros, de acordo com a descrição original.10 O teste é externamente cadenciado, regido por um sinal audível em que a velocidade aumenta a cada minuto, varia de 1,79 a 10,2km/h. Existem 15 níveis nesse teste e o voluntário poderia andar ou correr durante o teste. O teste terminava quando o participante não conseguia alcançar as extremidades duas vezes consecutivas, caso ele/ela precisasse parar devido à fadiga ou falta de ar, ou caso a saturação de oxigênio no sangue (SpO2) caísse abaixo de 82%.23 O teste foi feito duas vezes no mesmo dia, com um intervalo de 30 minutos. A frequência cardíaca (FC) e a SpO2 foram avaliadas continuamente. A pressão arterial (PA), a fadiga do membro inferior e a dispneia de acordo com a escala de Borg modificada foram avaliadas no início e no fim do teste.24 O MST foi feito após 400μg de broncodilatador, nos pacientes do AG, a fim de atingir o melhor desempenho e evitar o broncoespasmo induzido pelo exercício. A distância percorrida (DW) do melhor teste (maior distância abrangida) foi o resultado do MST, expresso em metros e como percentual do valor preditivo.25
Todos os participantes fizeram o MST conectado a um sistema de análises de trocas gasosas (VO2000 MedGraphics Corporation®, St. Paul, EUA). Foram medidos o consumo máximo de oxigênio (VO2), a produção pulmonar de dióxido de carbono (VCO2), a ventilação por minuto (VE) e a ventilação por minuto sobre a ventilação voluntária máxima).
Força muscular periféricaA contração isométrica voluntária máxima (MIVC) do músculo quadríceps femoral foi medida com os participantes sentados em um aparelho de extensão de pernas (Carci®, São Paulo, Brasil) com célula de carga (Modelo do sistema de eletromiograma EMG800C, São José dos Campos, Brasil). A MIVC do músculo bíceps braquial foi feita com os participantes sentados em uma cadeira. Foram feitos três testes para cada músculo por cinco segundos cada, com um intervalo de descanso de um minuto entre as medições consecutivas.26 O resultado foi a maior contração do quadríceps femoral e do bíceps branquial. O tempo do teste de resistência isométrica foi registrado até 10% da queda de 60% da MIVC. O resultado foi o tempo de resistência.
Atividade física na vida cotidianaOs participantes foram monitorados por meio de um acelerômetro (ActiGraph, GT3X, FL, EUA) por sete dias consecutivos. O monitoramento foi considerado bem‐sucedido quando o participante usou o acelerômetro pelo menos quatro dias e por mais de 12h/dia.27 Os resultados foram o número de passos por dia (o estilo de vida sedentário foi definido como<11.500 passos por dia)27,28 o tempo gasto em sedentarismo/atividade física leve (SLPA) foi definido entre 0‐2295 passos por dia; e o tempo gasto em atividade física moderada/intensa (MVPA) foi definido pela contagem de passos > 2.296 por dia.27
Análises dos dadosO tamanho da amostra foi calculado com base na DW no MST e na força muscular do quadríceps em um estudo‐piloto. O tamanho do efeito para a DW entre os grupos foi de 0,89, com α=0,05 e poder de 80%, n=21 por grupo. O tamanho do efeito para a força muscular do quadríceps foi de 1,5, com α=0,05 e poder de 80%, n=8 por grupo. A correlação moderada (r=0,6) foi estimada entre a força muscular e a capacidade funcional, com α=0,05 e poder de 80%, n=19 por grupo.
A normalidade dos dados foi analisada por meio do teste de Shapiro‐Wilk. Os dados paramétricos são apresentados como valores médios (DP), ao passo que os dados não paramétricos são apresentados como mediana e intervalo interquartil (IQ 25%‐75%). Para comparação do AG e do CG, foi usado o teste t não pareado ou o teste de Mann‐Whitney. O AG foi estratificado de acordo com as etapas da Gina,19 da seguinte maneira: asma intermitente/persistente (Gina 1, 2, 3) ou asma moderada/grave (Gina 4 e 5). A análise de variância (Anova) foi feita com o teste Bonferroni como um teste post‐hoc, a fim de avaliar as diferenças na gravidade dos casos do AG e do CG. Os testes de correlação de Pearson ou Spearman foram usados para correlacionar a capacidade funcional, a força muscular, a PADL e o perfil inflamatório. O teste qui‐quadrado foi feito para dessaturação durante os testes de exercício dos grupos. O SPSS (IBM SPSS Estatística para Windows, Versão 20.0. NY, EUA) foi o software de estatística usado no estudo. Um valor p<0,05 foi considerado estatisticamente significativo.
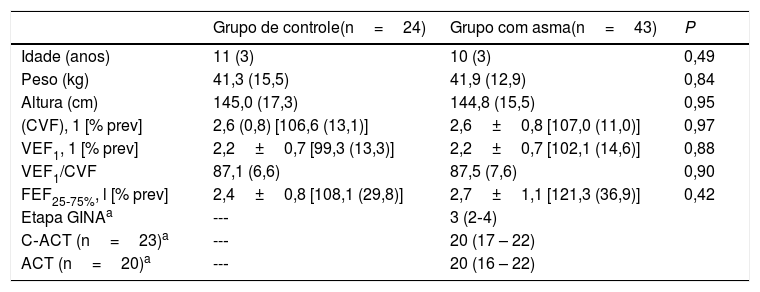
ResultadosParticiparam deste estudo 67 pessoas com asma. Dessas, 12 abandonaram o estudo, 11 foram excluídas por se apresentar fisicamente ativas e uma foi excluída devido a uma doença cardíaca. Concluíram o protocolo 43 participantes com asma. Para o grupo de controle (CG), 37 voluntários foram convidados a participar e 24 concluíram o estudo; 12 desistiram e um foi excluído por não conseguir completar os testes. No grupo com asma (AG), 20 voluntários (46%) eram mulheres, ao passo que no CG, 14 participantes (58%) eram mulheres. A tabela 1 apresenta as características dos grupos.
Características dos grupos
| Grupo de controle(n=24) | Grupo com asma(n=43) | P | |
|---|---|---|---|
| Idade (anos) | 11 (3) | 10 (3) | 0,49 |
| Peso (kg) | 41,3 (15,5) | 41,9 (12,9) | 0,84 |
| Altura (cm) | 145,0 (17,3) | 144,8 (15,5) | 0,95 |
| (CVF), 1 [% prev] | 2,6 (0,8) [106,6 (13,1)] | 2,6±0,8 [107,0 (11,0)] | 0,97 |
| VEF1, 1 [% prev] | 2,2±0,7 [99,3 (13,3)] | 2,2±0,7 [102,1 (14,6)] | 0,88 |
| VEF1/CVF | 87,1 (6,6) | 87,5 (7,6) | 0,90 |
| FEF25‐75%, l [% prev] | 2,4±0,8 [108,1 (29,8)] | 2,7±1,1 [121,3 (36,9)] | 0,42 |
| Etapa GINAa | --‐ | 3 (2‐4) | |
| C‐ACT (n=23)a | --‐ | 20 (17 – 22) | |
| ACT (n=20)a | --‐ | 20 (16 – 22) |
Os dados são representados em média (DP).
Em 37 participantes (86%) do AG, a doença foi total ou parcialmente controlada (ACT ou C‐ACT> 16) e os medicamentos diários foram os seguintes: oito participantes (19%) tomavam doses baixas de corticosteroides inalados (ICS); 21 participantes (49%) tomavam doses médias de ICS; sete (16%) tomavam doses elevadas de ICS; e sete (16%) foram submetidas à Beta2 agonista de curta duração (Saba). Além disso, 26 pessoas (60%) foram classificadas nas etapas 1 e 2 (asma leve: dose baixa de ICS e antileucotrienos ou cromonas) e 3da Gina (asma moderada: dose baixa de ICS/Laba (beta2 agonista de longa duração) e 17 (40%) foram classificados nas etapas 4 e 5da Gina (asma grave: dose alta de ICS/Laba).
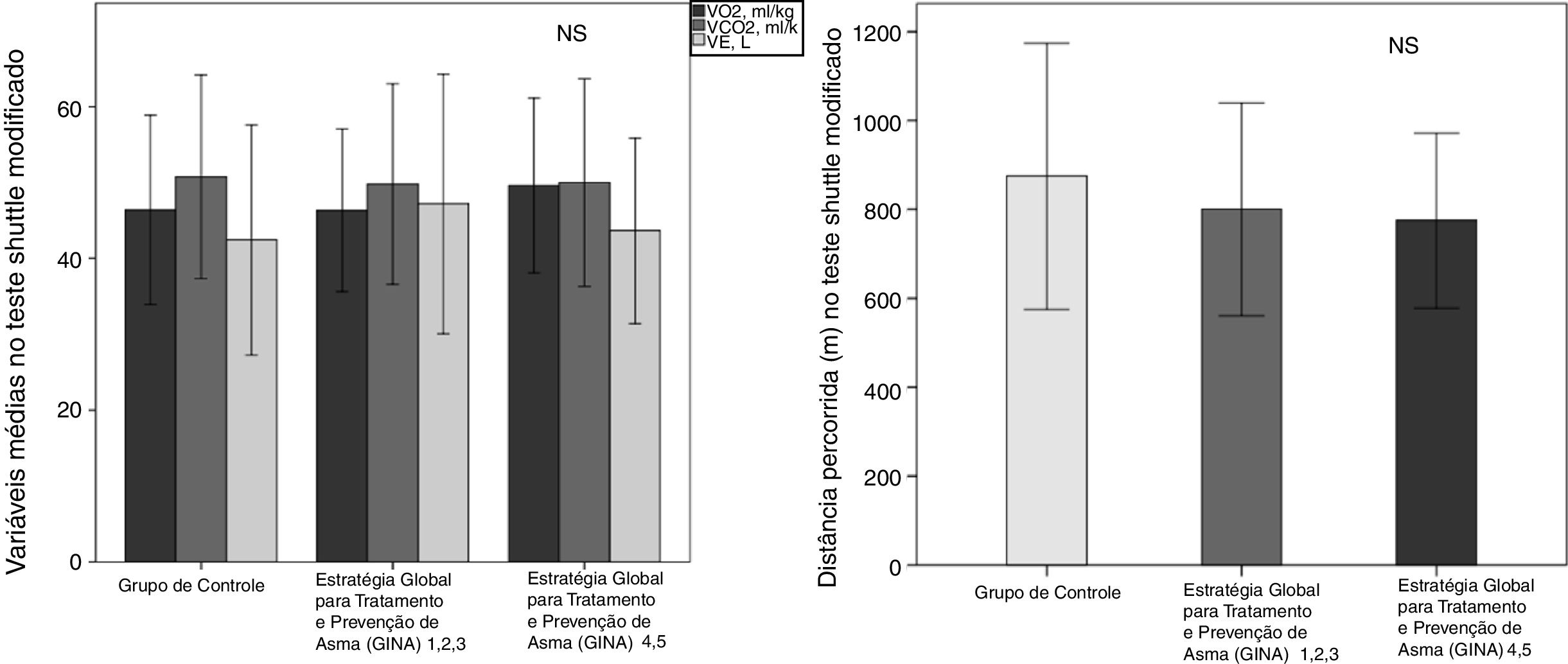
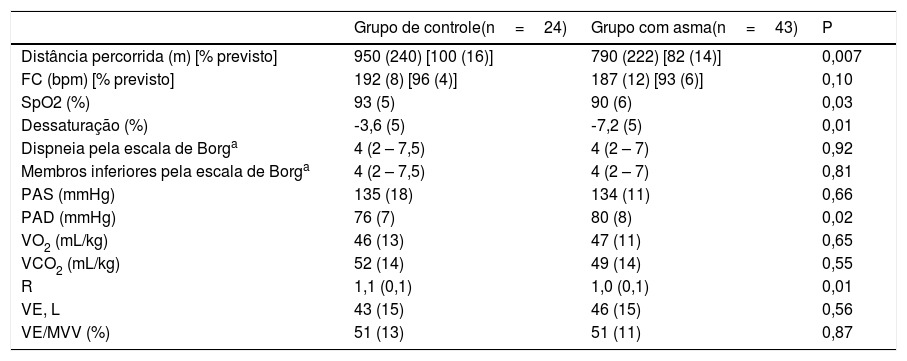
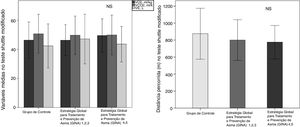
A capacidade funcional, avaliada com base na distância percorrida (DW), e a SpO2 do AG foram menores em comparação com o CG (tabela 2). Não houve diferenças no pico de VO2 e VCO2, no VE e na DW de acordo com a gravidade da asma (p> 0,05, figura 1).
Variáveis no pico do teste shuttle modificado (MST)
| Grupo de controle(n=24) | Grupo com asma(n=43) | P | |
|---|---|---|---|
| Distância percorrida (m) [% previsto] | 950 (240) [100 (16)] | 790 (222) [82 (14)] | 0,007 |
| FC (bpm) [% previsto] | 192 (8) [96 (4)] | 187 (12) [93 (6)] | 0,10 |
| SpO2 (%) | 93 (5) | 90 (6) | 0,03 |
| Dessaturação (%) | ‐3,6 (5) | ‐7,2 (5) | 0,01 |
| Dispneia pela escala de Borga | 4 (2 – 7,5) | 4 (2 – 7) | 0,92 |
| Membros inferiores pela escala de Borga | 4 (2 – 7,5) | 4 (2 – 7) | 0,81 |
| PAS (mmHg) | 135 (18) | 134 (11) | 0,66 |
| PAD (mmHg) | 76 (7) | 80 (8) | 0,02 |
| VO2 (mL/kg) | 46 (13) | 47 (11) | 0,65 |
| VCO2 (mL/kg) | 52 (14) | 49 (14) | 0,55 |
| R | 1,1 (0,1) | 1,0 (0,1) | 0,01 |
| VE, L | 43 (15) | 46 (15) | 0,56 |
| VE/MVV (%) | 51 (13) | 51 (11) | 0,87 |
Os dados são representados em média (DP).
mediana (25‐75%); bpm, batidas por minuto; FC, frequência cardíaca; MVV, ventilação voluntária máxima.
PAD, pressão arterial diastólica; PAS, pressão arterial sistólica; R, coeficiente respiratório; SpO2, saturação de oxigênio no sangue; VCO2, produção de dióxido de carbono; VE, ventilação por minuto; VO2, consumo de oxigênio.
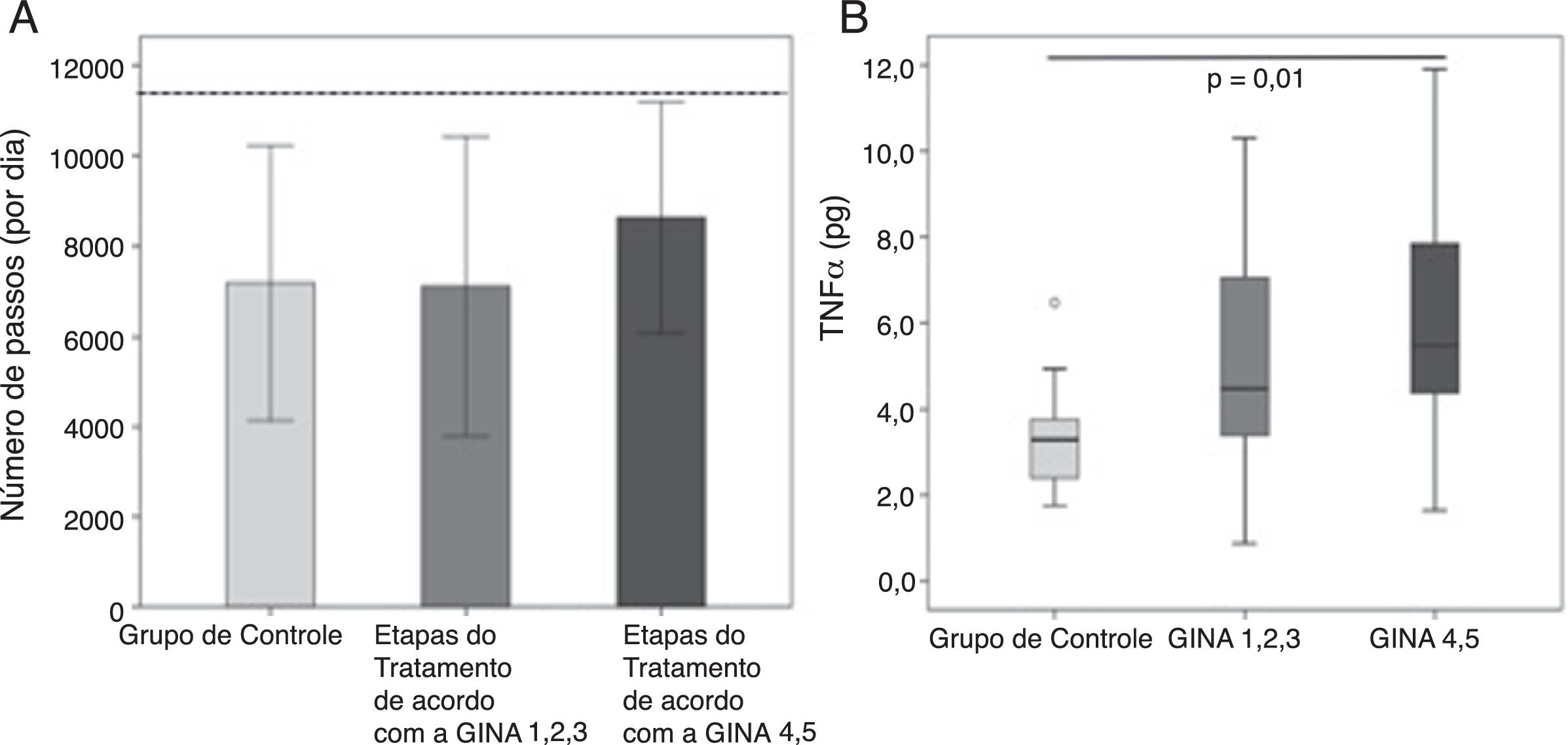
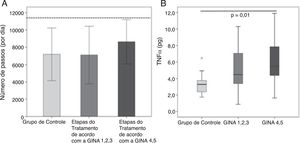
Não houve diferenças na força muscular do bíceps (9,7±3,6kg em comparação com 8,8±2,0kg, p=0,30) e do quadríceps (41,2±30,7kg em comparação com 39,9±21,2kg, p=0,28) entre o AG e o CG, respectivamente, e a gravidade da asma não afetou essas variáveis (não constam os dados). Os 36 participantes do AG e os 23 participantes do CG usaram corretamente o acelerômetro e o número de passos por dia foi semelhante entre os grupos (CG: 7.181 [3040] em comparação com a AG: 7.743 [3075] passos, p=0,41). Exceto por dois participantes do AG, todas as pessoas conseguiram alcançar o número de passos por dia para serem considerados ativos na vida cotidiana. O número de passos dados pelos participantes com asma grave (nas tapas 4 e 5da Gina) não foi diferente dos passos dados pelos participantes com grau de asma mais leve (nas etapas 1, 2 e 3da Gina) ou pelo CG (p=0,37; figura 2A).
Não foi possível coletar amostras de sangue de 13 pessoas do AG e de sete do CG. Com exceção dos níveis de fator de necrose tumoral alfa, nenhum outro nível de citocina estava diferente nos grupos (não constam os dados). O TNFα do AG foi de 4,5 (3,3‐7,0) pg/mL em comparação com 3,2 (2,3‐3,7) pg/mL do CG, p=0,007. Os participantes com asma mais grave (nas etapas 4 e 5da GINA) apresentaram níveis maiores de TNFα em comparação com os participantes do CG (p=0,02; figura 2B).
Houve uma correlação significativa entre a força muscular do quadríceps e a DW (r=0,62, P <0,001) e entre a PADL e o nível de TNFα (r=‐0,54, p=0,005) no AG (Material Complementar, figura S1). Entretanto, não houve correlações significativas entre força muscular do quadríceps, PADL e nível de TNFα.
Também não houve diferenças entre a DW e a força muscular de acordo com a pontuação do ACT e do C‐ACT (pontuação> 20 e os participantes com pontuação ≤ 20; não constam os dados). Não observamos efeito adverso durante a aplicação do MST.
DiscussãoAté onde sabemos, este é o primeiro estudo a fazer uma avaliação global e integrativa da capacidade funcional, da força muscular periférica, da atividade física na vida cotidiana (PADL) e dos perfis inflamatórios de uma população pediátrica com asma que recebia tratamento regular. A capacidade funcional foi menor no AG; a PADL foi semelhante entre os participantes com asma e os saudáveis e ambos os grupos não atingiram as exigências mínimas para serem considerados ativos; houve uma associação entre a força muscular do quadríceps e a distância percorrida e entre a PADL e o TNFα.
A capacidade funcional avaliada pelo MST foi diferente entre o AG e o CG; 23 participantes (53%) do AG caminharam menos de 80% da distância prevista durante esse teste. Em média, os participantes do AG caminharam 160 metros a menos do que os participantes do CG, o que é uma diferença importante por ser maior do que a diferença mínima relatada clinicamente com relação à DW (20‐76 m).29
Ambos os grupos apresentaram demanda ventilatória semelhante de acordo com a escala de Borg, contudo o AG percorreu uma distância menor do que o CG. Em contraste com esses resultados, Augusto et al.13 não detectaram diferença no teste adicional de caminhada (Shuttle Walk Test) de adolescentes com asma comparado com o do grupo de controle, porém os voluntários do teste não correram, o que pode ter resultado em um efeito‐teto. Até onde sabemos, nenhum estudo com participantes com asma usou o MST, conforme descrito por Bradley et al.,10 o qual fornece uma melhor avaliação da capacidade funcional.
A força muscular periférica é um fator importante que influencia a capacidade de praticar atividade física; contudo, é raramente estudada em crianças e adolescentes com asma. Villa et al.17 relataram redução da resistência muscular, porém não da força, nos quadríceps de crianças com asma grave. Não observamos diferenças na força muscular dos grupos, apesar de nossa avaliação ter sido feita com uma avaliação mais detalhada (ou seja, avaliação da célula de carga). Essa diferença entre os estudos pode ter ocorrido devido a diferenças no tratamento regular e na gravidade menor da asma entre os pacientes neste estudo comparados com os do estudo de Villa et al.
Curiosamente, o nível de PADL das crianças e adolescentes com asma não foi diferente do nível do CG e ambos os grupos foram considerados sedentários por terem dado menos de 11.500 passos por dia.27,28 Assumiu‐se um estilo de vida sedentário para o AG devido a restrições de exercícios impostas pela doença.30 Foi reportada PADL normal em participantes eutróficos com asma,31 contudo foram reportados resultados diferentes anteriormente.16 Com relação às medições da PADL (ou seja, questionários ou avaliação objetiva por meio de um acelerômetro), a gravidade da doença e o tratamento regular podem influenciar os resultados.
Também foi observada uma associação entre a DW e a força muscular do quadríceps em pacientes com asma. Essa correlação era esperada. A disfunção muscular esquelética foi sugerida como um fator que contribui para reduzir a tolerância a exercícios em pacientes com fibrose cística32,33 causada por inflamação sistêmica, estresse oxidativo e inatividade.34 Além disso, a fraqueza muscular esquelética tem sido associada à capacidade funcional de pacientes com doenças crônicas, como a fibrose cística35 e a doença pulmonar obstrutiva crônica (DPOC).36 Outra correlação observada foi entre a PADL e o TNFα: quanto maior o nível de inflamação, menor o NS dados por dia. Al‐Sahir et al. propuseram uma correlação entre o TNFα e a atividade física entre os pacientes com DPOC que é semelhante a nossos resultados entre pacientes pediátricos.37 Embora essas correlações sejam teoricamente esperadas, até onde sabemos, foi demonstrado neste estudo em uma população pediátrica com asma pela primeira vez.
Uma limitação a este estudo foi que o número de participantes classificados nas etapas 4 e 5da Gina foi menor do que os classificados nas etapas 1, 2 e 3da Gina. Esse número menor reflete a distribuição esperada da gravidade da asma. Além disso, não conseguimos avaliar a PADL em todos os participantes, devido à disponibilidade dos equipamentos; contudo, a maior parte dos participantes conseguiu fazer essa avaliação.
As aplicações práticas desses resultados são a melhor compreensão das baixas capacidades de praticar exercícios e do comportamento sedentário entre pacientes com asma que recebem tratamento regular, o que pode fornecer uma melhor orientação nas prescrições de tratamento e exercícios durante a reabilitação pulmonar.
Por fim, esta avaliação multidimensional de crianças e adolescentes com asma que recebiam tratamento regular revelou uma redução da capacidade funcional entre a população estudada e um comportamento sedentário. Além disso, os participantes com menos força muscular nos quadríceps apresentaram menor capacidade funcional e os participantes com asma mais sedentários apresentaram níveis maiores de TNFα.
FinanciamentoEste estudo contou com o auxílio da Fundação de Amparo à Pesquisa do Estado de São Paulo (Fapesp), bolsa: 2014/12040‐0. O RSS foi embasado na Fundação de Amparo à Pesquisa do Estado de São Paulo (Fapesp), bolsa: 2016/17553‐0.
Conflitos de interesseOs autores declaram não haver conflitos de interesse.
Como citar este artigo: Reimberg MM, Pachi JR, Scalco RS, Serra AJ, Fernandes L, Politti F, et al. Patients with asthma have reduced functional capacity and sedentary behavior. J Pediatr (Rio J). 2020;96:53–9.