The objective of this study was to evaluate the effects of two low‐dose combined oral contraceptives on bone metabolism in adolescents for one year.
MethodsThis was a quasi‐experimental study. The adolescents were divided into three groups: oral contraceptives 1 (n=42) (20μg EE/150μg desogestrel), oral contraceptives 2 (n=66) (30μg EE/3mg drospirenone), and a control group (n=70). Adolescents underwent anthropometric assessment and densitometry (dual‐energy X‐ray). Bone age and bone formation markers (osteocalcin and bone alkaline phosphatase) were evaluated. The oral contraceptives users were evaluated again after 12 months. Linear regression analysis was used to indirectly study the effect of each additional year of chronological age on anthropometric and densitometric variables as well as on bone markers in the control group.
ResultsAt study entry, no significant differences were observed between the oral contraceptives 1, oral contraceptives 2, and controls in the analyzed variables. Linear regression analysis showed an increase in bone mineral density and bone mineral content for each additional year. There was a significant reduction in bone alkaline phosphatase levels; no significant difference was observed for osteocalcin in control individuals. Comparison of dual‐energy X‐ray variables at baseline and after one year showed no significant differences in the oral contraceptives 1 or oral contraceptives 2 groups. A significant reduction in bone alkaline phosphatase and osteocalcin levels was observed in both the oral contraceptives 1 and oral contraceptives 2 groups.
ConclusionAdolescent women gain peak bone mass during this phase of life. Two low‐dose combined oral hormonal contraceptives were associated with lower bone gain and lower bone formation markers than in untreated controls.
O objetivo deste estudo foi avaliar os efeitos de dois contraceptivos orais combinados de baixa dosagem por um ano sobre o metabolismo ósseo em adolescentes.
MétodosEste foi um estudo quase experimental. As adolescentes foram divididas em três grupos: contraceptivos orais 1 (n=42) (20μg de EE/150μg de desogestrel), contraceptivos orais 2 (n=66) (30μg EE/3mg de drospirenona) e grupo controle (n=70). As adolescentes foram submetidas à avaliação antropométrica e densitometria (raio-X de dupla energia). Foram avaliados a idade óssea e os marcadores de formação óssea (osteocalcina e fosfatase alcalina óssea). As usuárias de contraceptivos orais foram novamente avaliadas após 12 meses. A análise de regressão linear foi utilizada para estudar, indiretamente, o efeito de cada ano adicional da idade cronológica sobre as variáveis antropométricas e densitométricas e sobre os marcadores ósseos no grupo de controle.
ResultadosNo início do estudo, não foram observadas diferenças significativas nas variáveis analisadas entre as usuárias de contraceptivos orais 1, contraceptivos orais 2 e o grupo controle. A análise de regressão linear mostrou um aumento na densidade mineral óssea e no conteúdo mineral ósseo para cada ano adicional. Houve uma redução significativa nos níveis de fosfatase alcalina óssea e não foi observada diferença significativa para osteocalcina nos indivíduos controles. A comparação das variáveis do raio-X de dupla energia no início e após um ano não mostrou diferença significativa no grupo de contraceptivos orais 1 ou contraceptivos orais 2. Foi observada uma redução significativa nos níveis de fosfatase alcalina óssea e osteocalcina nos dois grupos contraceptivos orais 1 e contraceptivos orais 2.
ConclusãoAs adolescentes atingiram o pico de massa óssea durante essa fase da vida. Duas formulações de contraceptivos hormonais orais de baixa dosagem, após um ano de uso, se associaram a menor incremento na densidade mineral óssea e menor concentração de marcadores de formação óssea quando confrontados com resultados de adolescentes não usuárias de contraceptivos.
A aquisição de massa óssea adequada durante a infância e a adolescência foi identificada como um fator de proteção da saúde óssea na vida adulta.1 Um fator de risco para osteopenia/osteoporose e fraturas por fragilidade durante a vida adulta e a velhice é a densidade mineral óssea (DMO) ou falta de sua preservação durante a infância e adolescência. Parece praticamente impossível aumentar o pico de massa óssea na vida adulta, assim o indivíduo em crescimento deve ganhar a massa óssea necessária no momento adequado. A esse respeito, cerca de 40 a 45% da massa óssea presente na vida adulta são adquiridos durante a adolescência.2
Nesse contexto, deve‐se lembrar que os contraceptivos são prescritos em idades cada vez mais jovens para proteger o público jovem de gravidezes não intencionais no início da atividade sexual.3 Essa prática levantou dúvidas quanto à quantidade de estrogênio na formulação ser adequada para essa faixa etária, com relação ao desenvolvimento ósseo e ao atingimento de um pico de massa óssea adequado. A maior parte das pesquisas publicadas inclui uma ampla gama de mulheres de diferentes idades, inclusive adolescentes, pessoas jovens e até mesmo adultos jovens, bem como diversos momentos do crescimento e mineralização óssea, cria dificuldades ao interpretar os resultados de aumentos da massa óssea.
Estudos recentes que envolvem meninos e meninas jovens demonstraram uma relação entre os marcadores ósseos como preditores do desenvolvimento de conteúdo mineral ósseo (CMO) e DMO durante o período de maior ganho de massa óssea. Os resultados mostraram que as concentrações de marcadores de formação óssea e reabsorção são maiores nos primeiros anos da puberdade do que os estágios avançados de desenvolvimento púbere.4–7 Os possíveis efeitos dos contraceptivos sobre o ganho de massa óssea podem causar doenças de remodelação óssea.8,9
A importância dos contraceptivos hormonais para o ganho de massa óssea e sua participação na remodelação óssea destacam a necessidade de fazer estudos prospectivos que abordem especificamente a adolescência, um período caracterizado por maior aquisição de massa óssea, para avaliar os efeitos desses medicamentos sobre a saúde óssea nessa faixa etária e os possíveis resultados futuros na vida adulta e velhice.
Assim, o objetivo deste estudo foi avaliar prospectivamente se haveria quaisquer efeitos e possíveis diferenças entre o uso de dois tipos de contraceptivos orais (CO) de baixa dosagem, com 20μg etinilestradiol (EE)/150μg desogestrel ou 30μg EE/3mg de drospirenona, por um ano sobre o metabolismo ósseo das adolescentes e comparar os resultados com os obtidos para adolescentes saudáveis que não usaram COs.
MétodosEste foi um estudo quase experimento aprovado pelo Comitê de Ética em Pesquisa da Faculdade de Medicina de Botucatu, São Paulo, Brasil. A amostra consistiu de adolescentes saudáveis com estatura entre o percentil 5 e 95 para a idade e índice de massa corporal (IMC) entre percentil 5 e 95, de acordo com o Centro de Controle e Prevenção de Doenças.10 As adolescentes que disseram ter vida sexual ativa e quiseram iniciar o método contraceptivo foram incluídas nos grupos de exposição a CO e dois tipos de COs foram oferecidos. Aquelas que não pediram COs foram direcionadas para o grupo de controle.
As participantes foram divididas em três grupos. O Grupo 1 (CO1) consistiu em adolescentes saudáveis entre 12 anos completos e 20 anos incompletos no pós‐menarca, puberdade tardia.11 As adolescentes foram registradas na clínica ambulatorial de Medicina do Adolescente do Hospital Universitário e foram encaminhadas para orientação e prescrição de um método contraceptivo, devido à vida sexual ativa. Esses indivíduos (n = 42) receberam um contraceptivo oral (CO) combinado de baixa dosagem que contém etinilestradiol (EE) e 150μg de desogestrel. O grupo 2 (CO2) consistiu em adolescentes da mesma faixa etária e com as mesmas características que as do CO1. Esses indivíduos (n = 66) receberam outra formulação de CO combinado de baixa dosagem que contém 30μg EE e 3mg de drospirenona. O grupo de controle consistiu em 70 adolescentes pareadas para os outros dois grupos, que não usaram COs. Todas as adolescentes do estudo e dos grupos de controle estavam no pós‐menarca, apresentaram ciclos menstruais regulares e não apresentaram oligomenorreia/amenorreia. Todas as participantes não bebiam e não fumavam e não praticavam atividades esportivas além das duas horas de atividade física por semana durante o horário escolar. Os critérios de exclusão relacionados à saúde adotados para o estudo foram: histórico de prematuridade ou baixo peso ao nascer; tratamento prolongado com esteroides ou uso de suplementos de cálcio ou ferro nos 12 meses anteriores ao estudo; diabetes mellitus; desnutrição aguda ou crônica; doenças ósseas congênitas ou adquiridas; má absorção gastrointestinal; histórico de nefropatia com ou sem insuficiência renal; endocrinopatias; puberdade precoce ou tardia; uso crônico de drogas; fibrose cística e doença celíaca. Outros critérios de exclusão foram uso de medicamentos conhecidos por afetar negativamente o metabolismo ósseo, aquelas que usaram anteriormente um CO ou outro método de contraceptivo hormonal inclusive acetato de medroxiprogesterona de depósito, indivíduos que trocaram de métodos durante o estudo, ser vegetariana ou consumir dieta ricas em fibras e consumo diário de mais de 300mg de cafeína ou mais de 500mL de refrigerantes à base de cola.
Todas as adolescentes foram submetidas a avaliação antropométrica. O IMC foi calculado e o estágio puberal foi avaliado com os critérios de Tanner.11 A idade óssea foi determinada pelo método de Greulich e Pyle12 no início do estudo e após 12 meses de acompanhamento.
As adolescentes que concluíram todas as etapas anteriores foram submetidas a avaliação da massa óssea no início do uso do CO e no término do acompanhamento (após um ano). A massa óssea foi medida densitometricamente por absorciometria de dupla energia de raios X (DXA) com um aparelho Hologic QDR 4500 Discovery A (Hologic, Inc., Bedford, MA, EUA). Os biomarcadores de osteocalcina e fosfatase alcalina óssea (FAO) foram avaliados antes e depois de 12 meses do uso do CO. As dosagens foram medidas com o ensaio da Metra™ Biosystems (Quidel Corporation, CA, EUA), com os coeficientes de variação intraensaio e interensaio de 8 e 7,6%, respectivamente.
O estudo propôs um acompanhamento dos três grupos durante um ano; contudo, no momento do acompanhamento, há dificuldades com relação às adolescentes no grupo de controle, no momento em que elas foram submetidas à nova densitometria mineral óssea e coletas de sangue, procedimentos semelhantes aos propostos para os usuários dos contraceptivos. Essas dificuldades incluíram o que segue: muitas não voltaram no dia agendado para a coleta de sangue ou densitometria, começar a usar uma medicação que estava entre os critérios de exclusão e, por fim, um grande percentual solicitou a prescrição de um método contraceptivo. Por esse motivo, foi tomada a decisão de excluir o grupo de controle e fazer uma análise de regressão linear com uma resposta normal com observações independentes entre as adolescentes do grupo de controle, o que possibilitou uma estimativa do efeito anual sobre nossos resultados e compensou a ausência de um acompanhamento de um ano entre as adolescentes no grupo de controle. Com essa técnica, conseguimos comparar os grupos indiretamente durante um ano de acompanhamento.
Análise estatísticaO teste de Kruskal‐Wallis foi usado para comparar as variáveis de base entre os grupos de controle, CO1 e CO2 e o teste de Mann‐Whitney para comparação entre os grupos de CO1 e CO2. O teste Anova foi usado para as variáveis IMC, escore z do IMC e o percentil do IMC (valores apresentados como média), pois essas variáveis apresentaram distribuição simétrica.
Os efeitos da idade sobre as variáveis antropométricas e densitométricas e sobre as concentrações de marcadores ósseos no grupo de controle foram avaliados por regressão linear simples com uma resposta normal. O teste de Wilcoxon foi usado para comparar as variáveis antropométricas e densitométricas e os marcadores ósseos no início e após 12 meses no grupo de CO1 e CO2. Para o IMC, o escore z do IMC e o percentil do IMC, foi usado o teste pareado. As diferenças e as associações foram consideradas significativas quando p < 0,05.
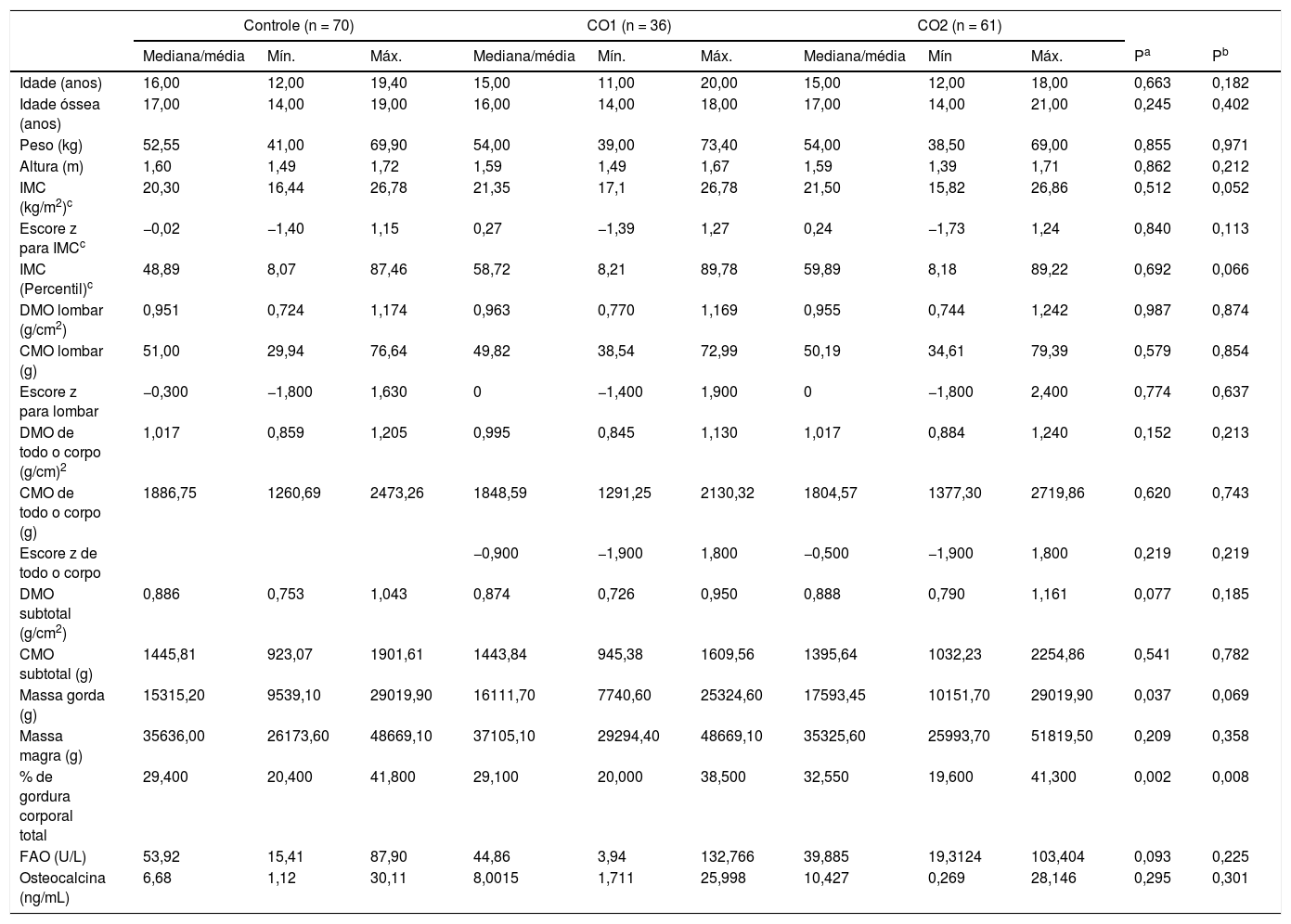
ResultadosNo grupo de CO1, 36 indivíduos concluíram o estudo e seis foram excluídos por optarem por não continuar com o CO, devido a motivos pessoais. Dos 66 indivíduos incluídos no grupo de CO2, cinco foram excluídos pelos mesmos motivos pessoais. A comparação das variáveis antropométricas e densitométricas, da composição corporal obtida por densitometria e das concentrações de FAO e osteocalcina no início não revelou diferenças significativas entre os três grupos, indicou a homogeneidade entre os grupos no momento da inclusão, exceto percentual de gordura corporal. Essa variável foi maior no grupo de CO2 em comparação com os grupos de controle e CO1. Contudo, nenhum dos pacientes estava obeso (tabela 1).
Comparação das variáveis antropométricas e densitométricas e marcadores de formação óssea no início entre as adolescentes que recebem contraceptivos orais de baixa dosagem e o grupo de controle
| Controle (n = 70) | CO1 (n = 36) | CO2 (n = 61) | |||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|
| Mediana/média | Mín. | Máx. | Mediana/média | Mín. | Máx. | Mediana/média | Mín | Máx. | Pa | Pb | |
| Idade (anos) | 16,00 | 12,00 | 19,40 | 15,00 | 11,00 | 20,00 | 15,00 | 12,00 | 18,00 | 0,663 | 0,182 |
| Idade óssea (anos) | 17,00 | 14,00 | 19,00 | 16,00 | 14,00 | 18,00 | 17,00 | 14,00 | 21,00 | 0,245 | 0,402 |
| Peso (kg) | 52,55 | 41,00 | 69,90 | 54,00 | 39,00 | 73,40 | 54,00 | 38,50 | 69,00 | 0,855 | 0,971 |
| Altura (m) | 1,60 | 1,49 | 1,72 | 1,59 | 1,49 | 1,67 | 1,59 | 1,39 | 1,71 | 0,862 | 0,212 |
| IMC (kg/m2)c | 20,30 | 16,44 | 26,78 | 21,35 | 17,1 | 26,78 | 21,50 | 15,82 | 26,86 | 0,512 | 0,052 |
| Escore z para IMCc | −0,02 | −1,40 | 1,15 | 0,27 | −1,39 | 1,27 | 0,24 | −1,73 | 1,24 | 0,840 | 0,113 |
| IMC (Percentil)c | 48,89 | 8,07 | 87,46 | 58,72 | 8,21 | 89,78 | 59,89 | 8,18 | 89,22 | 0,692 | 0,066 |
| DMO lombar (g/cm2) | 0,951 | 0,724 | 1,174 | 0,963 | 0,770 | 1,169 | 0,955 | 0,744 | 1,242 | 0,987 | 0,874 |
| CMO lombar (g) | 51,00 | 29,94 | 76,64 | 49,82 | 38,54 | 72,99 | 50,19 | 34,61 | 79,39 | 0,579 | 0,854 |
| Escore z para lombar | −0,300 | −1,800 | 1,630 | 0 | −1,400 | 1,900 | 0 | −1,800 | 2,400 | 0,774 | 0,637 |
| DMO de todo o corpo (g/cm)2 | 1,017 | 0,859 | 1,205 | 0,995 | 0,845 | 1,130 | 1,017 | 0,884 | 1,240 | 0,152 | 0,213 |
| CMO de todo o corpo (g) | 1886,75 | 1260,69 | 2473,26 | 1848,59 | 1291,25 | 2130,32 | 1804,57 | 1377,30 | 2719,86 | 0,620 | 0,743 |
| Escore z de todo o corpo | −0,900 | −1,900 | 1,800 | −0,500 | −1,900 | 1,800 | 0,219 | 0,219 | |||
| DMO subtotal (g/cm2) | 0,886 | 0,753 | 1,043 | 0,874 | 0,726 | 0,950 | 0,888 | 0,790 | 1,161 | 0,077 | 0,185 |
| CMO subtotal (g) | 1445,81 | 923,07 | 1901,61 | 1443,84 | 945,38 | 1609,56 | 1395,64 | 1032,23 | 2254,86 | 0,541 | 0,782 |
| Massa gorda (g) | 15315,20 | 9539,10 | 29019,90 | 16111,70 | 7740,60 | 25324,60 | 17593,45 | 10151,70 | 29019,90 | 0,037 | 0,069 |
| Massa magra (g) | 35636,00 | 26173,60 | 48669,10 | 37105,10 | 29294,40 | 48669,10 | 35325,60 | 25993,70 | 51819,50 | 0,209 | 0,358 |
| % de gordura corporal total | 29,400 | 20,400 | 41,800 | 29,100 | 20,000 | 38,500 | 32,550 | 19,600 | 41,300 | 0,002 | 0,008 |
| FAO (U/L) | 53,92 | 15,41 | 87,90 | 44,86 | 3,94 | 132,766 | 39,885 | 19,3124 | 103,404 | 0,093 | 0,225 |
| Osteocalcina (ng/mL) | 6,68 | 1,12 | 30,11 | 8,0015 | 1,711 | 25,998 | 10,427 | 0,269 | 28,146 | 0,295 | 0,301 |
CO1, adolescentes que recebem contraceptivos orais que contêm 20μg EE/150g de desogestrel; CO2, adolescentes que recebem contraceptivos orais que contêm 30μg EE/3mg de drospirenona.
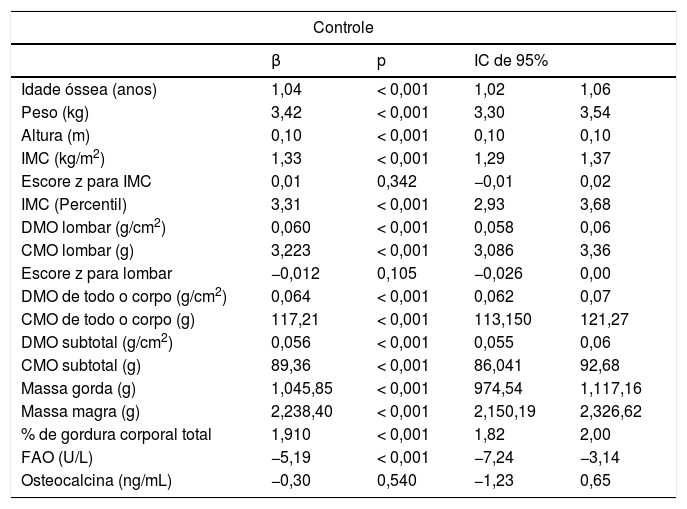
A análise de regressão linear simples foi usada para estudar, indiretamente, o efeito de cada ano adicional da idade cronológica sobre as variáveis antropométricas e densitométricas e sobre os marcadores ósseos no grupo de controle. Para cada ano adicional de idade cronológica, a idade óssea aumentou 1,04 ano, o peso em 3,42kg e IMC em 1,33kg/m2. O efeito anual estatisticamente significativo sobre a estatura (aumento de 0,1 m por ano) não está de acordo com o efeito biologicamente esperado. Assim, esse efeito foi reavaliado com um modelo de regressão linear com inserção de um intercepto, que resultou em um efeito biologicamente mais sensível sobre a estatura de praticamente zero (p = 0,953) (tabela 2).
Análise de regressão linear para avaliar o efeito da idade sobre as variáveis antropométricas e densitométricas e os marcadores de formação óssea em adolescentes que não usam contraceptivos orais (grupo de controle)
| Controle | ||||
|---|---|---|---|---|
| β | p | IC de 95% | ||
| Idade óssea (anos) | 1,04 | < 0,001 | 1,02 | 1,06 |
| Peso (kg) | 3,42 | < 0,001 | 3,30 | 3,54 |
| Altura (m) | 0,10 | < 0,001 | 0,10 | 0,10 |
| IMC (kg/m2) | 1,33 | < 0,001 | 1,29 | 1,37 |
| Escore z para IMC | 0,01 | 0,342 | −0,01 | 0,02 |
| IMC (Percentil) | 3,31 | < 0,001 | 2,93 | 3,68 |
| DMO lombar (g/cm2) | 0,060 | < 0,001 | 0,058 | 0,06 |
| CMO lombar (g) | 3,223 | < 0,001 | 3,086 | 3,36 |
| Escore z para lombar | −0,012 | 0,105 | −0,026 | 0,00 |
| DMO de todo o corpo (g/cm2) | 0,064 | < 0,001 | 0,062 | 0,07 |
| CMO de todo o corpo (g) | 117,21 | < 0,001 | 113,150 | 121,27 |
| DMO subtotal (g/cm2) | 0,056 | < 0,001 | 0,055 | 0,06 |
| CMO subtotal (g) | 89,36 | < 0,001 | 86,041 | 92,68 |
| Massa gorda (g) | 1,045,85 | < 0,001 | 974,54 | 1,117,16 |
| Massa magra (g) | 2,238,40 | < 0,001 | 2,150,19 | 2,326,62 |
| % de gordura corporal total | 1,910 | < 0,001 | 1,82 | 2,00 |
| FAO (U/L) | −5,19 | < 0,001 | −7,24 | −3,14 |
| Osteocalcina (ng/mL) | −0,30 | 0,540 | −1,23 | 0,65 |
A análise das variáveis densitométricas no grupo de controle mostrou diferenças estatisticamente significativas na DMO da coluna lombar, na DMO de todo o corpo e na DMO subtotal, com aumentos de 0,060, 0,064 e 0,056g/cm2 em cada ano adicional, respectivamente. Aumentos também foram observados no CMO da coluna lombar, no CMO de todo o corpo e no CMO subtotal (3,22; 117,21 e 89,36g, respectivamente; p < 0,001). A massa gorda e a massa magra apresentaram um aumento de 1045,85 e 2238,40g, respectivamente (tabela 2).
A respeito dos biomarcadores ósseos, houve uma redução estatisticamente significativa no grupo de controle com relação à concentração de FAO (−5,19 U/L) com cada ano adicional da idade cronológica. Não foi observada diferença significativa para osteocalcina (tabela 2).
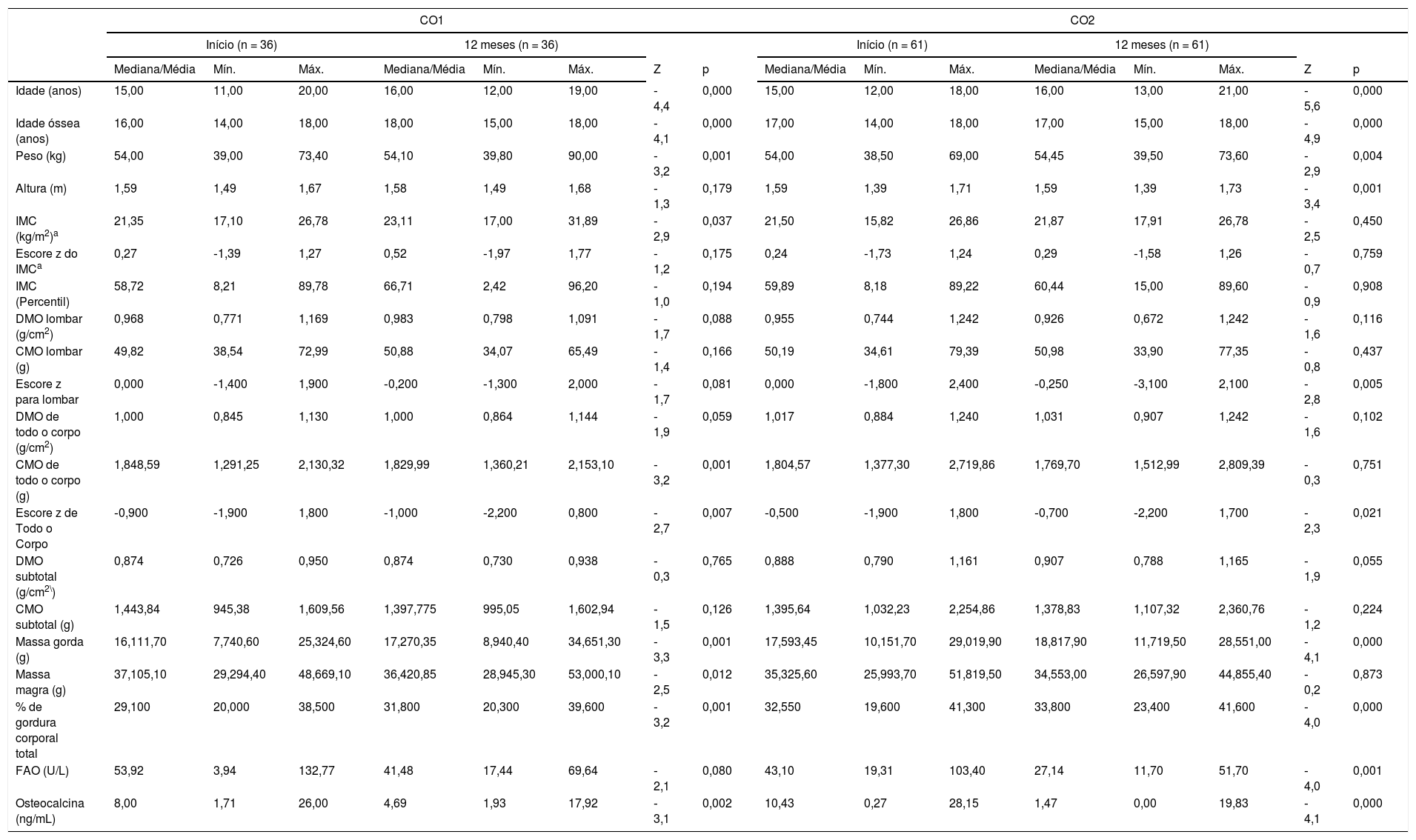
Não foram encontradas diferenças significativas para as seguintes variáveis: DMO lombar, CMO lombar, DMO de todo o corpo, CMO de todo o corpo, DMO subtotal e CMO subtotal no grupo de CO2 e as mesmas variáveis no grupo de CO1, exceto IMC de todo o corpo (p = 0,001). Diferenças significativas foram observadas na massa gorda e na percentual de gordura corporal entre o início e os 12 meses nas duas formulações de contraceptivos. Não foi observada diferença significativa na massa magra entre o início e após 12 meses no grupo de CO2 (tabela 3).
Comparação das variáveis antropométricas e densitométricas e marcadores de formação óssea entre o início e após 12 meses nos dois grupos que recebem contraceptivos orais
| CO1 | CO2 | |||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Início (n = 36) | 12 meses (n = 36) | Início (n = 61) | 12 meses (n = 61) | |||||||||||||
| Mediana/Média | Mín. | Máx. | Mediana/Média | Mín. | Máx. | Z | p | Mediana/Média | Mín. | Máx. | Mediana/Média | Mín. | Máx. | Z | p | |
| Idade (anos) | 15,00 | 11,00 | 20,00 | 16,00 | 12,00 | 19,00 | ‐4,4 | 0,000 | 15,00 | 12,00 | 18,00 | 16,00 | 13,00 | 21,00 | ‐5,6 | 0,000 |
| Idade óssea (anos) | 16,00 | 14,00 | 18,00 | 18,00 | 15,00 | 18,00 | ‐4,1 | 0,000 | 17,00 | 14,00 | 18,00 | 17,00 | 15,00 | 18,00 | ‐4,9 | 0,000 |
| Peso (kg) | 54,00 | 39,00 | 73,40 | 54,10 | 39,80 | 90,00 | ‐3,2 | 0,001 | 54,00 | 38,50 | 69,00 | 54,45 | 39,50 | 73,60 | ‐2,9 | 0,004 |
| Altura (m) | 1,59 | 1,49 | 1,67 | 1,58 | 1,49 | 1,68 | ‐1,3 | 0,179 | 1,59 | 1,39 | 1,71 | 1,59 | 1,39 | 1,73 | ‐3,4 | 0,001 |
| IMC (kg/m2)a | 21,35 | 17,10 | 26,78 | 23,11 | 17,00 | 31,89 | ‐2,9 | 0,037 | 21,50 | 15,82 | 26,86 | 21,87 | 17,91 | 26,78 | ‐2,5 | 0,450 |
| Escore z do IMCa | 0,27 | ‐1,39 | 1,27 | 0,52 | ‐1,97 | 1,77 | ‐1,2 | 0,175 | 0,24 | ‐1,73 | 1,24 | 0,29 | ‐1,58 | 1,26 | ‐0,7 | 0,759 |
| IMC (Percentil) | 58,72 | 8,21 | 89,78 | 66,71 | 2,42 | 96,20 | ‐1,0 | 0,194 | 59,89 | 8,18 | 89,22 | 60,44 | 15,00 | 89,60 | ‐0,9 | 0,908 |
| DMO lombar (g/cm2) | 0,968 | 0,771 | 1,169 | 0,983 | 0,798 | 1,091 | ‐1,7 | 0,088 | 0,955 | 0,744 | 1,242 | 0,926 | 0,672 | 1,242 | ‐1,6 | 0,116 |
| CMO lombar (g) | 49,82 | 38,54 | 72,99 | 50,88 | 34,07 | 65,49 | ‐1,4 | 0,166 | 50,19 | 34,61 | 79,39 | 50,98 | 33,90 | 77,35 | ‐0,8 | 0,437 |
| Escore z para lombar | 0,000 | ‐1,400 | 1,900 | ‐0,200 | ‐1,300 | 2,000 | ‐1,7 | 0,081 | 0,000 | ‐1,800 | 2,400 | ‐0,250 | ‐3,100 | 2,100 | ‐2,8 | 0,005 |
| DMO de todo o corpo (g/cm2) | 1,000 | 0,845 | 1,130 | 1,000 | 0,864 | 1,144 | ‐1,9 | 0,059 | 1,017 | 0,884 | 1,240 | 1,031 | 0,907 | 1,242 | ‐1,6 | 0,102 |
| CMO de todo o corpo (g) | 1,848,59 | 1,291,25 | 2,130,32 | 1,829,99 | 1,360,21 | 2,153,10 | ‐3,2 | 0,001 | 1,804,57 | 1,377,30 | 2,719,86 | 1,769,70 | 1,512,99 | 2,809,39 | ‐0,3 | 0,751 |
| Escore z de Todo o Corpo | ‐0,900 | ‐1,900 | 1,800 | ‐1,000 | ‐2,200 | 0,800 | ‐2,7 | 0,007 | ‐0,500 | ‐1,900 | 1,800 | ‐0,700 | ‐2,200 | 1,700 | ‐2,3 | 0,021 |
| DMO subtotal (g/cm2\) | 0,874 | 0,726 | 0,950 | 0,874 | 0,730 | 0,938 | ‐0,3 | 0,765 | 0,888 | 0,790 | 1,161 | 0,907 | 0,788 | 1,165 | ‐1,9 | 0,055 |
| CMO subtotal (g) | 1,443,84 | 945,38 | 1,609,56 | 1,397,775 | 995,05 | 1,602,94 | ‐1,5 | 0,126 | 1,395,64 | 1,032,23 | 2,254,86 | 1,378,83 | 1,107,32 | 2,360,76 | ‐1,2 | 0,224 |
| Massa gorda (g) | 16,111,70 | 7,740,60 | 25,324,60 | 17,270,35 | 8,940,40 | 34,651,30 | ‐3,3 | 0,001 | 17,593,45 | 10,151,70 | 29,019,90 | 18,817,90 | 11,719,50 | 28,551,00 | ‐4,1 | 0,000 |
| Massa magra (g) | 37,105,10 | 29,294,40 | 48,669,10 | 36,420,85 | 28,945,30 | 53,000,10 | ‐2,5 | 0,012 | 35,325,60 | 25,993,70 | 51,819,50 | 34,553,00 | 26,597,90 | 44,855,40 | ‐0,2 | 0,873 |
| % de gordura corporal total | 29,100 | 20,000 | 38,500 | 31,800 | 20,300 | 39,600 | ‐3,2 | 0,001 | 32,550 | 19,600 | 41,300 | 33,800 | 23,400 | 41,600 | ‐4,0 | 0,000 |
| FAO (U/L) | 53,92 | 3,94 | 132,77 | 41,48 | 17,44 | 69,64 | ‐2,1 | 0,080 | 43,10 | 19,31 | 103,40 | 27,14 | 11,70 | 51,70 | ‐4,0 | 0,001 |
| Osteocalcina (ng/mL) | 8,00 | 1,71 | 26,00 | 4,69 | 1,93 | 17,92 | ‐3,1 | 0,002 | 10,43 | 0,27 | 28,15 | 1,47 | 0,00 | 19,83 | ‐4,1 | 0,000 |
CO1, adolescentes que recebem contraceptivos orais que contêm 20μg EE/150g de desogestrel; CO2, adolescentes que recebem contraceptivos orais que contêm 30μg EE/3mg de drospirenona.
Teste de Wilcoxon para comparação entre os pontos de tempo nos grupos de CO1 e CO2.
Houve uma redução nos níveis medianos de FAO, passaram de 53,92 U/L no início para 41,48U/L após 12 meses de uso no grupo de CO1 (p = 0,080) e de 43,10 para 27,14U/L no grupo de CO2 (p < 0,001). Foram observadas reduções das concentrações de osteocalcina, passaram de 8,0 ng/mL no início para 4,69 ng/mL após 12 meses no grupo de CO1 (p = 0,002) e de 10,43 para 1,47 ng/mL no grupo de CO2 (p < 0,001) (tabela 3).
DiscussãoAs adolescentes saudáveis na faixa de 12 anos completos a 20 anos incompletos, que não usaram contraceptivos hormonais orais, de acordo com a análise de regressão linear usada para verificar o efeito de um ano de idade cronológica sobre as variáveis analisadas, mostraram um aumento significativo na massa óssea quando analisadas por densitometria óssea nos locais do esqueleto propostos. A respeito dos marcadores de formação óssea, foi observado um aumento das concentrações, o que coincidiu com o momento de pico de velocidade de crescimento (PVC), confirmou‐se o paralelismo entre esses eventos. Esse aumento foi acompanhado por uma redução nos níveis dos biomarcadores, que acompanharam a expectativa de desaceleração do PVC. Assim, apesar de os valores de DMO terem aumentado com a antecipação dos eventos de maturação, as concentrações dos três biomarcadores reduziram com a idade no fim da adolescência.7,13
No início, os três grupos estuados foram homogêneos em termos de características antropométricas e densitométricas, bem como os marcadores de formação óssea. As usuárias dos dois tipos de CO mostraram menor incremento ósseo entre o início e os 12 meses que o estimado para o grupo de controle, de acordo com os resultados obtidos por meio da análise de regressão linear, demonstraram um menor aumento da massa óssea em adolescentes que tomaram as duas formulações de contraceptivos. Deve‐se enfatizar que esse período da vida, que abrange a segunda década, é considerado único e fundamental para a saúde óssea futura, pois 92% da massa óssea total são adquiridos até aproximadamente 18 anos de idade e 99% até os 26 anos.14–16
Sabe‐se que as mulheres que fazem uso de COs não têm as altas concentrações de estrogênio endógeno observadas no ciclo médio, uma característica de ciclos espontâneos, bem como as oscilações vistas durante as diferentes fases dos ciclos menstruais.16 Os esforços para reduzir os efeitos colaterais, principalmente as complicações cardiovasculares resultantes do uso de COs, levou a uma redução gradual nas concentrações de estrogênio nas formulações dos contraceptivos, um fato que pode ter causado um efeito deletério sobre a DMO. Devido à menor concentração de esteroides sexuais na circulação, foi observado um aumento menor do pico de massa óssea adquirida na adolescência,17 apesar de outros órgãos e sistemas serem protegidos por essa redução nas concentrações de EE nos contraceptivos.
Ao compararmos os resultados deste estudo com os dados na literatura, podemos confirmar que o uso de COs precipita um menor aumento da massa óssea nas adolescentes, pois a análise de regressão linear mostrou um aumento da DMO e do CMO em todos os locais do esqueleto analisados nos indivíduos de controle. Esses resultados estão em linha com o relatado no estudo de Polatti et al.,18 nos quais a DMO aumentou 7,8% nos controles.18,19 Em contrapartida, neste estudo, a análise do ganho de massa óssea por densitometria revelou um aumento muito discreto das usuárias de COs após 12 meses, em comparação com o início, porém a diferença não foi estatisticamente significativa.
Cromer et al.20 avaliaram a evolução da massa óssea em 370 adolescentes entre 12 e 18 anos, divididas em uso e não uso de COs, em de 12 meses. As usuárias de acetato de medroxiprogesterona mostraram uma redução média de 1,4% na DMO da coluna lombar (p < 0,001), ao passo que aquelas que usam CO com 20μg de EE e 100μg de levonorgestrel ganharam 2,3% de DMO na coluna lombar. Contudo, esse aumento foi de 3,8% no grupo de controle. O aumento da DMO encontrado nas usuárias de COs observado no estudo de Polatti et al.18 e neste estudo é digno de nota: contudo, esse aumento foi menor do que o esperado para o grupo de não usuárias de CO. Esses resultados sugerem que os ganhos moderados na DMO em adolescentes que usam COs de baixa dosagem permitem certo ganho de massa óssea, porém não o pico de mineralização óssea necessário para servir como um “banco ósseo” para a vida adulta e a velhice.9,18–20
Além dos efeitos relacionados ao estrogênio, o impacto dos progestogênios sobre a massa óssea também deve ser considerado, com diferentes mecanismos subjacentes. Primeiro, os efeitos bem estabelecidos confirmam que as doses elevadas de progesterona atuam sobre o eixo hipotálamo‐hipófise‐gonadal, causam hipoestrogenismo, remodelação óssea antecipada e rápida perda de massa óssea.21,22 Outra possibilidade é que a progesterona exerça um efeito estimulador por meio dos receptores de progesterona e andrógenos.23 Os receptores de progesterona e andrógenos são expressos em osteoblastos e osteoclastos e a ativação desses dois receptores foi demonstrada por um aumento da massa óssea, aumentou a atividade dos osteoblastos e reduziu a reabsorção óssea resultante do estímulo dos osteoclastos.18,24
Muitos progestogênios comprometidos com os receptores de andrógenos, como a drospirenona e o desogestrel encontrados nos COs usados neste estudo, ativam os receptores de andrógenos por inibição competitiva, bloquearam, assim, a ação androgênica endógena. Esse mecanismo de ação resulta em importantes efeitos antiandrogênicos sobre o metabolismo ósseo, pois a testosterona desempenha um papel fundamental na obtenção de massa óssea. Diante do pequeno número de estudos que investigam a influência dos progestogênios presentes nas formulações os COs, é difícil distinguir se os efeitos sobre o metabolismo ósseo resultam da progesterona ou dos níveis reduzidos de estrogênio.23,24
Observa‐se um aumento nos marcadores ósseos durante o período de aceleração do crescimento nas meninas, corresponde ao estágio 2 de Tanner. A massa óssea também aumenta e o pico de concentração dos marcadores coincide com o PVC observado no estágio 3 de Tanner. Posteriormente, no momento da desaceleração do crescimento, os marcadores de metabolismo ósseo caem, ao passo que a massa óssea continua a aumentar, devido, provavelmente, aos níveis elevados de esteroides sexuais e ao fator de crescimento semelhante à insulina tipo 1. Esse fenômeno foi relatado por Tobiume et al.25 Em vista dessas considerações e como todas as adolescentes desta amostra estavam na puberdade tardia, acreditamos que a redução nas concentrações dos marcadores de formação óssea foi influenciada pelo uso de COs. Assim, os resultados dos marcadores ósseos obtidos neste estudo não aparecem ser influenciados somente pela idade, mas também pelas diferentes concentrações de EE nas duas formulações.
A respeito dos marcadores de formação óssea, este estudo demonstrou uma redução nas concentrações séricas desses marcadores nos dois grupos após 12 meses de uso dos COs, com reduções de 20 a 37% na FAO e 40 a 86% na osteocalcina. Resultados semelhantes foram relatados no estudo de Paoletti et al.,26 que comparou 28 mulheres entre 20 e 30 anos que usaram CO com 30μg de EE/3mg de drospirenona com não usuárias da mesma faixa etária. As concentrações séricas dos marcadores de formação óssea analisados caíram 20 a 30% nas usuárias de CO, porém continuaram inalteradas nos controles.
A redução observada nos biomarcadores de formação óssea pode ser atribuída ao uso de COs, o que foi confirmado pela demonstração das diferenças significativas nos níveis de FAO e osteocalcina nas adolescentes após um ano de acompanhamento.
As limitações deste estudo foram o curto período de acompanhamento das usuárias de CO e o pequeno número de participantes. Além disso, enfrentamos dificuldades de acompanhar as adolescentes no grupo de controle, devido ao grande número de meninas que não voltou nas datas agendadas para fazer as avaliações propostas.
Por outro lado, os pontos fortes deste estudo são seu modelo prospectivo e que a densitometria óssea e as medições dos biomarcadores ósseos foram feitas por um único técnico cego para a atribuição de grupo. Além disso, o uso das duas formulações de COs de baixa dose por um ano foi associado a menor aumento da massa óssea, com ganhos de DMO e CMO abaixo do estimado para essa faixa etária. Há comprovação de que a introdução desses contraceptivos na segunda década de vida está relacionada a níveis sistematicamente menores dos marcadores de formação óssea, confirma‐se o menor aumento da massa óssea demonstrado por densitometria. Acompanhar esses adolescentes por um tempo maior de exposição aos COs combinados é necessário para melhor entender os efeitos desses medicamentos sobre os biomarcadores de massa óssea e formação óssea.
FinanciamentoFundação de Amparo à Pesquisa do Estado de São Paulo (Fapesp), bolsas 07/07731‐0, 2011/05991‐0 e 2015/04040‐2, e Pró‐Reitoria de Pesquisa da Universidade Estadual Paulista (Unesp).
Conflitos de interesseOs autores declaram não haver conflitos de interesse.
Como citar este artigo: Rizzo AC, Goldberg TB, Biason TP, Kurokawa CS, Silva CC, Corrente JE, et al. One‐year adolescent bone mineral density and bone formation marker changes through the use or lack of use of combined hormonal contraceptives. J Pediatr (Rio J). 2019;95:567–74.