The literature suggests that a fetus will adapt to surrounding adversities by optimizing its use of energy to improve survival, ultimately leading to the programming of the individual's energy intake and expenditure. While recent reviews focused on the fetal programming of energy intake and food preferences, there is also some evidence that fetal adversity is associated with diminished physical activity levels. Therefore, we aimed to review (a) the evidence for an association between being born with intrauterine growth restriction and sedentarism over the life‐course and (b) the potential benefits of physical activity over cardiometabolic risk factors for this population.
SourcesPubMed, Scielo, Scopus and Embase.
Summary of findingsMost clinical studies that used objective measures found no association between intrauterine growth restriction and physical activity levels, while most studies that used self‐reported questionnaires revealed such relationships, particularly leisure time physical activity. Experimental studies support the existence of fetal programming of physical activity, and show that exposure to exercise during IUGR individuals’ life improves metabolic outcomes but less effect was seen on muscle architecture or function.
ConclusionsAlterations in muscle strength and metabolism, as well as altered aerobic performance, may predispose IUGR individuals to be spontaneously less physically active, suggesting that this population may be an important target for preventive interventions. Although very heterogeneous, the different studies allow us to infer that physical activity may have beneficial effects especially for individuals that are more vulnerable to metabolic modifications such as those with IUGR.
A literatura sugere que um feto se adaptará às adversidades externas ao aprimorar seu gasto energético para melhorar a sobrevida, o que leva, em última instância, à programação do consumo e gasto energético do indivíduo. Apesar de análises recentes terem focado na programação fetal do consumo energético e preferências alimentares, ainda há alguma comprovação de que as adversidades fetais estão associadas aos baixos níveis de atividade física. Portanto, visamos a analisar: a) a comprovação de uma associação entre nascer com restrição de crescimento intrauterino (RCIU) e sedentarismo durante o curso de vida e b) os possíveis benefícios da atividade física sobre os fatores de risco cardiometabólico dessa população.
FontesPubMed, Scielo, Scopus e Embase.
Resumo dos achadosA maior parte dos estudos clínicos que usaram medidas objetivas não constatou associação entre RCIU e os níveis de atividade física, ao passo que a maior parte dos estudos que usaram questionários de autorrelato revelou essas relações, principalmente no que diz respeito à atividade física de lazer. Estudos experimentais corroboram a existência de programação fetal de atividade física e mostram que a exposição a exercícios durante a vida de indivíduos com RCIU melhora os resultados metabólicos, porém menos efeito foi visto sobre a arquitetura ou função muscular.
ConclusõesAlterações na força muscular e no metabolismo, bem como o desempenho aeróbico alterado, podem predispor indivíduos com RCIU a serem espontaneamente menos ativos fisicamente, sugere que essa população pode ser um importante alvo de intervenções preventivas. Apesar de muito heterogêneos, os diferentes estudos nos possibilitam deduzir que a atividade física pode ter efeitos benéficos principalmente em indivíduos mais vulneráveis a modificações metabólicas, como aqueles com RCIU.
O conceito das Origens Desenvolvimentistas da Saúde e da Doença (DOHaD) visa a estudar as consequências que os eventos adversos que ocorrem durante as fases iniciais do desenvolvimento humano têm sobre os padrões de doença e saúde durante o curso da vida.1,2 Outro aspecto interessante relacionado a essa área de pesquisa é a programação de um comportamento, como a ingestão de alimentos, preferências alimentares ou disposição para envolvimento em atividades físicas, que, por fim, pode contribuir para o desenvolvimento dessas doenças. Apesar de a maior parte da área de DOHaD ter focado em como a programação fetal pode afetar os marcadores histológicos, anatômicos ou metabólicos, é intrigante pensar que as alterações neurobiológicas que afetam os comportamentos também podem ser igualmente afetadas por adversidades em períodos vulneráveis como vida fetal/infância/adolescência. Os comportamentos que envolvem “disposição” ou “escolhas” geralmente estão intimamente relacionados ao livre arbítrio na natureza humana e pode ser desconfortável sugerir que isso pode ser moldado por fatores determinantes neurológicos e genéticos e influenciado pelo ambiente.3 É possível que os parâmetros biológicos possam definir nosso próprio eu? Conforme declarado por David Goldman, “o livre arbítrio do indivíduo e, por extensão, a autonomia dos grupos de pessoas são parâmetros cuja existência pode decorrer da herança de estruturas cognitivas e da variação nessas estruturas devido à adaptação do desenvolvimento neurológico”.3
Uma forma de medir a adversidade intrauterina está relacionada ao baixo crescimento fetal. A restrição do crescimento intrauterino (RCIU) é a incapacidade de o feto atingir seu potencial total de crescimento,4 que pode ser causada, porém não é restrita, por insuficiência placentária,5,6 desnutrição materna e fumo,7 infecções e anomalias congênitas, medicamentos, obesidade e anormalidades cromossômicas.4,8 A carga estimada de RCIU é muito alta, considerando que, em países de renda baixa e média, por exemplo, a RCIU representa 27% dos nascidos vivos.9 Além disso, a RCIU tem sido associada a doenças não transmissíveis mais tarde na vida, como síndrome metabólica,2,10,11 diabetes tipo II11 e doenças cardiovasculares.12
A hipótese do fenótipo econômico propõe que o feto se adapta a adversidades externas (por exemplo, falta de nutrientes) ao aprimorar seu uso de energia para melhorar a sobrevida.1,2 Isso leva, em última instância, à programação do consumo e gasto energético do indivíduo.13–15 Com relação ao consumo energético, nosso grupo nos últimos anos estudou a programação das preferências alimentares com relação a alimentos palatáveis altamente calóricos.16–21 Por outro lado, é interessante reconhecer que eventos adversos no desenvolvimento inicial pode causar consequências comportamentais. Ao considerar o gasto, há também uma comprovação de que essa população pode ter níveis reduzidos de atividade física,22,23 o que contribui para o aumento de armazenamento e a consequente predisposição a estados metabólicos alterados.
Estudos experimentais mostraram que filhos de pais com RCIU são menos ativos, em comparação com os nascidos com peso normal ao nascer.23–25 A comprovação de menores níveis de atividade física de lazer e aumento nos níveis de comportamento sedentário já foi demonstrada por alguns estudos clínicos,22,26–30 ao passo que outros relataram resultados controversos, sem associação entre baixo peso ao nascer e menores níveis de atividade física.31–36
Além disso, ao considerar os efeitos prejudiciais da RCIU mais tarde na vida, alguns estudos também focaram nos possíveis benefícios que a atividade física pode ter sobre os resultados metabólicos da população em risco.37 Afigura‐se que a prática de exercícios pode atenuar fatores de risco cardiometabólico como intolerância a glicose,29 resistência à insulina38 e baixo perfil lipídico,39 principalmente na população com RCIU, nos quais esses fatores de risco são mais prevalentes.
Nesta análise, resumimos a comprovação clínica e experimental disponível com relação: 1) aos efeitos da RCIU sobre o comportamento sedentário e os níveis de atividade física e 2) aos possíveis benefícios das intervenções de prática de exercícios para atenuar os efeitos cardiometabólicos negativos da RCIU. Adicionalmente, exploramos alguns mecanismos que provavelmente estão envolvidos nessas associações.
Comprovação clínica da programação fetal do gasto energéticoA mensagem ambiental geral durante a vida intrauterina de um feto com RCIU é de escassez de nutrientes. Portanto, órgãos e sistemas são programadas para poupar energia.15 A programação fetal de gasto energético, inclusive níveis reduzidos de atividade física e massa magra corporal, poupa energia para crescimento e acumulação de gordura. Além disso, a força muscular está diretamente associada aos níveis de atividade física,40 então é provável que os indivíduos com RCIU poderão se exercitar menos, devido à falta de musculatura adequada.41,42
Há uma grande heterogeneidade na literatura com relação ao estudo de variáveis relacionadas a sedentarismo e atividade física. Apesar de alguns estudos usarem medições objetivas, como acelerômetro, outros usam questionários de autorrelato e medidas como atividade física de lazer (AFL). O acelerômetro, por exemplo, pode estimar a atividade total com uma média de contagem por minuto (com) durante o período de medição válido.43,44 O ponto de corte para definir nível moderado a vigoroso de atividade física também usa a média cpm, porém em termos de tempo gasto em cada dia nessa atividade.45 As medições não objetivas incluem AFL, medida por meio de questionários que avaliam a frequência e a duração de diferentes atividades de condicionamento (como correr, nadar) e não condicionamento (como jardinagem, trabalho de casa).46,47 Diferentes questionários foram validados para diferentes prazos, variam de tempo de retorno de uma semana48 a 12 semanas.47
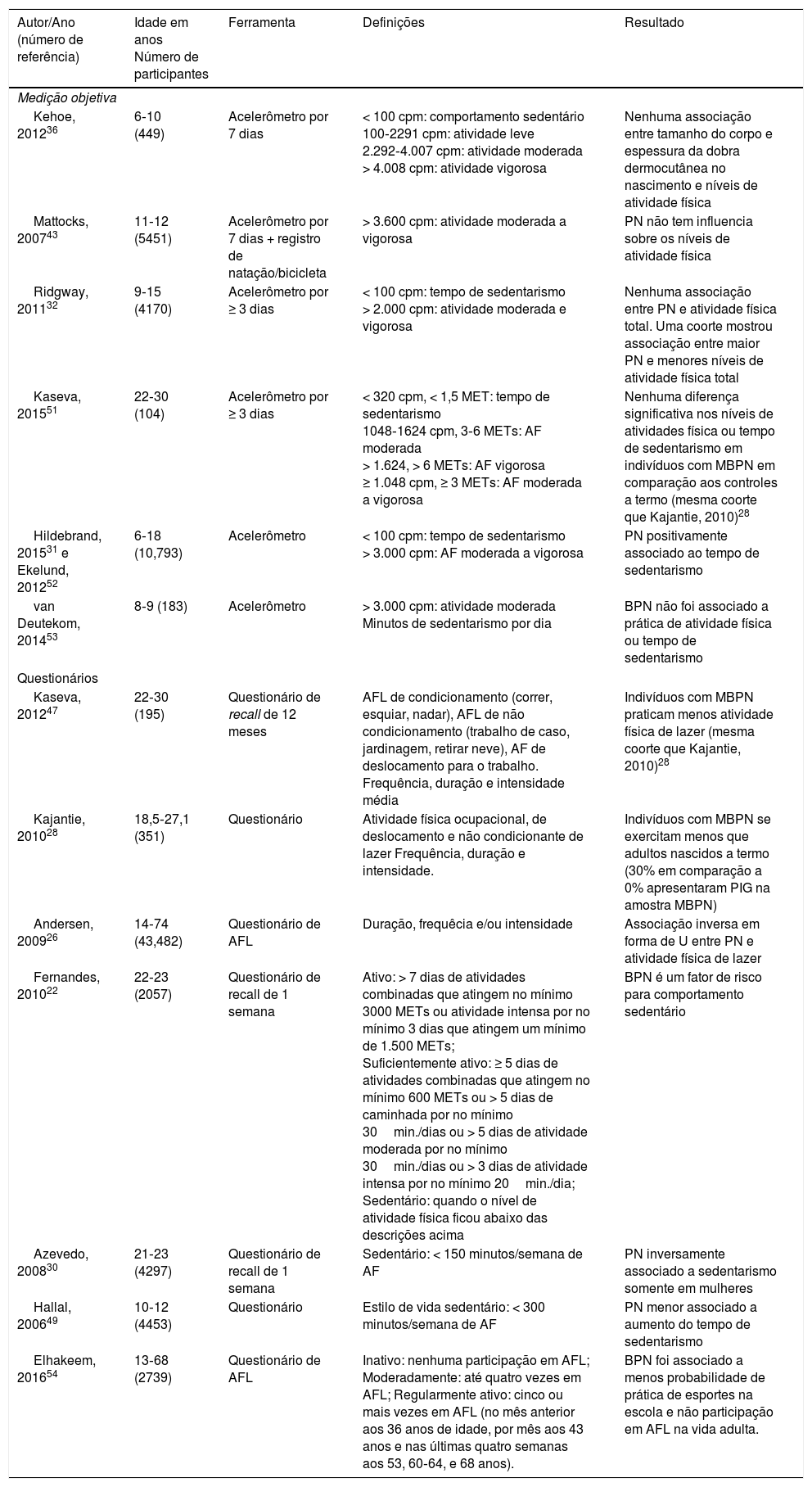
O sedentarismo é definido de acordo com o tempo gasto em atividade física e os pontos de corte também são variáveis entre os diferentes estudos, idades e metodologias usados. Por exemplo, em adolescente, um estilo de vida sedentário é considerado como menos de 300 minutos de atividade física por semana medido por meio de questionários, ao passo que, em adultos, é considerado menos de 150 minutos49 por semana.30 Diferentes estudos convertem as respostas dos questionários em Equivalente Metabólico da Tarefa (MET)‐minuto/semana e usam os pontos de cortes do MET para definir sedentarismo.22 Da mesma forma, um comportamento sedentário foi definido como < 100 cpm em crianças que usaram o acelerômetro.50 Portanto, ao considerar diferentes estudos, deve‐se ter em mente os conceitos e as interpretações específicos avaliados. Separamos os estudos em aqueles que usam dados de questionário objetivo e de autorrelato e, portanto, discutimos os possíveis benefícios da atividade física para indivíduos com RCIU. A tabela 1 resume as principais características dos estudos clínicos.
Resumo dos estudos clínicos que avaliam a relação entre RCIU e atividade física/sedentarismo
| Autor/Ano (número de referência) | Idade em anos Número de participantes | Ferramenta | Definições | Resultado |
|---|---|---|---|---|
| Medição objetiva | ||||
| Kehoe, 201236 | 6‐10 (449) | Acelerômetro por 7 dias | < 100 cpm: comportamento sedentário 100‐2291 cpm: atividade leve 2.292‐4.007 cpm: atividade moderada > 4.008 cpm: atividade vigorosa | Nenhuma associação entre tamanho do corpo e espessura da dobra dermocutânea no nascimento e níveis de atividade física |
| Mattocks, 200743 | 11‐12 (5451) | Acelerômetro por 7 dias + registro de natação/bicicleta | > 3.600 cpm: atividade moderada a vigorosa | PN não tem influencia sobre os níveis de atividade física |
| Ridgway, 201132 | 9‐15 (4170) | Acelerômetro por ≥ 3 dias | < 100 cpm: tempo de sedentarismo > 2.000 cpm: atividade moderada e vigorosa | Nenhuma associação entre PN e atividade física total. Uma coorte mostrou associação entre maior PN e menores níveis de atividade física total |
| Kaseva, 201551 | 22‐30 (104) | Acelerômetro por ≥ 3 dias | < 320 cpm, < 1,5 MET: tempo de sedentarismo 1048‐1624 cpm, 3‐6 METs: AF moderada > 1.624, > 6 METs: AF vigorosa ≥ 1.048 cpm, ≥ 3 METs: AF moderada a vigorosa | Nenhuma diferença significativa nos níveis de atividades física ou tempo de sedentarismo em indivíduos com MBPN em comparação aos controles a termo (mesma coorte que Kajantie, 2010)28 |
| Hildebrand, 201531 e Ekelund, 201252 | 6‐18 (10,793) | Acelerômetro | < 100 cpm: tempo de sedentarismo > 3.000 cpm: AF moderada a vigorosa | PN positivamente associado ao tempo de sedentarismo |
| van Deutekom, 201453 | 8‐9 (183) | Acelerômetro | > 3.000 cpm: atividade moderada Minutos de sedentarismo por dia | BPN não foi associado a prática de atividade física ou tempo de sedentarismo |
| Questionários | ||||
| Kaseva, 201247 | 22‐30 (195) | Questionário de recall de 12 meses | AFL de condicionamento (correr, esquiar, nadar), AFL de não condicionamento (trabalho de caso, jardinagem, retirar neve), AF de deslocamento para o trabalho. Frequência, duração e intensidade média | Indivíduos com MBPN praticam menos atividade física de lazer (mesma coorte que Kajantie, 2010)28 |
| Kajantie, 201028 | 18,5‐27,1 (351) | Questionário | Atividade física ocupacional, de deslocamento e não condicionante de lazer Frequência, duração e intensidade. | Indivíduos com MBPN se exercitam menos que adultos nascidos a termo (30% em comparação a 0% apresentaram PIG na amostra MBPN) |
| Andersen, 200926 | 14‐74 (43,482) | Questionário de AFL | Duração, frequêcia e/ou intensidade | Associação inversa em forma de U entre PN e atividade física de lazer |
| Fernandes, 201022 | 22‐23 (2057) | Questionário de recall de 1 semana | Ativo: > 7 dias de atividades combinadas que atingem no mínimo 3000 METs ou atividade intensa por no mínimo 3 dias que atingem um mínimo de 1.500 METs; Suficientemente ativo: ≥ 5 dias de atividades combinadas que atingem no mínimo 600 METs ou > 5 dias de caminhada por no mínimo 30min./dias ou > 5 dias de atividade moderada por no mínimo 30min./dias ou > 3 dias de atividade intensa por no mínimo 20min./dia; Sedentário: quando o nível de atividade física ficou abaixo das descrições acima | BPN é um fator de risco para comportamento sedentário |
| Azevedo, 200830 | 21‐23 (4297) | Questionário de recall de 1 semana | Sedentário: < 150 minutos/semana de AF | PN inversamente associado a sedentarismo somente em mulheres |
| Hallal, 200649 | 10‐12 (4453) | Questionário | Estilo de vida sedentário: < 300 minutos/semana de AF | PN menor associado a aumento do tempo de sedentarismo |
| Elhakeem, 201654 | 13‐68 (2739) | Questionário de AFL | Inativo: nenhuma participação em AFL; Moderadamente: até quatro vezes em AFL; Regularmente ativo: cinco ou mais vezes em AFL (no mês anterior aos 36 anos de idade, por mês aos 43 anos e nas últimas quatro semanas aos 53, 60‐64, e 68 anos). | BPN foi associado a menos probabilidade de prática de esportes na escola e não participação em AFL na vida adulta. |
AF, atividade física; AFL, atividade física de lazer; com, contagens por minuto; MBPN, muito baixo peso ao nascer; MET, equivalente metabólico da tarefa; PIG, pequeno para a idade gestacional; PN, peso ao nascer; RCIU, restrição do crescimento intrauterino.
Kehoe et al. avaliaram as medições do acelerômetro em crianças (seis a 10 anos) na área rural da Índia. Houve 8% de crianças pequenas para a idade gestacional (PIG) na amostra (consideradas como peso ao nascer de < 2,5kg) e o peso ao nascer variou de 1,57 a 4,75kg. Não houve associações significativas entre quaisquer das medições antropométricas no nascimento e as variáveis de atividade física.36 É interessante observar que, nesse estudo, o estado socioeconômico foi negativamente associado à prática de atividade física. Apesar de os dados não terem sido mostrados, os autores descreveram que foi feita uma análise separada para PIGs e prematuros e que houve uma tendência para os PIGs serem menos ativos. Parece que a definição de PIG não foi adequada e o uso de outras definições para PIG (ou seja: menores que 10 percentil ou índice de peso ao nascer < 0,85) resultaria em uma proporção maior de baixo peso ao nascer em determinada idade gestacional na população descrita.
A coorte do Estudo Longitudinal Avon de Pais e Filhos (ALSPAC) incluiu uma grande amostra de crianças em idade escolar e não houve relação entre os níveis de atividade física, medidos por meio de acelerômetro, e quaisquer medições antropométricas neonatais (peso ao nascer, índice ponderal, perímetro cefálico) ou idade gestacional.43 O peso ao nascer foi usado como uma variável contínua, porém o estudo não categorizou os indivíduos como PIG ou RCIU.
Outro estudo incluiu quatro coortes de nascimento de países europeus e do Brasil32 e não encontrou associação significativa entre o peso ao nascer e atividade física medida de forma objetiva. A coorte do Brasil que foi incluída neste estudo revelou resultados na direção oposta e maior peso ao nascer foi associado a menores níveis de atividade.32
Kaseva et al. usaram a mesma metodologia com acelerômetro para medir de forma objetiva os níveis de atividade física em uma coorte (Estudo de Helsinque) de jovens adultos que tiveram muito baixo peso ao nascer (MBPN) (< 1.500g).51 De modo geral, não houve diferenças nos níveis de atividade física ou tempo de sedentarismo entre os participantes com MBPN e os controles.
Hildebrand et al.31 e Ekelund et al.52 usaram a Base de Dados Internacional de Acelerometria de Crianças e constataram que o peso ao nascer foi positivamente associado ao tempo de sedentarismo e à circunferência da cintura.31 Não houve dado relacionado à idade gestacional, então os autores não puderam diferenciar entre baixo peso ao nascer causado por RCIU ou prematuridade. Em 2014, van Deutekom et al. descreveram que peso ao nascer não foi relacionado à prática de atividade física nem a comportamento sedentário.53
Estudos que usam questionários de autorrelato para avaliar a associação entre RCIU e atividade físicaDois outros estudos foram feitos na coorte de Helsinque anteriormente descrita,28,47 porém avaliaram a atividade física por meio de questionários de AFL. O estudo por Kaseva et al. constatou AFL acentuadamente reduzida em adultos com MBPN em comparação com os controles.47 Kajantie et al. descreveram achados semelhantes.28 Quando perguntados sobre a quantidade de tempo gasto em atividade física durante seu tempo de lazer, os indivíduos com MBPN apresentaram significativamente menos tempo dedicado à AFL em comparação com os controles (35% em comparação com 25%). É importante observar que a amostra de indivíduos com MBPN incluiu 30% de PIGs, ao passo que a amostra de controle não teve indivíduos com PIG. A análise dos subgrupos que comparou os nascidos com PIG e MBPN e MBPN adequados para a idade gestacional (AIG) não revelou diferença em quaisquer das variáveis de atividade física, nem escore DP de peso ao nascer e idade gestacional como variáveis contínuas no grupo de MBPN. Nesse estudo, a RCIU não parece ter implicado os achados e é provável que a associação seja atribuível a prematuridade.28
Em uma amostra de crianças e adultos nascidos com RCIU, os professores relataram menor capacidade de prática de esportes aos 13 anos e menor prática de AFL autorrelatada em adultos.54 Uma metanálise por Andersen et al.26 incluiu uma ampla gama de faixas etárias, de 14 a 74 anos, de 13 coortes nórdicas. Baixo e alto peso ao nascer foram associados a menores níveis de AFL em mulheres e homens.
Alguns estudos exploraram outros possíveis fatores que interagem com o peso ao nascer para influenciar os níveis de comportamento sedentário, como nível de escolaridade e situação socioeconômica. Uma coorte de adultos jovens de Fernandes et al. encontrou uma associação entre indivíduos sedentários e com BPN com níveis de escolaridade mais elevados.22 Outra coorte brasileira revelou uma associação inversa entre peso ao nascer e AFL em mulheres, porém constatou que a situação socioeconômica também esteve relacionada aos níveis de prática de exercício.30 Hallal et al. apresentaram conclusões semelhantes quanto ao fato de menor peso ao nascer estar associado a comportamento sedentário aos 10‐12 anos. Outros fatores de risco para comportamento sedentário foram maior nível de escolaridade materna e renda familiar, de forma semelhante aos outros dois estudos descritos. Com base em diferentes estudos, é possível apreender que as variáveis socioeconômicas (de renda e escolaridade) afetam profundamente a associação entre peso ao nascer e o comportamento sedentário, ao comparar diferentes estratos sociais em uma comunidade específica ou ao comparar estudos feitos em países de diferentes perfis econômicos.
Benefícios da atividade física em indivíduos com RCIUEm 2014, Gatford et al. fizeram uma análise de comprovação clínica e experimental de que a prática de exercícios pode melhorar os resultados metabólicos após RCIU.55 Está claro que adultos com RCIU são beneficiados pela prática de atividade física quando se trata de resultados cardiometabólicos, porém ainda não está claro se esses benefícios são diferentes ao comparar indivíduos com RCIU com indivíduos com peso normal ao nascer. A tabela 2 resume a principal comprovação sobre os efeitos cardiometabólicos da prática de exercícios em indivíduos com RCIU.
Efeitos dos níveis de atividade física sobre os resultados metabólicos de BPN/ RCIU
| Autor/Ano | Idade em anos (número de participantes) | Resultado |
|---|---|---|
| Aoyama, 201356 | 20‐64 (379) | PN e capacidade cardiorrespiratória inversamente associados a HOMA‐RI |
| Eriksson, 200429 | 65‐75 (500) | A prática regular e moderada de exercícios protege contra intolerância à glicose em idosos com aumento do risco de desenvolver diabetes Tipo 2 (nascidos com BPN) |
| Labayen, 201359 | 12‐17 (538) | Atender às recomendações de atividade física pode atenuar o efeito negativo de BPN nos níveis de leptina no soro |
| Laaksonen, 200338 | 42‐60 (462) | A prática de atividade física de lazer regular e vigorosa ou boa capacidade cardiorrespiratória parecem atenuar a associação de BPN com resistência à insulina e síndrome metabólica |
| Madsen, 201558 | 19‐21 (117) | Indivíduos com BPN são metabolicamente beneficiados pela prática de exercícios em comparação a controles com PNN |
| Ortega, 201160 | 12‐17 (846) | Maiores níveis de atividade física podem atenuar os efeitos adversos do BPN em adolescentes com sensibilidade à insulina |
| Redmond, 201339 | 20 (36) | O baixo Índice Ponderal tem menor perfil lipídico e apresenta melhora nos valores com treinamento |
| Ridgway, 201157 | 9‐15 (1254) | A atividade física não modifica a associação entre BPN e resistência à insulina |
BPN, baixo peso ao nascer; HOMA‐RI, avaliação do modelo de homeostase de insulina; PN, peso ao nascer; PNN, peso normal ao nascer.
Aoyama et al. estudaram 379 adultos (20‐64 anos) e avaliaram seu modelo de homeostase de insulina (HOMA‐RI) e capacidade cardiorrespiratória. Menor peso ao nascer e capacidade cardiorrespiratória foram associados a aumento do índice HOMA‐RI, ao passo que IMC e circunferência abdominal foram positivamente associados a HOMA‐RI. Uma análise adicional que usou o índice HOMA‐RI como uma variável independente, ajustada para capacidade cardiorrespiratória, pouco modificou a associação entre peso ao nascer e resistência à insulina. Os fatores de estilo de vida podem ser mais importantes do que o peso ao nascer, pois a principal variável preditora de resistência à insulina foi capacidade cardiorrespiratória.56
Ridgway et al. avaliaram uma população mais nova (9‐15 anos) com medições de acelerômetro para verificar se atividade física e condicionamento aeróbico podem modificar a associação entre peso ao nascer e resultados metabólicos. O peso ao nascer não foi associado a insulina de jejum, exceto quando o modelo foi ajustado para circunferência da cintura de adolescentes. Os dados foram pouco modificados mesmo após ajuste adicional para tempo gasto na prática de exercícios.57 Existe a possibilidade de que a idade jovem dos indivíduos na avaliação desempenhe um papel nesses achados, se considerarmos que as mudanças no metabolismo podem ainda não estar presentes nessa idade.
Um estudo feito na Índia incluiu homem jovens saudáveis (18‐22 anos), excluiu obesos e aqueles que fazem uso de medicamentos que podem alterar o perfil de glicose, para uma intervenção com uso de bicicleta por mais de seis semanas para avaliar as mudanças no metabolismo da glicose. Aproximadamente metade da amostra abrangeu homens nascidos com BPN. Os dados de base não revelaram diferença significativa nos níveis de glicemia de jejum ou insulina entre grupos com BPN e peso normal ao nascer. Os níveis de insulina plasmática de jejum, HOMA‐RI e secreção de insulina (HOMA‐SI) se apresentaram melhores igualmente após a intervenção nos dois grupos.58 Uma limitação é que o estudo selecionou somente indivíduos saudáveis. Como a RCIU é um fator de risco conhecido para síndrome metabólica2,10,11 e diabetes tipo II,11 a exclusão de indivíduos com estados metabólicos alterados (obesos e aqueles que fazem uso de medicamentos) pode levar à falsa conclusão de que eles não seriam ainda mais beneficiados por uma intervenção de prática de exercícios.
Redmond et al. avaliaram diferentes resultados de uma intervenção de prática de exercícios no perfil metabólico de adultos nascidos pequenos para a idade gestacional. Indivíduos com peso normal ao nascer apresentaram melhor perfil lipídico pré‐treino (principalmente colesterol total e LDL). Após treino, as diferenças dos grupos entre colesterol total e LDL desapareceram. O aumento no risco de doenças crônicas nos nascidos com RCIU pode ser atenuado por meio de mudanças no estilo de vida como introdução de uma rotina de exercícios.39
Entre os estudos que mostram efeitos benéficos da prática de exercícios, Eriksson et al. avaliaram idosos e mostraram que a prática frequente ou moderada de exercícios semanalmente foi associada a melhor tolerância à glicose e esse efeito foi ainda mais forte entre os nascidos com tamanho pequeno. Adicionalmente, homens nascidos com tamanho pequenos se exercitaram mais na vida adulta do que seus controles, o que pode ser interpretado como uma resposta adaptativa de sobrevivência do mais apto nesse grupo de alto risco.29 Ainda ao investigar adultos, Laaksonen et al. constataram que tamanho pequeno ao nascer foi associado a características de síndrome metabólica mesmo antes do desenvolvimento de diabetes ou doença cardiovascular. A associação não esteve presente quando AFL regular ou boa capacidade cardiorrespiratória foram consideradas.38
Dois estudos que envolveram adolescentes foram favoráveis à atividade física como um agente atenuador de resultados metabólicos alterados para os nascidos com tamanho pequeno.59,60 O primeiro constatou que conforme o peso ao nascer reduz, os níveis de leptina aumentam em meninas que não atenderam às recomendações de atividade física (≥ 60 minutos/dia de atividade física moderada a vigorosa). Não houve associação entre os níveis de leptina e o peso ao nascer naqueles que atenderam às recomendações de atividade física.59 Os níveis de leptina no soro são elevado em pessoas obesas, que parecem desenvolver resistência à leptina, e foi mostrado que BPN está associado a níveis mais elevados de leptina no soro em adolescentes do sexo feminino.61 O segundo artigo mostrou que níveis mais elevados de atividade física desempenharam um papel importante na alteração da associação entre BPN e HOMA‐RI.60
Apesar de as coortes e os estudos serem heterogêneos em termos de muitas variáveis como idade, país de origem e tipo de atividade física, parece que a prática de atividade física pode ter efeitos benéficos principalmente em indivíduos mais vulneráveis a modificações metabólicas do que os nascidos com BPN.
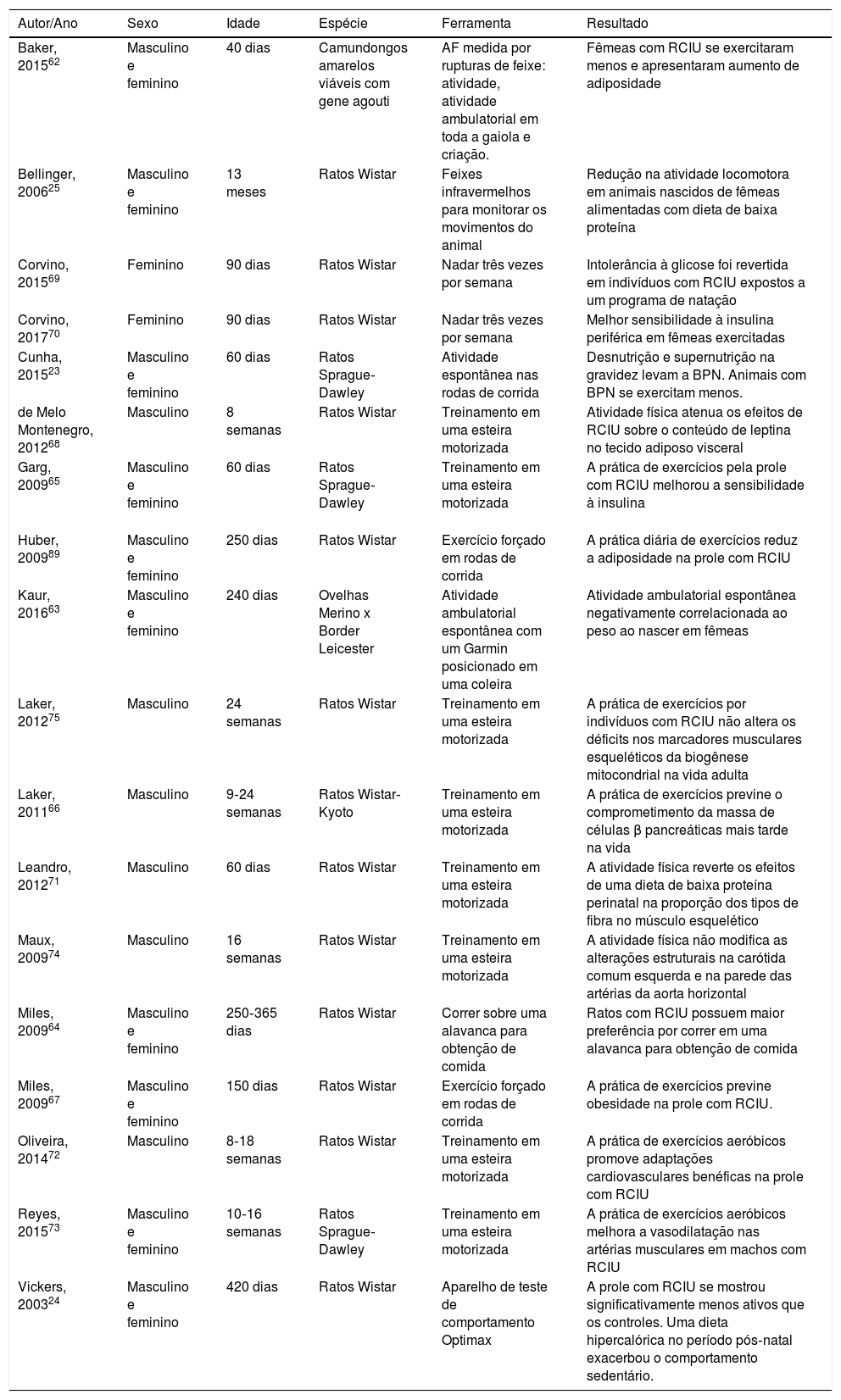
Comprovação experimentalEfeitos da restrição do crescimento intrauterino sobre os níveis de atividade físicaDa mesma forma descrita nos estudos clínicos, a comprovação experimental também mostra heterogeneidade na metodologia usada para avaliar a atividade física. A prática de atividade física espontânea é medida pela filmagem da gaiola, por espectroscopia de infravermelho ou por contador digital ligado às rodas de corrida. A tabela 3 resume as principais características dos resultados dos estudos experimentais.
Para identificar alterações nos níveis de atividade física entre ratos fêmeas nascidos com RCIU, Baker et al. testaram animais nascidos de fêmeas magras e obesas e todos os animais foram adotados por fêmeas magras. Foi observada RCIU na prole de fêmeas obesas. Animais fêmeas nascidos de fêmeas obesas apresentaram níveis reduzidos de atividade física espontânea e gasto energético, com aumento das taxas de obesidade na vida adulta.62 Kaur et al. induziram a RCIU por meio de manipulação cirúrgica dos locais de fixação da placenta endometrial de ovelhas e mediram a atividade física espontânea na prole. Restrição placentária e baixo peso ao nascer foram associados ao maior nível de atividade ambulatorial espontânea.63
Cunha et al. avaliaram a atividade física espontânea em ratos nascidos com RCIU (fêmeas que receberam dieta alimentar 50% restrita a partir do 10° dia de gravidez até o nascimento) em comparação com ratos nascidos de fêmeas que receberam uma dieta ad libitum e ratos nascidos de fêmeas que receberam uma dieta altamente calórica. Ambos os grupos extremos (dieta alimentar 50% restrita e dieta altamente calórica durante a gravidez) apresentaram filhotes com RCIU ao nascer e ambos apresentaram diferentes níveis de atividade física em comparação com os controles. Contudo, houve efeitos opostos em diferentes sexos: as fêmeas dos grupos extremos apresentaram aumento no nível de atividade física em comparação com os controles, ao passo que os machos dos grupos extremos mostraram redução no nível de atividade em relação aos controles.23 Se considerarmos que as alterações no sistema mesolímbico podem ser um possível mecanismo para explicar o efeito observado na atividade física, foram avaliados os receptores D2 no caudato dorsal e as fêmeas do grupo com restrição alimentar apresentaram redução nos níveis do receptor D2 estriatal em comparação com o grupo de controle.23
Bellinger et al. alimentaram as ratas grávidas com uma dieta controlada ou de baixa proteína em diferentes períodos gestacionais (inicial, médio ou tardio). A atividade locomotora da prole foi medida com uma matriz de sensores infravermelhos. Uma dieta de baixa proteína em todos os períodos gestacionais foi significativamente associada à menor prática de atividade locomotora em filhotes fêmeas, ao passo que nos filhotes machos o efeito foi observado somente quando a dieta de baixa proteína foi oferecida no início da gravidez.25
Vickers et al. compararam ratos adultos nascidos de fêmeas submetidas a uma dieta desnutrida durante a gravidez em comparação com os controles. Os animais com RCIU (nascidos de fêmeas que receberam uma dieta desnutrida durante a gravidez) se mostraram mais sedentários em comparação com os controles, independentemente da dieta pós‐natal (padrão ou hipercalórica). O efeito ocorreu em ambos os sexos, porém foi mais nítido em machos.24 No estudo de Miles et al., os animais puderem escolher entre correr na roda e pressionar uma alavanca de resposta para obtenção do alimento. A prole com RCIU (nascidos de fêmeas desnutridas) revelou maior preferência por exercícios em comparação com a prole ad libitum.64
Intervenção de exercícios para atenuar os resultados metabólicos da RCIU em animaisGarg et al. conduziram um ensaio de treinamento inicial com exercícios para analisar seu efeito sobre a cinética de glicose. Ratas grávidas foram dividas para receber dieta normal ou restrita durante os dias 11 a 21 de gestação. Foi feita uma intervenção no treinamento de exercícios na prole para suprimir a produção de insulina estimulada por glicose e produção de glicose hepática, o que levou a uma melhoria geral na sensibilidade à insulina.65 Um curto período de treinamento físico em filhotes foi associado a aumentos significativos na massa de células β em todos os animais e esse exercício inicial restaurou a massa de células β para controlar os níveis na prole com RCIU. Contudo, a secreção de insulina não foi alterada pela intervenção.66
Miles et al. conseguiram demonstrar que a prática diária de exercícios em ratos adultos com RCIU preveniu o desenvolvimento de obesidade. Apesar de a prole com RCIU ter apresentado aumento na adiposidade em comparação aos controles, não foi observada resistência à insulina. A atividade física diária impediu o desenvolvimento de obesidade e apresentou efeitos positivos sobre os parâmetros metabólicos na prole com RCIU.67 Em um estudo diferente, a atividade física também afetou o conteúdo de leptina do tecido adiposo em ratos com RCIU. A prole de fêmeas alimentadas com dieta de baixa proteína apresentou aumento na leptina no tecido visceral, porém isso foi revertido pela prática de exercícios.68 Os ratos com RCIU que nadaram também apresentaram prevenção do desenvolvimento de intolerância à glicose, bem como redução da adiposidade em outra amostra.69 Ratos de fêmeas adultas com RCIU que foram exercitadas continuamente por 60 minutos durante a gravidez apresentaram melhor sensibilidade à insulina periférica, apesar de essa amostra não ter sido associada a RCIU na prole.70
Outros efeitos interessantes da atividade física em ratos com RCIU são a proporção de fibras musculares,71 melhor vasoconstrição induzida por Angiotensina II, alterações relacionadas aos níveis de superóxido72 e melhorias na vasodilatação mediada por hiperpolarização endotelial em artérias musculares.73 Em contrapartida, um estudo de Maux et al. constatou que o treinamento físico moderado não modifica as alterações estruturais associadas à desnutrição na carótida comum esquerda e parede das artérias da aorta horizontal.74 Com o uso de uma metodologia diferente com ligação bilateral do vaso uterino ou cirurgia simulada em fêmeas grávidas para induzir RCIU, Laker et al. não encontraram efeito de reprogramação relacionado à prática de exercícios nos marcadores musculares esqueléticos de biogênese mitocondrial na vida adulta.75
Portanto, a partir dos diferentes estudos experimentais, é possível inferir que há comprovação para corroborar a existência de um efeito de programação fetal sobre a atividade física/comportamento sedentário mais tarde na vida. Além disso, a exposição a exercícios durante o curso da vida parece conseguir reverter alguns dos efeitos prejudiciais de nascer com RCIU, principalmente com relação aos resultados metabólicos, apesar de haver reversão menos consistente nos danos encontrados na arquitetura ou função muscular.
MecanismosAlguns dos possíveis mecanismos implícitos nas alterações mencionadas nos níveis de atividade física na RCIU já foram descritos entre os resultados experimentais (tabela 3). Há outros artigos que focam nesses mecanismos em estudos clínicos que serão descritos (tabela 4).
Resumo dos dados experimentais associados a RCIU e níveis de atividade física
| Autor/Ano | Sexo | Idade | Espécie | Ferramenta | Resultado |
|---|---|---|---|---|---|
| Baker, 201562 | Masculino e feminino | 40 dias | Camundongos amarelos viáveis com gene agouti | AF medida por rupturas de feixe: atividade, atividade ambulatorial em toda a gaiola e criação. | Fêmeas com RCIU se exercitaram menos e apresentaram aumento de adiposidade |
| Bellinger, 200625 | Masculino e feminino | 13 meses | Ratos Wistar | Feixes infravermelhos para monitorar os movimentos do animal | Redução na atividade locomotora em animais nascidos de fêmeas alimentadas com dieta de baixa proteína |
| Corvino, 201569 | Feminino | 90 dias | Ratos Wistar | Nadar três vezes por semana | Intolerância à glicose foi revertida em indivíduos com RCIU expostos a um programa de natação |
| Corvino, 201770 | Feminino | 90 dias | Ratos Wistar | Nadar três vezes por semana | Melhor sensibilidade à insulina periférica em fêmeas exercitadas |
| Cunha, 201523 | Masculino e feminino | 60 dias | Ratos Sprague‐Dawley | Atividade espontânea nas rodas de corrida | Desnutrição e supernutrição na gravidez levam a BPN. Animais com BPN se exercitam menos. |
| de Melo Montenegro, 201268 | Masculino | 8 semanas | Ratos Wistar | Treinamento em uma esteira motorizada | Atividade física atenua os efeitos de RCIU sobre o conteúdo de leptina no tecido adiposo visceral |
| Garg, 200965 | Masculino e feminino | 60 dias | Ratos Sprague‐Dawley | Treinamento em uma esteira motorizada | A prática de exercícios pela prole com RCIU melhorou a sensibilidade à insulina |
| Huber, 200989 | Masculino e feminino | 250 dias | Ratos Wistar | Exercício forçado em rodas de corrida | A prática diária de exercícios reduz a adiposidade na prole com RCIU |
| Kaur, 201663 | Masculino e feminino | 240 dias | Ovelhas Merino x Border Leicester | Atividade ambulatorial espontânea com um Garmin posicionado em uma coleira | Atividade ambulatorial espontânea negativamente correlacionada ao peso ao nascer em fêmeas |
| Laker, 201275 | Masculino | 24 semanas | Ratos Wistar | Treinamento em uma esteira motorizada | A prática de exercícios por indivíduos com RCIU não altera os déficits nos marcadores musculares esqueléticos da biogênese mitocondrial na vida adulta |
| Laker, 201166 | Masculino | 9‐24 semanas | Ratos Wistar‐Kyoto | Treinamento em uma esteira motorizada | A prática de exercícios previne o comprometimento da massa de células β pancreáticas mais tarde na vida |
| Leandro, 201271 | Masculino | 60 dias | Ratos Wistar | Treinamento em uma esteira motorizada | A atividade física reverte os efeitos de uma dieta de baixa proteína perinatal na proporção dos tipos de fibra no músculo esquelético |
| Maux, 200974 | Masculino | 16 semanas | Ratos Wistar | Treinamento em uma esteira motorizada | A atividade física não modifica as alterações estruturais na carótida comum esquerda e na parede das artérias da aorta horizontal |
| Miles, 200964 | Masculino e feminino | 250‐365 dias | Ratos Wistar | Correr sobre uma alavanca para obtenção de comida | Ratos com RCIU possuem maior preferência por correr em uma alavanca para obtenção de comida |
| Miles, 200967 | Masculino e feminino | 150 dias | Ratos Wistar | Exercício forçado em rodas de corrida | A prática de exercícios previne obesidade na prole com RCIU. |
| Oliveira, 201472 | Masculino | 8‐18 semanas | Ratos Wistar | Treinamento em uma esteira motorizada | A prática de exercícios aeróbicos promove adaptações cardiovasculares benéficas na prole com RCIU |
| Reyes, 201573 | Masculino e feminino | 10‐16 semanas | Ratos Sprague‐Dawley | Treinamento em uma esteira motorizada | A prática de exercícios aeróbicos melhora a vasodilatação nas artérias musculares em machos com RCIU |
| Vickers, 200324 | Masculino e feminino | 420 dias | Ratos Wistar | Aparelho de teste de comportamento Optimax | A prole com RCIU se mostrou significativamente menos ativos que os controles. Uma dieta hipercalórica no período pós‐natal exacerbou o comportamento sedentário. |
BPN, baixo peso ao nascer; RCIU, restrição do crescimento intrauterino.
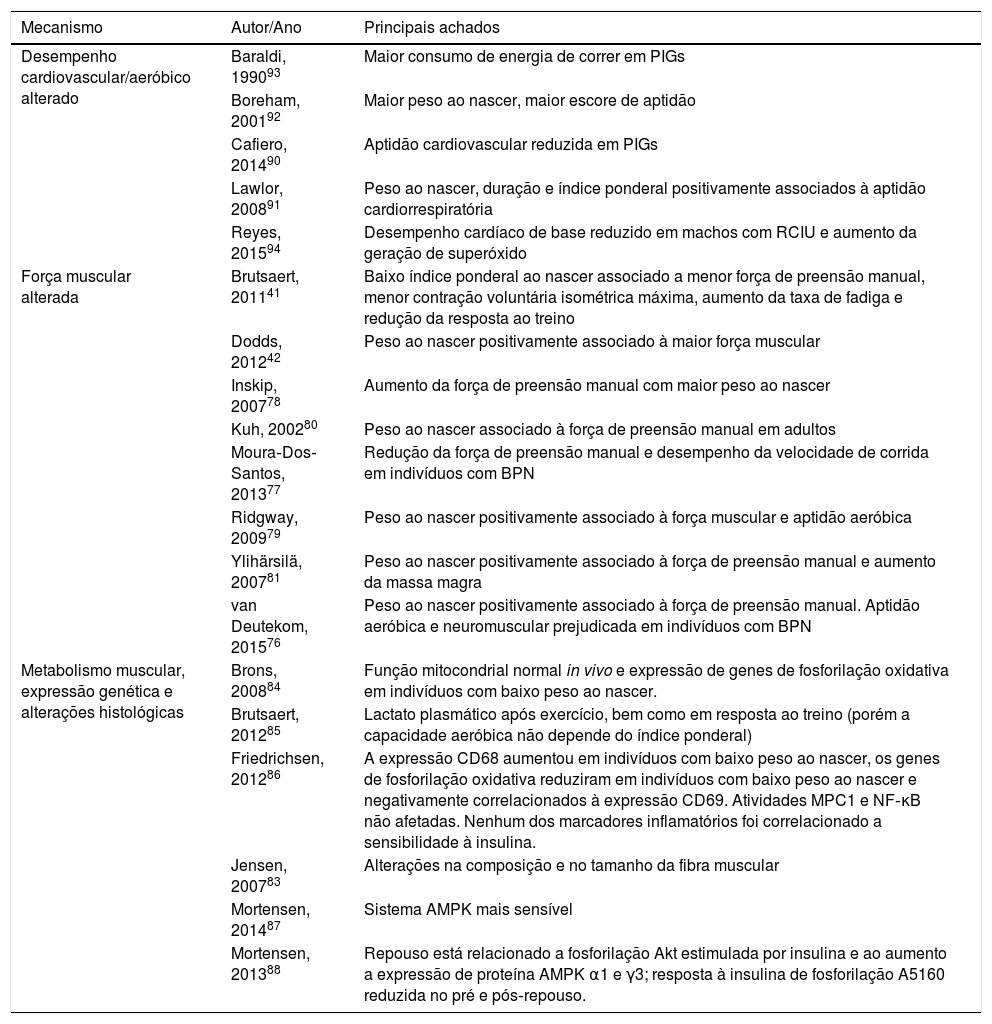
Mecanismos propostos implícitos na associação entre RCIU e menores níveis de atividade física
| Mecanismo | Autor/Ano | Principais achados |
|---|---|---|
| Desempenho cardiovascular/aeróbico alterado | Baraldi, 199093 | Maior consumo de energia de correr em PIGs |
| Boreham, 200192 | Maior peso ao nascer, maior escore de aptidão | |
| Cafiero, 201490 | Aptidão cardiovascular reduzida em PIGs | |
| Lawlor, 200891 | Peso ao nascer, duração e índice ponderal positivamente associados à aptidão cardiorrespiratória | |
| Reyes, 201594 | Desempenho cardíaco de base reduzido em machos com RCIU e aumento da geração de superóxido | |
| Força muscular alterada | Brutsaert, 201141 | Baixo índice ponderal ao nascer associado a menor força de preensão manual, menor contração voluntária isométrica máxima, aumento da taxa de fadiga e redução da resposta ao treino |
| Dodds, 201242 | Peso ao nascer positivamente associado à maior força muscular | |
| Inskip, 200778 | Aumento da força de preensão manual com maior peso ao nascer | |
| Kuh, 200280 | Peso ao nascer associado à força de preensão manual em adultos | |
| Moura‐Dos‐Santos, 201377 | Redução da força de preensão manual e desempenho da velocidade de corrida em indivíduos com BPN | |
| Ridgway, 200979 | Peso ao nascer positivamente associado à força muscular e aptidão aeróbica | |
| Ylihärsilä, 200781 | Peso ao nascer positivamente associado à força de preensão manual e aumento da massa magra | |
| van Deutekom, 201576 | Peso ao nascer positivamente associado à força de preensão manual. Aptidão aeróbica e neuromuscular prejudicada em indivíduos com BPN | |
| Metabolismo muscular, expressão genética e alterações histológicas | Brons, 200884 | Função mitocondrial normal in vivo e expressão de genes de fosforilação oxidativa em indivíduos com baixo peso ao nascer. |
| Brutsaert, 201285 | Lactato plasmático após exercício, bem como em resposta ao treino (porém a capacidade aeróbica não depende do índice ponderal) | |
| Friedrichsen, 201286 | A expressão CD68 aumentou em indivíduos com baixo peso ao nascer, os genes de fosforilação oxidativa reduziram em indivíduos com baixo peso ao nascer e negativamente correlacionados à expressão CD69. Atividades MPC1 e NF‐κB não afetadas. Nenhum dos marcadores inflamatórios foi correlacionado a sensibilidade à insulina. | |
| Jensen, 200783 | Alterações na composição e no tamanho da fibra muscular | |
| Mortensen, 201487 | Sistema AMPK mais sensível | |
| Mortensen, 201388 | Repouso está relacionado a fosforilação Akt estimulada por insulina e ao aumento a expressão de proteína AMPK α1 e γ3; resposta à insulina de fosforilação A5160 reduzida no pré e pós‐repouso. |
AMPK, quinase de proteína ativada por monofosfato de adenosina; BPN, baixo peso ao nascer; MPC1, proteína miocitária chemotactica‐1; NF‐κB, fator nuclear‐κB; PIG, pequeno para a idade gestacional; RCIU, restrição do crescimento intrauterino.
O mecanismo mais comumente estudado envolve alterações na força muscular. Conforme anteriormente declarado, baixo nível de força muscular está associado a níveis mais baixos de atividade física. A associação positiva entre peso ao nascer e força de preensão manual foi descrita em diferentes faixas etárias: na infância,76,77 adultos jovens,41 adultos e idosos.78–81 Baixo nível de força muscular já foi associado a fatores de risco metabólico como pressão arterial, HOMA‐RI e triglicerídeos em crianças em idade escolar.82 Dodds et al. conduziram uma análise sistemática e uma metanálise e encontraram 19 estudos que confirmam essa associação, que é mantida durante todo o curso da vida.42 Cada aumento de quilograma no peso ao nascer resultou em um aumento de 2,07kg e 1,59kg na força muscular em homens e mulheres, respectivamente.
Um estudo concluiu que o baixo crescimento fetal afeta a geração de força muscular, com base nos achados de menor força de preensão manual, menor contração voluntária isométrica máxima dos fêmures do quadríceps, aumento nas taxas de fadiga antes e depois dos treinos e redução na resposta ao treino naqueles nascidos com baixo índice ponderal.41 Jensen et al. investigaram as alterações na morfologia do músculo esquelético e mostraram uma alteração na proporção de diferentes fibras musculares em adultos jovens com RCIU. Por hipótese, o aumento do tamanho da fibra pode ser um marcador inicial de resistência à insulina nessa população.83 Além disso, Brons et al. avaliaram os efeitos do BPN sobre a disfunção mitocondrial no músculo esquelético. O estudo confirmou os achados anteriores de metabolismo da glicose anormal em indivíduos com BPN. Contudo, não houve indicação de que a disfunção mitocondrial pode ser a chave para explicar os defeitos metabólicos inerentes à resistência à insulina.84
Outros artigos encontraram diferenças no metabolismo muscular do lactato,85 na expressão CD68 mRNA, o que sugeriu infiltração de macrófagos e expressão genética com fosforilação oxidativa reduzida (OXPHOS) quando expostos a repouso,86 bem como sinalização de insulina no músculo esquelético.87 Mortensen et al. sugeriram que o BPN pode ter um sistema de quinase de proteína ativada por AMP (AMPK), embasado na comprovação de um aumento na ativação AMPK ativada por exercícios, bem como aumento dos efeitos sobre o alvo a jusante ACC2 (acetil coenzima A carboxilase 2) em indivíduos com BPN.88 Além disso, Ylihärsilä et al. concluíram que BPN está associado a menor massa magra na vida adulta e isso contribui para o risco de sarcopenia relativa e a incapacidade funcional relacionada mais tarde na vida.81
Em outro estudo, a desnutrição pré‐natal causou uma redução no tamanho da fibra muscular. A prática de exercícios não afeta a composição do tipo da fibra. A atividade dos marcadores enzimáticos dos caminhos oxidativos e glicolíticos foi significativamente diferente nos nascidos com RCIU. De modo geral, a atividade física preveniu obesidade nos nascidos com RCIU.89
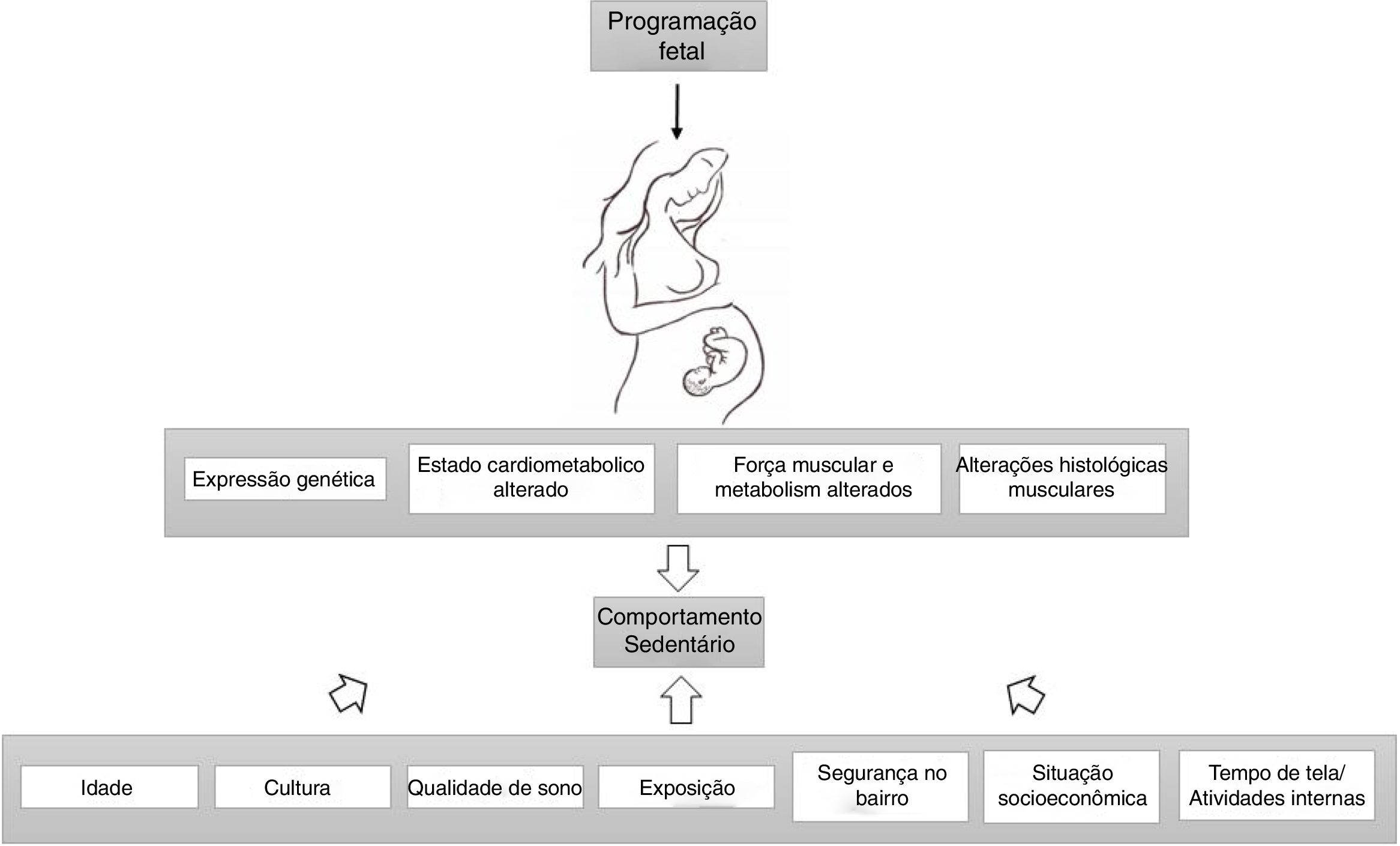
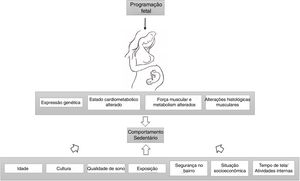
Por fim, alguns autores descreveram uma redução na capacidade cardiorrespiratória/aeróbica nos nascidos com baixo peso ao nascer.79,90–92 Os resultados de Van Deutekom et al. indicam que o BPN e o crescimento acelerado dos neonatos podem afetar negativamente a aptidão aeróbica e neuromuscular na infância.76 Outros relataram que o gasto energético de correr foi maior entre crianças prematuras nascidas com PIG em comparação com os controles nascidos a termo, sem diferença entre os controles prematuros AGA e a termo.93 O desempenho da velocidade de corrida também apresentou redução em outra amostra de crianças com BPN.77 Os dados experimentais mostraram redução no desempenho cardíaco em homens nascidos com RCIU, bem como aumento da geração de superóxido.94 A figura 1 apresenta os fatores que afetam os níveis de atividade física com relação à RCIU.
A programação fetal altera a expressão genética, o estado cardiometabólico, a força muscular, o metabolismo e a histologia, leva a níveis alterados de atividade física em indivíduos com RCIU. Idade, cultura, exposição, qualidade do sono, situação socioeconômica, segurança da vizinhança, tempo de tela e atividades internas também moderam a associação entre peso ao nascer e comportamento sedentário.
Conforme destacado anteriormente por Gatford et al., há alguma comprovação que associa RCIU a níveis alterados de atividade física, bem como que descreve os possíveis resultados benéficos da intervenção com exercícios sobre os resultados metabólicos; contudo, poucos estudos foram feitos e os resultados estão misturados.55 A maior parte dos estudos clínicos focou no desempenho cardiovascular e nas alterações musculares que podem ajudar a explicar a redução nos níveis de atividade física nessa população. Os estudos experimentais, por outro lado, foram mais além, explicaram as alterações na sensibilidade à insulina, secreção de leptina e estrutura e função vascular e muscular. Ainda, pouco se sabe sobre os mecanismos neurobiológicos que podem influenciar o comportamento sedentário.
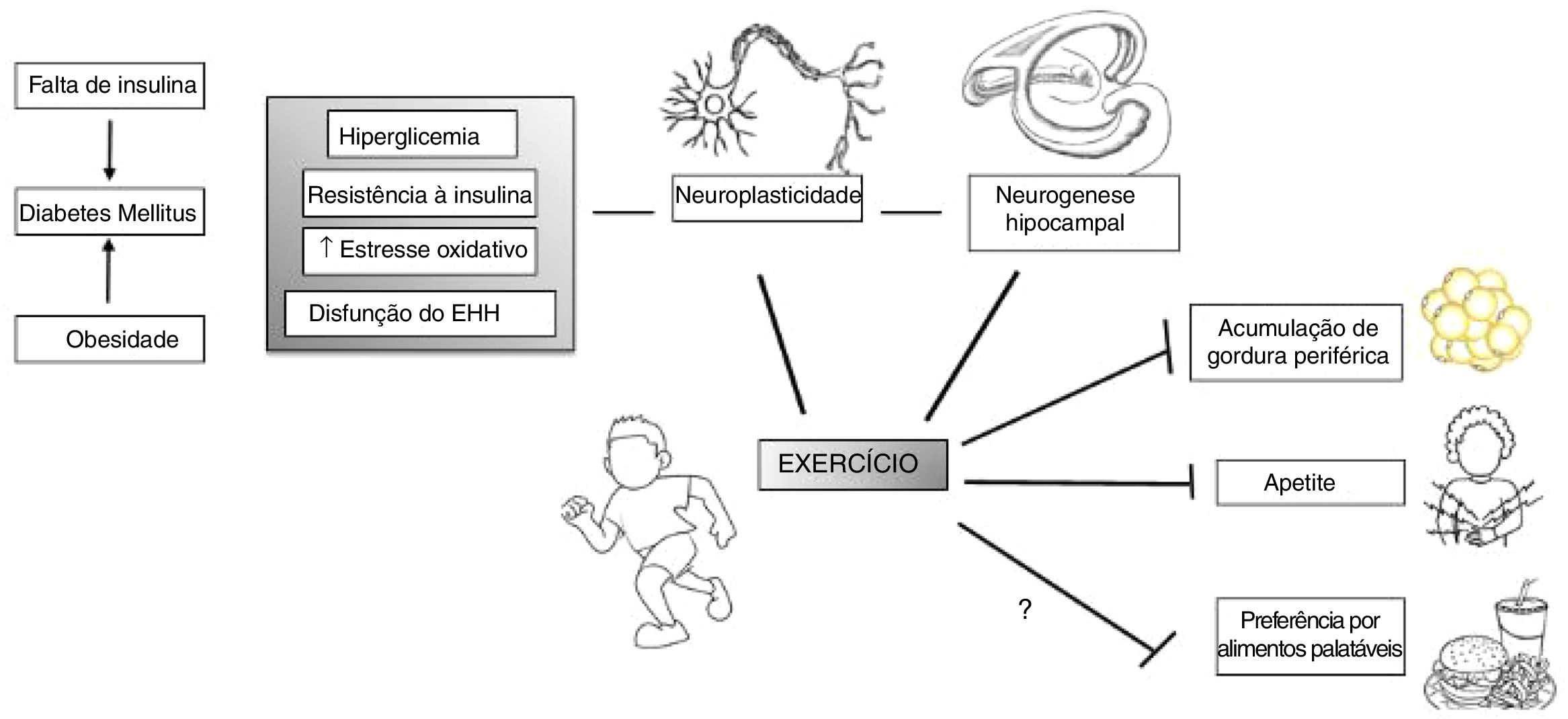
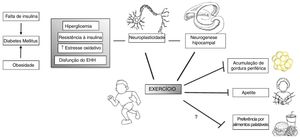
A prática de exercícios beneficia várias condições humanas, não somente as relacionadas à saúde física, mas também à saúde mental. A atividade física, aeróbica, de resistência ou coordenação, beneficia a função cognitiva em idosos.95 Ela também aumenta a conectividade cerebral entre os córtices frontal, posterior e temporal, afeta o volume hipocampal e os níveis séricos do fator neurotrófico derivado do cérebro (BDNF), um mediador de neurogênese no giro denteado do hipocampo95,96 (fig. 2).
A prática de exercícios pode agir em vulnerabilidades específicas que indivíduos com RCIU têm, como seu aumento do risco de desenvolvimento de diabetes tipo II e adiposidade, bem como disfunção do eixo hipotálamo‐hipófise (EHH). Além disso, a prática de exercícios atua em várias áreas e processos do cérebro, como aumento da neurogênese e neuroplasticidade e, portanto, influencia o comportamento. Adaptado e modificado de Yi.96
Do ponto de vista neurobiológico, a prática de exercícios influencia as liberações de cortisol, endocanabinoides, BDNF, dopamina e serotonina. A resposta ao estresse associado à prática de exercícios induz os efeitos inibitórios do cortisol secretado no hipotálamo e na hipófise por meio de receptores do córtex pré‐frontal medial e reduz a hiperexcitabilidade induzida pelo estresse da amígdala. Além disso, ao reduzir a quantidade de aminoácidos competitivos por meio da absorção muscular, o exercício aeróbico aumenta as chances de o triptofano cruzar a barreira hematoencefálica e, assim, tem o potencial de aumentar a serotonina, um importante neurotransmissor de processamento emocional, saciedade e funções de memória.97 Esses são alguns dos possíveis alvos de pesquisa futura, que explore principalmente os efeitos neurobiológicos da prática de exercícios em populações vulneráveis, como os nascidos com RCIU. Assim, uma pesquisa adicional seria beneficiada por visar a indivíduos com RCIU para intervenções estruturadas em estudos de grande escala bem projetados, para investigar os possíveis benefícios do treinamento físico. Além disso, as investigações neurobiológicas básicas que detalham os efeitos da prática de exercícios especificamente nesse grupo podem desvendar mecanismos que melhor padronizariam essas intervenções.
Conflitos de interesseOs autores declaram não haver conflitos de interesse.
Como citar este artigo: Bischoff AR, Cunha FS, Molle RD, Maróstica PJ, Silveira PP. Is willingness to exercise programmed in utero? Reviewing sedentary behavior and the benefits of physical activity in intrauterine growth restricted individuals. J Pediatr (Rio J). 2018;94:582–95.