Community‐acquired pneumonia is an important cause of morbidity in childhood, but the detection of its causative agent remains a diagnostic challenge. The authors aimed to evaluate the role of the chest radiograph to identify cases of community‐aquired pneumonia caused by typical bacteria.
MethodsThe frequency of infection by Streptococcus pneumoniae, Haemophilus influenzae, and Moraxella catarrhalis was compared in non‐hospitalized children with clinical diagnosis of community acquired pneumonia aged 2‐59 months with or without radiological confirmation (n=249 and 366, respectively). Infection by S. pneumoniae was diagnosed by the detection of a serological response against at least one of eight pneumococcal proteins (defined as an increase ≥2‐fold in the IgG levels against Ply, CbpA, PspA1 and PspA2, PhtD, StkP‐C, and PcsB‐N, or an increase ≥1.5‐fold against PcpA). Infection by H. influenzae and M. catarrhalis was defined as an increase ≥2‐fold on the levels of microbe‐specific IgG.
ResultsChildren with radiologically confirmed pneumonia had higher rates of infection by S. pneumoniae. The presence of pneumococcal infection increased the odds of having radiologically confirmed pneumonia by 2.8 times (95% CI: 1.8‐4.3). The negative predictive value of the normal chest radiograph for infection by S. pneumoniae was 86.3% (95% CI: 82.4‐89.7%). There was no difference on the rates of infection by H. influenzae and M. catarrhalis between children with community‐acquired pneumonia with and without radiological confirmation.
ConclusionsAmong children with clinical diagnosis of community‐acquired pneumonia submitted to chest radiograph, those with radiologically confirmed pneumonia present a higher rate of infection by S. pneumoniae when compared with those with a normal chest radiograph.
Avaliar o papel do raios X de tórax na identificação de casos de pneumonia adquirida na comunidade (PAC) causada por agentes bacterianos.
MétodosA frequência de infecção por Streptococcus pneumoniae, Haemophilus influenzae e Moraxella catarrhalis em crianças com PAC não hospitalizadas foi comparada com a presença de confirmação radiológica da pneumonia (n=249 crianças com pneumonia radiologicamente confirmada e 366 crianças com raios X de tórax normal). Infecção por S. pneumoniae foi diagnosticada com base na resposta sorológica a pelo menos uma dentre oito proteínas pneumocócicas investigadas (aumento ≥ 2 vezes nos níveis de IgG em relação a Ply, CbpA, PspA1 e 2, PhtD, StkP‐C e PcsB‐N ou aumento≥ 1,5 vez em relação aPcpA). Infecção por H. influenzae e M. catarrhalis foi definida por aumento ≥ 2 vezes nos níveis de IgG específica a antígenos de cada agente.
ResultadosCrianças com pneumonia radiologicamente confirmada apresentaram maior taxa de infecção pelo pneumococo. Além disso, a presença de infecção pneumocócica foi um fator preditor de pneumonia radiologicamente confirmada, o que aumenta sua chance de detecção em 2,8 vezes (IC 95%: 1,8‐4,3). O valor preditivo negativo do raios X normal para a infecção por S. pneumoniae foi 86,3% (IC95%: 82,4%‐89,7%). Não houve diferença nas frequências de infecção por H. influenzae e M. catarrhalis entre crianças com PAC com ou sem confirmação radiológica.
ConclusãoCrianças com diagnóstico clínico de PAC submetidas a um raios X de tórax que apresentam confirmação radiológica têm maior taxa de infecção por S. pneumoniae comparadas com as crianças com raios X normal.
A pneumonia adquirida na comunidade (PAC) é uma importante causa de morbidez e mortalidade em crianças.1 Contudo, o diagnóstico etiológico da PAC é desafiador. As radiografias de tórax têm sido usadas como uma ferramenta de diagnóstico por meio da identificação de padrões radiológicos sugestivos de processo inflamatório, como infiltrados pulmonares. Contudo, o papel do raios X de tórax em PAC pediátrica continua controverso, devido a problemas com o uso rotineiro desse exame, como má concordância entre os observadores2 e incapacidade de diferenciação entre agentes etiológicos distintos.3,4 Por outro lado, uma proporção significativa de crianças com diagnóstico clínico de PAC apresenta raios X de tórax normal após internação5 e importantes diferenças na internação e foi relatada evolução entre crianças com PAC com ou sem confirmação radiológica.6–9 De modo geral, esses dados sugerem que a doença em crianças com ou sem pneumonia radiologicamente confirmada pode ser causada por mecanismos distintos e/ou diferentes agentes etiológicos.
No Brasil, Streptococcus pneumoniae, Haemophilus influenzae e Moraxella catarrhalis foram relatados como importantes agentes bacterianos de pneumonia pediátrica em crianças hospitalizadas.10 Neste estudo, investigamos a presença de infecção S. pneumoniae, H. influenzae e M. catarrhalis em crianças brasileiras não hospitalizadas entre dois e 59 meses com diagnóstico clínico de pneumonia com ou sem confirmação radiológica. Ao fazê‐lo, visamos a avaliar o papel do raios X de tórax na identificação de prováveis causas de PAC causada por bactérias típicas.
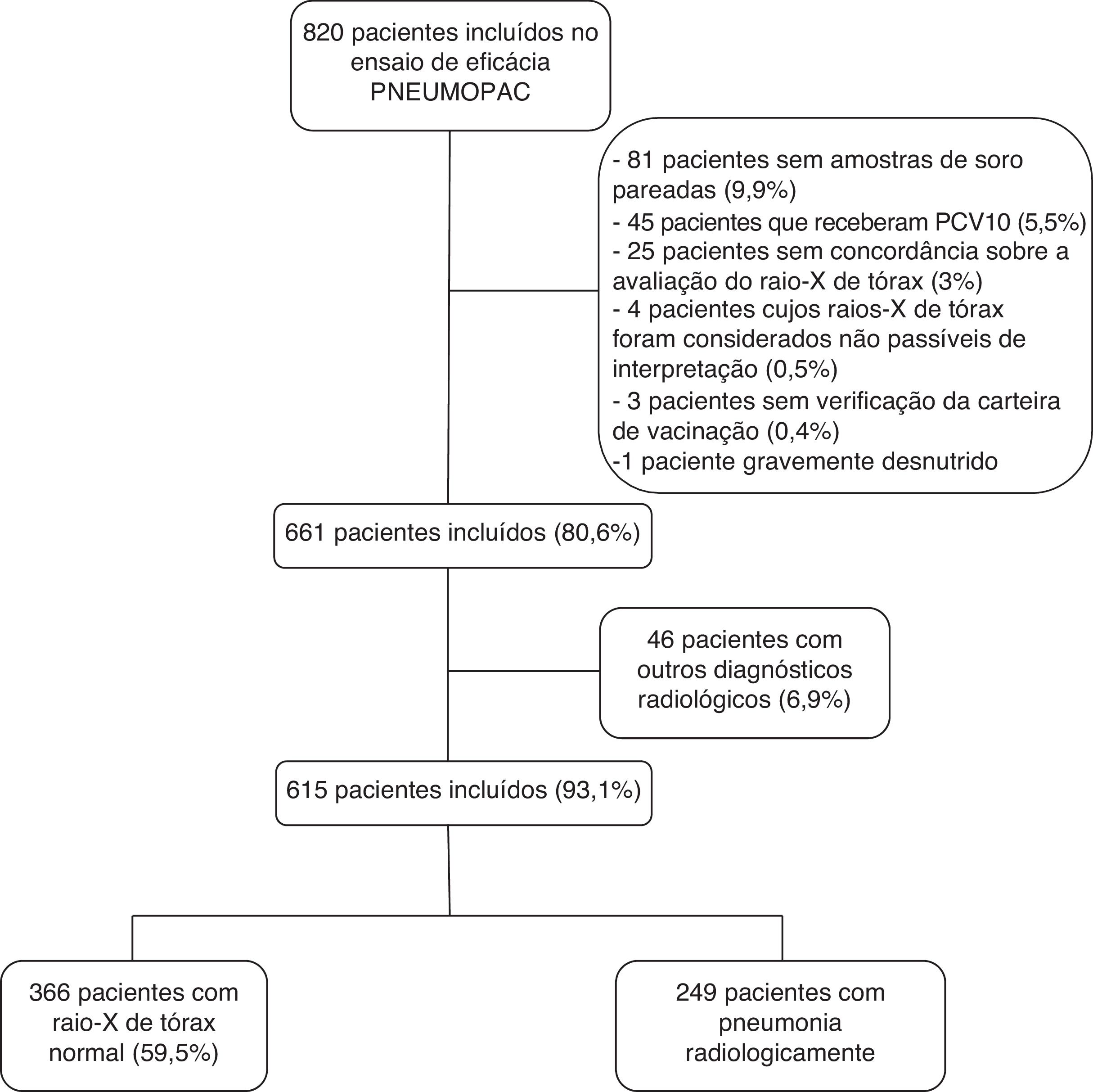
MétodosModelo do estudo e participantesEste estudo de coorte prospectivo fez parte de um ensaio clínico que avaliou o uso de amoxicilina oral administrada três ou duas vezes ao dia em crianças entre 2‐59 meses diagnosticadas com PAC (ensaio de eficácia Pneumopac, ClinicalTrials.gov NCT01200706).11 Nesse ensaio, participaram 820 crianças registradas na Unidade de Emergência da Universidade Federal da Bahia, em Salvador, Nordeste do Brasil, de novembro de 2006 a maio de 2011. Todas as crianças fizeram o exame de raios X de tórax (frontal e lateral) na internação e foram coletados amostras de sangue na internação e na visita de acompanhamento 2‐4 semanas depois. Os critérios de inclusão abrangeram o relato de queixas respiratórias e detecção de achados no trato respiratório inferior, juntamente com a presença de infiltrado/consolidação pulmonar no raios X de tórax, de acordo com a interpretação do pediatra responsável. Os responsáveis legais pelos pacientes incluídos forneceram um consentimento informado por escrito no momento da participação.
Todos os raios X de tórax foram analisados independentemente por dois radiologistas pediátricos (CAA‐N e SCA) cegos com relação aos dados clínicos. Foi demonstrada anteriormente uma concordância geral de 78,7% por esses dois radiologistas pediátricos.5 Caso não tenha havido concordância com relação aos achados finais de qualquer exame, esse raios X de tórax foi então avaliado por um terceiro radiologista (RVB). Os achados radiológicos foram registrados de acordo com a interpretação padronizada de estudos epidemiológicas publicada anteriormente pela Organização Mundial da Saúde.12 A pneumonia radiologicamente confirmada foi definida como a presença de infiltrado ou consolidação pulmonar em duas avaliações independentes.
O uso de vacina pneumocócica conjugada (10‐valente) (PCV10) foi implantado universalmente em Salvador, Brasil, em julho de 2010, para crianças <2 anos.13 Toda criança incluída no teste de eficácia Pneumopac que podia receber a PCV10 teve sua carteira de vacinação verificada pessoalmente por um dos pesquisadores (ICB) após o ensaio ser concluído. Os pacientes que receberam qualquer dose de PCV10 e aqueles cuja carteira de vacinação não pôde ser identificada foram excluídos dessa análise. Os pacientes com desnutrição grave, definida como escore Z de peso para a idade abaixo de ‐3,00,14 também foram excluídos. A avaliação nutricional foi feita com o software Anthro (WHO, World Health Organization). As crianças com tiragem subcostal ou sinais de perigo (incapacidade de ingerir líquidos, convulsões, cianose central, gemidos em uma criança calma) foram excluídas do ensaio de eficácia Pneumopac, bem como aquelas com doenças crônicas subjacentes.
Este estudo foi aprovado pelo Comitê de Ética da Universidade Federal da Bahia e foi conduzido de acordo com os princípios da Declaração de Helsinque.
Procedimentos laboratoriaisFoi usado o imunoensaio à base de beads multiplexadas fluorescentes (FMIA) para quantificar os níveis de anticorpos contra os antígenos proteicos de S. pneumoniae, H. influenzae e M. catarrhalis com a tecnologia Luminex xMAP® (Luminex Corporation, TX, EUA).15 Este ensaio incluiu oito proteínas recombinantes de S. pneumoniae (pneumolisina [Ply], proteína de ligação da colina A [CbpA], proteína de superfície pneumocócica A famílias 1 e 2 [PspA 1 e 2], proteína de ligação da colina pneumocócica A [PcpA], proteína tríade histidina pneumocócica D [PhtD], proteína serina/treonina quinase [StkP‐C, SP1732‐3], proteína necessária para separação da parece celular do Streptococcus do Grupo B [PcsB‐N, SP2216‐1]), três proteínas recombinantes de H. influenzae (Proteína D NTHi, NTHi0371‐1 e NTHi0830) e cinco proteínas recombinantes de M. catarrhalis (MC Omp CD, MC_RH4_2506, MC_RH4_1701, MC_RH4_3729‐1 e MC_RH4_4730). Nove conjuntos de beads foram criados com as proteínas acima na seguinte combinação: Ply, CbpA, PcpA, PhtD, StkP‐C e PcsB‐N e foram conjugadas em uma região de beads, cada; Ply, CbpA, PcpA, PhtD, StkP‐C e PcsB‐N foram conjugadas na mesma região de beads; e todas as proteínas de H. influenzae e M. catarrhalis foram conjugadas em uma região de grânulos por bactéria.
Este ensaio forneceu os valores de intensidade média de fluorescência (MFI) para cada antígeno e soro avaliado. O valor de MGI representa uma medida indireta da concentração de IgG em relação aos antígenos estudados. Cópias verdadeiras foram usadas em todo o procedimento e suas leituras de fluorescência foram calculadas pela média. Para garantir a repetibilidade dos ensaios, foram analisados controles altos e baixos em cada placa. Adicionalmente, amostras agudas e convalescentes foram analisadas na mesma placa. Todas as amostras foram testadas com diluições de 1:400 e 1:1.600 e, se necessário, foram feitas diluições adicionais. A ocorrência de uma resposta sorológica contra S. pneumoniae foi definida como um aumento nos níveis de anticorpos ≥ 2 vezes maior para IgG contra Ply, CbpA, PspA 1 e 2, PhtD, StkP‐C e PcsB‐N ou aumento de ≥ 1,5 vez maior para IgG contra PcpA, com base na validação de um teste sorológico sensível e específico para o diagnóstico da doença invasiva pneumocócica.16 O diagnóstico de infecção por S. pneumoniae foi estabelecido pela detecção de resposta sorológica contra quaisquer dos antígenos avaliados, com base na especificidade do ensaio e na boa correlação com o Elisa.15 A sensibilidade e a especificidade de uma resposta sorológica contra cada antígeno foram publicadas anteriormente.16 A ocorrência de infecção por H. influenzae ou M. catarrhalis foi definida como um aumento nos níveis de anticorpos ≥ 2 vezes entre as amostras aguda e convalescentes.15,17 Todos os testes sorológicos foram feitos por DCA e ICB no Instituto Nacional de Saúde e Bem‐Estar, em Helsinque, Finlândia. A frequência dessas infecções analisadas por distribuição etária, intervalo de coleta de amostras e duração da doença foi publicada em outro lugar.17
Análise estatísticaAs variáveis categóricas foram comparadas com o teste de qui‐quadrado ou teste exato de Fisher, conforme adequado, e as variáveis contínuas foram avaliadas com o teste U de Mann‐Whitney, pois elas apresentaram uma distribuição não paramétrica. Foi calculado o valor preditivo negativo do raios X de tórax normal para o diagnóstico de infecção por S. pneumoniae. A regressão logística multivariada foi feita com a presença de pneumonia radiologicamente confirmada como a variável dependente e a infecção por S. pneumoniae como a variável independente. Esse modelo foi ajustado por idade e infecção por H. Influenzae ou M. catarrhalis. Todos os testes estatísticos foram bicaudais, com um nível de significância de 0,05. O software Stata/SE 12.0 (StataCorp. 2011. Stata Statistical Software: Release 12. College Station, TX, EUA) foi usado para calcular o valor preditivo negativo do raios X de tórax normal e o software SPSS (SPSS Inc., versão 9.0. Chicago, EUA) foi usado para o restante da análise.
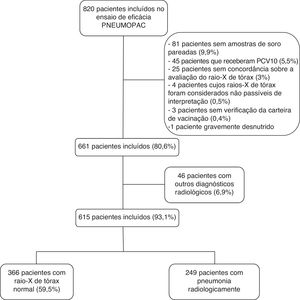
ResultadosDos 820 pacientes incluídos no ensaio de eficácia Pneumopac, 615 foram incluídos neste estudo, 249 (40,5%) dos quais apresentaram pneumonia radiologicamente confirmada e 366 (59,5%) apresentaram raios X de tórax normal. A figura 1 mostra o fluxograma dos casos incluídos e excluídos nesta investigação. De modo geral, 311 (50,6%) eram meninos e a idade média foi de 27,2 meses (percentil de 25 a 75: 14,9‐41,4 meses). Consolidação foi detectada pelos radiologistas um, dois e três em 84,6%, 79,8% e 67,3% dos casos com pneumonia radiologicamente confirmada concordante, respectivamente. Os casos restantes de pneumonia radiologicamente confirmada foram diagnosticados com base na detecção de infiltrados pulmonares.
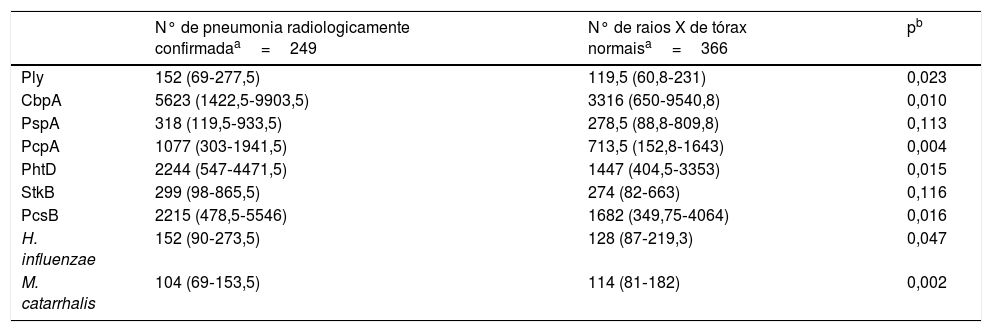
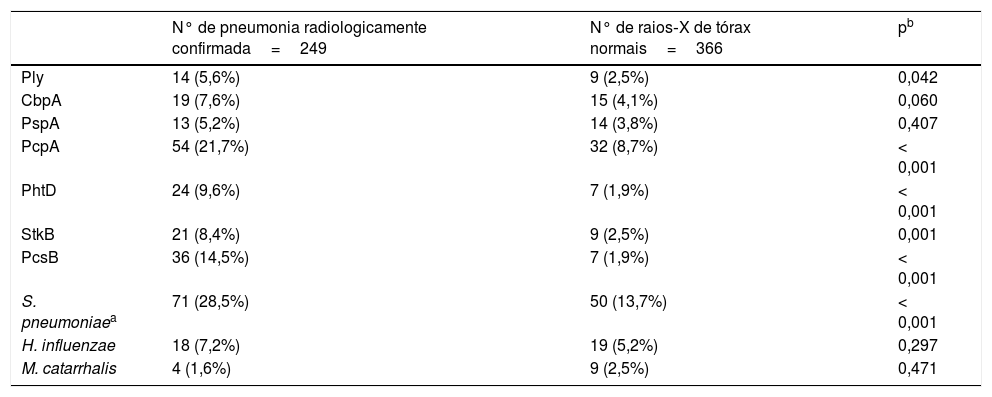
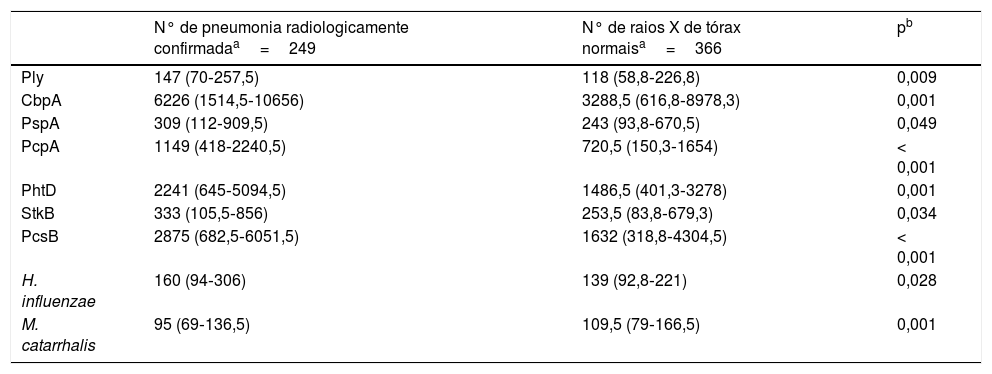
A comparação dos níveis de anticorpos na internação (primeira amostra de soro) contra os antígenos estudados com o uso de uma diluição de 1:1.600 é mostrada na tabela 1. As crianças com pneumonia radiologicamente confirmada apresentaram níveis significativamente maiores de anticorpos contra vários antígenos proteicos de S. pneumoniae e H. influenzae e menores níveis de anticorpos com relação às proteínas de M. catarrhalis. Resultados semelhantes foram obtidos ao se usar um fator de diluição de 1:400 (dados não mostrados). As crianças com pneumonia radiologicamente confirmada também apresentaram uma maior frequência de infecção por S. pneumoniae. As respostas dos anticorpos contra as proteínas de S. pneumoniae foram detectadas em 28,5% das crianças com pneumonia radiologicamente confirmada e em 13,7% das crianças com raios X de tórax normal (p<0,001). As respostas dos anticorpos contra a PcpA, PhtD e PcsB foram detectadas com mais frequência em crianças com pneumonia radiologicamente confirmada. Esses resultados são mostrados na tabela 2. Quando os níveis de anticorpos contra os antígenos estudados na segunda amostra de soro foram comparados com um fator de diluição de 1:1.600, contatamos níveis maiores de IgG contra todas as proteínas de S. pneumoniae e H. influenzae e menores níveis de anticorpos em relação a M. catarrhalis, conforme mostrado na tabela 3. Resultados semelhantes foram obtidos ao se usar um fator de diluição de 1:400 (dados não mostrados).
Comparação dos valores de intensidade média de fluorescência (MFI) da primeira amostra de soro de crianças com pneumonia radiologicamente confirmada ou aquelas com raios X de tórax normal, com o uso de um fator de diluição de 1:1600
| N° de pneumonia radiologicamente confirmadaa=249 | N° de raios X de tórax normaisa=366 | pb | |
|---|---|---|---|
| Ply | 152 (69‐277,5) | 119,5 (60,8‐231) | 0,023 |
| CbpA | 5623 (1422,5‐9903,5) | 3316 (650‐9540,8) | 0,010 |
| PspA | 318 (119,5‐933,5) | 278,5 (88,8‐809,8) | 0,113 |
| PcpA | 1077 (303‐1941,5) | 713,5 (152,8‐1643) | 0,004 |
| PhtD | 2244 (547‐4471,5) | 1447 (404,5‐3353) | 0,015 |
| StkB | 299 (98‐865,5) | 274 (82‐663) | 0,116 |
| PcsB | 2215 (478,5‐5546) | 1682 (349,75‐4064) | 0,016 |
| H. influenzae | 152 (90‐273,5) | 128 (87‐219,3) | 0,047 |
| M. catarrhalis | 104 (69‐153,5) | 114 (81‐182) | 0,002 |
Comparação das frequências de resposta dos anticorpos contra antígenos proteicos em crianças com diagnóstico clínico de PAC e pneumonia radiologicamente confirmada ou raios X de tórax normal
| N° de pneumonia radiologicamente confirmada=249 | N° de raios‐X de tórax normais=366 | pb | |
|---|---|---|---|
| Ply | 14 (5,6%) | 9 (2,5%) | 0,042 |
| CbpA | 19 (7,6%) | 15 (4,1%) | 0,060 |
| PspA | 13 (5,2%) | 14 (3,8%) | 0,407 |
| PcpA | 54 (21,7%) | 32 (8,7%) | < 0,001 |
| PhtD | 24 (9,6%) | 7 (1,9%) | < 0,001 |
| StkB | 21 (8,4%) | 9 (2,5%) | 0,001 |
| PcsB | 36 (14,5%) | 7 (1,9%) | < 0,001 |
| S. pneumoniaea | 71 (28,5%) | 50 (13,7%) | < 0,001 |
| H. influenzae | 18 (7,2%) | 19 (5,2%) | 0,297 |
| M. catarrhalis | 4 (1,6%) | 9 (2,5%) | 0,471 |
Comparação dos valores de intensidade média de fluorescência (MFI) da segunda amostra de soro de crianças com pneumonia radiologicamente confirmada ou aquelas com raios X de tórax normal, com o uso de um fator de diluição de 1:1600
| N° de pneumonia radiologicamente confirmadaa=249 | N° de raios X de tórax normaisa=366 | pb | |
|---|---|---|---|
| Ply | 147 (70‐257,5) | 118 (58,8‐226,8) | 0,009 |
| CbpA | 6226 (1514,5‐10656) | 3288,5 (616,8‐8978,3) | 0,001 |
| PspA | 309 (112‐909,5) | 243 (93,8‐670,5) | 0,049 |
| PcpA | 1149 (418‐2240,5) | 720,5 (150,3‐1654) | < 0,001 |
| PhtD | 2241 (645‐5094,5) | 1486,5 (401,3‐3278) | 0,001 |
| StkB | 333 (105,5‐856) | 253,5 (83,8‐679,3) | 0,034 |
| PcsB | 2875 (682,5‐6051,5) | 1632 (318,8‐4304,5) | < 0,001 |
| H. influenzae | 160 (94‐306) | 139 (92,8‐221) | 0,028 |
| M. catarrhalis | 95 (69‐136,5) | 109,5 (79‐166,5) | 0,001 |
Foi feita uma regressão logística multivariada para avaliar o efeito da infecção por S. pneumoniae na presença de pneumonia radiologicamente confirmada, ajustou‐se esse modelo por infeção por H. Influenzae ou M. catarrhalis e idade. A presença de infecção por S. pneumoniae aumentou as chances de pneumonia radiologicamente confirmada em 2,8 (IC de 95%; 1,8‐4,3). A presença de infecção por H. Influenzae ou M. catarrhalis ou a idade da criança não afetaram as chances de detecção de pneumonia radiologicamente confirmada (razão de chance [IC de 95%: 1,42 [0,7‐2,9]; 0,4 [0,1‐1,6]; e 0,9 [0,9‐1], respectivamente). Além disso, o valor preditivo negativo do raios X de tórax normal para o diagnóstico de infecção pelo pneumococo foi de 86,3% (IC de 95%: 82,4%‐89,7%).
DiscussãoEste estudo demonstra que as crianças com pneumonia radiologicamente confirmada apresentam uma maior frequência de infecção por S. pneumoniae do que as crianças com raios X de tórax normal. A presença de infecção por pneumococo foi associada de maneira independente a pneumonia radiologicamente confirmada entre crianças não hospitalizadas com PAC clínica. Adicionalmente, a presença de raios X de tórax normal apresentou um alto valor preditivo negativo na detecção de respostas dos anticorpos contra a S pneumoniae.
Constatamos uma maior frequência de resposta dos anticorpos contra vários antígenos de S. pneumoniae no grupo de crianças com pneumonia radiologicamente confirmada em comparação com crianças com raios X de tórax normal. Esse achado corrobora os resultados de estudos anteriores que demonstraram que a presença de infiltrados alveolares nos raios X de tórax foi associada a pneumonia bacteriana.18 Por exemplo, Nascimento‐Carvalho et al. também relataram que a infecção por S. pneumoniae foi detectada com mais frequência entre crianças com PAC hospitalizadas que apresentaram pneumonia radiográfica do que em crianças com raios X de tórax normal.19 Por outro lado, as crianças com raios X de tórax normal apresentaram maior incidência de infecção viral.19 Este é o primeiro relato sobre a associação entre infecção pneumocócica e pneumonia radiologicamente confirmada entre crianças não hospitalizadas com PAC clínica.
Dessa forma, o valor preditivo negativo do raios X de tórax normal na detecção de infecção pneumocócica foi alto (86,3% (IC de [95%: 82,4%‐89,7%). Apesar de uma associação entre a infecção bacteriana e os infiltrados alveolares/consolidação ter sido descrita anteriormente,18 esses achados não podem estabelecer de forma confiável o diagnóstico etiológico da PAC.4,5 Assim, nosso achado que de o raios X de tórax normal tem um alto valor preditivo negativo na infecção pneumocócica pode ajudar na interpretação desse exame. Vale notar que constatamos um alto valor preditivo negativo no raios X de tórax normal em uma população com alta prevalência de infecção pneumocócica,10 o que reforçou nossos resultados. De modo geral, nossos dados mostram que as crianças com PAC não grave com pneumonia radiologicamente confirmada apresentam maior chance de infecção por S. pneumoniae, ao passo que as crianças com raios X de tórax normal não são propensas a apresentar infecção por esse agente e podem não ser beneficiadas pela terapia antibiótica empírica.
Os dados dos ensaios de vacina reforçam a relação entre a infecção pneumocócica e a pneumonia radiologicamente confirmada, pois foi encontrado um efeito diferencial da vacinação pneumocócica nas taxas de PAC pediátrica a depender dos critérios diagnósticos aplicados. Por exemplo, a eficácia da vacina PCV (10‐valente) foi significativamente maior em crianças com consolidação no raios X de tórax do que em crianças com infiltrados alveolares ou exclusivamente com diagnóstico clínico de PAC.20 O maior impacto da vacinação pneumocócica em crianças com consolidação nos raios X de tórax sugere, assim, que os pacientes com esse diagnóstico radiológico apresentam maior incidência de infecção pneumocócica. Esses achados são compatíveis com aqueles relatados por Lucero et al., que demonstraram uma boa eficácia da vacina PCV (10‐valente) em crianças com pneumonia radiográfica definida como consolidação e uma eficácia praticamente insignificante da vacina em criança com diagnóstico clínico de pneumonia.21 Esse ensaios de vacina fornecem comprovação indireta da etiologia da pneumonia em crianças com padrões radiológicos distintos, indicam que as crianças com pneumonia radiologicamente confirmada de fato apresentam maior frequência de infecção por S. pneumoniae.
Contudo, o papel do raios X de tórax no manejo de crianças com PAC tem sido amplamente discutido. É importante destacar que Bradley et al. recomendaram que o raios X de tórax deve ser usado somente em crianças hospitalizadas ou com hipoxemia, insuficiência respiratória significativa, suspeita de complicações ou falha no tratamento.22 Essa posição é corroborada por Harris et al., que declararam que as crianças com sintomas e sinais sugestivos de pneumonia que não estejam internadas não devem ser submetidas a raios X de tórax rotineiramente.23 Essas recomendações devem‐se, em parte, a estudos anteriores que mostraram que a pneumonia bacteriana não pode ser diferenciada da pneumonia não bacteriana com base exclusivamente nos achados de um raios X de tórax anormal.3,4,24 Adicionalmente, a comprovação atual sugere que o uso de raios X de tórax não melhora o resultado de pacientes pediátricos com PAC.25 Contudo, é importante enfatizar que, quando o impacto do raios X de tórax sobre o manejo das crianças com CAP foi avaliado, os pacientes receberam antibióticos a critério do médico responsável, independentemente dos achados radiológicos, o que limitou o possível benefício de um estudo radiológico nesses pacientes como uma ferramenta de diagnóstico com implicações terapêuticas.25 Dessa forma, Hariis et al. recomendam o uso de antibióticos em todas as crianças com diagnóstico claro de PAC.23 Contudo, ambas as diretrizes concordam que crianças jovens não necessitam de uso rotineiro de antibióticos, pois a maior delas apresenta infecção viral aguda do trato respiratório inferior.22,23 Nesse cenário, apesar de o raios X de tórax não diferenciar inequivocamente os agentes etiológicos da PAC, ele pode ajudar a diferenciar os diferentes padrões de infecções do trato respiratório inferior. Uma comprovação recente demonstrou importantes diferenças entre as crianças com ou sem pneumonia radiologicamente confirmada no quadro clínico e na evolução. As crianças com pneumonia radiologicamente confirmada apresentam maior frequência e maior persistência de febre6–8 e, além disso, evoluem de forma mais grave, com internação mais prolongada, maior necessidade de apoio respiratório e maiores taxas de falha no tratamento.9 Essas diferenças indicam que as crianças com e sem pneumonia radiologicamente confirmada podem apresentar diferentes padrões de infecção no trato respiratório inferior e o raios X de tórax, quando feito, pode ajudar no manejo de casos duvidosos de PAC não grave.
Constatamos também que as crianças com pneumonia radiologicamente confirmada apresentaram maiores níveis de anticorpos contra várias proteínas pneumocócicas na internação e em convalescença. Foi relatado anteriormente que menores níveis de anticorpos antipneumocócitos na internação estão associados à maior frequência de respostas dos anticorpos contra S. pneumoniae devido à particularidades dos métodos sorológicos.17 Portanto, o nível de anticorpos na internação provavelmente não foi responsável pela maior taxa de respostas dos anticorpos contra o pneumococo em crianças com pneumonia radiológica. O maior nível de anticorpos na internação nesse grupo de crianças, por sua vez, pode ter sido causado por colonização anterior por S. pneumoniae. A colonização nasofaríngea é reconhecida como parte da história natural da doença pneumocócica, que progride se as barreiras imunológicas forem cruzadas pelas bactérias colonizadoras.26 Além disso, as crianças com pneumonia clínica e radiológica também são colonizadas com mais frequência por S. pneumoniae em comparação com controles saudáveis.27 Portanto, existe a possibilidade de que uma maior taxa de transporte de S. pneumoniae em crianças com pneumonia radiologicamente confirmada tenha causado os maiores níveis de anticorpos antipneumocócicos encontrados nesse subgrupo.
Não encontramos diferença nas taxas de resposta dos anticorpos contra H. influenzae e M. catarrhalis, possivelmente devido aos baixos números de respondedores em nosso grupo de estudo. Contudo, níveis discretamente maiores de anticorpos contra H. influenzae foram encontrados em crianças com pneumonia radiologicamente confirmada, bem como menores níveis de anticorpos contra a M. catarrhalis. Sabe‐se que vários agentes bacterianos competem na colonização do trato nasofaríngeo de pacientes pediátricos, criam um processo dinâmico de rotatividade de agentes colonizadores.27 O aumento nas taxas de colonização por S. pneumoniae também pode ter contribuído para a redução dos níveis de anticorpos contra M. catarrhalis nas amostras coletadas de crianças com pneumonia radiologicamente confirmada na internação. Por outro lado, já foi descrita uma correlação positiva entre colonização por S. pneumoniae e H. Influenzae, o que pode ter contribuído para os altos níveis de anticorpos na internação encontrados contra H. influenzae.28
As limitações de nosso estudo devem ser enfatizadas. Primeiro, os dados sobre a situação de colonização das crianças avaliadas não estavam disponíveis e não foi avaliado o efeito putativo do transporte pneumocócico sobre os níveis de anticorpos na internação. Segundo, nosso estudo foi composto por crianças não vacinadas, o que não representa a realidade na maior parte dos países na era pós‐PCV. Contudo, uma comprovação recente sugere que o uso da PCV não interfere no resultado do ensaio sorológico proteico em crianças com PAC,29 o que favorece a generalização de nossos resultados. Além disso, não tivemos dados sobre o uso de outras vacinas que podem ter influenciado os resultados aqui apresentados, como vacina contra H. influenzae tipo B. Contudo, a abrangência da vacina contra H. influenzae tipo B entre a população pediátrica no Brasil é alta (> 80%), então as taxas diferenciais da vacinação provavelmente não afetam nossos resultados.30 Por fim, como todos os antígenos de H. influenzae e M. catarrhalis foram conjugados em uma região de beads por bactéria, leituras de fluorescência individuais não foram obtidas para esses antígenos.
Conclusão: este estudo demonstra que, entre as crianças não hospitalizadas com PAC clínica submetidas a raios X de tórax, aquelas com pneumonia radiologicamente confirmada apresentaram maior frequência de infecção por S. pneumoniae em comparação com as crianças com raios X de tórax normal. Adicionalmente, a presença de infecção pneumocócica foi associada de maneira independente a pneumonia radiologicamente confirmada e o raios X de tórax normal apresentou um alto valor preditivo negativo de infecção pneumocócica.
FinanciamentoEste trabalho foi patrocinado pela Fundação de Amparo à Pesquisa do Estado da Bahia (Fapesb) e pelo Conselho Nacional de Desenvolvimento Científico e Tecnológico (CNPq).
Conflitos de interesseAndreas Meinke é funcionária da Valneva Austria GmbH. Os outros autores declaram não haver conflito de interesses.
À Sanofi Pasteur (Lyon, França) por fornecer as proteínas PcpA e PhtD; à Prof. Elaine Tuomanen do St. Judes Children's Research Hospital (Memphis, EUA) por fornecer as proteínas Ply, CbpA, PspA1; aos professores Susan Hollingshead, David Briles e Pat Coan da University of Alabama (Birmingham, EUA) por fornecerem a proteína PspA2 e à Valneva Austria GmbH (Vienna, Áustria) por fornecer as proteínas StkP‐C, PcsB‐N, Proteína D de NTHi, NTHi0371‐1, NTHi0830, MC Omp CD, MC_RH4_2506, MC_RH4_1701, MC_RH4_3729‐1 e MC_RH4_4730.
Como citar este artigo: Andrade DC, Borges IC, Vilas‐Boas AL, Fontoura MS, Araújo‐Neto CA, Andrade SC, et al. Infection by Streptococcus pneumoniae in children with or without radiologically confirmed pneumonia. J Pediatr (Rio J). 2018;94:23–30.