Perform a systematic review and meta‐analysis to assess the effectiveness and complications caused by the use of the high‐flow nasal cannula in relation to the post‐extubation continuous positive airway pressure system in preterm newborns.
Data SourcesThe searches were performed from January 2013 to December 2018 in the PubMed and Embase databases, as well as a manual search on the internet.
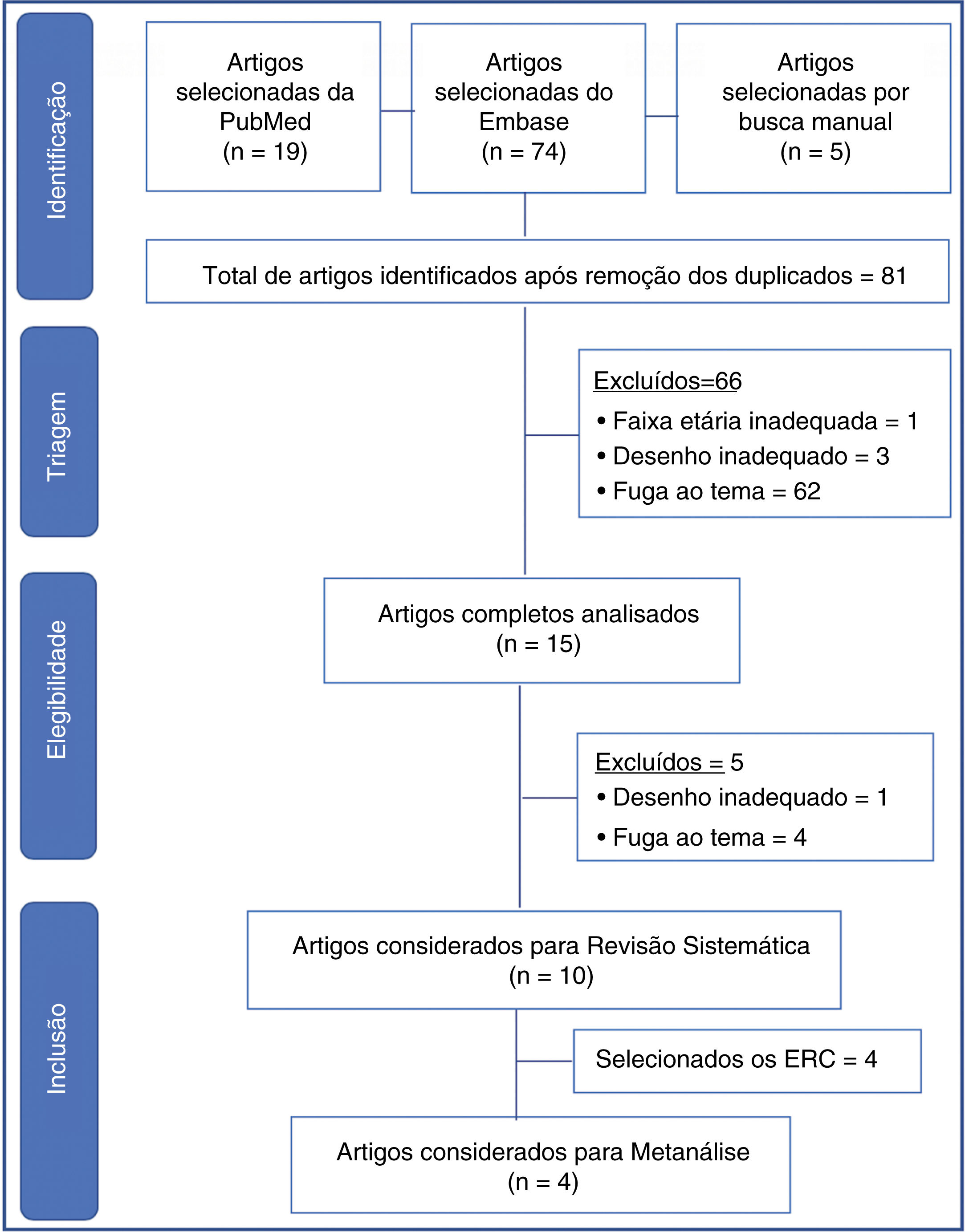
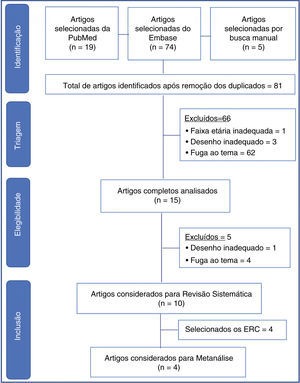
Data SynthesisTwo reviewers independently conducted the search, and a third reviewer resolved questions that arose. Ninety‐eight articles from the chosen sources were evaluated, and 66 were discarded because they did not meet the inclusion criteria (inadequate topic, age range, or design, in addition to the duplicates). Fifteen articles were read in full, and five more were discarded due to inadequacy to the topic or design. There were ten articles left for systematic review and four for meta‐analysis. The study showed non‐inferiority in terms of therapeutic failure of the high‐flow nasal cannula in relation to continuous positive airway pressure after extubation of preterm newborns. In the meta‐analysis, nasal trauma was significantly lower in patients submitted to the high‐flow nasal cannula compared to those using continuous positive airway pressure (p < 0.00001).
ConclusionThe high‐flow nasal cannula is not inferior to continuous positive airway pressure for post‐extubation respiratory support in preterm newborns with a gestational age of 32 weeks or less and greater than 28 weeks, in addition to resulting in less nasal trauma.
Realizar revisão sistemática e metanálise para avaliar efetividade e complicações decorrentes do uso da cânula nasal de alto fluxo em relação ao sistema de pressão positiva contínua de vias aéreas no período pós‐extubação em recém‐nascidos prematuros.
Fontes dos dadosAs buscas foram feitas de janeiro de 2013 a dezembro de 2018 nas bases de dados PubMed, Embase e busca manual em arquivos da internet.
Resumo dos dadosDois revisores fizeram a busca de forma independente, um terceiro revisor ficou para dirimir dúvidas. Foram avaliados 98 artigos das fontes escolhidas, 66 descartados por não se enquadrar nos critérios de inclusão (tema, faixa etária ou desenho inadequados, além dos duplicados). Foram lidos 15 artigos na íntegra, foram descartados mais 5 por inadequação ao tema ou desenho. Restaram 10 artigos para revisão sistemática e 4 para metanálise. O estudo evidenciou não inferioridade em termos de falha terapêutica da cânula nasal de alto fluxo em relação ao sistema de pressão positiva contínua de vias aéreas na pós‐extubação de recém‐nascidos prematuros. Na metanálise, foi significativamente menor o trauma nasal nos pacientes em cânula nasal de alto fluxo em relação ao que usaram sistema de pressão positiva contínua de vias aéreas (p < 0,00001).
ConclusãoA cânula nasal de alto fluxo não é inferior ao sistema de pressão positiva contínua de vias aéreas para o suporte respiratório pós‐extubação de recém‐nascidos prematuros com idade gestacional igual a ou menor do que 32 semanas e maior do que 28 semanas, além de provocar menos trauma nasal.
A insuficiência respiratória aguda, que exige ventilação mecânica invasiva (VMI) ou suporte respiratório não invasivo, figura como um problema frequente em recém‐nascidos (RN) prematuros após o nascimento.1
Estudos recentes sugerem que o aumento das taxas de sobrevida de RN prematuros extremos (< 28 semanas de idade gestacional) foi associado a uma maior necessidade de suporte respiratório.1 O suporte invasivo através de um tubo endotraqueal, até recentemente, era a forma mais usada de suporte respiratório primário. Entretanto, o suporte por ventilação não invasiva (VNI), especialmente com o uso da pressão positiva contínua nas vias aéreas (CPAP), tem mostrado benefícios e vantagens sobre a VMI.2 Além do uso como suporte respiratório primário, também já está bem estabelecido que o CPAP é dispositivo de transição de suporte respiratório após a extubação traqueal.3,4
A cânula nasal de alto fluxo (CNAF) é um dispositivo mais recente de suporte respiratório introduzido para RN e ganhou popularidade entre os médicos em todo o mundo, embora evidências que apoiem seu uso não estejam totalmente estabelecidas.4–6 Vários ensaios clínicos ao longo da última década relataram dados sobre o uso da CNAF em RN prematuros, tanto como modo primário de suporte respiratório no nascimento como após a extubação traqueal da VMI com resultados iversos.4–9Fizemos uma revisão sistemática e metanálise sobre o uso da CNAF como suporte respiratório em RN prematuros após a extubação traqueal com o objetivo primário de avaliar a possível não inferioridade do método em relação ao CPAP nasal (CPAP), em termos de sucesso terapêutico. Como objetivos secundários, avaliamos os riscos de algumas possíveis complicações relacionadas aos métodos.
MétodosO estudo foi baseado nas diretrizes do Preferred Reporting Items for Systematic Reviews and Meta‐Analyses Guidelines (PRISMA).10 Para a busca, foram usados vocabulários estruturados Medical Subject Headings (MeSH) para PubMed e Emtree para Embase. A estratégia de busca concentrou‐se no período de janeiro de 2013 a dezembro de 2018, sem filtros para idiomas, com as palavras‐chave “(high flow) AND (CPAP OR nCPAP) AND extubation AND (prematurity OR preterm)”.
Foi feita ainda uma “busca manual” em repositórios da internet, resumos de congressos e Google Scholar para identificar possíveis estudos não identificados pelas duas principais bases de dados pesquisadas.
Critérios de elegibilidadePara a revisão sistemática foram considerados elegíveis os estudos nos quais foi usado suporte respiratório através de cânula nasal de alto fluxo (> 1 L/minuto) em comparação com o CPAP nasal, imediatamente após a extubação em recém‐nascidos prematuros (< 37 semanas).
Para a metanálise foram considerados elegíveis os estudos randomizados e controlados.
Seleção de estudos e extração de dadosDois investigadores conduziram independentemente a busca nos bancos eletrônicos de dados e extraíram as informações. Um terceiro investigador foi chamado a participar em caso de discordância entre os dois primeiros.
Foram lidos os títulos e resumos de todos os artigos como triagem inicial e, após desconsiderar os duplicados, foram excluídos aqueles que não eram relacionados ao tema, relatos de casos, cartas ao editor, estudos experimentais, questionários, consensos de especialistas e editoriais. Os artigos restantes foram lidos na íntegra.
Os períodos e as áreas de recrutamento de pacientes foram avaliados a fim de evitar uma possível contagem duplicada de pacientes incluídos em mais de um relatório pelos mesmos autores/grupos de trabalho.
Os dados categóricos para os desfechos foram extraídos para cada grupo de intervenção (CNAF e CPAP) e foram calculadas as odds ratios com intervalo de confiança de 95% (IC 95%), cada evento foi considerado com efeito fixo, com o uso do método de Mantel‐Haenszel.
Para avaliação de não inferioridade foram calculadas as diferenças absolutas de risco para falhas terapêuticas e taxas de reintubação, com IC 95%; para que o tratamento com CNAF fosse considerado não inferior, o limite superior do intervalo de confiança de 95% deveria ser menor do que 20% e o limite inferior deveria ser negativo.11
A análise foi feita para efeitos fixos e os pesos são baseados no inverso das variâncias. As variâncias, por sua vez, são determinadas primariamente pelos tamanhos das amostras. Dessa forma, o estudo de Manley,12 que conta com a maior amostra (n = 303), contribui com maior peso para os desfechos e eventos adversos observados. Nesse tipo de análise, pode haver o risco de que os resultados de estudos menores possam ser praticamente ignorados, mas, devido à quase ausência de heterogeneidade, julgamos que a avaliação de efeitos fixos seja a mais adequada para essa metanálise.
Para comparação das idades gestacionais foram usadas médias e desvios‐padrão, com cálculo da diferença média ponderada. A metanálise foi feita com o programa Review Manager (Rev Man) 5.3 (Copenhagen: The Nordic Cochrane Centre, The Cochrane Collaboration, 2014).
Avaliação de risco de viésO risco de viés nos estudos foi avaliado por meio de consenso entre os investigadores.
ResultadosForam encontrados 98 artigos (19 no PubMed, 74 no Embase e 5 nas referências por busca manual). Após triagem inicial e retirada dos artigos duplicados, restaram 81. Foram descartados 66 artigos, foram excluídos aqueles que não eram relacionados ao tema, desenho inadequado à revisão (relatos de casos, cartas ao editor, estudos experimentais, questionários, consensos de especialistas e editoriais), além de um artigo com RN a termo.
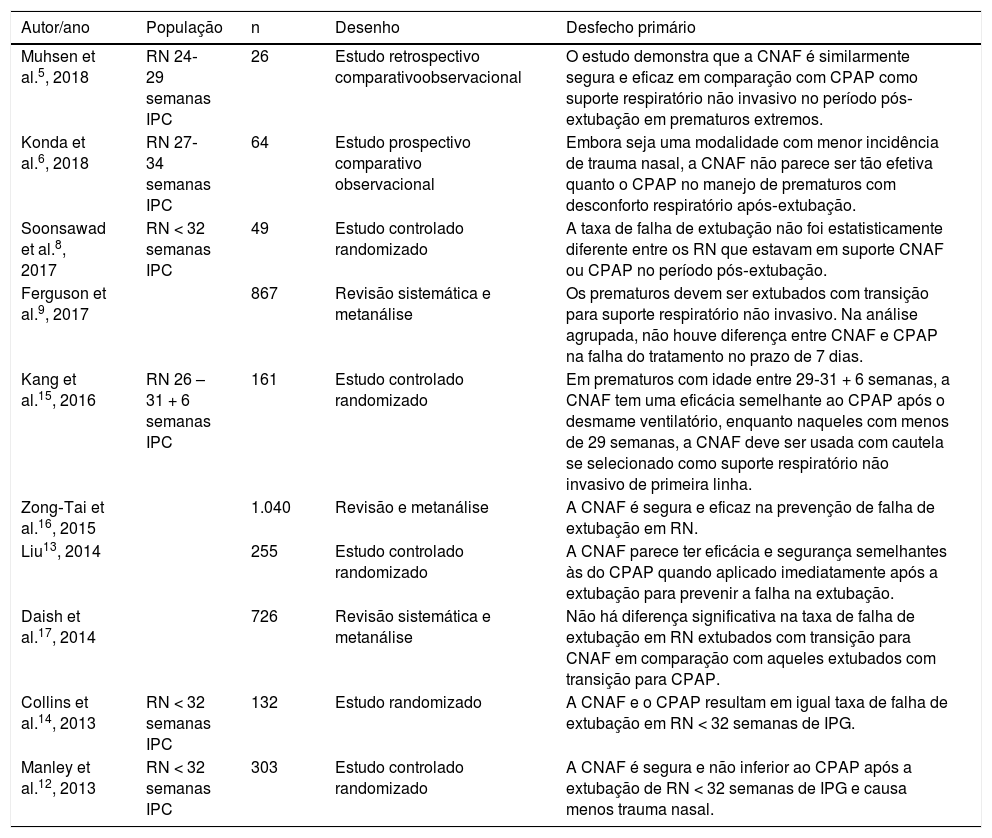
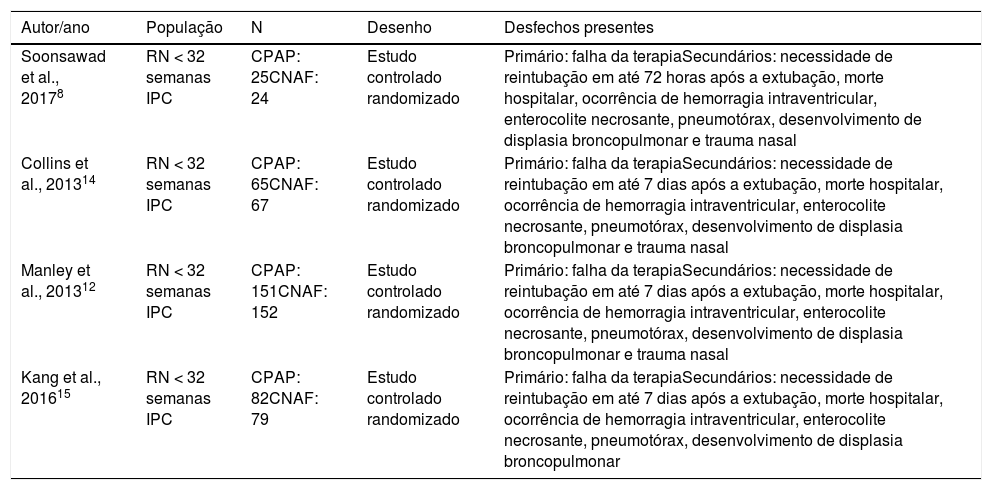
Os 15 artigos restantes foram lidos na íntegra, foram selecionados 10 artigos finais para a revisão sistemática (fig. 1). As características de cada estudo, inclusive autor principal, ano de publicação do estudo, desenho do estudo e desfecho principal estão na tabela 1. Dos estudos selecionados para a revisão sistemática, quatro eram randomizados controlados e foram incluídos para metanálise, com um total de 645 pacientes. Os dados estão resumidos na tabela 2.
Características dos estudos incluídos na revisão sistemática
| Autor/ano | População | n | Desenho | Desfecho primário |
|---|---|---|---|---|
| Muhsen et al.5, 2018 | RN 24‐29 semanas IPC | 26 | Estudo retrospectivo comparativoobservacional | O estudo demonstra que a CNAF é similarmente segura e eficaz em comparação com CPAP como suporte respiratório não invasivo no período pós‐extubação em prematuros extremos. |
| Konda et al.6, 2018 | RN 27‐34 semanas IPC | 64 | Estudo prospectivo comparativo observacional | Embora seja uma modalidade com menor incidência de trauma nasal, a CNAF não parece ser tão efetiva quanto o CPAP no manejo de prematuros com desconforto respiratório após‐extubação. |
| Soonsawad et al.8, 2017 | RN < 32 semanas IPC | 49 | Estudo controlado randomizado | A taxa de falha de extubação não foi estatisticamente diferente entre os RN que estavam em suporte CNAF ou CPAP no período pós‐extubação. |
| Ferguson et al.9, 2017 | 867 | Revisão sistemática e metanálise | Os prematuros devem ser extubados com transição para suporte respiratório não invasivo. Na análise agrupada, não houve diferença entre CNAF e CPAP na falha do tratamento no prazo de 7 dias. | |
| Kang et al.15, 2016 | RN 26 – 31 + 6 semanas IPC | 161 | Estudo controlado randomizado | Em prematuros com idade entre 29‐31 + 6 semanas, a CNAF tem uma eficácia semelhante ao CPAP após o desmame ventilatório, enquanto naqueles com menos de 29 semanas, a CNAF deve ser usada com cautela se selecionado como suporte respiratório não invasivo de primeira linha. |
| Zong‐Tai et al.16, 2015 | 1.040 | Revisão e metanálise | A CNAF é segura e eficaz na prevenção de falha de extubação em RN. | |
| Liu13, 2014 | 255 | Estudo controlado randomizado | A CNAF parece ter eficácia e segurança semelhantes às do CPAP quando aplicado imediatamente após a extubação para prevenir a falha na extubação. | |
| Daish et al.17, 2014 | 726 | Revisão sistemática e metanálise | Não há diferença significativa na taxa de falha de extubação em RN extubados com transição para CNAF em comparação com aqueles extubados com transição para CPAP. | |
| Collins et al.14, 2013 | RN < 32 semanas IPC | 132 | Estudo randomizado | A CNAF e o CPAP resultam em igual taxa de falha de extubação em RN < 32 semanas de IPG. |
| Manley et al.12, 2013 | RN < 32 semanas IPC | 303 | Estudo controlado randomizado | A CNAF é segura e não inferior ao CPAP após a extubação de RN < 32 semanas de IPG e causa menos trauma nasal. |
CNAF, cânula nasal de alto fluxo; CPAP, pressão positiva contínua de vias aéreas; IPC, idade pós‐conceptual; RN, recém‐nascidos.
Resumo dos estudos incluídos na metanálise
| Autor/ano | População | N | Desenho | Desfechos presentes |
|---|---|---|---|---|
| Soonsawad et al., 20178 | RN < 32 semanas IPC | CPAP: 25CNAF: 24 | Estudo controlado randomizado | Primário: falha da terapiaSecundários: necessidade de reintubação em até 72 horas após a extubação, morte hospitalar, ocorrência de hemorragia intraventricular, enterocolite necrosante, pneumotórax, desenvolvimento de displasia broncopulmonar e trauma nasal |
| Collins et al., 201314 | RN < 32 semanas IPC | CPAP: 65CNAF: 67 | Estudo controlado randomizado | Primário: falha da terapiaSecundários: necessidade de reintubação em até 7 dias após a extubação, morte hospitalar, ocorrência de hemorragia intraventricular, enterocolite necrosante, pneumotórax, desenvolvimento de displasia broncopulmonar e trauma nasal |
| Manley et al., 201312 | RN < 32 semanas IPC | CPAP: 151CNAF: 152 | Estudo controlado randomizado | Primário: falha da terapiaSecundários: necessidade de reintubação em até 7 dias após a extubação, morte hospitalar, ocorrência de hemorragia intraventricular, enterocolite necrosante, pneumotórax, desenvolvimento de displasia broncopulmonar e trauma nasal |
| Kang et al., 201615 | RN < 32 semanas IPC | CPAP: 82CNAF: 79 | Estudo controlado randomizado | Primário: falha da terapiaSecundários: necessidade de reintubação em até 7 dias após a extubação, morte hospitalar, ocorrência de hemorragia intraventricular, enterocolite necrosante, pneumotórax, desenvolvimento de displasia broncopulmonar |
CNAF, cânula nasal de alto fluxo; CPAP, pressão positiva contínua de vias aéreas; IPC, idade pós‐conceptual; RN, recém‐nascidos.
Todos os estudos excluíram RN com suspeita de obstrução respiratória, malformações de vias aéreas ou cardiopulmonares graves. Optamos por não usar na metanálise os dados do estudo de Liu C13 por incluir recém‐nascidos não prematuros.
Riscos de vieses observadosDevido às diferenças entre os dispositivos, não foi possível cegar as intervenções em qualquer dos estudos. Não houve tentativas de cegar as análises para os prognósticos secundários, com a única exceção para a ocorrência de hemorragias intraventriculares no estudo de Collins et al.,14 em que as avaliações das imagens de ultrassonografia foram feitas sem identificação por radiologistas.
A decisão sobre reintubação foi deixada a critério dos médicos assistentes em todos os estudos. Alterações de taxas de fluxo também foram deixadas a critério dos médicos assistentes nos estudos de Collins et al.14 e Manley et al.,12 o que pode ter gerado diferenças não descritas entre os grupos. Não há descrição do método de aplicação do fluxo nos outros estudos.
Quanto à alocação, os estudos de Collins et al.,14 Soonsawad et al.8 e Manley et al.12 descrevem a randomização adequada por sequências aleatórias geradas em computador e alocação através de abertura de envelopes opacos e selados, no momento da extubação. Não há descrição do processo de randomização e alocação no estudo Kang et al.15
Não há, em qualquer dos estudos, anotação sobre a forma de obtenção dos prognósticos secundários dos estudos, exceto para eventos adversos graves (pneumotórax) em Manley et al.,12 que eram comunicados ao investigador, e as lesões nasais, avaliadas através de escore próprio em Collins et al.14 A avaliação de desfechos secundários através de registros médicos, ou seja, de forma retrospectiva na alta ou óbito, tem o potencial de provocar vieses.
Desfechos avaliadosO desfecho primário avaliado foi a falha do método terapêutico em todos os estudos. Os critérios para falha terapêutica foram semelhantes: apneia (pausa respiratória > 20 segundos), necessitaram de retorno para o CPAP (em caso de CNAF), BIPAP ou reintubação, em caso do CPAP; acidose respiratória, com pH <7,20‐7,25 e PCO2 >60‐66mmHg; aumento sustentado da FiO2 >15‐20% após a extubação.
Desfechos secundários presentes nos estudos foram a necessidade de reintubação, morte hospitalar, ocorrência de hemorragia intraventricular, enterocolite necrosante, pneumotórax, desenvolvimento de displasia broncopulmonar e trauma nasal.
A displasia broncopulmonar foi definida em todos os estudos como a necessidade de suporte respiratório ou oxigênio suplementar com 36 semanas de idade pós‐gestacional. Já a enterocolite necrosante tem definição clara em Collins et al.,14 são considerados os casos por evidência cirúrgica ou radiográfica de pneumatose intestinal, gás hepatobiliar ou peritoneal e é reportada pelos critérios de Bell (≥ 2) nos outros artigos. Todas as hemorragias reportadas foram graus 3 (intraventriculares) e 4 (periventriculares). Os critérios para lesão nasal estão claros apenas em Collins et al.,14 foi usado um escore próprio. Infelizmente, esse estudo não relata os números de lesões em cada grupo, apenas os escores médios, não pode ser comparado aos demais estudos. Em Soonsawad et al.,8 o trauma nasal é definido como qualquer sinal de hiperemia ou ruptura da pele em contato com o dispositivo. A não aplicação de um escore pode levar a importante heterogeneidade.
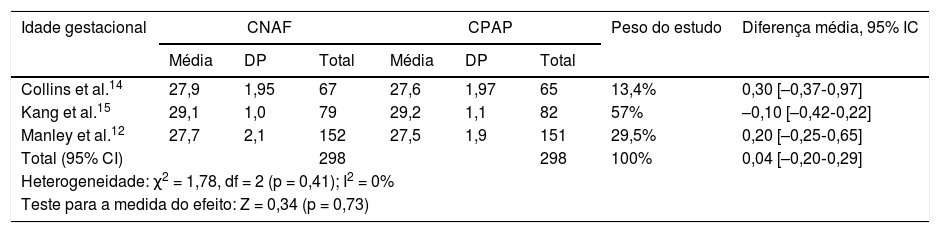
Idade gestacionalConforme demonstrado na tabela 3, não houve diferenças médias significativas nas idades gestacionais pós‐menstruais em 3 estudos, sem heterogeneidade significativa. O estudo Soonsawad et al.8 apresenta os valores das idades em medianas e intervalos interquartis (27,5 semanas, IIQ 26‐30 no grupo CNAF; 28 semanas, IIQ 25‐29,5 no grupo CPAP, p = 0,72), não foi possível a inclusão nessa comparação.
Comparação entre as idades gestacionais dos prematuros no momento da randomização
| Idade gestacional | CNAF | CPAP | Peso do estudo | Diferença média, 95% IC | ||||
|---|---|---|---|---|---|---|---|---|
| Média | DP | Total | Média | DP | Total | |||
| Collins et al.14 | 27,9 | 1,95 | 67 | 27,6 | 1,97 | 65 | 13,4% | 0,30 [–0,37‐0,97] |
| Kang et al.15 | 29,1 | 1,0 | 79 | 29,2 | 1,1 | 82 | 57% | –0,10 [–0,42‐0,22] |
| Manley et al.12 | 27,7 | 2,1 | 152 | 27,5 | 1,9 | 151 | 29,5% | 0,20 [–0,25‐0,65] |
| Total (95% CI) | 298 | 298 | 100% | 0,04 [–0,20‐0,29] | ||||
| Heterogeneidade: χ2 = 1,78, df = 2 (p = 0,41); I2 = 0% | ||||||||
| Teste para a medida do efeito: Z = 0,34 (p = 0,73) | ||||||||
CI, intervalo de confiança; CNAF, cânula nasal de alto fluxo; CPAP, pressão positiva contínua de vias aéreas; DP, desvio‐padrão.
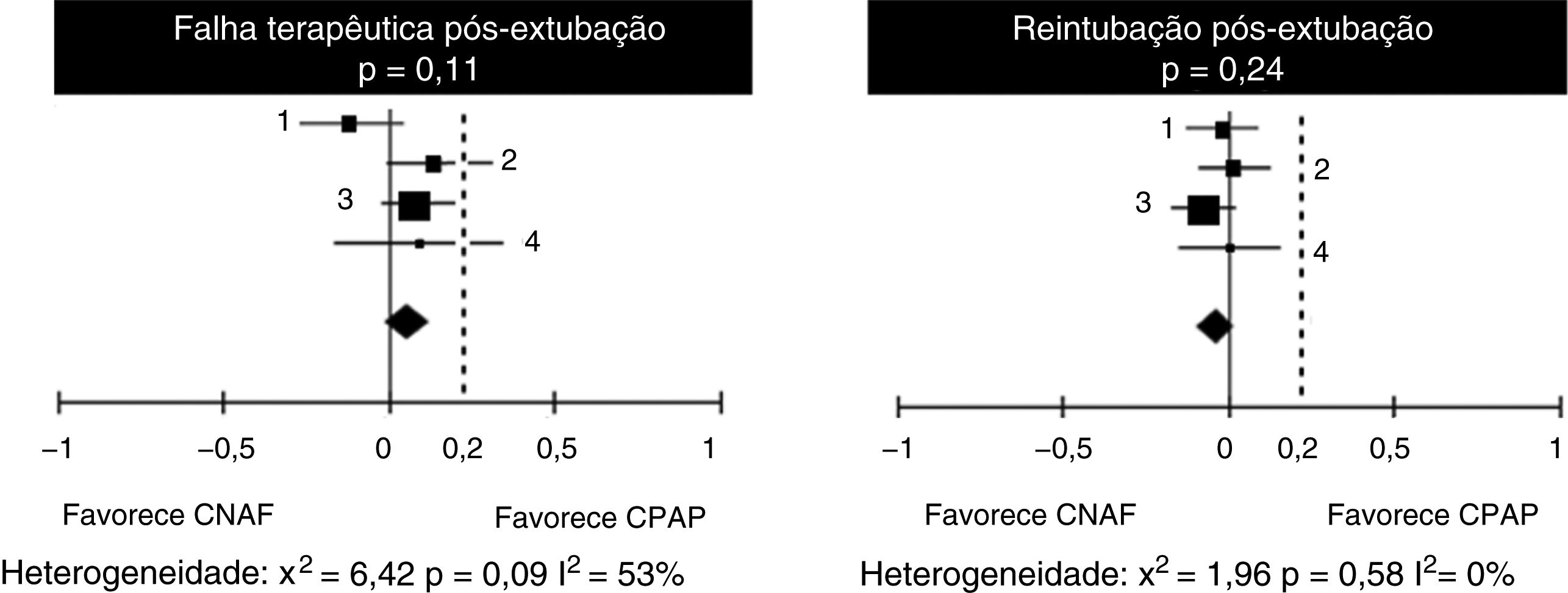
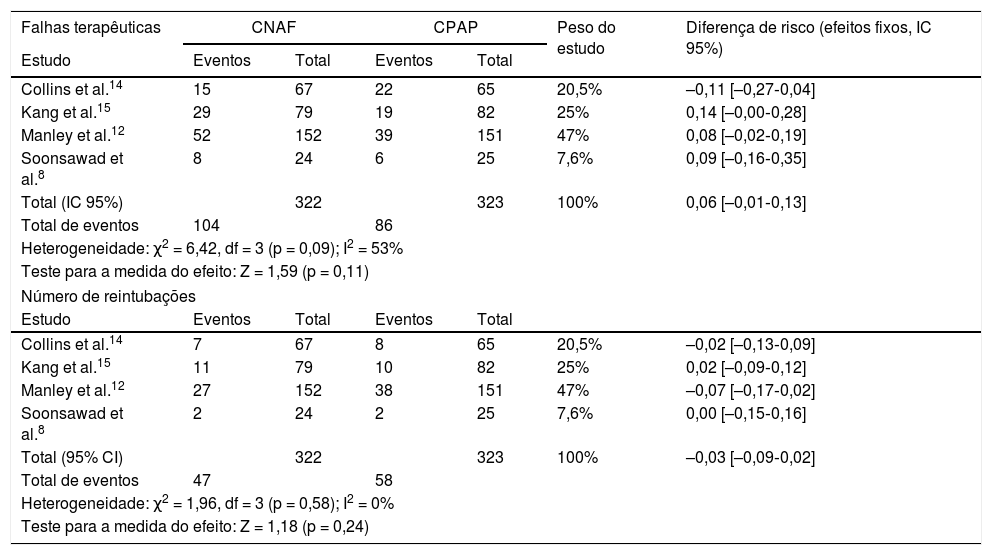
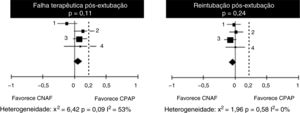
Em relação às falhas de tratamento, observa‐se na análise dos quatro estudos uma heterogeneidade substancial, ainda que não significativa (tabela 4). Ao analisar as taxas de reintubação, no entanto, a heterogeneidade desaparece. Não há diferença significativa entre o número de falhas nos pacientes que receberam CNAF ou CPAP, com diferença de risco de 9% (IC 95%, ‐1 a 13%) em favor do CPAP (p = 0,11). No entanto, em dois estudos (Kang et al.15 e Soonsawad et al.8) o limite superior do intervalo de confiança de 95% ultrapassa os 20% estabelecidos como parâmetro para não inferioridade (28% e 35%, respectivamente). Para o número de reintubações, a diferença de risco é de ‐3% a favor da CNAF (IC 95%, ‐9 a 2%, p = 0,24, fig. 2).
Diferenças de risco para falhas terapêuticas e número de reintubações após a extubação, pelo Mantel‐Haenszel. Valores negativos favorecem o CNAF e valores positivos demonstram superioridade do CPAP
| Falhas terapêuticas | CNAF | CPAP | Peso do estudo | Diferença de risco (efeitos fixos, IC 95%) | ||
|---|---|---|---|---|---|---|
| Estudo | Eventos | Total | Eventos | Total | ||
| Collins et al.14 | 15 | 67 | 22 | 65 | 20,5% | –0,11 [–0,27‐0,04] |
| Kang et al.15 | 29 | 79 | 19 | 82 | 25% | 0,14 [–0,00‐0,28] |
| Manley et al.12 | 52 | 152 | 39 | 151 | 47% | 0,08 [–0,02‐0,19] |
| Soonsawad et al.8 | 8 | 24 | 6 | 25 | 7,6% | 0,09 [–0,16‐0,35] |
| Total (IC 95%) | 322 | 323 | 100% | 0,06 [–0,01‐0,13] | ||
| Total de eventos | 104 | 86 | ||||
| Heterogeneidade: χ2 = 6,42, df = 3 (p = 0,09); I2 = 53% | ||||||
| Teste para a medida do efeito: Z = 1,59 (p = 0,11) | ||||||
| Número de reintubações | ||||||
| Estudo | Eventos | Total | Eventos | Total | ||
| Collins et al.14 | 7 | 67 | 8 | 65 | 20,5% | –0,02 [–0,13‐0,09] |
| Kang et al.15 | 11 | 79 | 10 | 82 | 25% | 0,02 [–0,09‐0,12] |
| Manley et al.12 | 27 | 152 | 38 | 151 | 47% | –0,07 [–0,17‐0,02] |
| Soonsawad et al.8 | 2 | 24 | 2 | 25 | 7,6% | 0,00 [–0,15‐0,16] |
| Total (95% CI) | 322 | 323 | 100% | –0,03 [–0,09‐0,02] | ||
| Total de eventos | 47 | 58 | ||||
| Heterogeneidade: χ2 = 1,96, df = 3 (p = 0,58); I2 = 0% | ||||||
| Teste para a medida do efeito: Z = 1,18 (p = 0,24) | ||||||
CI, intervalo de confiança; CNAF, cânula nasal de alto fluxo; CPAP, pressão positiva contínua de vias aéreas.
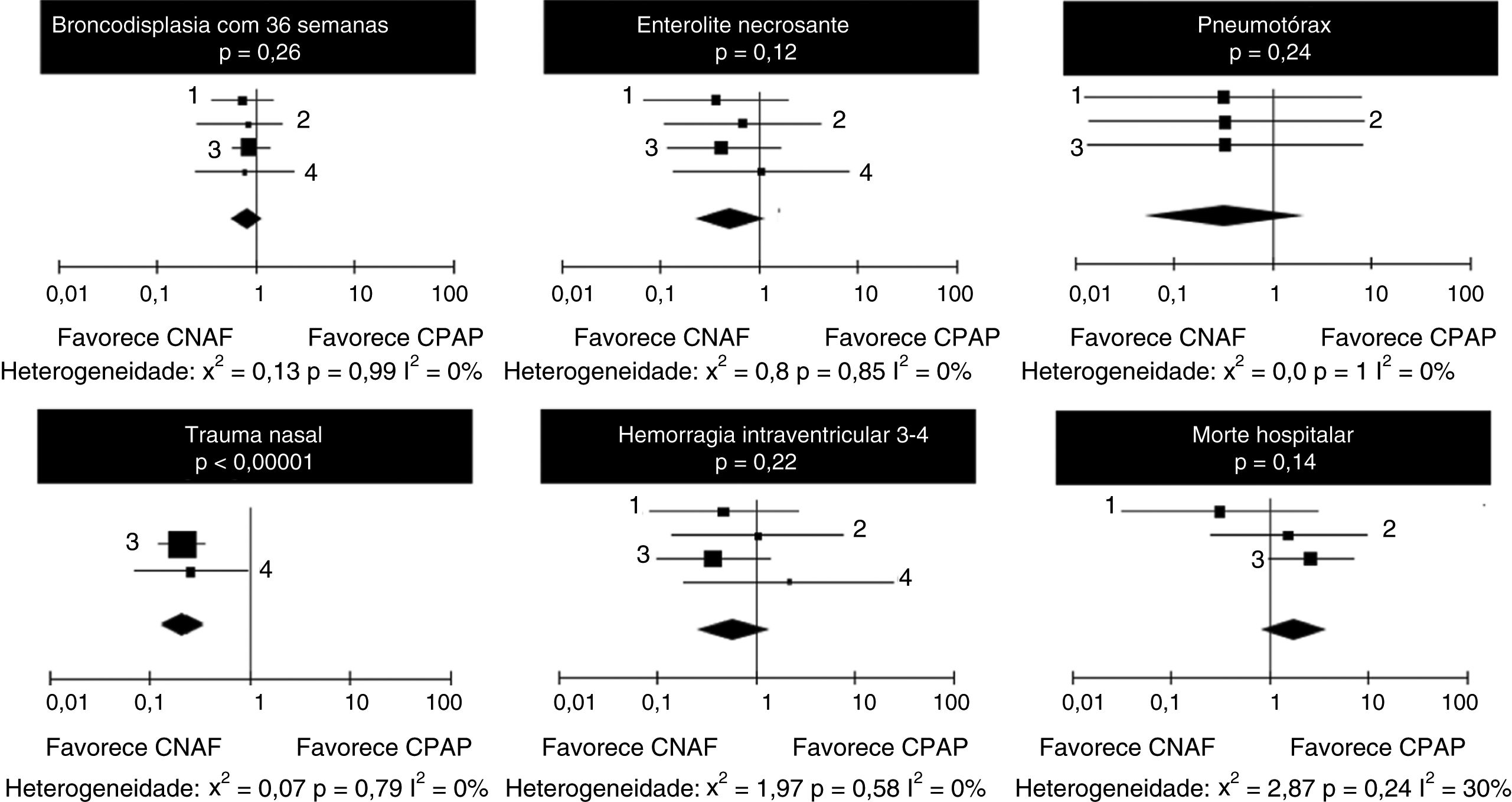
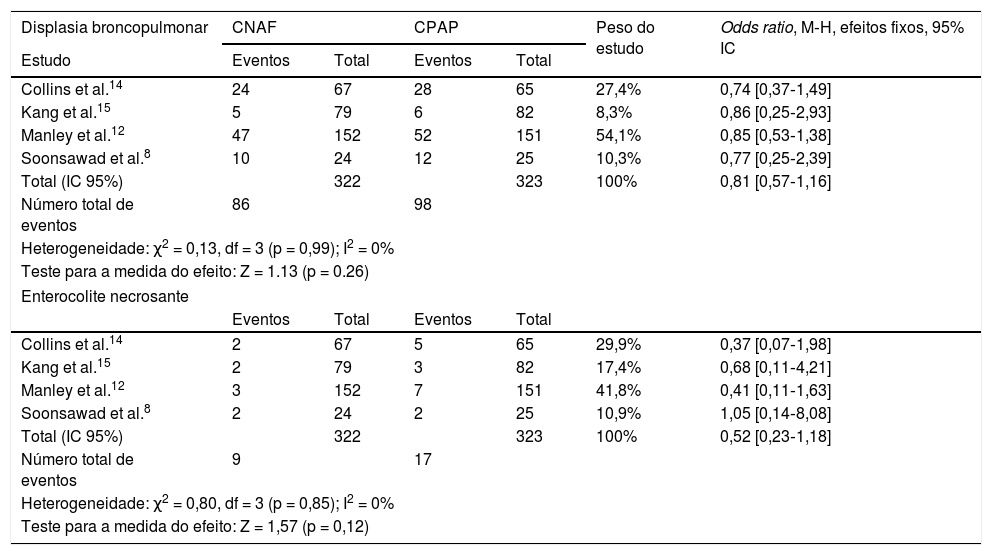
Em relação à ocorrência de displasia broncopulmonar e enterocolite necrosante, não se observou heterogeneidade entre os quatro estudos e as chances de ocorrência dos eventos foram semelhantes nos grupos que receberam CNAF ou CPAP (tabela 5).
Odds ratios para ocorrências de displasia broncopulmonar e enterocolite necrosante
| Displasia broncopulmonar | CNAF | CPAP | Peso do estudo | Odds ratio, M‐H, efeitos fixos, 95% IC | ||
|---|---|---|---|---|---|---|
| Estudo | Eventos | Total | Eventos | Total | ||
| Collins et al.14 | 24 | 67 | 28 | 65 | 27,4% | 0,74 [0,37‐1,49] |
| Kang et al.15 | 5 | 79 | 6 | 82 | 8,3% | 0,86 [0,25‐2,93] |
| Manley et al.12 | 47 | 152 | 52 | 151 | 54,1% | 0,85 [0,53‐1,38] |
| Soonsawad et al.8 | 10 | 24 | 12 | 25 | 10,3% | 0,77 [0,25‐2,39] |
| Total (IC 95%) | 322 | 323 | 100% | 0,81 [0,57‐1,16] | ||
| Número total de eventos | 86 | 98 | ||||
| Heterogeneidade: χ2 = 0,13, df = 3 (p = 0,99); I2 = 0% | ||||||
| Teste para a medida do efeito: Z = 1.13 (p = 0.26) | ||||||
| Enterocolite necrosante | ||||||
| Eventos | Total | Eventos | Total | |||
| Collins et al.14 | 2 | 67 | 5 | 65 | 29,9% | 0,37 [0,07‐1,98] |
| Kang et al.15 | 2 | 79 | 3 | 82 | 17,4% | 0,68 [0,11‐4,21] |
| Manley et al.12 | 3 | 152 | 7 | 151 | 41,8% | 0,41 [0,11‐1,63] |
| Soonsawad et al.8 | 2 | 24 | 2 | 25 | 10,9% | 1,05 [0,14‐8,08] |
| Total (IC 95%) | 322 | 323 | 100% | 0,52 [0,23‐1,18] | ||
| Número total de eventos | 9 | 17 | ||||
| Heterogeneidade: χ2 = 0,80, df = 3 (p = 0,85); I2 = 0% | ||||||
| Teste para a medida do efeito: Z = 1,57 (p = 0,12) | ||||||
CI, intervalo de confiança; CNAF, cânula nasal de alto fluxo; CPAP, pressão positiva contínua de vias aéreas.
Valores de OR < 1 favorecem CNAF e > 1 o CPAP.
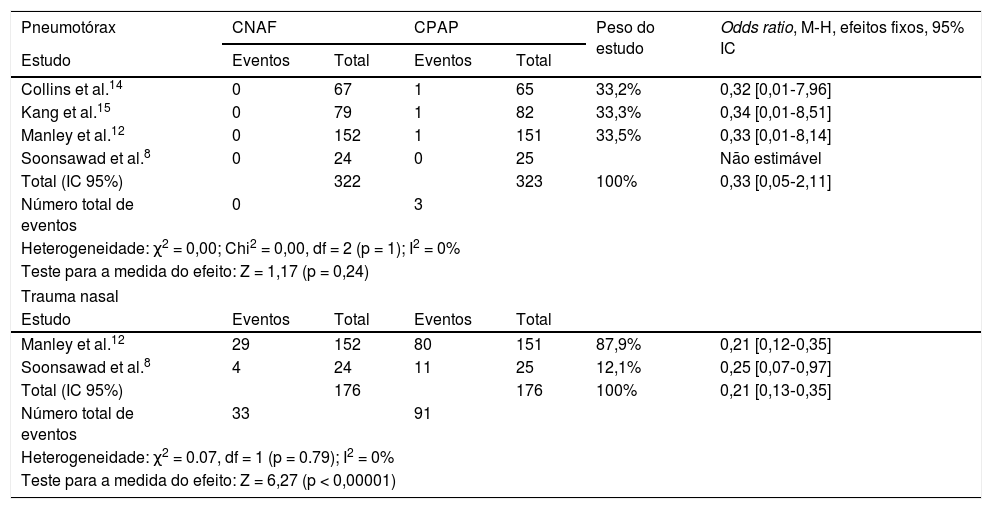
A ocorrência de pneumotórax após a extubação foi pequena em todos os estudos, não houve heterogeneidade ou diferença entre CPAP e CNAF (tabela 6). Quanto à ocorrência de trauma nasal em números absolutos, foi substancialmente maior nos pacientes que receberam CPAP (51,7%) do que nos que receberam CNAF (18,7%), p < 0,0001. Ressaltamos que foi possível fazer a comparação em apenas dois estudos.
Odds ratios para pneumotórax e trauma nasal
| Pneumotórax | CNAF | CPAP | Peso do estudo | Odds ratio, M‐H, efeitos fixos, 95% IC | ||
|---|---|---|---|---|---|---|
| Estudo | Eventos | Total | Eventos | Total | ||
| Collins et al.14 | 0 | 67 | 1 | 65 | 33,2% | 0,32 [0,01‐7,96] |
| Kang et al.15 | 0 | 79 | 1 | 82 | 33,3% | 0,34 [0,01‐8,51] |
| Manley et al.12 | 0 | 152 | 1 | 151 | 33,5% | 0,33 [0,01‐8,14] |
| Soonsawad et al.8 | 0 | 24 | 0 | 25 | Não estimável | |
| Total (IC 95%) | 322 | 323 | 100% | 0,33 [0,05‐2,11] | ||
| Número total de eventos | 0 | 3 | ||||
| Heterogeneidade: χ2 = 0,00; Chi2 = 0,00, df = 2 (p = 1); I2 = 0% | ||||||
| Teste para a medida do efeito: Z = 1,17 (p = 0,24) | ||||||
| Trauma nasal | ||||||
| Estudo | Eventos | Total | Eventos | Total | ||
| Manley et al.12 | 29 | 152 | 80 | 151 | 87,9% | 0,21 [0,12‐0,35] |
| Soonsawad et al.8 | 4 | 24 | 11 | 25 | 12,1% | 0,25 [0,07‐0,97] |
| Total (IC 95%) | 176 | 176 | 100% | 0,21 [0,13‐0,35] | ||
| Número total de eventos | 33 | 91 | ||||
| Heterogeneidade: χ2 = 0.07, df = 1 (p = 0.79); I2 = 0% | ||||||
| Teste para a medida do efeito: Z = 6,27 (p < 0,00001) | ||||||
CI, intervalo de confiança; CNAF, cânula nasal de alto fluxo; CPAP, pressão positiva contínua de vias aéreas.
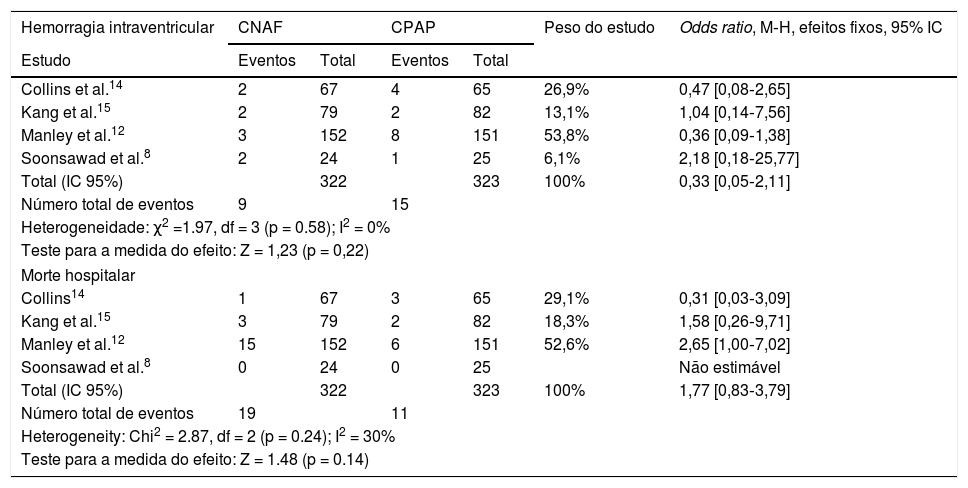
Não houve heterogeneidade significativa ou diferenças entre as chances de ocorrência de hemorragia intraventricular e mortes hospitalares nos pacientes que receberam CNAF ou CPAP (tabela 7). As odds ratios estão dispostas em forma gráfica na figura 3.
Odds ratios para hemorragia intraventricular e morte hospitalar
| Hemorragia intraventricular | CNAF | CPAP | Peso do estudo | Odds ratio, M‐H, efeitos fixos, 95% IC | ||
|---|---|---|---|---|---|---|
| Estudo | Eventos | Total | Eventos | Total | ||
| Collins et al.14 | 2 | 67 | 4 | 65 | 26,9% | 0,47 [0,08‐2,65] |
| Kang et al.15 | 2 | 79 | 2 | 82 | 13,1% | 1,04 [0,14‐7,56] |
| Manley et al.12 | 3 | 152 | 8 | 151 | 53,8% | 0,36 [0,09‐1,38] |
| Soonsawad et al.8 | 2 | 24 | 1 | 25 | 6,1% | 2,18 [0,18‐25,77] |
| Total (IC 95%) | 322 | 323 | 100% | 0,33 [0,05‐2,11] | ||
| Número total de eventos | 9 | 15 | ||||
| Heterogeneidade: χ2 =1.97, df = 3 (p = 0.58); I2 = 0% | ||||||
| Teste para a medida do efeito: Z = 1,23 (p = 0,22) | ||||||
| Morte hospitalar | ||||||
| Collins14 | 1 | 67 | 3 | 65 | 29,1% | 0,31 [0,03‐3,09] |
| Kang et al.15 | 3 | 79 | 2 | 82 | 18,3% | 1,58 [0,26‐9,71] |
| Manley et al.12 | 15 | 152 | 6 | 151 | 52,6% | 2,65 [1,00‐7,02] |
| Soonsawad et al.8 | 0 | 24 | 0 | 25 | Não estimável | |
| Total (IC 95%) | 322 | 323 | 100% | 1,77 [0,83‐3,79] | ||
| Número total de eventos | 19 | 11 | ||||
| Heterogeneity: Chi2 = 2.87, df = 2 (p = 0.24); I2 = 30% | ||||||
| Teste para a medida do efeito: Z = 1.48 (p = 0.14) | ||||||
CI, intervalo de confiança; CNAF, cânula nasal de alto fluxo; CPAP, pressão positiva contínua de vias aéreas; M-H, Mantel-Haenszel.
Não houve mortes e ocorrência de pneumotórax no estudo de Soonsawad.8 Apenas Manley12 e Soonsawad8 relataram trauma nasal de forma comparável.
DiscussãoO uso da CNAF tem se difundido nas unidades de terapia intensiva neonatais. Entre as possibilidades de uso está o suporte respiratório após extubação traqueal em pacientes recém‐nascidos prematuros. Entre os estudos selecionados para esta revisão, destacam‐se as metanálises. Esta revisão identificou quatro estudos controlados e randomizados de desenho bastante similar, foi possível analisar desfechos de interesse entre as duas intervenções feitas.
Nossa revisão demonstra que a CNAF tem desempenho não inferior ao CPAP em pacientes RN prematuros submetidos à extubação. Apesar de ainda haver divergências sobre a eficácia da CNAF sobre o CPAP, como demonstrou o estudo prospectivo de Konda et al.6 Eles relataram que “embora seja uma modalidade com menor incidência de trauma nasal, a CNAF não parece ser tão efetiva quanto o CPAP no manejo de prematuros com desconforto respiratório”.
Contudo, não foi possível análise de subgrupos, por exemplo, de crianças com idades gestacionais inferiores a 27 semanas, que foi a média observada nos estudos. Portanto, esta metanálise, e os estudos aqui analisados, não respondem à questão sobre qual é a menor idade gestacional segura para usar o método.
Manley et al.12 sugeriram precaução ao usar o método em prematuros extremos, com idades inferiores a 26 semanas, porque o estudo não teve poder para avaliar eficácia nesse subgrupo. Em Kang et al.15 foi feita análise de subgrupos em RN com idades gestacionais entre 26 e 28 semanas + 6 dias e foram comparados com RN com idades gestacionais entre 29 e 31 semanas + 6 dias. O grupo de RN mais prematuro apresentou significativamente maior percentual de falhas terapêuticas (45 vs. 30%, p = 0,03).
Ferguson et al.9 analisaram 867 pacientes incluídos nos estudos e concluíram que “os prematuros devem ser extubados com transição para suporte respiratório não invasivo, na análise agrupada não houve diferença entre CNAF e CPAP na falha do tratamento no prazo de 7 dias”. Zong‐Tai et al.16 analisaram 1.040 pacientes entre os estudos e concluíram que “a CNAF é segura e eficaz na prevenção de falha de extubação em recém‐nascidos”. Daish et al.17 analisaram 726 pacientes entre os estudos e concluíram que “não há diferença significativa na taxa de falha de extubação em neonatos extubados para CNAF em comparação com aqueles extubados para CPAP”.
Outro aspecto a se destacar na possibilidade de uso da CNAF é o menor risco de lesões nasais em pacientes submetidos a esse suporte respiratório comparativamente ao uso do CPAP.18 Em Collins,14 Manley12 e Soonsawad,8 o uso da CNAF foi associado a importante redução do risco de trauma nasal. A lesão à mucosa nasal pode ser uma causa de sepse não explicada em prematuros.19 É importante notar que a não aplicação de um escore pode levar a importante heterogeneidade.
Em todos os estudos, nos casos de falha terapêutica na CNAF, foi permitido que os RN recebessem outro tipo de suporte respiratório não invasivo como o CPAP. Em Manley,12 o CPAP com frequência não sincronizada evitou a reintubação em quase metade dos RN que falharam em CNAF. Esse retorno ao CPAP pode ter influenciado alguns dos desfechos secundários do grupo que usou a CNAF. Em Konda et al.,6 apesar de um maior número de casos com falha terapêutica no grupo que usou CNAF, o número de reintubações foi igual entre os dois grupos. Não houve um número significativo de casos com o CPAP versus “ventilação com pressão positiva intermitente nasal” (NIPPV) para se efetuar uma comparação.
Não há evidências suficientes sobre se o uso da CNAF não aumenta o tempo de oferta de oxigênio ao prematuro e consequentemente seja responsável por aumento no número de casos de displasia broncopulmonar e maior tempo de internação.20 Como é inerente a essa população, houve um grande número de casos de displasia broncopulmonar (28,5%), sem que a metanálise tenha detectado heterogeneidade e diferenças nas oddsratios. Podemos, então, afirmar que não há diferenças de risco para essa condição entre a CNAF e o CPAP e o mesmo pode ser entendido sobre o risco de reintubação e morte hospitalar. Para eventos como enterocolite necrosante, hemorragia intraventricular e pneumotórax, a ocorrência de poucos casos pode comprometer o poder de análise, mas não há aparentemente diferença nos riscos. Através dos dados de metanálise, podemos considerar a CNAF como uma modalidade de suporte respiratório segura e não relacionada a aumento de casos de displasia broncopulmonar.
Com os quatro estudos incluídos na metanálise para o desfecho primário, tivemos 645 pacientes e as diferenças de risco mostraram que a CNAF não foi inferior ao CPAP no suporte respiratório pós‐extubação em prematuros com menos de 32 semanas. O limite superior de 13% da diferença, observado na análise conjunta, parece razoável para afirmar a eficácia do método em relação ao CPAP.
Temos ainda poucos estudos de qualidade sobre o assunto, o que abre uma possibilidade para estudos controlados randomizados multicêntricos que possam melhor determinar a eficácia da CNAF em relação a outras formas de suporte respiratório não invasivo.
Esta revisão tem como limitação o reduzido número de estudos controlados randomizados disponíveis para análise. Os estudos eram metodologicamente adequados, embora a não ocultação da alocação não pudesse ser verificada em um dos estudos usado na metanálise (Kang et al.15). Os possíveis vieses observados, como por exemplo a falta de critérios para reintubação, deixada a critério dos médicos assistentes, pode ter levado a diferenças não identificadas entre os grupos, mas reflete a prática clínica diária nas unidades de terapia intensiva neonatais.
Como pontos fortes, podemos destacar a avaliação quase uniforme dos desfechos primários e secundários e o uso de métodos semelhantes para a entrega da mistura gasosa em cânulas de alto‐fluxo, com aparelhos mais modernos. Em Manley,12 Soonsawad8 e Kang15 foram usados equipamentos Fisher & Paykel® e em Collins14 foi usado Vapotherm®. Não houve evidências de que um modelo comercial seja superior a outro.
ConclusãoA CNAF não é inferior ao CPAP para o suporte respiratório após a extubação de recém‐nascidos prematuros com idade gestacional igual a ou menor do que 32 semanas e apresenta taxas semelhantes de reintubação, embora o uso deva ser cauteloso em prematuros extremos com idade gestacional inferior a 26 semanas, não é possível ainda determinar a eficácia nessa faixa etária. O risco menor de trauma nasal deve ser levado em consideração ao se escolher entre as terapias. O uso da CNAF parece ser seguro e eficiente. Estudos multicêntricos, com diversas faixas gestacionais, são necessários.
Conflitos de interesseOs autores declaram não haver conflitos de interesse.
Como citar este artigo: Colleti Junior J, Azevedo R, Araujo O, Carvalho WB. High‐flow nasal cannula as a post‐extubation respiratory support strategy in preterm infants: a systematic review and meta‐analysis. J Pediatr (Rio J). 2020;96:422–31.
Estudo feito no Hospital Santa Catarina, São Paulo, SP, Brasil.