This study examined the growth status and physical development of Brazilian children with autism spectrum disorders from 4 to 15 years of age. Furthermore, it was examined whether variation in growth patterns and weight status was influenced by the use of psychotropic medications.
MethodsOne‐hundred and twenty children aged 3.6–12.1 years at baseline (average=7.2 years, SD=2.3 years) diagnosed with autism spectrum disorders were measured on three repeated occasions across a 4‐year period. Stature, body mass, and body mass index were considered. Bayesian multilevel modeling was used to describe the individual growth patterns.
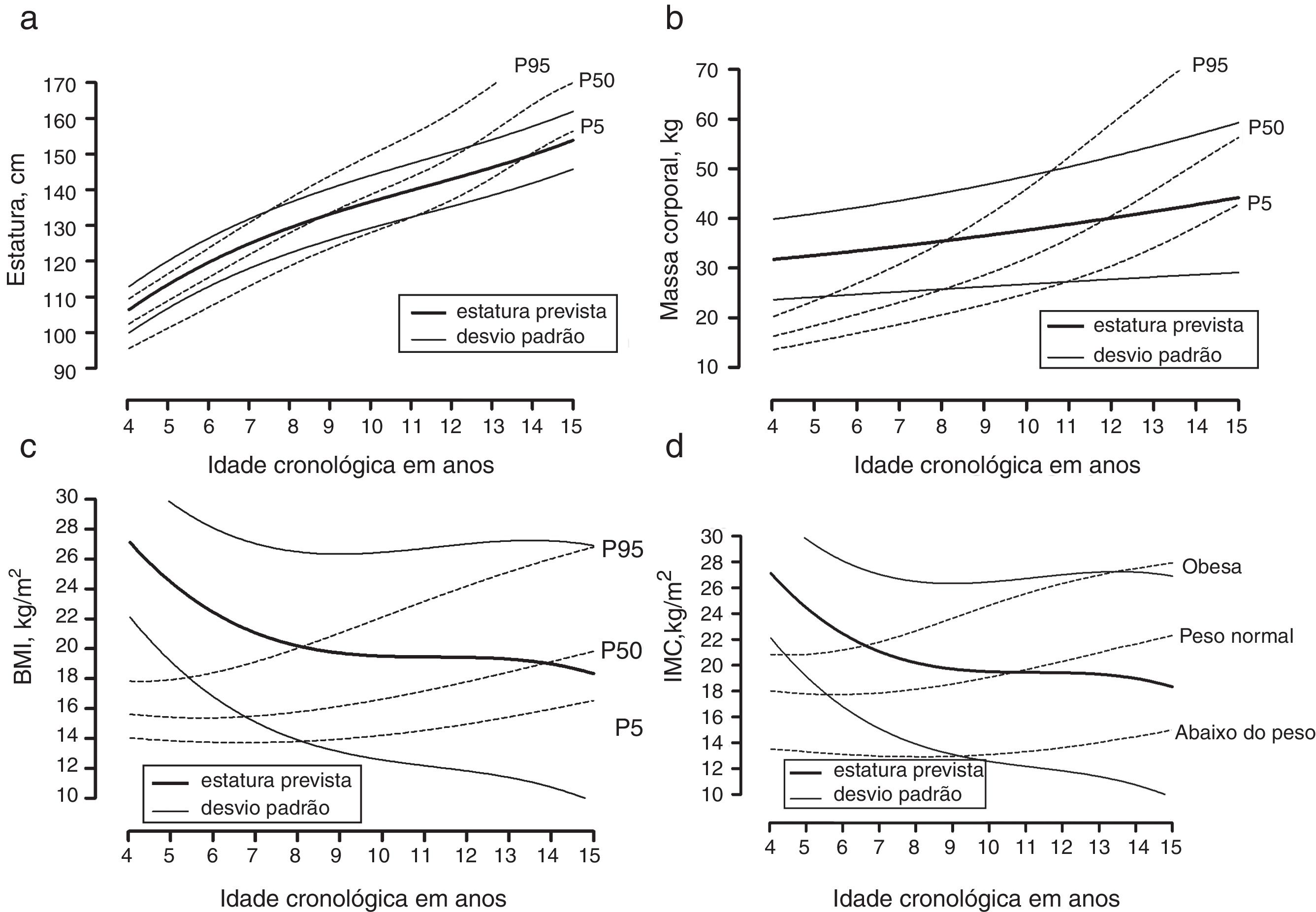
ResultsGrowth in stature was comparable to the age‐specific 50th percentile for Centers for Disease Control and Prevention reference data until approximately 8 years, but a substantial decrease in growth rate was observed thereafter, reaching the age‐specific 5th percentile at 15 years of age. Both body mass and body mass index values were, on average, higher than both the Brazilian and Centers for Disease Control and Prevention age‐specific 95th percentile reference until 8 years, but below the 50th specific‐age percentile at the age of 15 years.
ConclusionsBrazilian boys with autism spectrum disorders between 4 and 15 years appear to have impaired growth in stature after 8–9 years of age, likely impacting pubertal growth. A high prevalence of overweight and obesity was observed in early childhood, although a trend of substantial decrease in body mass and body mass index was apparent when children with autism spectrum disorders entered the years of pubertal development.
Este estudo examinou o estado de crescimento e o desenvolvimento físico de crianças brasileiras com transtornos do espectro autista entre 4 e 15 anos. Adicionalmente, examinamos se a variação nos padrões de crescimento e na massa corporal foi influenciada pelo uso de medicamentos psicotrópicos.
Métodos120 crianças com idades entre 3,6 e 12,1 anos no início do estudo (média = 7,2 anos, DP = 2,3 anos) diagnosticadas com transtornos do espectro autista foram avaliadas em três ocasiões repetidas em um período de 4 anos. Foram considerados estatura, massa corporal e índice de massa corporal. O modelo multinível bayesiano foi utilizado para descrever os padrões de crescimento individual.
ResultadosO crescimento em estatura foi comparável ao percentil 50 específico para a idade para os dados de referência do Centro de Controle e Prevenção de Doenças dos Estados Unidos até cerca de 8 anos. Porém, foi observada uma redução substancial na taxa de crescimento depois dos 8 anos, atingindo o percentil 5 específico para a idade aos 15 anos de idade. Tanto os valores de massa corporal quanto de índice de massa corporal foram, em média, maiores comparativamente ao percentil 95 específico para a idade até aos 8 anos da referência brasileira e do Centro de Controle e Prevenção de Doenças dos Estados Unidos, porém abaixo do percentil 50 específico para a idade aos 15 anos de idade.
ConclusõesOs meninos brasileiros com transtornos do espectro autista entre 4 e 15 anos parecem ter retardo do crescimento na estatura após os 8–9 anos, provavelmente afeta o crescimento púbere. Foi observada uma alta prevalência de sobrepeso e obesidade na primeira infância, apesar de uma tendência de redução substancial na massa corporal e no índice de massa corporal ter sido aparente quando as crianças com transtornos do espectro autista entraram nos anos de desenvolvimento púbere.
O transtorno do espectro do autismo (TEA) é um grupo de condições heterogêneas de neurodesenvolvimento, caracterizado pelo comprometimento precoce nas habilidades sociais, comunicação social e comportamentos restritos e repetitivos.1 A prevalência mundial do TEA é de cerca de 1%; contudo, os relatos da população revelaram um aumento consistente e significativo na prevalência do TEA. Essas alterações poderão ser explicadas por avanços nos conceitos e critérios de diagnóstico e maior conscientização e reconhecimento do TEA.1 No Brasil, a prevalência do TEA em crianças em idade escolar é de quase 0,3%.2
As crianças com TEA provavelmente apresentam um risco mais elevado de desenvolver obesidade e doenças metabólicas relacionadas à obesidade.3 Estima‐se que cerca de 30% das crianças com TEA eram obesas, em comparação com aproximadamente 24% das crianças sem TEA.4 Dados recentes mostram uma prevalência de 42,4% para sobrepeso e 21,4% para obesidade em crianças com TEA, em comparação com 26,1% para sobrepeso e 12,0% para obesidade em crianças da mesma idade.5
A presença de comportamentos restritivos e repetitivos em crianças e adolescentes com TEA pode afetar o desenvolvimento das habilidades motoras e os níveis de aptidão física, levar a baixo nível de atividade física diária.6 Consequentemente, isso leva a uma alta incidência de sobrepeso/obesidade e complicações associadas.4
Outras influências na massa e na composição corporal associadas ao TEA incluem seletividade alimentar,4 transtornos gastrointestinais,7 problemas de sono8 e medicação psicotrópica.9 Assim, devem ser consideradas as possíveis implicações para o crescimento de curto prazo e longo prazo das crianças.10
Cerca de 30% a 60% das crianças com TEA tomam medicamento psicotrópico prescrito para tratar as anormalidades comportamentais.4 O uso de antipsicóticos é acompanhado por alguns efeitos metabólicos adversos secundários, como aumento da massa corporal e efeitos colaterais metabólicos.11 Contudo, há poucos relatos disponíveis com pacientes com TEA, com base em observações transversais e em grande parte inconclusivas.
Tem havido um interesse de longa data em estudos de crescimento e situação do peso em crianças e adolescentes com TEA.12,13 Apesar de a base de dados sobre o estado físico e as possíveis preocupações de crescimento das crianças com TEA continuarem limitadas, contraditórias e inconclusivas10 e a maior parte delas ter como base observações transversais. Assim, são necessárias pesquisas para avaliar totalmente o estado físico e as possíveis preocupações de crescimento de crianças com TEA.10 No presente estudo, adotamos uma abordagem longitudinal mista para examinar os padrões de crescimento e a situação do peso de crianças com TEA entre quatro e 15 anos. Adicionalmente, examinamos se a variação nos padrões de crescimento e na situação do peso foi influenciada pelo uso de medicamentos psicotrópicos.
MétodosModelo do estudo e participantesEste estudo usou um modelo longitudinal misto com base em três medições repetidas em um período de quatro anos. A primeira medição foi em março de 2014, a segunda em março de 2015 e a terceira em fevereiro de 2017. Os meninos com TEA entre 3,6 e 12,1 anos no início do estudo (média=7,2 anos, desvio‐padrão=2,3 anos) se ofereceram para participar deste estudo (n=120). Os participantes foram recrutados de um centro pediátrico especializado para populações com TEA em Maceió, Alagoas (Brasil). Todos os participantes e suas famílias receberam informações sobre o estudo e assinaram um formulário de consentimento informado. O estudo foi feito de acordo com os padrões éticos da Declaração de Helsinque e aprovado pelo Comitê de Ética Humana da Universidade Federal do Alagoas (número de protocolo 1.091.864).
As crianças e os adolescentes eram heterogênicos em termos de características etiológicas (por exemplo, síndrome de Asperger, autismo ou transtorno do desenvolvimento sem especificação) e uso de medicação psicotrópica. Em todos os casos, o diagnóstico de um TEA foi confirmado por um psiquiatra experiente, com base nos critérios da classificação DSM‐IV.14 As informações sobre a medicação psicotrópica (antiepilépticos, antipsicóticos, antidepressivos e estimulantes) usada pelos participantes foram obtidas dos prontuários médicos. Contudo, não estava disponível o acesso às proporções das doses de medicação prescritas às crianças.
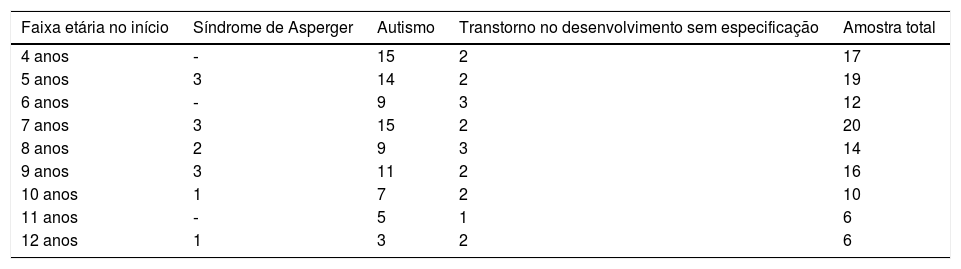
Foram classificadas 13 crianças com síndrome de Asperger, 88 com autismo e 19 com transtorno de desenvolvimento sem especificação. Com relação à prescrição dos medicamentos, 44 não estavam com prescrição de medicamentos durante o período de observação; dez foram medicadas com antipsicóticos (inclusive risperidona e periciazina); 49 foram medicadas com antipsicóticos combinados com outros medicamentos estimulantes (metilfenidato), antidepressivos (inclusive nortriptilina e fluoxetina) e/ou antiepilépticos (inclusive Carbamazepina, fenobarbital e clonazepam); 17 foram medicadas com estimulantes, antidepressivos e/ou antiepilépticos, porém não com antipsicóticos.
ProcedimentosA idade cronológica foi calculada com aproximação de 0,1 ano como data de nascimento menos a data do teste. A estatura e a massa corporal foram medidas por um único observador experiente. A estatura foi medida com um estadiômetro portátil (modelo 206 Seca, Hanover, MD, EUA) com aproximação de 0,1cm. A massa corporal foi medida com uma balança portátil calibrada (modelo 770 Seca, Hanover, MD, EUA) com aproximação de 0,1kg. O índice de massa corporal (IM) foi calculado como massa corporal (kg) pela estatura ao quadrado (m2). Os dados específicos para a idade de referência para a população americana foram usados para comparar os dados de estatura, massa corporal e situação do peso com base em valores de ponto de corte do IMC específicos para os dados de referência,15,16 bem como os valores de ponto de corte do IMC específicos para a população brasileira.17
Análise estatísticaModelo bayesianoOs métodos bayesianos tratam os parâmetros como variáveis aleatórias e combinam os dados da amostra e as informações de distribuição a priori para estimar as informações a posteriori. O modelo multinível é uma estrutura flexível e robusta para tratar naturalmente os dados longitudinais não consistentes, como este estudo, ultrapassam as falhas dos métodos frequentistas convencionais (mínimos quadrados ordinários e estimativas de máxima verossimilhança).18
Uma curva para modelo de crescimento polinomial de dois níveis básicos foi inicialmente usada para servir de referência para a estatura, a massa corporal e o IMC com relação à idade cronológica, separadamente (consulte os materiais complementares para obter detalhes sobre o modelo de crescimento polinomial de dois níveis básicos). O modelo descreve as medições sucessivas de cada participante com o passar do tempo, define a mudança do indivíduo em cada ponto de medição e sua variação (nível 1), as diferenças nas trajetórias entre os participantes e sua variação (nível 2). Para captar o crescimento na estatura na infância e no início da puberdade, consideramos pelo menos os coeficientes de crescimento até o cúbico.
A idade cronológica foi centralizada no início das observações médias (4,1 anos). Isso permite que o modelo forneça valores preditivos com informações significativas na abrangência das observações, em especial o termo intercepto. Para examinar a melhor descrição das tendências de crescimento, comparamos os modelos polinomiais e os efeitos nos grupos com o uso do Critério de Informação Amplamente Aplicável (WAIC).18 Após estabelecer as tendências polinomiais de alteração das dimensões corporais, exploramos a variação nas trajetórias entre os participantes expostos a uso de medicação psicotrópica (nível 3; variável binária – nenhuma medicação ou outra medicação não psicotrópica com código 0, uso de medicação psicotrópica com código 1). Exploramos se há variação entre os participantes em todo o grupo (nível 2 e nível 3) em todos os intervalores das observações.
Distribuições a priori nos parâmetrosEm cada uma das variáveis dependentes, ou seja, estatura, massa corporal e IMC, consideramos as priori informativas para o termo intercepto, com base nas estimativas de referência para estatura, massa corporal e IMC para a população americana.15 Consideramos a estimativa do percentil 97 para a massa corporal e o IMC, como uma prevalência de obesidade, a ser esperada em crianças com TEA.3–5,10 Para as estimativas de crescimento polinomial em toda a população, ajustamos as estimativas com o uso das distribuições a priori informativas semanais, priori normal (0, 10). Para os efeitos em todo o grupo, usamos as distribuições informativas semanais, prioris half‐Cauchy (0, 2). Para as correlações dos efeitos em todo o grupo, usamos uma priori LKJ não informativa (1), o que possibilitou que todas as matrizes de correlações fossem igualmente propensas a priori.18,19
Estimativa bayesianaAnalisamos quatro cadeias para 10.000 iterações com um período de aquecimento (warm‐up) de 5.000 iterações para garantir a convergência da cadeia de Markov. A convergência da cadeia de Markov foi avaliada por uma inspeção visual dos valores simulados (trace‐plots). A inspeção visual dos resíduos padronizados em relação aos valores ajustados, valores observados e a variável independente dos valores dos modelos e observados em relação aos valores ajustados foi explorada para determinar a validade dos modelos para descrever os dados. Usamos verificações preditivas a posteriori para confirmar se não omitimos interações relevantes.20 Usamos o WAIC para comparar os modelos e garantir que não ajustamos nossos dados em demasia.18,20
Todos os modelos foram estimados com os métodos bayesianos implantados por meio da simulação de Monte Carlo por meio das Cadeias de Markov (MCMC) e com o uso do método de Monte Carlo Hamiltoniano e sua extensão, No‐U‐Turn Sampler, e da Stan,21 obtida com o pacote BRMS,19 disponível como um pacote na linguagem estatística R.
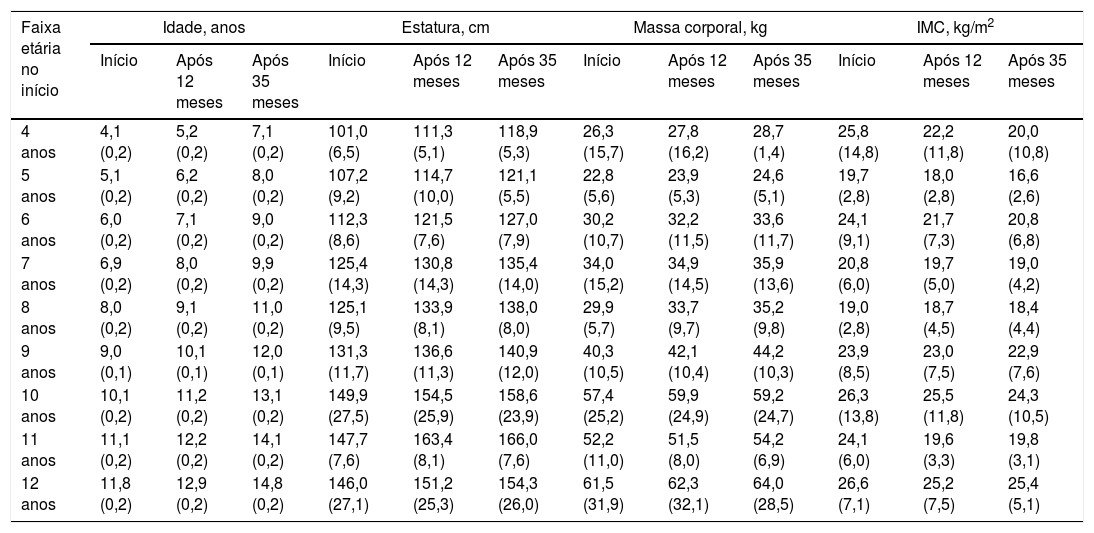
ResultadosAs estimativas descritivas em cada observação em todo o período de 35 meses nas crianças e adolescentes brasileiros com transtornos do espectro autista estão resumidas na tabela 1. Além disso, a distribuição das características etiológicas (síndrome de Asperger, autismo ou transtorno de desenvolvimento sem especificação) da amostra atual no início das observações é apresentada na tabela 2. A análise exploratória das tendências de crescimento mostrou que a estatura e o IMC foram mais bem descritos por um modelo cúbico, ao passo que a massa corporal foi mais bem descrita por um modelo quadrático.
Características da amostra em cada observação em todo o período de 35 meses em crianças e adolescentes com transtornos do espectro autista (as crianças foram agrupadas no início por faixa etária, por exemplo, 4 anos, de 3,5 a 4,4 anos)
| Faixa etária no início | Idade, anos | Estatura, cm | Massa corporal, kg | IMC, kg/m2 | ||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Início | Após 12 meses | Após 35 meses | Início | Após 12 meses | Após 35 meses | Início | Após 12 meses | Após 35 meses | Início | Após 12 meses | Após 35 meses | |
| 4 anos | 4,1 (0,2) | 5,2 (0,2) | 7,1 (0,2) | 101,0 (6,5) | 111,3 (5,1) | 118,9 (5,3) | 26,3 (15,7) | 27,8 (16,2) | 28,7 (1,4) | 25,8 (14,8) | 22,2 (11,8) | 20,0 (10,8) |
| 5 anos | 5,1 (0,2) | 6,2 (0,2) | 8,0 (0,2) | 107,2 (9,2) | 114,7 (10,0) | 121,1 (5,5) | 22,8 (5,6) | 23,9 (5,3) | 24,6 (5,1) | 19,7 (2,8) | 18,0 (2,8) | 16,6 (2,6) |
| 6 anos | 6,0 (0,2) | 7,1 (0,2) | 9,0 (0,2) | 112,3 (8,6) | 121,5 (7,6) | 127,0 (7,9) | 30,2 (10,7) | 32,2 (11,5) | 33,6 (11,7) | 24,1 (9,1) | 21,7 (7,3) | 20,8 (6,8) |
| 7 anos | 6,9 (0,2) | 8,0 (0,2) | 9,9 (0,2) | 125,4 (14,3) | 130,8 (14,3) | 135,4 (14,0) | 34,0 (15,2) | 34,9 (14,5) | 35,9 (13,6) | 20,8 (6,0) | 19,7 (5,0) | 19,0 (4,2) |
| 8 anos | 8,0 (0,2) | 9,1 (0,2) | 11,0 (0,2) | 125,1 (9,5) | 133,9 (8,1) | 138,0 (8,0) | 29,9 (5,7) | 33,7 (9,7) | 35,2 (9,8) | 19,0 (2,8) | 18,7 (4,5) | 18,4 (4,4) |
| 9 anos | 9,0 (0,1) | 10,1 (0,1) | 12,0 (0,1) | 131,3 (11,7) | 136,6 (11,3) | 140,9 (12,0) | 40,3 (10,5) | 42,1 (10,4) | 44,2 (10,3) | 23,9 (8,5) | 23,0 (7,5) | 22,9 (7,6) |
| 10 anos | 10,1 (0,2) | 11,2 (0,2) | 13,1 (0,2) | 149,9 (27,5) | 154,5 (25,9) | 158,6 (23,9) | 57,4 (25,2) | 59,9 (24,9) | 59,2 (24,7) | 26,3 (13,8) | 25,5 (11,8) | 24,3 (10,5) |
| 11 anos | 11,1 (0,2) | 12,2 (0,2) | 14,1 (0,2) | 147,7 (7,6) | 163,4 (8,1) | 166,0 (7,6) | 52,2 (11,0) | 51,5 (8,0) | 54,2 (6,9) | 24,1 (6,0) | 19,6 (3,3) | 19,8 (3,1) |
| 12 anos | 11,8 (0,2) | 12,9 (0,2) | 14,8 (0,2) | 146,0 (27,1) | 151,2 (25,3) | 154,3 (26,0) | 61,5 (31,9) | 62,3 (32,1) | 64,0 (28,5) | 26,6 (7,1) | 25,2 (7,5) | 25,4 (5,1) |
Distribuição das características etiológicas (síndrome de Asperger, autismo ou transtorno de desenvolvimento sem especificação) de crianças e adolescentes com transtornos do espectro autista no início das observações
| Faixa etária no início | Síndrome de Asperger | Autismo | Transtorno no desenvolvimento sem especificação | Amostra total |
|---|---|---|---|---|
| 4 anos | ‐ | 15 | 2 | 17 |
| 5 anos | 3 | 14 | 2 | 19 |
| 6 anos | ‐ | 9 | 3 | 12 |
| 7 anos | 3 | 15 | 2 | 20 |
| 8 anos | 2 | 9 | 3 | 14 |
| 9 anos | 3 | 11 | 2 | 16 |
| 10 anos | 1 | 7 | 2 | 10 |
| 11 anos | ‐ | 5 | 1 | 6 |
| 12 anos | 1 | 3 | 2 | 6 |
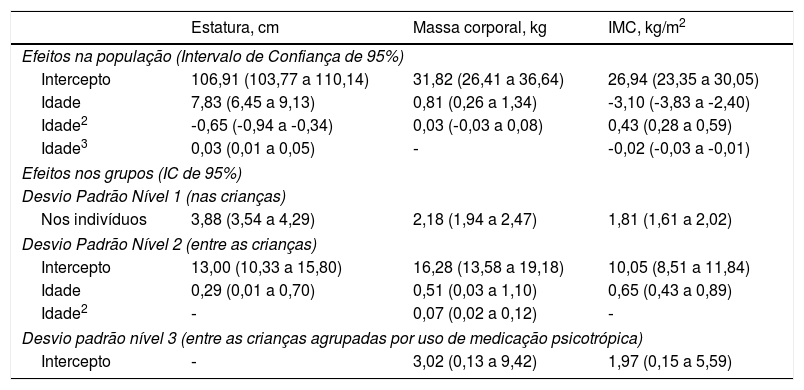
Os resultados do crescimento na estatura, massa corporal e IMC, no modelo multinível bayesiano, entre quatro e 15 anos das crianças e adolescentes com TEA estão resumidos na tabela 3. Os resultados mostraram que as mudanças na massa corporal e no IMC não variam entre as crianças agrupadas por uso de medicação (tabela 3). Esses resultados implicam que a medicação teve influência sobre a massa corporal e o IMC, que foi independente da idade cronológica em toda a gama de observações.
Crescimento em estatura do modelo multinível bayesiano, massa corporal e IMC entre 4 e 15 anos (idade cronológica aos 4,1 anos) de crianças e adolescentes com transtornos do espectro autista (n° de indivíduos=120, n° de observações=360)
| Estatura, cm | Massa corporal, kg | IMC, kg/m2 | |
|---|---|---|---|
| Efeitos na população (Intervalo de Confiança de 95%) | |||
| Intercepto | 106,91 (103,77 a 110,14) | 31,82 (26,41 a 36,64) | 26,94 (23,35 a 30,05) |
| Idade | 7,83 (6,45 a 9,13) | 0,81 (0,26 a 1,34) | ‐3,10 (‐3,83 a ‐2,40) |
| Idade2 | ‐0,65 (‐0,94 a ‐0,34) | 0,03 (‐0,03 a 0,08) | 0,43 (0,28 a 0,59) |
| Idade3 | 0,03 (0,01 a 0,05) | ‐ | ‐0,02 (‐0,03 a ‐0,01) |
| Efeitos nos grupos (IC de 95%) | |||
| Desvio Padrão Nível 1 (nas crianças) | |||
| Nos indivíduos | 3,88 (3,54 a 4,29) | 2,18 (1,94 a 2,47) | 1,81 (1,61 a 2,02) |
| Desvio Padrão Nível 2 (entre as crianças) | |||
| Intercepto | 13,00 (10,33 a 15,80) | 16,28 (13,58 a 19,18) | 10,05 (8,51 a 11,84) |
| Idade | 0,29 (0,01 a 0,70) | 0,51 (0,03 a 1,10) | 0,65 (0,43 a 0,89) |
| Idade2 | ‐ | 0,07 (0,02 a 0,12) | ‐ |
| Desvio padrão nível 3 (entre as crianças agrupadas por uso de medicação psicotrópica) | |||
| Intercepto | ‐ | 3,02 (0,13 a 9,42) | 1,97 (0,15 a 5,59) |
Apesar de crescimento na estatura e no IMC ter sido descrito por modelos cúbicos, foi observada variação substancial correspondente à idade entre crianças com TEA (efeitos no grupo no intercepto) e substancial entre a variação nas crianças para o coeficiente de crescimento linear. Vale observar que, para a massa corporal, o padrão quadrático para os efeitos da população foi adotado considerando a variação substancial no grupo no termo quadrático (entre a variação de trajetória dos indivíduos).
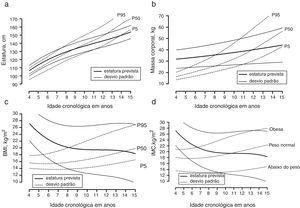
Os meninos brasileiros com TEA apresentaram estaturas e crescimento semelhantes próximo do percentil 50 específico para a idade de acordo com a referência americana até cerca de oito anos. Depois disso, o crescimento na estatura tendeu a se aproximar do percentil 10 específico para a idade até os 15 anos (fig. 1A). Os valores médios de massa corporal e a taxa de crescimento foram maiores do que o percentil 95 específico para a idade de acordo com a referência americana até cerca de oito anos, com uma redução, depois disso, na taxa de crescimento da massa próxima ao percentil 5 específico para a idade aos 15 anos (fig. 1B). Para o IMC, os valores médios foram maiores do que o percentil 95 específico para a idade de acordo com a referência americana até cerca de nove anos, com uma taxa de crescimento no IMC próxima ao percentil 50 específico para a idade aos 15 anos (fig. 1C). Assim, pelo menos até os nove anos as crianças com TEA eram obesas e uma parte substancial continuou acima do peso até os 15 anos. Considerando as referências brasileiras para IMC, foi confirmada a tendência observada para obesidade entre os neonatos com TEA. Contudo, aos nove anos as crianças na amostra atual apresentaram peso normal considerando as referências brasileiras específicas para a idade e uma tendência de redução do IMC mais nítida no início da puberdade, próxima ao percentil 5 específico para a idade aos 15 anos.
Crescimento médio em (a) estatura, (b) massa corporal, (c) índice de massa corporal das crianças e adolescentes com transtornos do espectro autista plotado em percentis de referência para meninos americanos (dados do CDC disponíveis no website http://www.cdc.gov/growthcharts/percentile_data_files.htm) e (d) índice de massa corporal de crianças e adolescentes com transtornos do espectro autista plotado em percentis de referência para meninos brasileiros.
Os principais achados de nossas observações longitudinais foram que a massa corporal e a situação do peso das crianças com TEA foram influenciadas pelo uso de medicação psicotrópica somente ou em associação com estimulantes e/ou antiepilépticos, independentemente da idade. Este estudo também mostrou que as crianças com TEA parecem ter estaturas e taxas de crescimento semelhantes às populações de referência15 até cerca de oito ou nove anos. Após essa idade, houve uma queda nas estaturas e na taxa de crescimento nas crianças com TEA, em comparação com os gráficos de crescimento de referência. Em nosso melhor conhecimento, este é o primeiro estudo que apresenta dados longitudinais para descrever o crescimento físico e a situação do peso de crianças com TEA, considerando a variação na medicação psicotrópica usada.
Os resultados deste estudo mostraram que as crianças com TEA parecem ter estaturas e taxas de crescimento semelhantes às populações de referência15 até cerca de oito ou nove anos. Após essa idade, houve uma queda nas estaturas e na taxa de crescimento nas crianças com TEA, em comparação com os gráficos de crescimento de referência. Nossos resultados são compatíveis com as observações que mostraram uma tendência de atraso no crescimento físico em crianças com TEA.12 As reduções na taxa de crescimento na estatura são próximas ao início da puberdade, afetam o crescimento púbere. Essa possível alteração no crescimento púbere em estatura pode refletir os efeitos de longo prazo da ingestão alimentar comprometida associada a comportamentos típicos das crianças com TEA.10,22 Há um grupo crescente de comprovação transversal que sugere que as crianças com TEA pode correr risco elevado de peso não saudável.3 No presente estudo, os valores de massa corporal e IMC, principalmente entre quatro e oito anos, foram altos em comparação com a referência específica para a idade de crianças normais15,16 e comparáveis com valores de ponto de corte do IMC específicos para a população brasileira.17 Em geral, a prevalência de sobrepeso e obesidade em crianças com TEA pode ser explicada pelos níveis menores de atividade física, atraso nos níveis das habilidades psicomotoras e baixos níveis de aptidão física associados.9 Contudo, após cerca de oito anos de idade, houve uma tendência de redução marcada de crescimento na massa corporal e no IMC, aproximou‐se ao percentil 5 específico para a idade aos 15 anos, ou seja, abaixo do peso para os valores de ponto de corte do IMC específicos para a idade para a população brasileira.17
Apesar de uma tendência inicial de obesidade no início da infância, o crescimento das crianças e adolescentes com TEA pode sofrer atrasos no crescimento físico. Conforme observado acima, isso pode refletir os efeitos de longo prazo da ingestão alimentar comprometida associada a comportamentos típicos da crianças com TEA. Além disso, houve relatos de desregulação hormonal em crianças com TEA em comparação com as crianças pareadas por idade, principalmente nos níveis elevados de leptina, testosterona total e testosterona livre e menor nível de hormônio do crescimento, desacil grelina e grelina acilada.23 Isso sugere que a possível desregulação do mecanismo hormonal pode ser um dos fatores responsáveis pela obesidade e pelos atrasos no crescimento físico. Infelizmente, há poucos dados disponíveis e com base em observações transversais; assim esses resultados reforçam a necessidade de investigação endócrina longitudinal adicional entre crianças e adolescentes com TEA.
Por outro lado, as crianças com TEA geralmente tomam medicamentos psicotrópicos prescritos para tratar anormalidades comportamentais.3,4 O uso de antipsicóticos é acompanhado por alguns efeitos metabólicos adversos secundários, como maior ganho de peso, efeitos colaterais metabólicos e novo início de diabetes mellitus tipo 2.24,25 As observações longitudinais mostraram ganho de peso substancial em pacientes tratados com risperidona, um tratamento medicamentoso antipsicótico.26 As crianças tratadas com risperidona ou quetiapina apresentaram risco mais elevado de desenvolver obesidade, circunferência da cintura elevada e dislipidemia durante os 12 meses de tratamento.27 Essas observações foram confirmadas pelo aumento nos marcadores metabólicos, inclusive glicemia de jejum, insulina de jejum, HOMA‐IR, triglicerídeos, proporção de triglicerídeos/colesterol HDL e proporção total. Juntas, as observações anteriores enfatizam a importância do monitoramento regular para identificação inicial e tratamento dos efeitos colaterais metabólicos e, além disso, o desenvolvimento de outros tratamentos (como exercício) para os sintomas do TEA.28 Nossos resultados mostraram uma influência substancial do uso de medicação psicotrópica somente ou em associação com estimulantes, antidepressivos e/ou antiepilépticos sobre a massa corporal e a situação do peso em crianças brasileiras com TEA. Observamos ainda que essa influência foi independente da idade na faixa observada.
Há limitações em nossa análise que valem ser mencionadas. A análise atual considerou somente meninos com TEA, pois a amostra disponível de meninas foi muito limitada para modelagem. O menor número de meninas com TEA em nossa amostra é compatível com a maior prevalência de TEA em meninos geralmente relatada.29 Usamos as referências americanas para comparar nossos dados. As referências americanas podem ser insuficientemente sensíveis para descrever o crescimento normal de crianças e adolescentes brasileiros, principalmente ao considerar a variabilidade étnica e socioeconômica e suas possíveis implicações sobre o estado de crescimento das crianças e adolescentes. Assim, garante‐se cautela nas interpretações e generalizações dos presentes resultados. Contudo, em nosso melhor conhecimento, não há referência de crescimento na população brasileira. Infelizmente, os padrões de crescimento da Organização Mundial de Saúde, que incluem uma subamostra da Região Sul do Brasil, não fornecem referências de massa corporal para a faixa etária de nosso estudo.30
Em resumo, as observações longitudinais deste estudo em meninos brasileiros com TEA entre quatro e 15 anos mostraram um padrão de crescimento normal em estatura até a idade próxima ao início da puberdade, seguido de uma redução marcada na taxa de crescimento durante a adolescência até a faixa de observação. Além disso, houve uma tendência de alta prevalência de sobrepeso e obesidade entre os meninos brasileiros com TEA, apesar de uma tendência de redução no IMC ter sido aparente quando as crianças entraram na idade de desenvolvimento púbere. Houve uma influência aparente do uso de medicamentos psicotrópicos sobre a situação do peso das crianças com TEA. Os modelos longitudinais futuros devem considerar também as interações entre os níveis de atividade física, comportamentos de seletividade alimentar e ingestão alimentar com crescimento somático.
Conflitos de interesseOs autores declaram não haver conflitos de interesse.
Como citar este artigo: Toscano CV, Ferreira JP, Gaspar JM, Carvalho HM. Growth and weight status of Brazilian children with autism spectrum disorders: A mixed longitudinal study. J Pediatr (Rio J). 2019;95:705–12.