To assess the carotid intima‐media thickness and factors associated with cardiovascular disease in children and adolescents with chronic kidney disease.
Material and methodsObservational, cross‐sectional study carried out at the Universidade Federal de São Paulo (chronic kidney disease outpatient clinics) with 55 patients (60% males) with a median age of 11.9 years (I25–I75: 9.2–14.8 years). Of the 55 patients, 43 were on conservative treatment and 12 were on dialysis. Serum laboratory parameters (creatinine, uric acid, C‐reactive protein, total cholesterol and fractions, and triglycerides), nutritional status (z‐score of body mass index, z‐score of height/age), body fat (fat percentage and waist circumference), and blood pressure levels were evaluated. The carotid intima‐media thickness measure was evaluated by a single ultrasonographer and compared with percentiles established according to gender and height. Data collection was performed between May 2015 and March 2016.
ResultsOf the children and adolescents with chronic kidney disease, 74.5% (95% CI: 61.0; 85.3) showed an increase (>P95) in carotid intima‐media thickness. In patients with stages I and II hypertension, 90.9% had increased carotid intima‐media thickness. Nutritional status, body fat and laboratory tests were not associated with increased carotid intima‐media thickness. After multivariate adjustment, only puberty (PR=1.30, p=0.037) and stages I and II arterial hypertension (PR=1.42, p=0.011) were independently associated with carotid intima‐media thickness alterations.
ConclusionThe prevalence of increased carotid thickness was high in children and adolescents with chronic kidney disease. Puberty and arterial hypertension were independently associated with increased carotid intima‐media thickness.
Avaliar a espessura médio‐intimal da carótida e os fatores associados à doença cardiovascular em crianças e adolescentes com doença renal crônica.
Material e métodosEstudo observacional transversal feito na Universidade Federal de São Paulo (ambulatórios de doença renal crônica) com 55 pacientes (60% do sexo masculino) com mediana de 11,9 anos (I25‐I75: 9,2–14,8). Dos 55 pacientes, 43 estavam em tratamento conservador e 12 em terapia dialítica. Foram avaliados os parâmetros laboratoriais séricos (creatinina, ácido úrico, proteína C‐reativa, colesterol total e frações e triglicérides), estado nutricional (escore z de índice de massa corpórea, escore z de estatura/idade), gordura corporal (percentual de gordura e circunferência abdominal) e pressão arterial. A medida da espessura médio‐intimal da carótida foi avaliada por um único ultrassonografista e comparada com percentis estabelecidos de acordo com o sexo e a estatura. A coleta de dados foi feita entre maio de 2015 e março de 2016.
ResultadosDas crianças e adolescentes com doença renal crônica, 74,5% (IC 95%: 61,0; 85,3) apresentaram aumento (> P95) da espessura médio‐intimal da carótida. Nos pacientes com hipertensão arterial estágios I e II, 90,9% apresentaram aumento da espessura médio‐intimal da carótida. O estado nutricional, a gordura corporal e os exames laboratoriais não apresentaram associação com o aumento da espessura médio‐intimal da carótida. Após ajuste multivariado, apenas a puberdade (RP=1,30; p=0,037) e a hipertensão arterial estágios I e II (RP=1,42; p=0,011) mostraram‐se independentemente associados à alteração da espessura médio‐intimal da carótida.
ConclusãoA prevalência do aumento da espessura da carótida foi elevada em crianças e adolescentes com doença renal crônica. A puberdade e a hipertensão arterial mostraram‐se independentemente associadas ao aumento da espessura médio‐intimal da carótida.
As complicações cardiovasculares constituem a principal causa de morte nos pacientes portadores de doença renal crônica (DRC). Os fatores de risco atribuídos à doença cardiovascular (DCV) são importantes, não apenas para identificar potenciais mudanças, mas também para avaliar o efeito de tratamentos, com o objetivo de reduzir o risco de morte.1 A presença de fatores de risco tradicionais para DCV, como hipertensão arterial, hiperlipidemia, diabetes, inatividade física, tabagismo e idade avançada, muitas vezes é agravada por vários fatores de risco não tradicionais relacionados à má função renal, como anemia, sobrecarga de volume, metabolismo alterado de lipídeos (dislipidemia), anormalidades no metabolismo cálcio‐fósforo (hiperparatiroidismo), hiper‐homocisteinemia, microalbuminúria, hiperuricemia e inflamação crônica. O conjunto desses fatores aumenta os riscos de morte por DCV nos pacientes com DRC.2,3 As crianças com DRC compõem uma população menos exposta aos fatores de risco cardiovasculares tradicionais, quando comparadas com pacientes adultos, o que permite uma avaliação sensível das anormalidades metabólicas e hemodinâmicas na fisiopatologia da arteriopatia da doença renal.4
Alguns estudos têm relacionado a frequência de fatores de risco tradicionais para o desenvolvimento de DCV em crianças com DRC. Silverstein et al.3 avaliaram 45 crianças transplantadas, todas no estágio 2‐4da DRC no momento do estudo. Verificaram que 2/3 dos pacientes tinham pelo menos dois fatores de risco para DCV, enquanto que 1/3 deles tinha pelo menos três fatores.
Métodos não invasivos de medidas de alteração vascular e biomarcadores circulatórios são importantes para avaliar a presença e gravidade do dano cardiovascular e têm sido comumente usados para estudar a evolução da DCV. A medida da espessura médio‐intimal da carótida (EMIC) tornou‐se uma ferramenta adicional para a detecção precoce de lesão arterial e sua alteração tem sido associada a aumento no risco de eventos coronários e mortalidade em pacientes adultos em diálise. Em pediatria essa alteração tem sido relatada tanto em pacientes em diálise como nos estágios 2‐4da DRC.1 Mitsnefes et al.5 observaram a espessura médio‐intimal da carótida de 31 crianças e adolescentes depois do transplante renal e constataram aterosclerose precoce, além de associação do aumento da EMIC com a hipertensão arterial. Em estudo conduzido por Oh et al.6 com 39 adolescentes em diálise e pós‐transplante renal, verificou‐se que a medida da espessura da carótida foi significativamente maior quando comparada com o grupo controle.
A quantidade crescente de estudos sobre avaliação da EMIC em crianças e adolescentes com DRC indica que esse método deve ser introduzido como uma ferramenta de rotina na avaliação e monitoração desses pacientes. Assim, as evidências atuais indicam que a avaliação de rotina do risco cardiovascular é importante para a detecção e o tratamento precoce das alterações vasculares. O presente estudo teve com objetivo avaliar a espessura médio‐intimal da carótida e os fatores associados à doença cardiovascular em crianças e adolescentes com DRC.
MétodosEste estudo transversal observacional incluiu 55 pacientes com DRC na fase dialítica e não dialítica acompanhados no ambulatório de nefrologia pediátrica da Universidade Federal de São Paulo (Unifesp). Os critérios de exclusão para o estudo foram: idade menor do que seis anos e maior ou igual a 18 anos, diagnóstico prévio de doenças cardiovasculares, neoplásicas, infecciosas, inflamatórias e lúpus eritematoso sistêmico. A coleta de dados foi feita entre maio de 2015 e março de 2016.
O estudo foi aprovado pelo Comitê de Ética em Pesquisa da Unifesp e o termo de consentimento livre esclarecido e assentimento foi obtido de todos os participantes e responsáveis do estudo.
Estadiamento puberalO estadiamento puberal foi avaliado pelos pediatras da equipe do serviço, com o critério de desenvolvimento dos caracteres sexuais secundários propostos por Marshall & Tanner.7
Pressão arterialPara verificação da pressão arterial foi usado aparelho digital (Dixtal®, SP, Brasil), o paciente estava em repouso por 3‐5 minutos e usou‐se manguito adequado (largura e comprimento) à circunferência do braço no ponto médio entre o olecrano e acrômio. A pressão arterial foi confirmada pelo método auscultatório e classificada segundo a Diretriz de Prática Clínica para Triagem e Controle da Pressão Arterial Elevada em Crianças e Adolescentes.8
Estado nutricional e composição corporalOs pacientes foram pesados com roupas íntimas, sem sapatos, em uma balança eletrônica (Filizola®, SP, Brasil) e medidos em estadiômetro fixado em parede. As medidas de peso e estatura foram usadas para o cálculo do escore z de índice de massa corpórea (zIMC) e escore z de estatura/idade (zE/I), de acordo com padrão de referência e a preconização da Organização Mundial da Saúde (2007).9 O índice de massa corporal (IMC) foi calculado como peso dividido pela estatura ao quadrado (kg/m2). A circunferência abdominal foi medida com fita flexível, inextensível, com precisão de 0,1cm e classificada segundo Freedman.10 A porcentagem de gordura corporal de meninos e meninas foi estimada com o uso das dobras cutâneas tricipital, bicipital, subescapular e suprailíaca segundo a fórmula de Bray11 e classificada de acordo com tabela em percentis proposta por McCarth.12 Para aferição das dobras cutâneas, usou‐se adipômetro da marca Lange® (Beta Technology Inc. Santa Cruz, CA, EUA) com precisão de 1mm: % de Gordura = 8,71+ 0,19 x DCS (dobras cutâneas subescapulares) + 0,76 x DCB (dobras cutâneas bicipitais) + 0,18 x DCSupra (dobras cutâneas suprailíacas) + 0,33 x DCT (dobras cutâneas tricipitais)
Exames laboratoriaisOs parâmetros laboratoriais foram analisados em equipamento (Cobas® C 501 ‐ Roche®‐Diagnostics, Indianapolis, IN, USA), no soro, após jejum de 12 horas: creatinina, ácido úrico, proteína C‐reativa – PCR, colesterol total – CT, HDL colesterol – HDL‐c e triglicérides – TG. A fração do LDL colesterol foi obtida com a equação de Friedewald et al:13 LDL‐c = (CT – HDL‐c + TG/5).
Para identificar dislipidemias foi usada a I Diretriz de Prevenção da Aterosclerose na Infância e na Adolescência.14
Classificação da doença renal crônicaA doença renal crônica foi classificada em cinco estágios, de acordo com o proposto pela National Kidney Foundation (NKF KDOQI).15
A taxa de filtração glomerular foi estimada pela equação de Scharwtz.16
Ultrassonografia do complexo médio‐intimal da artéria carótidaA medida da espessura do complexo médio‐intimal foi feita por um único ultrassonografista, cego à identidade do paciente e ao grupo de estudo, com aparelho de ultrassom com transdutor linear de 7MHz de frequência e 0,1mm de resolução (General Electric®, Wauwatosa, USA). Os pacientes permaneceram em maca, em decúbito dorsal e a cabeça virada ligeiramente para o lado contralateral, com repouso prévio de 10 minutos antes do início do exame. A medida foi feita na parede posterior da artéria carótida esquerda no eixo longitudinal, foram incluídas a primeira linha ecogênica e a linha hipoecogênica no terço distal da carótida comum, por ser uma medida mais reprodutível, pelo fato de não ter interferência de artefatos ultrassonográficos no local. Para classificação da espessura da carótida foi usada a tabela de percentis proposta por Doyon,17 de acordo com o sexo e a estatura. Valores de espessura médio intimal da carótida acima do percentil 95 foram classificados como alterados.
Análise estatísticaInicialmente foi estimada a prevalência de crianças e adolescentes com alteração da EMIC de pacientes com DRC e seu respectivo intervalo de confiança de 95% (IC95%). As variáveis qualitativas foram descritas através do número e da porcentagem (%); enquanto que as variáveis quantitativas foram descritas como mediana e interquartis (I25; I75). Com o objetivo de estimar a associação de alteração da EMIC com fatores de risco, foi calculada a razão de prevalência (RP) e respectivo IC95%, com alteração da EMIC como variável dependente e os vários fatores de exposição como variáveis independentes. As variáveis selecionadas na análise univariada que apresentaram valor de p inferior a 0,20 foram selecionadas para compor o modelo multivariado. Optou‐se pelo cálculo da razão de prevalência em vez do cálculo da odds ratio, uma vez que o evento avaliado (alteração da EMIC) se mostrou frequente, isto é prevalência maior ou igual a 20%. As razões de prevalência e seus respectivos intervalos de confiança de 95% foram estimados com o modelo linear generalizado (Generalized Linear Model – GLM) com distribuição binomial e função de ligação logarítmica (log link function). Todos os testes usados foram bilaterais e um valor de p menor do que 5% (p < 0,05) foi considerado como estatisticamente significante. Todas as análises foram feitas no Stata versão 14.2 para Windows (Stata, College Station, TX).
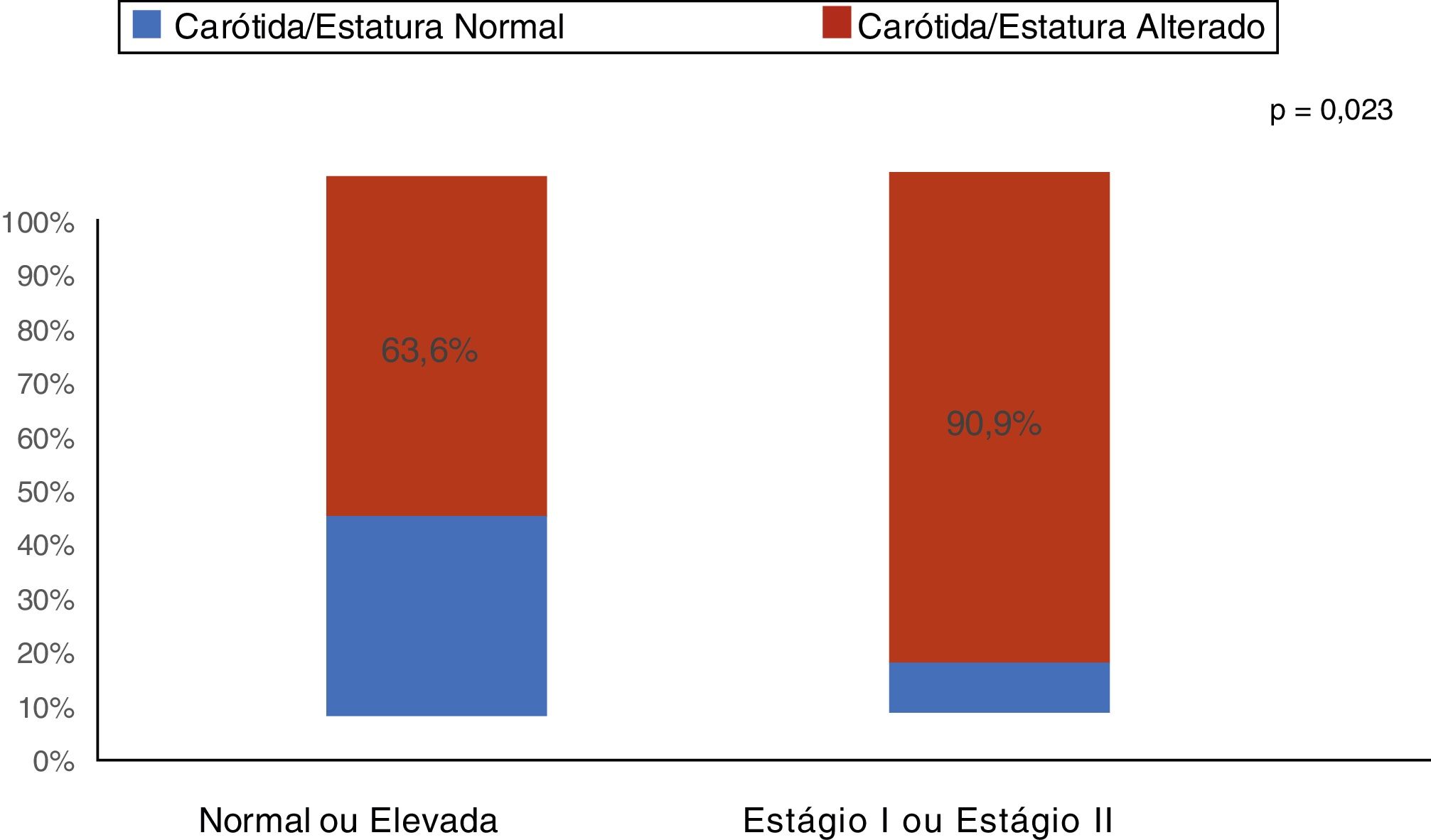
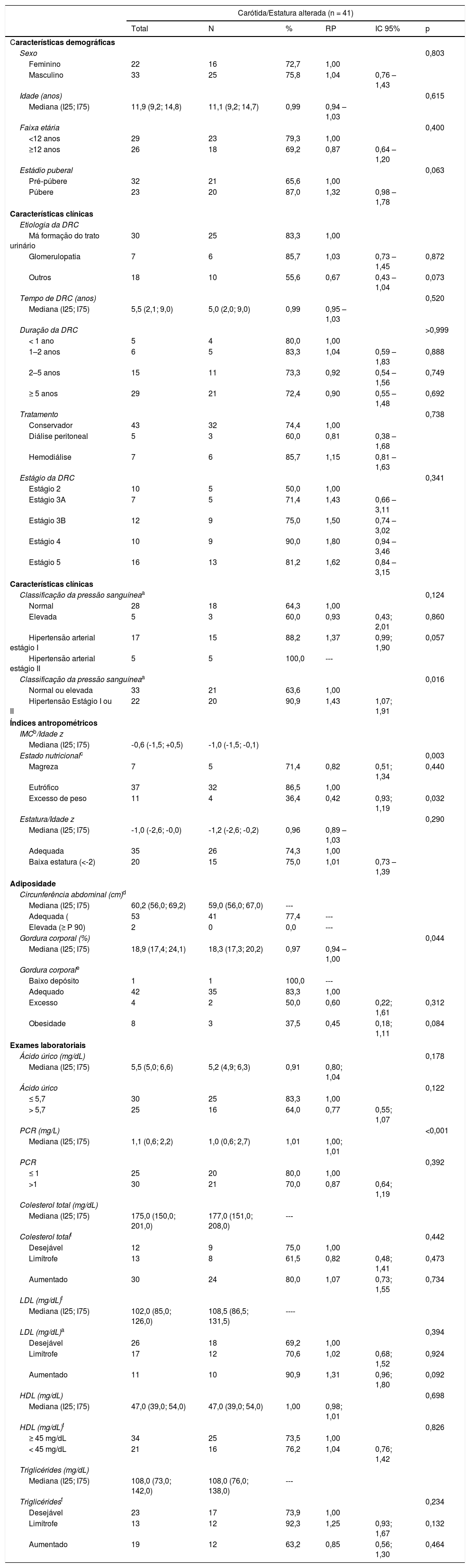
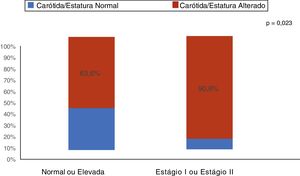
ResultadosA mediana foi de 11,9 anos (I25‐I75: 9,2‐14,8). Dos 55 pacientes (60% do sexo masculino), 43 estavam em tratamento conservador e 12 em terapia dialítica. Aumento (acima do percentil 95) da EMIC foi encontrado em 74,5% (IC95%: 61,0; 85,3) das crianças e adolescentes com DRC. As principais características clínicas e demográficas encontram‐se na tabela 1. Como mostra a figura 1, entre os pacientes com hipertensão arterial estágio I e II, 90,9% apresentaram aumento da EMIC. O estado nutricional e a gordura corporal não apresentaram associação com o aumento da EMIC (tabela 1). Quanto aos exames laboratoriais, proteína C‐reativa e ácido úrico estavam elevados em 54,5% e 45,5% dos pacientes com DRC, respectivamente. Não foi encontrada associação entre aumento da proteína C‐reativa e ácido úrico com o aumento da EMIC (tabela 1).
Características demográficas, clínicas, antropométricas e laboratoriais de pacientes pediátricos com doença renal crônica, segundo a presença de alteração da espessura médio‐intimal da carótida
| Carótida/Estatura alterada (n = 41) | ||||||
|---|---|---|---|---|---|---|
| Total | N | % | RP | IC 95% | p | |
| Características demográficas | ||||||
| Sexo | 0,803 | |||||
| Feminino | 22 | 16 | 72,7 | 1,00 | ||
| Masculino | 33 | 25 | 75,8 | 1,04 | 0,76 – 1,43 | |
| Idade (anos) | 0,615 | |||||
| Mediana (I25; I75) | 11,9 (9,2; 14,8) | 11,1 (9,2; 14,7) | 0,99 | 0,94 – 1,03 | ||
| Faixa etária | 0,400 | |||||
| <12 anos | 29 | 23 | 79,3 | 1,00 | ||
| ≥12 anos | 26 | 18 | 69,2 | 0,87 | 0,64 – 1,20 | |
| Estádio puberal | 0,063 | |||||
| Pré‐púbere | 32 | 21 | 65,6 | 1,00 | ||
| Púbere | 23 | 20 | 87,0 | 1,32 | 0,98 – 1,78 | |
| Características clínicas | ||||||
| Etiologia da DRC | ||||||
| Má formação do trato urinário | 30 | 25 | 83,3 | 1,00 | ||
| Glomerulopatia | 7 | 6 | 85,7 | 1,03 | 0,73 – 1,45 | 0,872 |
| Outros | 18 | 10 | 55,6 | 0,67 | 0,43 – 1,04 | 0,073 |
| Tempo de DRC (anos) | 0,520 | |||||
| Mediana (I25; I75) | 5,5 (2,1; 9,0) | 5,0 (2,0; 9,0) | 0,99 | 0,95 – 1,03 | ||
| Duração da DRC | >0,999 | |||||
| < 1 ano | 5 | 4 | 80,0 | 1,00 | ||
| 1–2 anos | 6 | 5 | 83,3 | 1,04 | 0,59 – 1,83 | 0,888 |
| 2–5 anos | 15 | 11 | 73,3 | 0,92 | 0,54 – 1,56 | 0,749 |
| ≥ 5 anos | 29 | 21 | 72,4 | 0,90 | 0,55 – 1,48 | 0,692 |
| Tratamento | 0,738 | |||||
| Conservador | 43 | 32 | 74,4 | 1,00 | ||
| Diálise peritoneal | 5 | 3 | 60,0 | 0,81 | 0,38 – 1,68 | |
| Hemodiálise | 7 | 6 | 85,7 | 1,15 | 0,81 – 1,63 | |
| Estágio da DRC | 0,341 | |||||
| Estágio 2 | 10 | 5 | 50,0 | 1,00 | ||
| Estágio 3A | 7 | 5 | 71,4 | 1,43 | 0,66 – 3,11 | |
| Estágio 3B | 12 | 9 | 75,0 | 1,50 | 0,74 – 3,02 | |
| Estágio 4 | 10 | 9 | 90,0 | 1,80 | 0,94 – 3,46 | |
| Estágio 5 | 16 | 13 | 81,2 | 1,62 | 0,84 – 3,15 | |
| Características clínicas | ||||||
| Classificação da pressão sanguíneaa | 0,124 | |||||
| Normal | 28 | 18 | 64,3 | 1,00 | ||
| Elevada | 5 | 3 | 60,0 | 0,93 | 0,43; 2,01 | 0,860 |
| Hipertensão arterial estágio I | 17 | 15 | 88,2 | 1,37 | 0,99; 1,90 | 0,057 |
| Hipertensão arterial estágio II | 5 | 5 | 100,0 | --‐ | ||
| Classificação da pressão sanguíneaa | 0,016 | |||||
| Normal ou elevada | 33 | 21 | 63,6 | 1,00 | ||
| Hipertensão Estágio I ou II | 22 | 20 | 90,9 | 1,43 | 1,07; 1,91 | |
| Índices antropométricos | ||||||
| IMCb/Idade z | ||||||
| Mediana (I25; I75) | ‐0,6 (‐1,5; +0,5) | ‐1,0 (‐1,5; ‐0,1) | ||||
| Estado nutricionalc | 0,003 | |||||
| Magreza | 7 | 5 | 71,4 | 0,82 | 0,51; 1,34 | 0,440 |
| Eutrófico | 37 | 32 | 86,5 | 1,00 | ||
| Excesso de peso | 11 | 4 | 36,4 | 0,42 | 0,93; 1,19 | 0,032 |
| Estatura/Idade z | 0,290 | |||||
| Mediana (I25; I75) | ‐1,0 (‐2,6; ‐0,0) | ‐1,2 (‐2,6; ‐0,2) | 0,96 | 0,89 – 1,03 | ||
| Adequada | 35 | 26 | 74,3 | 1,00 | ||
| Baixa estatura (<‐2) | 20 | 15 | 75,0 | 1,01 | 0,73 – 1,39 | |
| Adiposidade | ||||||
| Circunferência abdominal (cm)d | ||||||
| Mediana (I25; I75) | 60,2 (56,0; 69,2) | 59,0 (56,0; 67,0) | --‐ | |||
| Adequada ( | 53 | 41 | 77,4 | --‐ | ||
| Elevada (≥ P 90) | 2 | 0 | 0,0 | --‐ | ||
| Gordura corporal (%) | 0,044 | |||||
| Mediana (I25; I75) | 18,9 (17,4; 24,1) | 18,3 (17,3; 20,2) | 0,97 | 0,94 – 1,00 | ||
| Gordura corporale | ||||||
| Baixo depósito | 1 | 1 | 100,0 | --‐ | ||
| Adequado | 42 | 35 | 83,3 | 1,00 | ||
| Excesso | 4 | 2 | 50,0 | 0,60 | 0,22; 1,61 | 0,312 |
| Obesidade | 8 | 3 | 37,5 | 0,45 | 0,18; 1,11 | 0,084 |
| Exames laboratoriais | ||||||
| Ácido úrico (mg/dL) | 0,178 | |||||
| Mediana (I25; I75) | 5,5 (5,0; 6,6) | 5,2 (4,9; 6,3) | 0,91 | 0,80; 1,04 | ||
| Ácido úrico | 0,122 | |||||
| ≤ 5,7 | 30 | 25 | 83,3 | 1,00 | ||
| > 5,7 | 25 | 16 | 64,0 | 0,77 | 0,55; 1,07 | |
| PCR (mg/L) | <0,001 | |||||
| Mediana (I25; I75) | 1,1 (0,6; 2,2) | 1,0 (0,6; 2,7) | 1,01 | 1,00; 1,01 | ||
| PCR | 0,392 | |||||
| ≤ 1 | 25 | 20 | 80,0 | 1,00 | ||
| >1 | 30 | 21 | 70,0 | 0,87 | 0,64; 1,19 | |
| Colesterol total (mg/dL) | ||||||
| Mediana (I25; I75) | 175,0 (150,0; 201,0) | 177,0 (151,0; 208,0) | --‐ | |||
| Colesterol totalf | 0,442 | |||||
| Desejável | 12 | 9 | 75,0 | 1,00 | ||
| Limítrofe | 13 | 8 | 61,5 | 0,82 | 0,48; 1,41 | 0,473 |
| Aumentado | 30 | 24 | 80,0 | 1,07 | 0,73; 1,55 | 0,734 |
| LDL (mg/dL)f | ||||||
| Mediana (I25; I75) | 102,0 (85,0; 126,0) | 108,5 (86,5; 131,5) | ---- | |||
| LDL (mg/dL)a | 0,394 | |||||
| Desejável | 26 | 18 | 69,2 | 1,00 | ||
| Limítrofe | 17 | 12 | 70,6 | 1,02 | 0,68; 1,52 | 0,924 |
| Aumentado | 11 | 10 | 90,9 | 1,31 | 0,96; 1,80 | 0,092 |
| HDL (mg/dL) | 0,698 | |||||
| Mediana (I25; I75) | 47,0 (39,0; 54,0) | 47,0 (39,0; 54,0) | 1,00 | 0,98; 1,01 | ||
| HDL (mg/dL)f | 0,826 | |||||
| ≥ 45 mg/dL | 34 | 25 | 73,5 | 1,00 | ||
| < 45 mg/dL | 21 | 16 | 76,2 | 1,04 | 0,76; 1,42 | |
| Triglicérides (mg/dL) | ||||||
| Mediana (I25; I75) | 108,0 (73,0; 142,0) | 108,0 (76,0; 138,0) | --‐ | |||
| Triglicéridesf | 0,234 | |||||
| Desejável | 23 | 17 | 73,9 | 1,00 | ||
| Limítrofe | 13 | 12 | 92,3 | 1,25 | 0,93; 1,67 | 0,132 |
| Aumentado | 19 | 12 | 63,2 | 0,85 | 0,56; 1,30 | 0,464 |
IC 95%, intervalo de confiança de 95%; Interquartis (I25‐I75); RP, razão de prevalência.
A tabela 2 apresenta as variáveis eleitas para compor o modelo multivariado, isto é, aquelas que apresentaram resultados com valor de p inferior a 0,2.
Análise univariada dos fatores associados ao aumento da espessura médio‐intimal da carótida em pacientes pediátricos com doença renal crônica
| Univariada | ||
|---|---|---|
| RPb (IC95%) | p | |
| Estadio puberal – Púbere x Pré‐púbere | 1,32 (0,98; 1,78) | 0,063 |
| Etiologia da DRC | ||
| Glomerulopatia x Má‐formação | 1,03 (0,73; 1,45) | 0,872 |
| Outros x Má‐formação | 0,67 (0,43; 1,04) | 0,073 |
| Estágio da DRC | ||
| Estágio 3A ou 3B x Estágio 2 | 1,47 (0,75; 2,89) | 0,261 |
| Estágio 4 x Estágio 2 | 1,80 (0,94; 3,46) | 0,078 |
| Estágio 5 x Estágio 2 | 1,62 (0,84; 3,15) | 0,151 |
| % Gordura corporal | 0,97 (0,94; 1,00) | 0,044 |
| Pressão arterial sanguíneaHipertenso estágio I ou II x normal ou elevada | 1,43 (1,07; 1,91) | 0,016 |
| PCR | 1,01 (1,00; 1,01) | <0,001 |
| LDL | ||
| Limítrofe x desejável | 1,02 (0,68; 1,52) | 0,924 |
| Aumentado x desejável | 1,31 (0,96; 1,80) | 0,092 |
RPb, razão de prevalência bruta (modelo univariado).
Após ajuste multivariado, conforme mostra a tabela 3, apenas a puberdade (RP = 1,30; IC95%: 1,01; 0,66 p = 0,037) e a hipertensão arterial estágios I e II (RP = 1,42; IC95%: 1,08; 1,85 p = 0,011) mostraram‐se independentemente associados com a alteração da EMIC.
Análise multivariada dos fatores associados ao aumento da espessura médio‐intimal da carótida em pacientes pediátricos com doença renal crônica
| Multivariada | ||
|---|---|---|
| RPaj (IC95%) | p | |
| Estadio puberal – Púbere x Pré‐púbere | 1,30 (1,01; 0,66) | 0,037 |
| Pressão arterial sanguíneaHipertenso estágio I ou II x normal ou elevada | 1,42 (1,08; 1,85) | 0,011 |
RPaj, razão de prevalência ajustada (modelo multivariado).
O presente estudo com crianças e adolescentes em estágios 2‐5 DRC mostrou que é frequente a presença de determinados fatores de risco para doença cardiovascular, como a hipertensão arterial (40%), o aumento do LDL colesterol (51,9%), o estádio puberal (58,2%) e a inflamação (54,5%). Aumento da espessura da camada médio‐intimal foi evidenciado em 90,9% dos pacientes com hipertensão arterial. Deve ser destacado que a hipertensão arterial e a puberdade foram as variáveis independentemente associadas ao aumento da espessura da carótida nos pacientes pediátricos com DRC.
Estado nutricional e composição corporalA importância dos marcadores antropométricos é evidenciada pela sua associação com a mortalidade e amplamente descrita em pacientes pediátricos com DRC.
O IMC geralmente é usado como um indicador de adiposidade entre crianças e adolescentes. O aumento do IMC na infância é um forte preditor de morte prematura por DCV na idade adulta média e tardia. No entanto, as comorbidades relacionadas à obesidade estão mais associadas ao padrão de distribuição de gordura corporal do que a massa total de gordura.18 A circunferência abdominal é um indicador mais sensível do que o IMC para avaliação de risco para DCV e está associada com a aterogenicidade em crianças e adolescentes sem DRC.19 Embora haja um maior risco de DCV nesses pacientes, os resultados deste estudo não mostraram associação entre a adiposidade abdominal e o percentual de gordura corporal com alteração da carótida na análise multivariada.
Em nosso estudo 67,3% dos pacientes apresentaram estatura adequada para a idade. Ao contrário do que encontramos, Ku et al.20 mostraram que crianças e adolescentes em diálise ou transplante com baixa estatura apresentavam maior risco de mortalidade, principalmente por causas cardíacas e infecciosas.
Em pesquisa feita nos Estados Unidos por Wong et al.21 foi verificado que o risco de mortalidade aumentou 14% para cada redução de unidade de escore z de estatura, independentemente do tipo de tratamento (diálise ou transplante).
As variáveis de excesso de gordura (índice antropométrico – IMC e composição corporal – massa gorda e adiposidade central) e a baixa estatura não fizeram parte da análise multivariada. Neste estudo, os pacientes receberem intervenção dietética com nutricionista, que reflete em educação e monitoração nutricional, acarreta melhor qualidade alimentar dessa população estudada. Recente estudo observou mudanças do estado nutricional e composição corporal de pacientes adultos com DRC acompanhados por seis meses após orientação nutricional.22
Exames laboratoriaisAlterações lipídicas são estabelecidas como um fator de risco para o desenvolvimento de aterosclerose. A associação entre dislipidemia e aumento da espessura médio‐intimal da carótida tem sido evidenciada em estudos com crianças. Brady et al. avaliaram pacientes pediátricos nos estágios 2‐4da DRC e comprovaram essa associação.23 No estudo de Khandelwal et al.24 a associação do aumento da espessura médio‐intimal da carótida, triglicérides, colesterol total e LDL colesterol foi encontrada nas crianças em vários estágios da DRC.
Neste estudo, o LDL colesterol teve uma associação com a alteração da espessura da carótida na análise univariada, porém na análise multivariada essa associação não foi confirmada.
A inflamação é um dos eventos responsáveis pelas DCVs em DRC e os marcadores inflamatórios são identificados em concentrações elevadas em crianças em diálise.25 Nossos achados demonstraram que apesar das concentrações elevadas de PCR terem mostrado uma associação com a espessura da carótida alterada na análise univariada, não foi observada associação na análise multivariada.
A hiperuricemia tem sido amplamente estudada em pacientes com DRC por ser um fator de risco cardiovascular modificável e ter um papel significante para a disfunção endotelial, inflamação e aterosclerose.18 Em nosso estudo os 45,5% dos pacientes apresentaram hiperuricemia e esse marcador não se associou ao evento da espessura da carótida alterada.
Hipertensão arterial e puberdadeA hipertensão arterial sistêmica (HAS) é um dos determinantes mais críticos para a progressão da doença renal em crianças e um dos principais fatores de risco para complicações cardiovasculares. Os achados na literatura evidenciam a correlação entre pressão arterial elevada e sinais de arterio/aterosclerose em crianças, é um dos fatores modificáveis mais importantes entre os fatores de risco para DCV.26
Em nosso estudo, verificou‐se que dos 40% dos pacientes hipertensos estágios I e II, 90,4% deles apresentavam aumento da espessura da carótida. Enquanto que no grupo com pressão normal ou elevada, mais da metade (63,6%) já tinha aumento na da camada médio‐intimal da carótida. Quando se comparam os dois grupos, observa‐se diferença estatisticamente significante nas proporções de alteração da camada médio‐intimal (p = 0,023). A hipertensão arterial é frequente nos pacientes com DRC e vários estudos demonstram esse fator de risco para complicações cardiovasculares. No estudo de Flynn et al.,27 que incluiu 586 crianças com DRC, foi observado que a hipertensão arterial estava presente em 54% dos pacientes. Apesar do uso de medicação anti‐hipertensiva, 48% dessas crianças apresentaram pressão arterial inadequadamente controlada. Em outro estudo americano com pacientes pediátricos transplantados, foi verificado que 48% da hipertensão arterial não controlada no início da DRC aumentaram para 50‐75% no estágio final da DRC. Após o transplante, a prevalência reportada de hipertensão arterial foi de 50‐87%.28
Alterações da artéria carótida também foram confirmadas por Brady et al.,23 que avaliaram fatores de risco para DCV, e a hipertensão arterial foi significativamente associada ao aumento da espessura da carótida em crianças de dois a 18 anos com DRC. Poyrazoglu et al.29 observaram a espessura médio‐intimal da carótida de 34 crianças com DRC e constataram um aumento da EMIC nessa população, além de associação do aumento da EMIC com a hipertensão arterial.
Com relação ao estadiamento puberal, os pacientes púberes (G2/M2 a G5/M5) apresentaram maior associação com aumento da espessura da carótida (RP = 1,30; IC95%: 1,01; 0,66; p = 0,037). Em um estudo com crianças saudáveis, conduzido por Baroncini et al.,30 foi verificado que a alteração da espessura da carótida se associou ao aumento da idade, assim como visto em adultos. Tais achados poderiam ter relação com o fato de que na puberdade as mudanças hormonais podem induzir a um aumento da porcentagem de gordura corporal total e alterações das lipoproteínas, principalmente elevação do LDL‐c.30 Outra explicação possível seria que a EMIC aumenta em resposta a reação fisiológica do vaso, para se adaptar ao aumento da pressão arterial que ocorre com o avançar da idade.17 Além disso, em um estudo com 24 crianças com DRC conduzido por Bilginer et al.,28 foi verificada associação entre o tempo de DRC e aumento da EMIC.
Entre as limitações desse estudo, um maior tamanho amostral poderia proporcionar maior poder e menores intervalos de confiança. Outra limitação é que se o estudo tivesse um grupo controle, poderia ser comparada a ocorrência dos fatores de risco de DCV não específicos da DRC no grupo de pacientes estudados.
Concluímos que a puberdade e a hipertensão arterial são importantes determinantes no aumento da EMIC. E que os fatores de risco estudados desempenham um papel importante na morbimortalidade associada à DCV em crianças com DRC. As implicações desses achados necessitam de investigações em pesquisas futuras. Porém, a avaliação precoce e de rotina desses fatores, juntamente com a intervenção adequada, é fundamental para prevenir a progressão da DCV e mortalidade nesses pacientes.
Conflitos de interesseOs autores declaram não haver conflitos de interesse.
Como citar este artigo: Lopes R, Morais MB, Oliveira FL, Brecheret AP, Abreu AL, Andrade MC. Evaluation of carotid intima‐media thickness and factors associated with cardiovascular disease in children and adolescents with chronic kidney disease. J Pediatr (Rio J). 2019;95:696–704.