To determine the prevalence of increased serum fibrinogen levels and its association with cardiometabolic risk factors in overweight or obese children and adolescents.
MethodsCross‐sectional study with 138 children and adolescents (overweight or obese) followed at a reference outpatient clinic of the public health care network. Fibrinogen concentration was divided into quartiles, and values above or equal to the third quartile were considered high. The association between high fibrinogen values and cardiometabolic risk factors was assessed using Pearson's chi‐squared test or Fisher's exact test, as necessary. Logistic regression was used to adjust variables predictive of fibrinogen levels. Analyses were performed using SPSS version 22.0 and SAS software, considering a confidence interval of 95%.
ResultsSerum fibrinogen levels were elevated in 28.3% of individuals, showing association with the presence of high CRP (p=0.003, PR: 2.41, 95% CI: 1.30‐4.46) and the presence of four or more risk factors (p=0.042; PR: 1.78, 95% CI: 1.00‐3.17). After a logistic regression, only elevated CRP remained associated with altered fibrinogen levels (p=0.024; PR: 1.32; 95% CI: 1.09‐5.25).
ConclusionsIncreased fibrinogen was prevalent in the study population and was associated with ultrasensitive C‐reactive protein and the presence of four or more cardiovascular risk factors; it should be included in the assessment of individuals at risk.
Verificar a prevalência de níveis séricos elevados de fibrinogênio e sua associação com os fatores de risco cardiometabólicos em crianças e adolescentes com sobrepeso ou obesidade.
MétodosEstudo transversal com 138 crianças e adolescentes (obesos ou com sobrepeso) acompanhados em um ambulatório de referência da rede pública. A concentração do fibrinogênio foi distribuída em quartis e considerada elevada quando os valores eram iguais ou superiores ao terceiro quartil. A associação entre o valor elevado do fibrinogênio com os fatores de risco cardiometabólicos foi verificada com o teste qui‐quadrado de Pearson ou o teste exato de Fisher, quando necessário. A regressão logística foi usada para ajuste das variáveis preditoras do nível do fibrinogênio. As análises foram feitas no SPSS 22.0 e SAS e considerou‐se o intervalo de confiança de 95%.
ResultadosOs níveis séricos de fibrinogênio estiveram elevados em 28,3% dos indivíduos e apresentaram associação com a PCR elevada (RP: 2,41; IC95%: 1,30‐4,46, p=0,003) e com a presença de quatro ou mais fatores de risco (RP: 1,78; IC95%: 1,00‐3,17; p=0,042). Após a regressão logística, apenas o PCR elevado continuou associado ao fibrinogênio alterado (RP: 1,32; IC95% 1,09‐5,25; p=0,024).
ConclusõesO aumento do fibrinogênio foi prevalente na população estudada, esteve associado à proteína C reativa ultrassensível e ao número igual ou superior a quatro de fatores de risco cardiovasculares e deve ser incluído na avaliação de indivíduos sob risco.
A prevalência de excesso de peso tem aumentado em todas as faixas etárias no Brasil, a exemplo do que acontece em todo o mundo.1 Dados da Pesquisa de Orçamentos Familiares2 demonstram que a proporção de crianças obesas quadruplicou nos últimos 20 anos e a de adolescentes triplicou no mesmo período, achados semelhantes aos observados em países desenvolvidos.3,4
A obesidade representa uma condição inflamatória subclínica que agrega um número substancial de fatores de risco cardiometabólicos.5 Stoopa et al. 6 ao avaliar o estado inflamatório e protrombótico de crianças e adolescentes com obesidade ou eutróficas, verificaram níveis elevados de fibrinogênio já em idades inferiores a seis anos nas obesas, independentemente do estado puberal.
A inflamação na aterogênese é decorrente da síntese, secreção e armazenamento de citocinas pró‐inflamatórias pelos adipócitos e produz um estado de baixo grau de inflamação com complicações vasculares e metabólicas7 que leva à disfunção endotelial vascular, considerada o início do processo aterogênico.8 Fatores de coagulação, como o fibrinogênio e o fluxo sanguíneo, e fatores inflamatórios vêm ganhando importância na determinação do processo aterosclerótico e são considerados importantes fatores de risco para doenças cardiovasculares.7,9
O fibrinogênio, uma proteína de fase aguda, integra o grupo de biomarcadores inflamatórios produzidos pelos hepatócitos e é considerado um importante marcador para acompanhar a evolução do processo inflamatório aterosclerótico,10 uma vez que atua na gênese do processo aterotrombótico por meio da regulação da adesão e proliferação celular, vasoconstrição no local da lesão endotelial, estimulação da agregação de plaquetas e viscosidade do sangue.7,8
Embora a relação da obesidade com a hiperfibrinogenemia seja reportada em crianças, a associação do fibrinogênio com os fatores de risco cardiometabólicos ainda não está bem esclarecida.11,12 A busca de biomarcadores para identificar precocemente indivíduos com maior risco de desenvolver aterosclerose e o conhecimento de sua relação com os demais fatores de risco cardiometabólicos é fundamental para o entendimento e a elaboração de intervenções que visem a diminuir a morbimortalidade por doenças cardiovasculares.
Dessa forma, o presente estudo teve como objetivo verificar a prevalência de níveis séricos elevados de fibrinogênio e sua associação com os fatores de risco cardiometabólicos em crianças e adolescentes com sobrepeso ou obesidade.
MétodosEstudo transversal, feito entre junho/2011 e abril/2012, no Centro de Obesidade Infantil (COI), localizado no Instituto de Saúde Elpídeo de Almeida (Isea), Campina Grande‐PB. O COI, serviço de referência para obesidade infantil no município, é formado por pesquisadores e equipe multidisciplinar que inclui médicos (pediatra e endocrinologista), farmacêuticos, nutricionistas, psicólogas, enfermeiras, assistente social e profissional de educação física.
No momento em que foi iniciada a pesquisa existiam 450 crianças e adolescentes obesos ou com sobrepeso cadastrados no COI. Foram incluídos aqueles que frequentaram o COI durante todo o período do estudo e constituíram uma amostra de conveniência de 138 crianças e adolescentes. Foram excluídos aqueles que apresentavam doenças ou estavam em um uso de medicação que interferisse no metabolismo glicídico ou lipídico; com diagnóstico de síndrome genética; e que modificaram o estado nutricional para eutrofia. Para fins deste estudo, o cálculo do poder estatístico da amostra foi feito a posteriori, a fim de permitir estimar a prevalência de fibrinogênio alterado de 28,3% e assegurar que o tamanho amostral permitisse responder aos objetivos propostos. Para medidas de associação, a amostra apresentou o poder de 85% (β =15%) para o nível de confiança de 95%.
As variáveis antropométricas (peso, estatura e circunferência abdominal) foram verificadas em duplicata e foi considerado o valor médio das duas aferições, de acordo com as recomendações da Organização Mundial da Saúde (OMS).13
O estado nutricional foi classificado de acordo do Índice de Massa Corpórea (IMC), conforme recomendações do Centers of Disease Control and Prevention (CDC), em sobrepeso (IMC ≥ percentil 85 e<percentil 95), obesidade (IMC ≥ percentil 95 e<percentil 97) e obesidade acentuada (IMC ≥ percentil 97).14 A circunferência abdominal (CA) foi considerada aumentada quando apresentou valores superiores ou iguais ao percentil 90, segundo a International Diabetes Federation (IDF),15 com limite máximo de 88cm para meninas e 102cm para os meninos, de acordo com o National Cholesterol Education Program Adult Treatment Pannel III (NECP‐ATPIII).16
A pressão arterial foi aferida pelo método oscilométrico com equipamento da marca Tycos® (Welch Allyn Inc., NY, EUA), de acordo com as normas estabelecidas nas VI Diretrizes Brasileiras de Hipertensão Arterial.17
O colesterol total (CT), a lipoproteína de alta densidade (HDL‐c), os triglicerídeos (TG) e a glicemia foram avaliados segundo o método colorimétrico enzimático, em equipamento automático (BioSystems, Modelo 310, Applied Biosystems, CA, EUA); o fibrinogênio por método coagulométrico; a proteína C reativa ultrassensível (PCRus) e a insulina por quimioluminescência em equipamento automatizado Immulite 1000 (Siemens®, Siemens Healthcare, Erlangen, Alemanha). A lipoproteína de baixa densidade (LDL‐c) foi calculada por meio da fórmula de Friedwald.18 A coleta sanguínea foi feita após 12 horas de jejum.
Como critério para diagnóstico da resistência insulínica (RI) foi usado o índice de homeostase glicêmica da resistência insulínica (HOMA‐IR), classificado quando apresentou valores iguais ou superiores a 2,5.19
Foram considerados como fatores de risco cardiometabólicos: IMC ≥ percentil 97, CA igual ou superior ao percentil 90 para sexo, idade e etnia, com limite de 88cm para meninas e 102cm para os meninos;16 pressão arterial sistólica (PAS) e/ou pressão arterial diastólica (PAD) igual ou superior ao percentil 90 para sexo, estatura e idade,17 TG ≥ 130mg/dL, CT ≥ 170mg/dL; HDL‐c<45mg/dL; LDL‐c ≥ 130mg/dL; glicemia de jejum ≥ 100mg/dL; insulina ≥ 15μUI/mL; HOMA‐IR ≥ 2,5 e PCR>3mg/L.20,21 Indivíduos com PCR ≥ 10mg/L foram excluídos da análise dessa variável, uma vez que, nesses casos, é recomendado afastar processo inflamatório agudo.21
Os níveis do fibrinogênio foram distribuídos em quartis e os valores iguais ou superiores ao percentil 75da amostra estudada, que corresponde a 3,4g/L, foram considerados como elevados, devido à inexistência de ponto de corte para a população infantil.22
O projeto foi aprovado pelo Comitê de Ética em Pesquisa da Universidade Estadual da Paraíba (UEPB) (CAEE ‐ 0256.0.133.000‐1) e desenvolvido mediante a assinatura do Termo de Consentimento Livre e Esclarecido pelos pais ou responsáveis, que autorizaram a participação das crianças e adolescentes no estudo.
Os dados foram apresentados por meio de proporções e mediana com respectivo intervalo interquartílico (IQ). A associação entre os valores de fibrinogênio elevado (valores iguais ou superiores ao percentil 75) com sexo, faixa etária, estado nutricional, CA, PAS, PAD, TG, HDL‐c, LDL‐c, CT, glicemia, insulina, HOMA‐IR e PCR‐us, foi avaliada com o teste do qui‐quadrado de Pearson ou o teste exato de Fisher, quando necessário, e foram descritos as razões de prevalência (RP) e seus respectivos intervalos de confiança.
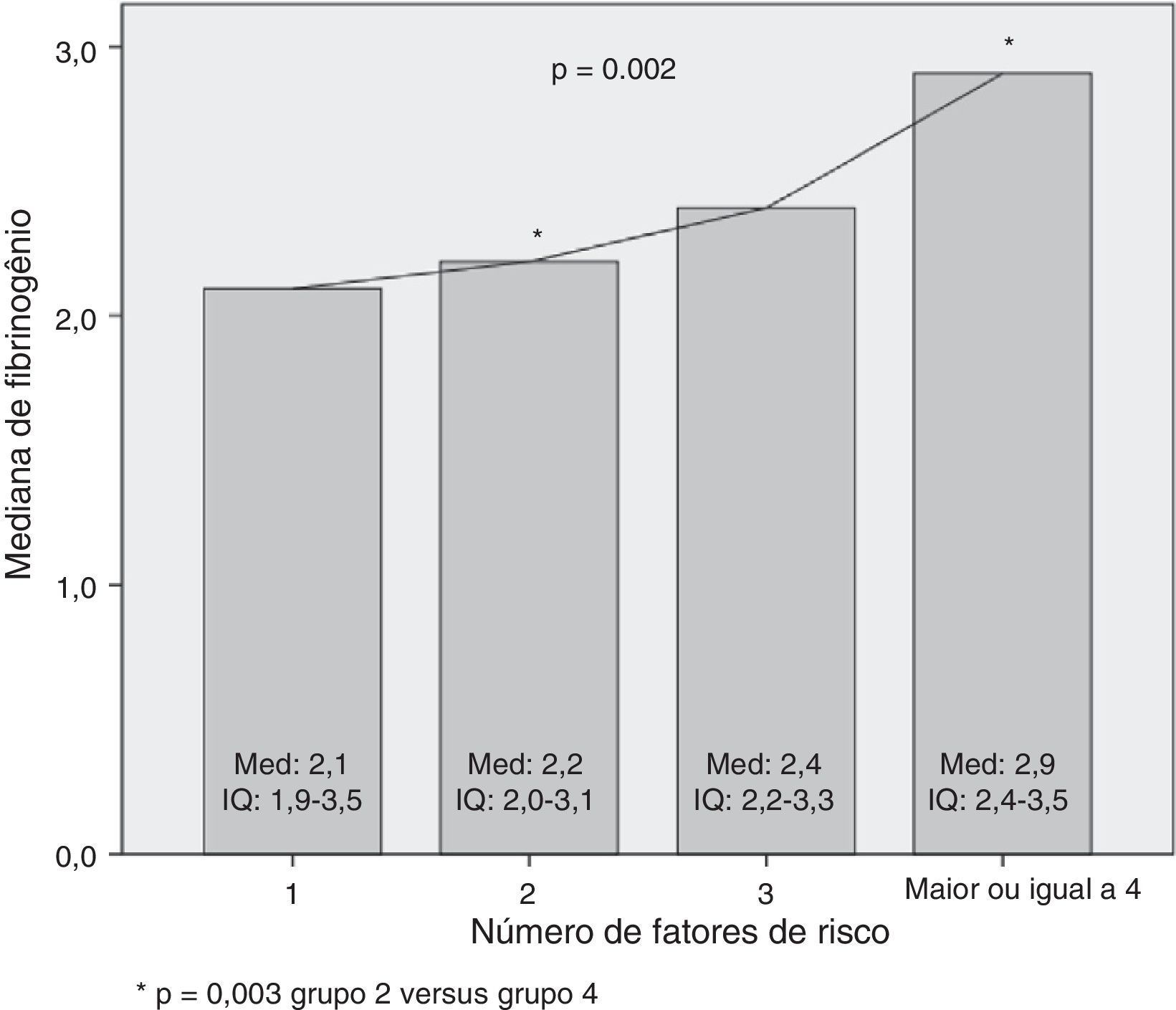
Após a aplicação do teste de Kolmogorov‐Smirnov, que constatou uma distribuição não paramétrica da variável “fibrinogênio”, aplicou‐se o teste de KrusKal‐Wallis para testar a associação da mediana do fibrinogênio com o estado nutricional (sobrepeso, obesidade e obesidade acentuada) e com o número de fatores de risco cardiometabólicos (1 = um fator de risco; 2 = dois fatores de risco; 3 = três fatores de risco; 4 = quatro ou mais fatores de risco). Posteriormente, para avaliação da diferença dessas medidas entre cada grupo, foi aplicado o teste de Mann‐Whitney, ajustado para assegurar que o erro α não ultrapassasse o valor 0,05.
Para o ajuste das variáveis foi usada a regressão logística múltipla, cujo critério definido para a inclusão das variáveis foi a associação com a variável dependente na análise bivariada com um valor de “p” inferior a 0,20. As variáveis foram incluídas na análise de regressão pelo método enter, de acordo com o valor decrescente da Razão de Prevalência. Como medida de qualidade de ajuste dos modelos de regressão logística foi usado o teste de Hosmer e Lemeshow, no qual um p ≥ 0,05 indica que o modelo está ajustado.
As análises foram feitas com o programa SPSS, versão 22.0 (SPSS Inc., Chicago, EUA) e SAS University Edition (SAS Institute Inc., Cary, NC, EUA). Foi considerado o intervalo de confiança de 95%.
ResultadosAs características biológicas, clínicas e laboratoriais dos 138 indivíduos avaliados estão descritas nas tabelas 1 e 2. A proporção verificada para os fatores de risco cardiometabólicos foi de: 5,8% para apenas um fator; 13% para dois; 28,3% para três e 52,9% para quatro ou mais fatores.
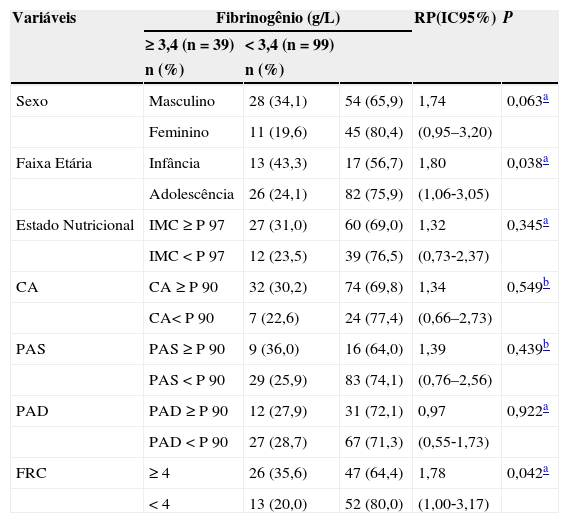
Distribuição da frequência das variáveis biológicas e clínicas de acordo com os níveis de fibrinogênio em crianças e adolescentes com sobrepeso ou obesidade
| Variáveis | Fibrinogênio (g/L) | RP(IC95%) | P | ||
|---|---|---|---|---|---|
| ≥ 3,4 (n=39) | < 3,4 (n=99) | ||||
| n (%) | n (%) | ||||
| Sexo | Masculino | 28 (34,1) | 54 (65,9) | 1,74 | 0,063a |
| Feminino | 11 (19,6) | 45 (80,4) | (0,95–3,20) | ||
| Faixa Etária | Infância | 13 (43,3) | 17 (56,7) | 1,80 | 0,038a |
| Adolescência | 26 (24,1) | 82 (75,9) | (1,06‐3,05) | ||
| Estado Nutricional | IMC ≥ P 97 | 27 (31,0) | 60 (69,0) | 1,32 | 0,345a |
| IMC<P 97 | 12 (23,5) | 39 (76,5) | (0,73‐2,37) | ||
| CA | CA ≥ P 90 | 32 (30,2) | 74 (69,8) | 1,34 | 0,549b |
| CA< P 90 | 7 (22,6) | 24 (77,4) | (0,66–2,73) | ||
| PAS | PAS ≥ P 90 | 9 (36,0) | 16 (64,0) | 1,39 | 0,439b |
| PAS<P 90 | 29 (25,9) | 83 (74,1) | (0,76–2,56) | ||
| PAD | PAD ≥ P 90 | 12 (27,9) | 31 (72,1) | 0,97 | 0,922a |
| PAD<P 90 | 27 (28,7) | 67 (71,3) | (0,55‐1,73) | ||
| FRC | ≥ 4 | 26 (35,6) | 47 (64,4) | 1,78 | 0,042a |
| < 4 | 13 (20,0) | 52 (80,0) | (1,00‐3,17) | ||
CA, circunferência abdominal; PAS, pressão arterial sistólica; PAD, pressão arterial diastólica; FRC, fatores de risco cardiometabólicos.
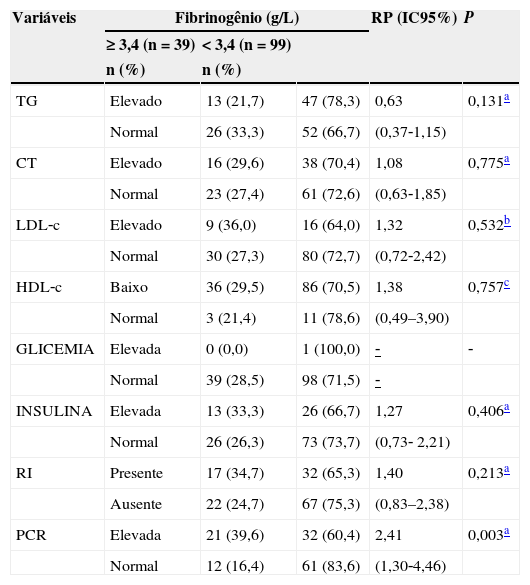
Distribuição de frequência das variáveis laboratoriais de acordo com os grupos de fibrinogênio em crianças e adolescentes com sobrepeso ou obesidade
| Variáveis | Fibrinogênio (g/L) | RP (IC95%) | P | ||
|---|---|---|---|---|---|
| ≥ 3,4 (n=39) | < 3,4 (n=99) | ||||
| n (%) | n (%) | ||||
| TG | Elevado | 13 (21,7) | 47 (78,3) | 0,63 | 0,131a |
| Normal | 26 (33,3) | 52 (66,7) | (0,37‐1,15) | ||
| CT | Elevado | 16 (29,6) | 38 (70,4) | 1,08 | 0,775a |
| Normal | 23 (27,4) | 61 (72,6) | (0,63‐1,85) | ||
| LDL‐c | Elevado | 9 (36,0) | 16 (64,0) | 1,32 | 0,532b |
| Normal | 30 (27,3) | 80 (72,7) | (0,72‐2,42) | ||
| HDL‐c | Baixo | 36 (29,5) | 86 (70,5) | 1,38 | 0,757c |
| Normal | 3 (21,4) | 11 (78,6) | (0,49–3,90) | ||
| GLICEMIA | Elevada | 0 (0,0) | 1 (100,0) | ‐ | ‐ |
| Normal | 39 (28,5) | 98 (71,5) | ‐ | ||
| INSULINA | Elevada | 13 (33,3) | 26 (66,7) | 1,27 | 0,406a |
| Normal | 26 (26,3) | 73 (73,7) | (0,73‐ 2,21) | ||
| RI | Presente | 17 (34,7) | 32 (65,3) | 1,40 | 0,213a |
| Ausente | 22 (24,7) | 67 (75,3) | (0,83–2,38) | ||
| PCR | Elevada | 21 (39,6) | 32 (60,4) | 2,41 | 0,003a |
| Normal | 12 (16,4) | 61 (83,6) | (1,30‐4,46) | ||
TG, triglicerídeos; CT, colesterol total; LDL‐c, lipoproteína de baixa densidade; HDL‐c, lipoproteínas de alta densidade; RI, resistência à insulina; PRC, proteína C‐reativa.
O fibrinogênio elevado esteve presente em 28,3% dos participantes e foi mais frequente entre as crianças do que nos adolescentes (p = 0,038; RP: 1,80; IC95%: 1,06‐3,05); com quatro ou mais fatores de risco (p=0,042; RP: 1,78; IC95%:1,00‐3,17) cardiometabólicos e naqueles com PCR‐us elevada (p=0,003; RP: 2,41; IC95%: 1,30‐4,46). Essa última condição esteve presente em 52,9%.
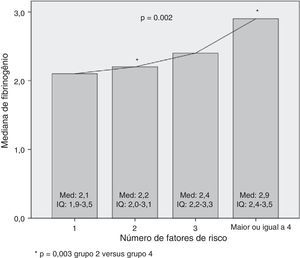
Não se verificou diferença estatisticamente significativa na relação da mediana do fibrinogênio com as categorias do estado nutricional: sobrepeso=3,0 (IQ:2,3‐3,6); obesidade=2,5 (IQ: 2,1‐3,2); obesidade acentuada=2,6 (IQ: 2,2‐3,5); p=0,284. Já na relação com o risco cardiometabólico, observou‐se que a mediana do fibrinogênio aumentou à medida que cresceu o número de fatores de risco (p=0,002). Essa diferença ocorreu em função dos grupos com dois e com quatro ou mais fatores (p=0,003) (fig. 1).
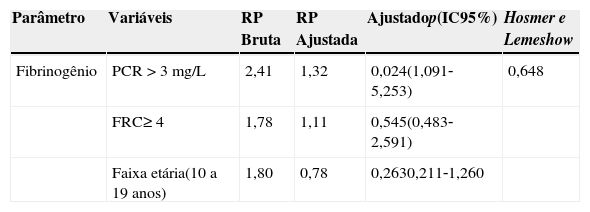
Na regressão logística múltipla, o PCR>3mg/L esteve associado independentemente aos valores elevados do fibrinogênio (igual ou superior ao percentil 75), com risco de 1,32 (p=0,024; IC95%: 1,09‐5,25). O modelo final, que incluiu como variáveis explicativas o PCR>3m/L, o número de fatores de risco ≥ 4 e a faixa etária (10 a 18 anos), apresentou um bom ajuste, avaliado pelo teste de Hosmer e Lemeshow (0,648) (tabela 3).
Valores da razão de prevalência bruta e ajustada (intervalo de confiança de 95%) de alterações do fibrinogênio em crianças e adolescentes com sobrepeso ou obesidade
| Parâmetro | Variáveis | RP Bruta | RP Ajustada | Ajustadop(IC95%) | Hosmer e Lemeshow |
|---|---|---|---|---|---|
| Fibrinogênio | PCR>3mg/L | 2,41 | 1,32 | 0,024(1,091‐5,253) | 0,648 |
| FRC≥ 4 | 1,78 | 1,11 | 0,545(0,483‐2,591) | ||
| Faixa etária(10 a 19 anos) | 1,80 | 0,78 | 0,2630,211‐1,260 |
PCR, proteína C‐reativa; FRC, fatores de risco cardiometabólico.
No presente estudo, a maioria dos avaliados apresentava obesidade e agregava quatro ou mais fatores de risco cardiometabólicos. Foi verificado, ainda, que o nível elevado de fibrinogênio, um dos fatores de avaliação do estado pró‐trombótico, esteve presente em mais de um quarto da amostra. O estado pró‐trombótico é considerado o desequilíbrio entre fatores pró‐coagulantes e pró‐fibrinolíticos, caracterizado, principalmente do ponto de vista laboratorial, pela elevação do fibrinogênio, do fator de inibição da ativação do plasminogênio (PAI‐1) e pela ativação de vias de coagulação. Está também associado à disfunção endotelial.23
Em indivíduos obesos, a elevação dos níveis de fibrinogênio e de outros fatores de coagulação, como o PAI‐1 e o fator de Von Willebrand (vWF‐Ag), tem sido associada a um aumento de eventos cardiovasculares.24 Alguns estudos8,22 verificaram níveis de fibrinogênio significativamente mais elevados em crianças com sobrepeso comparados com os níveis encontrados em crianças eutróficas.
Os níveis elevados de fibrinogênio em crianças obesas podem ser explicados pelo aumento de sua síntese. Embora não exista relato de sua produção pelo tecido adiposo, a liberação de adipocitocinas na circulação portal influenciaria a produção de fibrinogênio e de outros fatores de coagulação no fígado.7
Em pesquisa feita com 313 crianças e adolescentes obesos foi detectada uma menor prevalência de aumento nos níveis de fibrinogênio (10,7%)24 em comparação com o presente estudo (28,3%). Isso pode ser explicado porque na referida pesquisa foi usado um ponto de corte (4,0g/L a 4,5g/L), para considerar o fibrinogênio elevado, superior ao adotado neste estudo (3,4g/L). Essa comparabilidade entre os estudos é dificultada por não existir consenso para o valor normal dos níveis de fibrinogênio na infância.25 Além disso, o comportamento dos fatores de risco cardiovasculares pode variar de acordo com a etnia.24
As concentrações de fibrinogênio encontradas nos estudos atuais são preocupantes, especialmente pelo fato de estarem elevadas tanto em crianças obesas pré‐púberes quanto púberes.6 Embora o processo de estrias gordurosas e a formação de placas ateromatosas tenha sido identificado patologicamente, principalmente em adolescentes, o aumento significativo de marcadores como fibrinogênio e PAI‐1 em crianças obesas sugere o incremento do risco cardiovascular nessa faixa etária e pode acarretar a formação de placas de ateroma antes do início da puberdade nos jovens obesos.26
Em relação aos fatores de risco cardiometabólicos analisados, todas as crianças e todos os adolescentes apresentavam pelo menos um fator de risco. A mediana dos níveis séricos de fibrinogênio esteve associada ao aumento do número de fatores de risco. Isso pode ser explicado pela potencialização do risco cardiometabólico devido à aglomeração de vários biomarcadores desfavoráveis à saúde cardiovascular.22 Esse achado reforça a importância de uma intervenção precoce em crianças e adolescentes obesos ou com sobrepeso, principalmente na presença de quatro ou mais fatores de risco, uma vez que a normalização dos níveis do fibrinogênio é relatada após haver perda de peso, mudanças no estilo de vida e prática de exercício físico.5
Estudos também mostram a associação de alguns fatores de risco cardiometabólicos com níveis elevados de fibrinogênio desde a infância, como IMC,6,24 HOMA‐IR,6,25 insulina de jejum,6,24,25 glicemia,26 triglicerídeos, colesterol total, LDL‐c e HDL‐c baixo.24
Neste estudo o fibrinogênio foi associado apenas com o PCRus e a presença de quatro ou mais fatores de risco cardiometabólicos. Esse fato pode ser decorrente da composição da amostra estudada, que envolve apenas crianças e adolescentes com sobrepeso e obesidade, condição associada a um estado inflamatório subclínico, diferentemente dos demais estudos acima relatados.6,24,25 Após a regressão logística, o valor do PCRus permaneceu como uma variável preditora do nível elevado do fibrinogênio, associado a uma chance 1,3 vez maior de o indivíduo desenvolver essa condição.
Já com relação ao perfil lipídico, apesar de não ter sido encontrada associação com o fibrinogênio, a maior prevalência de colesterol total e de LDL‐c foi observada entre os que apresentaram o fibrinogênio elevado. A relação entre alterações vasculares e as lipoproteínas, especialmente as de baixa densidade, tem sido explicada como oriunda do dano induzido por radicais livres de oxigênio que, ao oxidarem essas lipoproteínas, promovem a destruição das células endoteliais e desencadeiam uma cascata de alterações com hipercoagulabilidade e redução da fibrinólise, sinalizada pela maior produção de fibrinogênio.24
Esse promove a aterosclerose por meio de diferentes mecanismos e liga‐se aos receptores de células endoteliais (Intercellular Adhesion Molecule 1‐ ICAM1); desencadeia a liberação de mediadores vasoativos, a proliferação de células do músculo liso e a indução da quimiotaxia de monócitos; desempenha também um papel na formação de células espumosas e facilita a transferência do colesterol das plaquetas para macrófagos e monócitos.6
É importante ressaltar que o fibrinogênio é uma proteína de fase aguda da inflamação com atividade pró‐coagulante e, juntamente com a PCR‐us, tem sido usada para predizer doença cardiovascular em diferentes grupos. Ambas parecem ser marcadores mais fidedignos do que a interleucina 6 (IL‐6), que tem uma meia‐vida curta.27 Ressalta‐se, ainda, que a inflamação desempenha um papel‐chave na iniciação e promoção da aterosclerose e pode levar à síndrome coronária aguda (SCA), pela indução de instabilidade da placa.23
Este estudo apresenta algumas limitações, como a ausência na literatura de um ponto de corte para os níveis normais do fibrinogênio em crianças e adolescentes, o que dificulta a comparação entre os estudos; a amplitude da faixa etária, pois há características peculiares nos diferentes grupos, como o estadiamento puberal, que interfere no metabolismo e na deposição lipídica, apesar de esse fato não ter sido observado em relação ao fibrinogênio; o uso apenas do fibrinogênio como marcador para avaliação do estado pró‐trombótico, apesar de alguns pesquisadores o considerarem um marcador de doença cardiovascular mais fidedigno do que a IL‐6;27 e o uso de uma amostra de conveniência que, como tal, pode não refletir as características da população em geral.
É importante salientar que essas limitações não diminuem a importância deste estudo, uma vez que ele inova ao destacar o comportamento do fibrinogênio em relação aos fatores de risco cardiometabólicos em crianças e adolescentes brasileiros com excesso de peso. Isso porque os estudos publicados na literatura com essa temática foram feitos em outros países e, como destacado, essa relação pode variar de acordo com a etnia.28
Dessa forma, os achados do presente estudo fortalecem a concepção de que o fibrinogênio e o PCRus são potenciais biomarcadores que podem ser usados em escolares obesos, mesmo naqueles sem complicações associadas, para o rastreamento de crianças ou adolescentes com risco de desenvolver doença cardiovascular. Ressalta‐se, ainda, que estudos longitudinais são necessários para elucidar o papel desses biomarcadores na gênese da doença aterosclerótica na infância.
FinanciamentoPrograma de Incentivo à Pós‐Graduação e Pesquisa (PROPESQ) Edital 01/2008 ‐ Pró‐Reitoria de Pós‐Graduação, Universidade Estadual da Paraíba (PRPGP/UEPB), Termo de Concessão n° 98/2008.
Conflitos de interesseOs autores declaram não haver conflitos de interesses.
Como citar este artigo: Azevedo WF, Cantalice AS, Gonzaga NC, Simões MO, Guimarães AL, Carvalho DF, et al. Fibrinogen: cardiometabolic risk marker in obese or overweight children and adolescents. J Pediatr (Rio J). 2015;91:464–70.
Estudo feito no Núcleo de Estudos em Pesquisas Epidemiológicas (Nepe), Centro de Obesidade Infantil (COI), Universidade Estadual da Paraíba (UEPB), João Pessoa, PB, Brasil.