To determine the frequency of nonalcoholic fatty liver disease using nuclear magnetic resonance as a noninvasive method.
MethodologyThis was a cross‐sectional study conducted on 50 children and adolescents followed up at an outpatient obesity clinic. The subjects were submitted to physical examination, laboratory tests (transaminases, liver function tests, lipid profile, glycemia, and basal insulin) and abdominal nuclear magnetic resonance (calculation of hepatic, visceral, and subcutaneous fat).
ResultsNonalcoholic fatty liver disease was diagnosed in 14 (28%) participants, as a severe condition in eight (percent fat >18%), and as non‐severe in four (percent fat from 9% to 18%). Fatty liver was associated with male gender, triglycerides, AST, ALT, AST/ALT ratio, and acanthosis nigricans. Homeostasis model assessment of insulin resistance and metabolic syndrome did not show an association with fatty liver.
ConclusionThe frequency of nonalcoholic fatty liver disease in the present population of children and adolescents was lower than that reported in the international literature. It is suggested that nuclear magnetic resonance is an imaging exam that can be applied to children and adolescents, thus representing an effective noninvasive tool for the diagnosis of nonalcoholic fatty liver disease in this age range. However, further national multicenter studies with longitudinal design are needed for a better analysis of the correlation between nonalcoholic fatty liver disease and its risk factors, as well as its consequences.
Determinar a frequência da doença hepática gordurosa não alcoólica utilizando ressonância magnética nuclear como um método não invasivo.
MetodologiaEste foi um estudo transversal realizado em 50 crianças e adolescentes acompanhadas em uma Clínica Ambulatorial de Obesidade. Os indivíduos foram submetidos a exame físico, testes de laboratório (transaminases, testes de função hepática, perfil lipídico, glicemia e insulina basal) e ressonância magnética nuclear abdominal (cálculo da gordura hepática, visceral e subcutânea).
ResultadosA doença hepática gordurosa não alcoólica foi diagnosticada em 14 (28%) participantes, como uma condição grave em oito (percentual de gordura > 18%) e não grave em quatro (percentual de gordura de 9 a 18%). Fígado gorduroso foi associado a sexo masculino, triglicerídeos, aspartato aminotransferase (AST), alanina aminotransferase (ALT), proporção de AST/ALT e acanthosis nigricans. O Modelo de Avaliação da Homeostase de Resistência à Insulina e a síndrome metabólica não mostraram associação com fígado gorduroso.
ConclusãoA frequência da doença hepática gordurosa não alcoólica na população atual de crianças e adolescentes foi inferior à relatada na literatura internacional. Sugerimos que a ressonância magnética nuclear seja um exame de imagem que pode ser aplicado em crianças e adolescentes, representando, assim, uma ferramenta não invasiva eficaz no diagnóstico de doença hepática gordurosa não alcoólica nessa faixa etária. Contudo, estudos multicêntricos nacionais adicionais de modelo longitudinal são necessários para uma melhor análise da correlação entre a doença hepática gordurosa não alcoólica e seus fatores de risco, bem como suas consequências.
A obesidade é uma doença crônica de alta prevalência em todo o mundo.1 Entre suas consequências, a doença hepática gordurosa não alcoólica (DHGNA) é considerada a etiologia mais comum de doença hepática entre crianças em países desenvolvidos. A DHGNA pode se manifestar como uma simples esteatose hepática (EH) e esteatose‐hepatite não alcoólica (EHNA) e raramente como cirrose ou carcinoma hepatocelular.2 A DHGNA é frequentemente associada a obesidade, resistência à insulina e hipertrigliceridemia. Os fatores de risco clínicos conhecidos para EHNA são diabetes mellitus tipo 2 e pan‐hipopituitarismo, entre outros.3
O padrão de base para o diagnóstico de DHGNA é biópsia de fígado; contudo, como esse é um método invasivo, outros métodos indiretos, como exames de imagem e laboratoriais, em combinação com histórico de saúde e exame clínico, têm sido usados em crianças e adolescentes.4
A ressonância magnética nuclear (RMN) é o exame de imagem mais sensível e objetivo para detecção e quantificação de EH em adultos, inclui níveis muito menores do que os valores de referência normais, cujo ponto de corte é ≤ 9%.5 A RMN diferencia a EH focal de possíveis lesões malignas,6 avalia a distribuição de adiposidade corporal, não emite radiação ionizante e não depende de operador.7
A prevalência de DHGNA entre crianças e adolescentes obesos varia quando diagnosticada por biópsia de fígado, RMN, ultrassom (US) ou alterações nas transaminases, com respectivos percentuais de 13 a 58,1%, 31,8 a 40%, 13,7 a 75% e 14 a 55,8%.1 Essa variação também pode ser influenciada por diversos fatores, como idade, sexo, etnia, região geográfica e grau de obesidade, além do método de avaliação.8
Em vista da alta prevalência de obesidade1 e consequentemente alta prevalência de esteatose hepática, o objetivo do presente estudo é determinar a frequência de DHGNA por RMN e correlacioná‐la com parâmetros clínicos e laboratoriais em crianças e adolescentes obesos acompanhados em uma clínica ambulatorial de obesidade.
MetodologiaEstudo transversal feito em crianças e adolescentes obesos acompanhados em uma clínica ambulatorial de obesidade de referência de 2014 a 2016, em Ribeirão Preto, Estado de São Paulo, com alto Índice de Desenvolvimento Humano (IDH), ocupa a classificação 40 no ranking do Brasil, foram 24,3% de crianças e adolescentes e uma população composta de 73,8% indivíduos brancos e 26% não brancos.9
De acordo com os pesquisadores, Ribeirão Preto tem uma prevalência de diabetes e intolerância a glicose em adultos de 12,1 e 7,7%, respectivamente,10 e sobrepeso em 30,9% das crianças em idade escolar,11 o que caracteriza uma cidade com grande população em risco de DHGNA.
O tamanho da amostra foi de 50 pacientes de acordo com um cálculo estatístico que considerou prevalência de 20% e precisão de 10%, ou seja, um percentual de erro aceitável para a prevalência estimada de 20%.
Os pacientes entre quatro e 16 anos foram convidados a participar. O consentimento informado foi obtido dos pais/responsáveis e o consentimento foi obtido de adolescentes, quando aplicável. Os critérios de exclusão incluíram presença de doença hepática ou genética, imunodeficiência, medicamentos que podem alterar as transaminases e doenças infecciosas ou inflamatórias.
A obesidade foi caracterizada por índice de massa corporal (IMC) ≥ percentil 95 de acordo com os valores de referência do Centro de Controle e Prevenção de Doenças (CDC).12 O IMC foi calculado como peso (kg)/estatura2 (m2). O peso foi medido com uma balança eletrônica do tipo plataforma, com o indivíduo descalço e de pé no centro da balança. A estatura foi medida com um estadiômetro rígido com o indivíduo descalço com calcanhares juntos, costas retas e braços estendidos ao longo do corpo. Para análise homogênea de sexo e idade, o escore Z para IMC foi calculado com o uso do software AnthroPlus (OMS, AnthroPlus, versão 1.0.2). Os indivíduos com escore Z > 3 e entre +2 e +3 foram incluídos nos grupos de obesos e superobesos, respectivamente.
A quantificação das frações de gordura hepática, abdominal e subcutânea foi determinada por RMN13,14 com o uso de um instrumento de alto campo com magnitude Tesla 1,5 (modelo ACHIEVA; Philips Medical Systems, Países Baixos), que permitiu a feitura das sequências T2 e T1: a) sequência T2 ponderada no plano coronal, sequência turbo‐spin‐echo (TSE) com respiração suprimida [TR (tempo de repetição) = 737 msec, TE (Tempo de Eco) = 80 msec, ângulo de folga = 90°, echo‐train‐length = 121, espessura da seção = 6mm, lacuna = 8%, 30 seções em 22 segundos de respiração suprimida) usada como localizador]; b) sequência T1 ponderada no plano axial, duplo eco em fase (TE = 4,6 mseg) e fora de fase (TE = 2,3 msec) com respiração suprimida, spoiled gradient echo (SGE) (TR = 111 msec, ângulo de folga = 80°, espessura da seção = 6mm, lacuna = 7%, 30 seções por echo durante 29 segundos de respiração suprimida), com aquisições no abdômen, inclusive o fígado e a região umbilical. Para a análise de gordura visceral, foi usado um corte axial obtido na sequência T1 no nível da cicatriz umbilical, com segmentação manual de gordura subcutânea e visceral e cálculo da área em mm2. A soma das áreas de gordura visceral e subcutânea na mesma seção foi considerada a área total de gordura abdominal. A quantidade de gordura nessas áreas foi calculada pela obtenção do número e tamanho dos voxels segmentados (mm). Para a análise de gordura hepática, foi selecionada a região central no melhor posicionamento do fígado e quatro regiões de interesse que medem 10mm2 foram selecionadas nos segmentos VI/VII, V/VIII, IV e II/III, evitaram‐se grandes vasos intra‐hepáticos. A média das quatro medições permitiu o cálculo da fração de gordura hepática com o uso da fórmula descrita por Fishbein et al.13 (IS em fase – IS fora de fase)/2 IS em fase. Os valores de referência acima de 18% e entre 9 e 18% foram considerados EH graves e não graves, respectivamente.5 Nenhum paciente foi sedado.
As variáveis dependentes incluíram: sexo do indivíduo, escore Z, IMC, triglicerídeos, HDL, aspartato aminotransferase (AST), alanina aminotransferase (ALT), proporção AST/ALT (< 1 sugere DHGNA e ≥ 1 sugere fibrose e cirrose intensas),15 gama GT, colesterol total, lipoproteína de baixa densidade (LDL), Modelo de Avaliação da Homeostase (HOMA), acanthosis nigricans, síndrome metabólica e pressão sanguínea.
Os dados foram analisados estatisticamente com o software SAS/STAT (SAS Institute.Inc, para Windows, versão 2014, NC, EUA).
Como os dados quantitativos mostraram distribuição assimétrica, os testes não paramétricos foram usados na análise.
O teste de Mann‐Whitney foi usado para comparar as variáveis dependentes com relação ao percentual de gordura hepática, gordura subcutânea e gordura visceral. O teste de Kruskal‐Wallis foi usado para comparar a pressão arterial sistólica e diastólica com relação às variáveis acima. O teste exato de Fisher foi usado para comparar as proporções dos parâmetros estudados. O nível de relevância foi estabelecido em 5% em todas as análises.
O coeficiente de correlação de Spearman (p) foi calculado para determinar a correlação entre o percentual de gordura hepática, gordura visceral, gordura subcutânea e circunferência abdominal e o modelo de regressão log‐binomial foi usado para estimar o índice de prevalência na análise de fatores associados para EH.
O estudo foi aprovado pelo Comitê de Ética em Pesquisa local, protocolo HCRP n° 6984/2010.
ResultadosDos 50 indivíduos incluídos no estudo, 56% (28) eram meninos, entre quatro e 16 anos. Distribuídos de acordo com a faixa etária, 44,0% (22) foram classificados como crianças entre quatro e 10 anos (média 8,3; DP ±1,8) e 56% (28) como adolescentes entre 11 e 19 anos (média 12,6; DP ± 1,6).
O exame clínico revelou medição alterada da circunferência abdominal em 100% (50) dos indivíduos, hipertensão sistólica e diastólica em 20% (10), fígado palpável em 10% (5) e acanthosis nigricans em 58% (29). Nenhum indivíduo apresentou icterícia ou baço palpável.
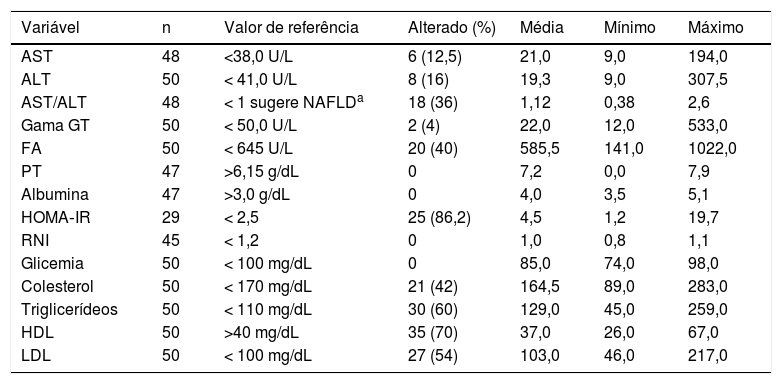
Apesar de a frequência do índice alterado do HOMA ter sido 86,2% (25/29), não foi possível calcular esse índice em toda a amostra. Os resultados dos exames laboratoriais restantes estão listados na tabela 1.
Resultados dos testes bioquímicos feitos em 50 pacientes acompanhados na Clínica Ambulatorial de Obesidade, número de pacientes testados, valor de referência, número de pacientes com resultados alterados, mediana e valores mínimos e máximos
| Variável | n | Valor de referência | Alterado (%) | Média | Mínimo | Máximo |
|---|---|---|---|---|---|---|
| AST | 48 | <38,0 U/L | 6 (12,5) | 21,0 | 9,0 | 194,0 |
| ALT | 50 | < 41,0 U/L | 8 (16) | 19,3 | 9,0 | 307,5 |
| AST/ALT | 48 | < 1 sugere NAFLDa | 18 (36) | 1,12 | 0,38 | 2,6 |
| Gama GT | 50 | < 50,0 U/L | 2 (4) | 22,0 | 12,0 | 533,0 |
| FA | 50 | < 645 U/L | 20 (40) | 585,5 | 141,0 | 1022,0 |
| PT | 47 | >6,15 g/dL | 0 | 7,2 | 0,0 | 7,9 |
| Albumina | 47 | >3,0 g/dL | 0 | 4,0 | 3,5 | 5,1 |
| HOMA‐IR | 29 | < 2,5 | 25 (86,2) | 4,5 | 1,2 | 19,7 |
| RNI | 45 | < 1,2 | 0 | 1,0 | 0,8 | 1,1 |
| Glicemia | 50 | < 100 mg/dL | 0 | 85,0 | 74,0 | 98,0 |
| Colesterol | 50 | < 170 mg/dL | 21 (42) | 164,5 | 89,0 | 283,0 |
| Triglicerídeos | 50 | < 110 mg/dL | 30 (60) | 129,0 | 45,0 | 259,0 |
| HDL | 50 | >40 mg/dL | 35 (70) | 37,0 | 26,0 | 67,0 |
| LDL | 50 | < 100 mg/dL | 27 (54) | 103,0 | 46,0 | 217,0 |
ALT, alanina aminotransferase; AST, aspartato aminotransferase; FA, fosfatase alcalina; Gama GT, gamaglutamiltranspeptidase; HDL, lipoproteína de alta densidade; HOMA‐IR, Modelo de Avaliação da Homeostase de Resistência à Insulina; LDL, lipoproteína de baixa densidade; PT, proteínas totais; RNI, razão normalizada internacional.
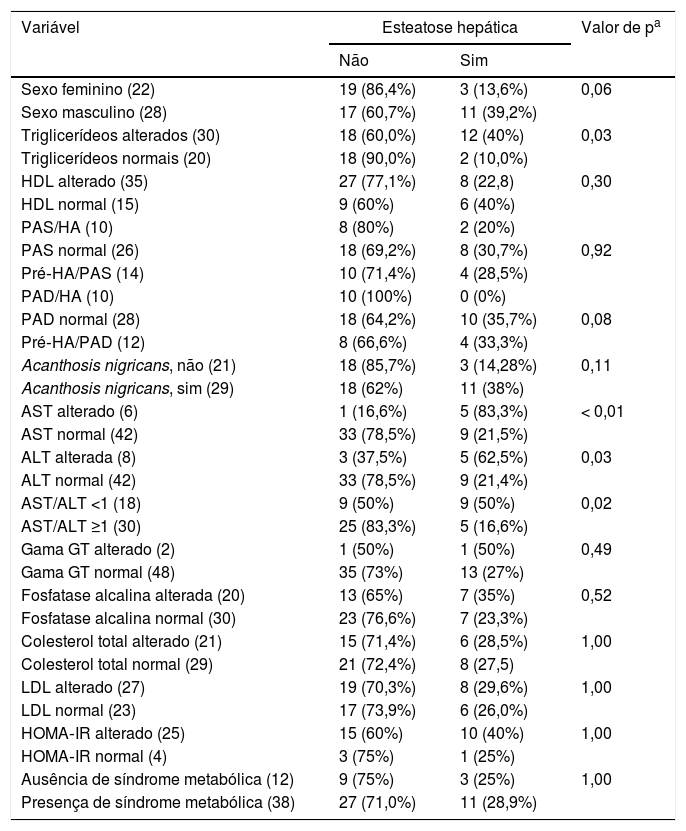
DHGNA foi diagnosticada em 28% dos indivíduos (14/50) e 57,1% (8/14) mostraram esteatose grave e 42,9% (6/14) esteatose não grave. A tabela 2 lista a frequência do diagnóstico de EH de acordo com as diferentes variáveis analisadas.
Frequência das variáveis estudadas com relação ao diagnóstico de esteatose hepática em 50 pacientes acompanhados na Clínica Ambulatorial de Obesidade
| Variável | Esteatose hepática | Valor de pa | |
|---|---|---|---|
| Não | Sim | ||
| Sexo feminino (22) | 19 (86,4%) | 3 (13,6%) | 0,06 |
| Sexo masculino (28) | 17 (60,7%) | 11 (39,2%) | |
| Triglicerídeos alterados (30) | 18 (60,0%) | 12 (40%) | 0,03 |
| Triglicerídeos normais (20) | 18 (90,0%) | 2 (10,0%) | |
| HDL alterado (35) | 27 (77,1%) | 8 (22,8) | 0,30 |
| HDL normal (15) | 9 (60%) | 6 (40%) | |
| PAS/HA (10) | 8 (80%) | 2 (20%) | |
| PAS normal (26) | 18 (69,2%) | 8 (30,7%) | 0,92 |
| Pré‐HA/PAS (14) | 10 (71,4%) | 4 (28,5%) | |
| PAD/HA (10) | 10 (100%) | 0 (0%) | |
| PAD normal (28) | 18 (64,2%) | 10 (35,7%) | 0,08 |
| Pré‐HA/PAD (12) | 8 (66,6%) | 4 (33,3%) | |
| Acanthosis nigricans, não (21) | 18 (85,7%) | 3 (14,28%) | 0,11 |
| Acanthosis nigricans, sim (29) | 18 (62%) | 11 (38%) | |
| AST alterado (6) | 1 (16,6%) | 5 (83,3%) | < 0,01 |
| AST normal (42) | 33 (78,5%) | 9 (21,5%) | |
| ALT alterada (8) | 3 (37,5%) | 5 (62,5%) | 0,03 |
| ALT normal (42) | 33 (78,5%) | 9 (21,4%) | |
| AST/ALT <1 (18) | 9 (50%) | 9 (50%) | 0,02 |
| AST/ALT ≥1 (30) | 25 (83,3%) | 5 (16,6%) | |
| Gama GT alterado (2) | 1 (50%) | 1 (50%) | 0,49 |
| Gama GT normal (48) | 35 (73%) | 13 (27%) | |
| Fosfatase alcalina alterada (20) | 13 (65%) | 7 (35%) | 0,52 |
| Fosfatase alcalina normal (30) | 23 (76,6%) | 7 (23,3%) | |
| Colesterol total alterado (21) | 15 (71,4%) | 6 (28,5%) | 1,00 |
| Colesterol total normal (29) | 21 (72,4%) | 8 (27,5) | |
| LDL alterado (27) | 19 (70,3%) | 8 (29,6%) | 1,00 |
| LDL normal (23) | 17 (73,9%) | 6 (26,0%) | |
| HOMA‐IR alterado (25) | 15 (60%) | 10 (40%) | 1,00 |
| HOMA‐IR normal (4) | 3 (75%) | 1 (25%) | |
| Ausência de síndrome metabólica (12) | 9 (75%) | 3 (25%) | 1,00 |
| Presença de síndrome metabólica (38) | 27 (71,0%) | 11 (28,9%) | |
ALT, alanina aminotransferase; AST, aspartato aminotransferase; Gama GT, gamaglutamiltranspeptidase; HA, hipertensão arterial; HDL, lipoproteína de alta densidade; HOMA‐IR, Modelo de Avaliação da Homeostase de Resistência à Insulina; LDL, lipoproteína de baixa densidade; PAD, pressão arterial diastólica; PAS, pressão arterial sistólica.
Dos 14 participantes com DHGNA, 78,6% (11) eram meninos e 21,4% (três) meninas. Houve uma diferença significativa em comparação com o percentual de gordura hepática que favoreceu os meninos (p = 0,04); contudo, gordura visceral foi encontrada no sexo feminino (p = 0,04).
Com relação ao grau de obesidade, 34% (17/50) dos indivíduos eram obesos e 66% (33/50) eram superobesos. EH foi observada em 23,5% (4/17) dos indivíduos obesos e em 30,3% (10/33) dos indivíduos superobesos. Houve uma diferença estatisticamente significativa no percentual de gordura visceral e subcutânea entre os dois grupos (p = 0,03 e p = 0,04, respectivamente), porém não no percentual de gordura hepática.
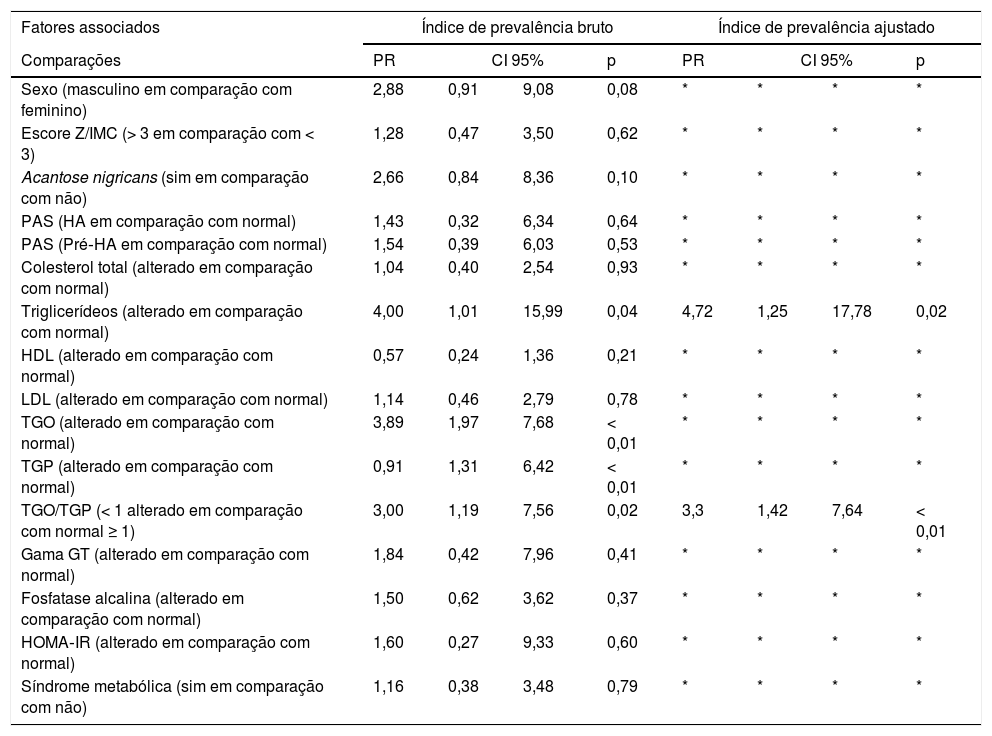
Entre os lipídios séricos, apenas triglicerídeos alterados foram associados ao percentual de gordura hepática (índice de prevalência: 4; IC de 95%: 1,01‐15,99).
Acanthosis nigricans foi detectada em 58% (29/50) dos indivíduos e 37,9% (11/29) deles tinham EH; contudo, foi observada diferença significativa apenas para o percentual de gordura hepática (p = 0,03).
As alterações no AST foram observadas em 12,5% (6/50) dos casos, 83,5% (cinco) deles apresentaram DHGNA. ALT apresentou alteração em 16% (8/50) dos casos, 62,5% deles (cinco) apresentaram DHGNA. As transaminases foram associadas à fração de gordura hepática. O índice de prevalência foi 3,89 (IC de 95%: 1,97‐7,68) para pacientes com AST alterado e 2,91 (IC de 95%: 1,31‐6,42) para ALT alterada.
A proporção AST/ALT foi < 1 em 36% (18/50) da população e 50% (9/18) dos indivíduos apresentaram proporção alterada com EH. Houve uma associação entre a proporção de AST/ALT e a fração de gordura hepática; o índice de prevalência para pacientes com proporção de AST/ALT < 1 foi igual a 3 (IC de 95%: 1,19‐7,56). A tabela 3 lista o índice de prevalência para fatores associados a esteatose hepática.
Índice de prevalência estimado por meio do ajuste dos modelos de regressão log‐binomiais para fatores associados a esteatose hepática em 50 pacientes acompanhados na Clínica Ambulatorial de Obesidade
| Fatores associados | Índice de prevalência bruto | Índice de prevalência ajustado | ||||||
|---|---|---|---|---|---|---|---|---|
| Comparações | PR | CI 95% | p | PR | CI 95% | p | ||
| Sexo (masculino em comparação com feminino) | 2,88 | 0,91 | 9,08 | 0,08 | * | * | * | * |
| Escore Z/IMC (> 3 em comparação com < 3) | 1,28 | 0,47 | 3,50 | 0,62 | * | * | * | * |
| Acantose nigricans (sim em comparação com não) | 2,66 | 0,84 | 8,36 | 0,10 | * | * | * | * |
| PAS (HA em comparação com normal) | 1,43 | 0,32 | 6,34 | 0,64 | * | * | * | * |
| PAS (Pré‐HA em comparação com normal) | 1,54 | 0,39 | 6,03 | 0,53 | * | * | * | * |
| Colesterol total (alterado em comparação com normal) | 1,04 | 0,40 | 2,54 | 0,93 | * | * | * | * |
| Triglicerídeos (alterado em comparação com normal) | 4,00 | 1,01 | 15,99 | 0,04 | 4,72 | 1,25 | 17,78 | 0,02 |
| HDL (alterado em comparação com normal) | 0,57 | 0,24 | 1,36 | 0,21 | * | * | * | * |
| LDL (alterado em comparação com normal) | 1,14 | 0,46 | 2,79 | 0,78 | * | * | * | * |
| TGO (alterado em comparação com normal) | 3,89 | 1,97 | 7,68 | < 0,01 | * | * | * | * |
| TGP (alterado em comparação com normal) | 0,91 | 1,31 | 6,42 | < 0,01 | * | * | * | * |
| TGO/TGP (< 1 alterado em comparação com normal ≥ 1) | 3,00 | 1,19 | 7,56 | 0,02 | 3,3 | 1,42 | 7,64 | < 0,01 |
| Gama GT (alterado em comparação com normal) | 1,84 | 0,42 | 7,96 | 0,41 | * | * | * | * |
| Fosfatase alcalina (alterado em comparação com normal) | 1,50 | 0,62 | 3,62 | 0,37 | * | * | * | * |
| HOMA‐IR (alterado em comparação com normal) | 1,60 | 0,27 | 9,33 | 0,60 | * | * | * | * |
| Síndrome metabólica (sim em comparação com não) | 1,16 | 0,38 | 3,48 | 0,79 | * | * | * | * |
Gamma GT, gama glutamil transferase; HA, hipertensão arterial; HDL, lipoproteína de alta densidade; HOMA‐IR, Modelo de Avaliação da Homeostase da Resistência à Insulina; IMC, índice de massa corporal; LDL, lipoproteína de baixa densidade; PAS, pressão arterial sistólica.
Houve baixa correlação entre a circunferência abdominal e a fração de gordura hepática (coeficiente de Spearman: 0,31); forte correlação para gordura subcutânea (coeficiente de Spearman: 0,87) e correlação moderada para gordura visceral (coeficiente de Spearman: 0,61).
O percentual de gordura visceral e subcutânea mostrou baixa correlação com o percentual de gordura hepática de acordo com o coeficiente de correlação de Spearman, ou seja, 0,3 e 0,36, respectivamente.
DiscussãoUm exame que foi fortemente enfatizado na literatura nos últimos anos é a espectroscopia de RMN, que, apesar de sua alta precisão, é um exame demorado de difícil feitura. Por esse motivo, no presente estudo, escolhemos a RMN, que envolve riscos mínimos, não é invasiva e é de rápida e fácil feitura. A RMN fornece resultados mais precisos que o ultrassom, não usa radiação ionizante e abrange espacialmente todo o fígado.16 Com essa ferramenta, a frequência da esteatose hepática no presente estudo foi de 28%. Ela foi menor do que a detectada na literatura em todo mundo (estudos italianos e americanos), quando usada a RMN, que varia de 31,8 a 40% de acordo com Padilha et al.1 Essa diferença na prevalência pode ser devida a diferenças em regiões, grupos étnicos e faixas etárias. Não encontramos estudo brasileiro para comparação. Nossa população consistiu em crianças com ampla miscigenação étnica, com um pouco mais de um terço de etnia branca autodeclarada e negra. Esse fato pode, em parte, explicar nossa menor prevalência, pois os relatos da literatura americana informam que a proporção de DHGNA é menor entre crianças negras (1,5%) e maior em crianças de origem hispânica (11,8%).17 A maior prevalência foi detectada na Ásia.8 Estudos sobre a prevalência da doença relacionados a diferenças étnicas têm limitações inerentes, ou seja, os dados sobre as etnias são autorrelatados e não podem ser coletados de forma confiável, as diferenças entre os grupos étnicos também podem difíceis de interpretar, pois há dificuldade para classificar os indivíduos multiétnicos. Por fim, a etnia e a situação socioeconômica estão, muitas vezes, altamente correlacionadas, complicam a interpretação das disparidades observadas nos resultados de saúde.18
Nosso índice de sexo foi 3,6:1, favoreceu meninos e corrobora os da literatura, confirma a predominância da esteatose hepática em indivíduos do sexo masculino.19 Outro estudo brasileiro detectou uma taxa de 2,7:1.20 Uma explicação para maiores taxas de fígado gorduroso em meninos do que em meninas é que os indivíduos do sexo masculino são mais propensos a distribuir o excesso de gordura corporal na parte intra‐abdominal. Estudos em adultos demonstram uma relação entre a quantidade de tecido adiposo visceral e presença de esteatose hepática. Outro possível motivo para uma diferença com base no sexo no desenvolvimento de fígado gorduroso é a influência dos hormônios sexuais. Os hormônios sexuais fazem a distribuição de gordura e músculo.19
Com relação à idade, entre crianças com menos de 10 anos, 31,8% apresentaram EH, que foi grave em quatro. Esse achado é diferente dos relatados por Duarte & Silva,20 que, em um estudo de 77 crianças/adolescentes obesos, observaram somente esteatose leve em crianças, com forma moderada detectada somente entre os adolescentes. A prevalência de fígado gorduroso aumentou com a idade, variou de 0,7%, para idades entre 2‐4 anos, até 17,3%, para idades entre 15‐19 anos. A prevalência pediátrica da DHGNA atinge seu pico na puberdade; os fatores que podem explicar a maior taxa de DHGNA em adolescentes incluem hormônios sexuais e resistência à insulina na puberdade ou seu aumento no controle sobre escolhes alimentares não saudáveis e estilo de vida sedentário.21 Provavelmente, as crianças em nosso estudo tiveram acesso a alimentos não saudáveis mais cedo.
Com relação ao perfil lipídico, houve relevância estatística somente entre triglicerídeos e a fração de gordura hepática. De acordo com Schwimmer et al.,22 as crianças com EH confirmada por biópsia apresentaram níveis significativamente altos de triglicerídeos, colesterol total, LDL, insulina, glicose e pressão sanguínea. Outros autores demonstraram uma correção entre o aumento nos níveis de triglicerídeos e redução no HDL em pacientes com EH.23
Esteatose hepática em combinação com aumento na ALT sérica é um marcador usado para diagnóstico presuntivo de EH na ausência de avaliação histopatológica.20 Neste estudo, detectamos aumento na proporção de transaminases alteradas em 16% de nossos indivíduos. As proporções de transaminases alteradas variam consideravelmente na literatura. No Brasil, Souza et al.24 detectaram somente uma taxa de 3% de níveis ALT anormais em crianças com sobrepeso e obesas. Um estudo populacional americano25 de adolescentes obesos relata crianças acompanhadas em centros de referência para tratamento de obesidade na Itália26 e China,27 detectou aumento nos níveis de ALT em 9,5%, 25% e 24% dos indivíduos investigados, respectivamente. Uma explicação para esses diferentes valores é que os serviços de referência geralmente abrangem uma população de obesos patológicos com comorbidades mais associadas, levam, assim, a uma maior proporção de transaminases elevadas.
Observamos que os pacientes obesos com EH mostraram maiores alterações nas transaminases. Cinco indivíduos (37,5%) com esteatose mostraram AST alterado e o mesmo percentual foi observado para ALT. Essas proporções foram maiores do que as relatadas por Duarte e Silva,20 que detectaram alterações em 9,1% (3/33) de seu grupo com EH. Detectamos diferença significativa nos níveis de transaminase em comparação com o percentual de gordura hepática. De acordo com Pacifico et al.,28 a concentração de transaminases está positivamente correlacionada a um aumento na fração de gordura hepática, como também é o caso para insulina e resistência à insulina. Fishbein et al.5 mostraram que o aumento nos níveis de transaminase foi significativamente maior em pacientes com aumento grave na gordura hepática. Souza et al.24 relataram que as alterações na ALT já podem ser relacionadas a certo grau de inflamação hepática, caracterizam estágio mais avançado de DHGNA.
A proporção de AST/ALT, que sugere a presença de DHGNA quando inferior a 1,15 mostrou alteração em 18 (36%) pacientes, somente um dos quais apresentou EH. A proporção foi correlacionada à fração de gordura hepática, com índice de prevalência igual a 3.
Síndrome metabólica foi detectada em 76% pacientes, 28,9% deles apresentaram EH e não foi estatisticamente correlacionada a gordura hepática, visceral ou subcutânea. Contudo, a literatura mostra que a síndrome metabólica, doença altamente aterogênica, está relacionada à presença de DHGNA em adultos.3,29
Acanthosis nigricans esteve presente em 58% participantes, 11 deles com EH. Essa proporção foi intermediária com relação ao relatado por Schwimmer et al.,30 ou seja, 49% das 43 crianças submetidas a biópsia de fígado para diagnóstico de DHGNA, e ao relatado por Duarte e Silva,20 que identificaram acanthosis nigricans em 81,8% de seus pacientes. Assim, esse achado é um importante sinal que deve ser considerado pelo pediatra, pois reflete hiperinsulinemia e, indiretamente, EH. No presente estudo, detectamos diferença estatisticamente significativa para o percentual de gordura hepática e acanthosis nigricans.
A literatura mundial mostra uma relação entre DHGNA e resistência à insulina.24 Também foi proposto que a gordura visceral pode ser o principal fator de contribuição para EH em condições de resistência à insulina.23 O presente estudo não mostrou correlação entre HOM e o percentual de gordura hepática, visceral ou subcutânea.
Considerando grupos de obesos e superobesos, não detectamos diferença estatisticamente significativa no percentual de gordura hepática entre os grupos e uma diferença foi observada somente para gordura visceral e subcutânea.
Não encontramos diferença na média de circunferência abdominal entre os indivíduos obesos com e sem EH. Esses achados são diferentes do relatado por Duarte e Silva,20 que encontraram diferença significativa no resultado em um estudo de crianças/adolescentes obesos. Houve uma correlação positiva para gordura subcutânea, uma correlação moderada para gordura visceral e nenhuma para o percentual de gordura hepática.
Awai et al.,31 em uma análise sistemática, observaram que a presença de gordura hepática determinada por US em um pouco mais da metade das crianças (48‐56%) foi confirmada por RMN e observaram que os achados da ressonância foram fortemente correlacionados (r 0,88) ao nível histológico de esteatose em crianças com DHGNA.
Este estudo apresentou algumas limitações, como o pequeno tamanho da amostra e o fato de ter sido feito em um centro de referência para obesidade, ter incluído uma grande proporção de indivíduos superobesos, representou, portanto, coorte de alto risco para DHGNA, que pode ser uma seleção de viés. Seria necessário um estudo multicêntrico nacional para validação externa da população brasileira.
Os resultados observados permitem concluir que a frequência de 28% de DHGNA determinada pela RMN, como uma ferramenta de diagnóstico, foi menor do que os valores relatados na literatura internacional. Entre os parâmetros estudados, os melhores fatores que podem ter sido associados a EH foram triglicerídeos, AST, ALT, proporção AST/ALT, sexo masculino, acanthosis nigricans e escore Z elevado (acima de 3) para IMC. Gostaríamos de chamar atenção para o valor desses parâmetros de exames físicos e laboratoriais ao avaliar pacientes obesos, pois eles podem ajudar a identificar EH e permitir, assim, diagnóstico precoce. Confirmamos que a RMN é um exame de imagem que pode ser aplicado em crianças e adolescentes, representa, assim, uma ferramenta não invasiva eficaz no diagnóstico de EH nessa faixa etária. Contudo, estudos multicêntricos nacionais adicionais de modelo longitudinal são necessários para uma melhor análise da correlação entre a EH e seus fatores de risco, bem como suas consequências.
Conflitos de interesseOs autores declaram não haver conflitos de interesse.
Como citar este artigo: Benetolo PO, Fernandes MI, Ciampo IR, Elias‐Junior J, Sawamura R. Evaluation of nonalcoholic fatty liver disease using magnetic resonance in obese children and adolescents. J Pediatr (Rio J). 2019;95:34–40.