To describe the antimicrobial activity of ¿‐defensin‐2 produced in the mammary gland and secreted in human breast milk.
MethodsThe peptide production was performed by DNA cloning. ¿‐defensin‐2 levels were quantified in 61 colostrum samples and 39 mature milk samples from healthy donors, by an indirect enzyme‐linked immunosorbent assay (ELISA). Using halo inhibition assay, this study assessed activity against seven clinical isolates from diarrheal feces of children between 0 and 2 years of age. The activity of ¿‐defensin‐2 against three opportunistic pathogens that can cause nosocomial infections was determined by microdilution test.
ResultsThe peptide levels were higher in colostrum (n=61) than in mature milk samples (n=39), as follows: median and range, 8.52 (2.6‐16.3) ¿g/ml versus 0.97 (0.22‐3.78), p<0.0001; Mann‐Whitney test. The recombinant peptide obtained showed high antimicrobial activity against a broad range of pathogenic bacteria. Its antibacterial activity was demonstrated in a disk containing between 1–4¿g, which produced inhibition zones ranging from 18 to 30mm against three isolates of Salmonella spp. and four of E. coli. ¿‐defensin‐2 showed minimum inhibitory concentrations (MICs) of 0.25¿g/mL and 0.5¿g/mL for S. marcescen and P. aeruginosa, respectively, while a higher MIC (4¿g/mL) was obtained against an isolated of multidrug‐resistant strain of A. baumannii.
ConclusionsTo the authors’ knowledge, this study is the first to report ¿‐defensin‐2 levels in Latin American women. The production and the activity of ¿‐defensin‐2 in breast milk prove its importance as a defense molecule for intestinal health in pediatric patients.
Descrever a atividade antimicrobiana da defensina‐beta 2 na glândula mamária e secretada no leite materno humano.
MétodosA produção de peptídeos foi realizada por clonagem de DNA. Os níveis de defensina‐beta 2 foram quantificados em 61 amostras de colostro e 39 de leite maduro de doadoras saudáveis pelo teste ELISA indireto. Por um ensaio de halo de inibição, avaliamos a atividade contra sete isolados clínicos diarreicos de crianças entre 0 e 2 anos. A atividade da defensina 2 contra três patógenos oportunistas que podem causar infecções nosocomiais foi determinada pelo teste de microdiluição.
ResultadosOs níveis de peptídeos estavam significativamente maiores nas amostras de colostro (n=61) que de leite maduro (n=39), como segue: 8,52 (2,6‐16,3¿g/mL) mediana e faixa em comparação a 0,97 (0,22‐3,78), p<0,0001; teste de Mann‐Whitney. O peptídeo recombinante foi obtido da alta atividade antimicrobiana demonstrada contra uma ampla gama de bactérias patogênicas. Sua atividade antibacteriana foi demonstrada em um disco contendo entre 1‐4¿g, que produziu zonas de inibição entre 18 e 30mm contra três isolados de Salmonella spp. e quatro de E. coli. A defensina‐beta 2 demonstrou concentrações inibitórias mínimas (CIMs) de 0,25¿g/mL e 0,5¿g/mL para S. marcescen and P. aeruginosa, ao passo que uma CIM maior (4¿g/mL) foi obtida contra um isolado de cepa multirresistente de A. baumannii.
ConclusõesAté onde sabemos, este estudo é o primeiro a relatar níveis de defensina em mulheres da América Latina. A produção e a atividade da defensina 2 no leite materno comprovam sua importância como uma molécula de defesa para a saúde intestinal em pacientes pediátricos.
A Organização Mundial de Saúde relata que 6,6 milhões de crianças com menos de cinco anos de idade morreram em 2012. Ademais, 44% dessas mortes ocorreram durante o período neonatal. Do final do período neonatal aos primeiros cinco anos de vida, as principais causas de óbito são pneumonia, diarreia e malária. A desnutrição é o fator de contribuição de base em aproximadamente 45% de todos os óbitos infantis, tornando as crianças mais vulneráveis a doenças graves.1 Mais da metade dessas mortes prematuras de crianças deve‐se a condições que podem ser evitadas ou tratadas com acesso a intervenções simples e acessíveis; uma delas é a amamentação.
Apenas durante a lactação, os seres humanos enfrentam o grande desafio de sobrevivência por meio do leite materno. Este está associado à proteção contra doenças diarreicas, infecções do trato respiratório e enterocolite necrosante (ECN).2–5 A proteção contra infecção em neonatos amamentados parece ocorrer por meio de diversos fatores de defesa adquiridos e inatos complementares encontrados no leite materno, inclusive oligossacarídeos e seus glicoconjugados,6 e nos peptídeos antimicrobianos (PAMs).7,8
Dentre os PAMs, a família das defensinas constitui uma importante parte da resposta imune inata na secreção de fluidos. Uma comprovação cada vez mais forte sugere a importância das defensinas na resposta imune. Resultados em estudos recentes sobre as atividades homeostáticas e de combate a doenças das defensinas humanas apontam para sua principal relevância em várias doenças pediátricas. Por exemplo, as concentrações elevadas de defensina‐beta 2 (hBD2) refletindo fortes respostas imunes intestinais foram associadas a cursos moderados de ECN.9 Contudo, os neonatos com ECN grave não apresentaram aumento nas concentrações fecais de hBD2 antes e durante a doença. Esses estudos sugerem que uma deficiência específica na ativação da imunidade inata em neonatos com extremo baixo peso ao nascer (EBPN), em vez de uma barreira epitelial intestinal prejudicada, leva a um curso mais grave de ECN.9 No contexto, a ingestão de hBD2 a partir do leite materno ganha importância. Notavelmente, os níveis de hBD2 no intestino correspondem a defensinas no leite materno7,8,10 e secreções das células epiteliais intestinais. As últimas são induzidas por anticorpos catalíticos presentes no leite materno, agindo por meio de dois receptores ativados por proteases presentes na membrana plasmática.11
As concentrações de componentes totais e específicos do leite materno humano viriam entre as mães, durante o dia, de acordo com a idade gestacional do neonato e durante a lactação.10,12 A presença de hBD2 intacto também foi relatada nas fezes dos neonatos, o que mostra que a hBD2 tende a resistir aos processos digestivos do trato gastrointestinal.13 De fato, foi proposto que a quantificação das defensinas nas fezes pode ser um biomarcador efetivo da saúde e de doenças intestinais na população pediátrica.14 A resistência da HBD2 à digestão aumentaria sua disponibilidade, o que possibilitaria a proteção de toda a superfície mucosa do trato gastrointestinal.
Neste relatório, temos um objetivo duplo. Primeiro, buscamos a quantificação de hBD2 no leite materno de doadoras venezuelanas. Segundo, caracterizamos a atividade antimicrobiana da hBD2 em comparação a bactérias associadas a enterocolite em neonatos e a bactérias gram‐negativas associadas a infecções nosocomiais.
Materiais e métodosMateriaisO kit de clonagem® TOPO® TA para sequenciamento e o kit de expressão direcional pET TOPO® foram adquiridos da Invitrogen (Invitrogen Corp., Carlsbad, Califórnia, EUA). Todos os outros reagentes foram de grau reagente analítico.
Coleta e preparação do leite maternoFoi obtido o consentimento por escrito de todas as doadoras envolvidas neste estudo antes da coleta e processamento das amostras. Nenhuma das doadoras no estudo apresentou histórico de doenças reumatológicas, respiratórias, cardiovasculares ou gastrointestinais. Os critérios de inclusão foram lactantes saudáveis que deram à luz a termo. Os critérios de exclusão foram mães que tiveram partos cesáreos, que receberam tratamento com antibiótico, com suspeita de infecção, ou com histórico de doenças autoimunes. As amostras do primeiro ao sexto dias após o nascimento são caracterizadas como colostro, ao passo que as amostras coletadas depois do 10° dia de nascimento são caracterizadas leite maduro. Obtivemos 61 amostras de colostro e 39 de leite maduro. Todas as amostras foram coletadas utilizando um protocolo padronizado aprovado pelo Comitê de Bioética do Hospital Universitário da Universidad Central de Venezuela (UCV). As amostras foram coletadas de mães saudáveis (18‐30 anos de idade) incluídas no serviço de banco de leite do Hospital Universitário. Antes da coleta, os mamilos foram limpos com cotonete e água estéril.
As amostras foram coletadas de dos seios e centrifugadas a 4° C (1.000×g por 15 minutos) para que as mesmas tivessem um aglomerado de células na parte inferior e uma camada de gordura na parte superior. O soro de leite sobrenadante no meio foi aliquotado e congelado a –80° C. Quando pronto para uso, foi descongelado a 4° C.
Culturas de célulasCélulas SKBR3 cultivadas (linhagem celular de adenocarcinoma de mama humano, HTB‐30 cat. n° 11965‐092 American Type Culture Collection (ATCC), Manassas, EUA).
Cepas de bactériasIsolados clínicos: A bactéria Acinetobacter baumannii (cepa multirresistente isolada de pacientes com infecção nosocomial do Hospital Universitário de Caracas – ICV) foi gentilmente doada pelo Dr. G. Alonso (Instituto de Biologia Experimental – UCV). Foi testado um total de sete enteropatógenos de amostras diarreicas das crianças, sendo três do gênero Salmonella: Salmonella paratyphi, Salmonella arizona, Salmonella sp. e quatro isolados diferentes de E.coli. Todos foram identificados com ensaios bacteriológicos padrão, utilizando o sistema Vitek® 32 (BioMérieux Inc., Missouri, EUA) e o cartão GNI (BioMérieux Inc., Missouri, EUA).
A cepa Pseudomonas aeruginosa ATCC 276532 foi cordialmente cedida pelo Dr. Takiff do Laboratório de Genética Molecular – IVIC. A bactéria Escherichia coli ATCC 25922 foi obtida do centro ATCC.
AnimaisGalinhas marrons de cinco meses de idade foram compradas de um fazendeiro local.
Reação em cadeia da polimerase com transcrição reserva (RT‐PCR)As células SKBR3 foram cultivadas para confluência de 80%. As células foram então tratadas por quatro horas com lipopolissacarídeo (LPS) (1¿g/mL), conforme descrito anteriormente.11 O RNA foi extraído das células SKBR3 utilizando o reagente Trizol® (Invitrogen, Carlsbad, CA, EUA), de acordo com as instruções do fabricante. O DNAc da defensina 2 foi amplificado pela reação RT_PCR utilizando iniciadores antissenso hBD2, conforme anteriormente relatado.11 A clonagem direcional do produto da PCR foi atingida utilizando iniciadores designados com locais de restrição específicos.
hBD2S:CCCGGGCATGAGGGTCTTGTATCTCCTCTTC
hBD2R:GAATTCGGAGCCCTTTCTGAATCCGCA; (255bp)
Os produtos de PCR resultantes foram purificados, e o gene completo hBD2da codificação das células SKBR3 foi clonado no vetor 100 pET (kit de expressão e clonagem direcionais pET TOPO Champion, Invitrogen, Califórnia, EUA). As proteínas de fusão foram expressas em um sistema de E.coli (Cepa BL21 DE3), de acordo com as instruções do fabricante. A proteína de fusão recombinante foi utilizada em ambos os testes de atividade antimicrobiana. Também foi utilizada para produzir anticorpos das gemas de ovos das galinhas.
Produção e purificação de anticorpos das gemas de ovos para hBD2 recombinanteO antígeno de 100¿g (hBD2 recombinante) foi diluído em solução tampão fosfato salino (PBS) e emulsionada com igual volume de adjuvante incompleto de Freund. A suspensão foi injetada por via subcutânea nas aves. As aves receberam injeções adicionais da proteína 7, 21, 31 e 42 dias depois. A imunoglobulina Y (IgY) foi purificada a partir de ovos individuais utilizando um kit de Purificação de IgY de Frangos (Cat n° 44918, Pierce Biotechnology, Illinois, EUA), seguindo as instruções do fabricante. Antes da imunização, purificamos a IgY para obter IgY pré‐imune para ser utilizada como controle negativo na padronização do teste ELISA.
Quantificação de hBD2 pelo teste ELISA indiretoFoi projetado um teste ELISA indireto para quantificação de defensina‐beta 2. As imunoplacas de 96 poços (MaxisorpTM, Affymetrix, Califórnia, EUA) foram revestidas, de um dia para o outro, com amostras de leite clarificadas e com peptídeos de defensina 1 ou 2, utilizados como padrões. Foram utilizadas as BD‐1 e BD‐2 humanas recombinantes comerciais (Cat n° 300‐51A e 300‐49, Peprotech México, Cidade do México, México). Os padrões e amostras foram diluídos em tampão de revestimento de carbonato e as placas foram bloqueadas por 4 horas em 200mL de tampão de bloqueio. A ¿‐defensina 2 anti‐humana de galinhas com IgY policlonal foi diluída em tampão de bloqueio 1:1000 e acrescida de (100¿l). Duas horas depois, a anti‐imunoglobulina secundária de coelhos conjugada com peroxidase (diluição 1:5000) em tampão de bloqueio foi acrescida de (100¿l) e incubada por 1 hora e 50 minutos. A reação colorimétrica foi feita conforme descrito anteriormente.11 Como controle, as amostras em cada placa foram tratadas com IgY pré‐imunes ou sem anticorpos primários para determinar qualquer ligação não específica. A concentração de defensina das amostras foi calculada pela interpolação de três curvas padrão construídas por meio de duas diluições de série de nossa hBD2 recombinante. A diluição ideal da amostra foi estabelecida por titulação e variou entre os doadores. Nossos testes controle mostraram que os anticorpos policlonais utilizados para as ¿‐defensinas 2 foram seletivos. Assim, a IgY anti ¿‐defensina 2 não reagiu com ¿‐defensina 1.
Testes de atividade antimicrobianaAs cepas testadas foram cultivadas em meio Luria‐Bertano (LB) líquido para um OD600 ∼1.0. As suspensões resultantes foram diluídas a uma concentração de ∼104 de unidades de formação de colônias (CFU) por mL. A alíquota de LB de 100 l foi distribuída em placas de 96 poços.15 A atividade antibacteriana da hBD2 foi avaliada com peptídeo diluído em série para obter concentrações de 8; 4; 2; 1; 0,5; 0,25 e 0,125¿g/mL. Um controle de crescimento sem hBD2 e um controle de esterilidade sem inóculo também foram incluídos em cada cepa. As placas foram incubadas a 35° C e as medições de turbidez a 600nm utilizando um leitor de microplacas por multidetecção Synergy HT (Synergy HT, Bio‐Tek Instruments, Vermont, EUA). Em um único experimento, cada concentração de hBD2 foi testada três vezes. Cada micro‐organismo foi analisado no mínimo em três experimentos independentes. A análise estatística e as curvas de resposta à dose foram obtidas utilizando o software K4 fornecido pela Synergy HT (Bio‐Tek Instruments, Vermont, EUA). As concentrações inibitórias mínimas (CIMs) foram determinadas a partir das curvas dos perfis de inibição do crescimento com uma absorbância de OD600nm, e representam a menor concentração da hBD2 que inibiu o crescimento bacteriano em 90% na 24a hora de cultura.
Susceptibilidade a antimicrobianos por testes de difusão em discoA susceptibilidade in vitro de isolados clínicos a defensina pode ser aproximadamente determinada por testes de difusão em disco.16 Foi utilizada canamicina como controle interno. Os discos foram preparados utilizando uma solução de antibiótico reserva acrescentando uma solução antimicrobiana em cada disco de papel. Utilizamos folhas de papel‐filtro da BioRad (Cat n°: 170‐3956, BioRad, Califórnia, EUA). Eles foram preparados uma hora antes da aplicação nas placas, seguido de 30 minutos de absorção. Os discos preparados não foram armazenados, tendo sido secos antes da aplicação.
Após 24 horas de incubação, as zonas de inibição foram medidas. O diâmetro das áreas de inibição pôde ser convertido às categorias de susceptível, intermediário ou resistente (S, I ou R), de acordo com as tabelas padrão. A interpretação, pontos de interrupção e esquema de categorização foram feitos de acordo com as recomendações do Instituto de Padronização Clínica e Laboratorial (Clinical and Laboratory Standard Institute – CLSI).
Análise estatísticaA apresentação gráfica e a análise estatística dos dados foram feitas utilizando o software GraphPad Prism (versão 4.0) (GraphPad Software Inc., Califórnia, EUA). Foi utilizado o teste U de Mann‐Whitney para comparação entre os grupos. A relevância estatística foi estabelecida em p<0,05.
ResultadosExpressão do peptídeo recombinante de hBD2O peptídeo recombinante de hBD2 foi produzido a partir do DNAc da célula epitelial mamária com base na conhecida sequência de nucleotídeos da hBD2 (também conhecida como DEFB4A), e sua identidade foi estabelecida pelo sequenciamento do DNA. Esse peptídeo recombinante foi utilizado para produzir IgY policlonal. Esses anticorpos foram utilizados no ELISA indireto para a detecção e a quantificação da ¿‐defensina humana nas amostras de leite humano.
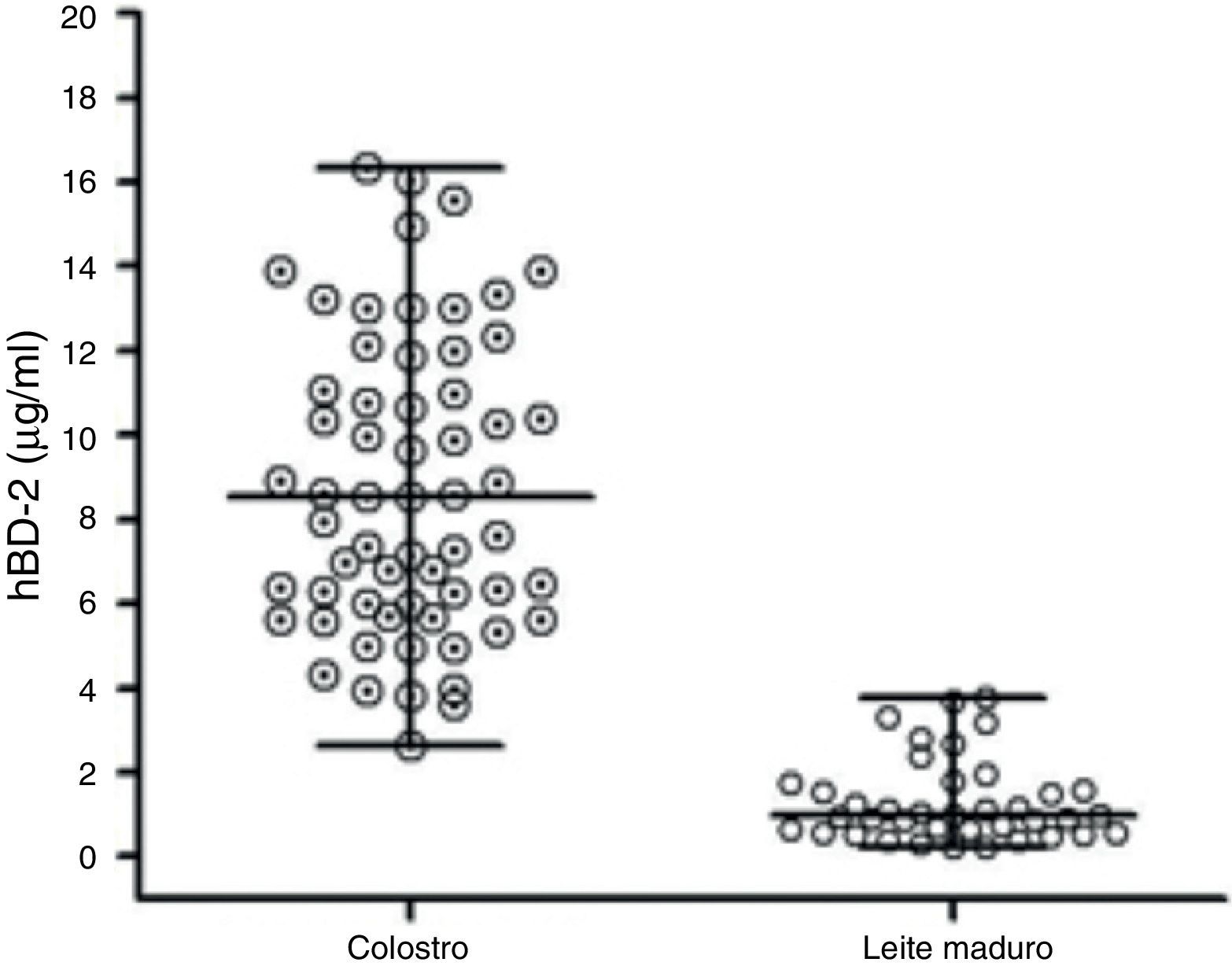
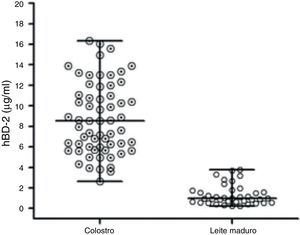
Quantificação de hBD2 nas amostras de leite humanoUm total de 100 mães venezuelanas saudáveis foi recrutado para este estudo. Os níveis de peptídeo estavam significativamente maiores no colostro: 8,52 (2,6‐16,3¿g/mL) mediana e faixa, que nas amostras de leite materno 0,97 (0,22‐3.78), p<0,0001; teste de Mann‐Whitney. A quantificação de hBD2 nas amostras de leite humano apresentou variabilidade interindividual, bem como em cada estágio da lactação (fig. 1).
Níveis de defensina encontrados nas amostras de leite materno das 100 doadoras. As linhas horizontais indicam a mediana de concentração de defensina nas amostras de colostro e leite maduro. Os níveis de peptídeos estavam significativamente maiores no colostro, 8,52 (2,6‐16,3¿g/mL) mediana e faixa, que no leite maduro, 0,97 (0,22‐3,78). Foi usado o teste de Mann‐Whitney para comparar os grupos, com p < 0,0001.
O peptídeo recombinante foi analisado para verificação da atividade dos antienteropatógenos. Os resultados desses experimentos são mostrados na tabela 1 e figura 2.
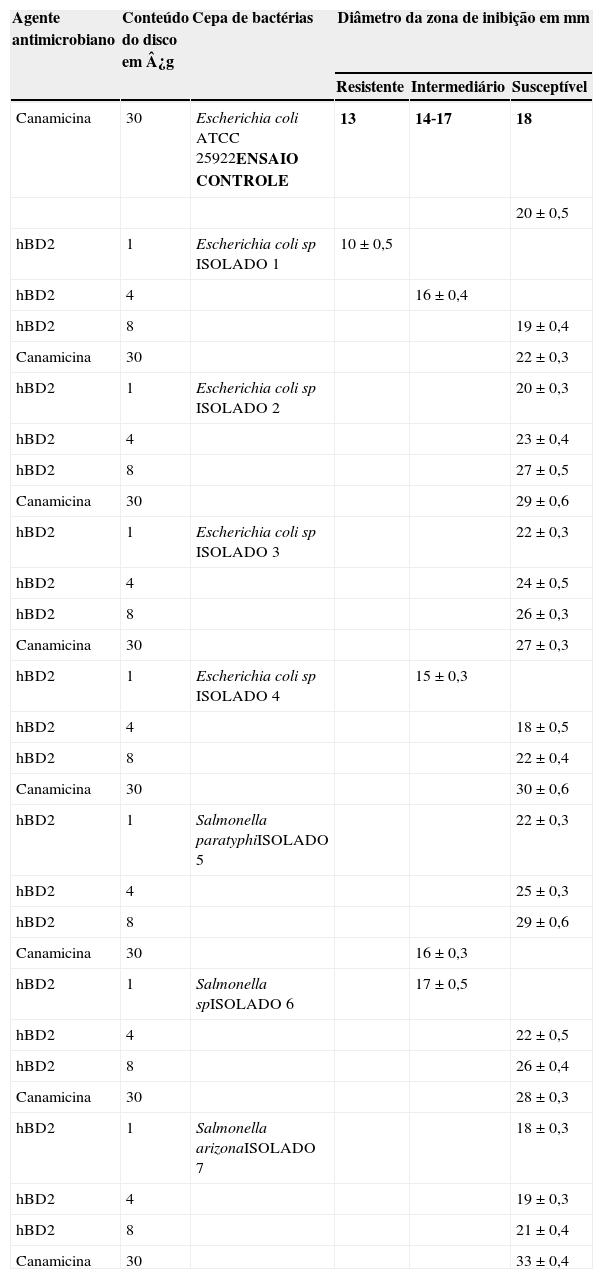
Concentrações inibitórias mínimas de peptídeo defensina‐beta 2 humano contra sete cepas clínicas isoladas de Salmonella e E. coli
| Agente antimicrobiano | Conteúdo do disco em ¿g | Cepa de bactérias | Diâmetro da zona de inibição em mm | ||
|---|---|---|---|---|---|
| Resistente | Intermediário | Susceptível | |||
| Canamicina | 30 | Escherichia coli ATCC 25922ENSAIO CONTROLE | 13 | 14‐17 | 18 |
| 20±0,5 | |||||
| hBD2 | 1 | Escherichia coli sp ISOLADO 1 | 10±0,5 | ||
| hBD2 | 4 | 16±0,4 | |||
| hBD2 | 8 | 19±0,4 | |||
| Canamicina | 30 | 22±0,3 | |||
| hBD2 | 1 | Escherichia coli sp ISOLADO 2 | 20±0,3 | ||
| hBD2 | 4 | 23±0,4 | |||
| hBD2 | 8 | 27±0,5 | |||
| Canamicina | 30 | 29±0,6 | |||
| hBD2 | 1 | Escherichia coli sp ISOLADO 3 | 22±0,3 | ||
| hBD2 | 4 | 24±0,5 | |||
| hBD2 | 8 | 26±0,3 | |||
| Canamicina | 30 | 27±0,3 | |||
| hBD2 | 1 | Escherichia coli sp ISOLADO 4 | 15±0,3 | ||
| hBD2 | 4 | 18±0,5 | |||
| hBD2 | 8 | 22±0,4 | |||
| Canamicina | 30 | 30±0,6 | |||
| hBD2 | 1 | Salmonella paratyphiISOLADO 5 | 22±0,3 | ||
| hBD2 | 4 | 25±0,3 | |||
| hBD2 | 8 | 29±0,6 | |||
| Canamicina | 30 | 16±0,3 | |||
| hBD2 | 1 | Salmonella spISOLADO 6 | 17±0,5 | ||
| hBD2 | 4 | 22±0,5 | |||
| hBD2 | 8 | 26±0,4 | |||
| Canamicina | 30 | 28±0,3 | |||
| hBD2 | 1 | Salmonella arizonaISOLADO 7 | 18±0,3 | ||
| hBD2 | 4 | 19±0,3 | |||
| hBD2 | 8 | 21±0,4 | |||
| Canamicina | 30 | 33±0,4 | |||
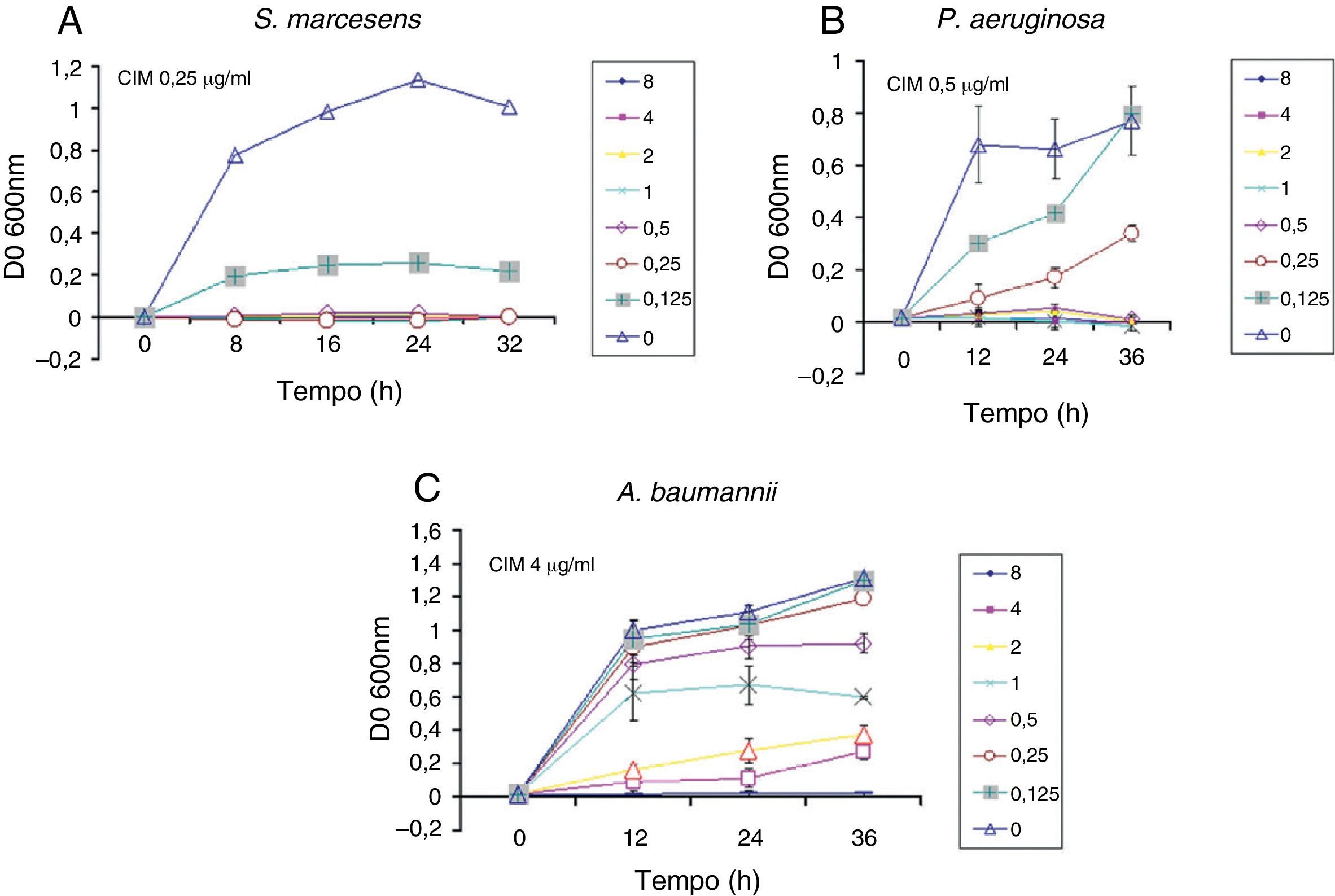
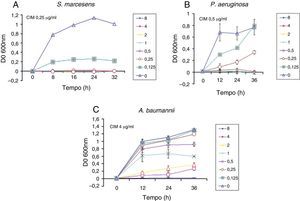
Efeito da hBD2 sobre o crescimento bacteriano. Densidade óptica em diferentes momentos de crescimento em LB de três cepas, (A) S. marcesens (B) P. aeruginosa e (C) A. baumannii, durante o tratamento com diluições em série do peptídeo recombinante. A mais alta concentração de peptídeos testada foi de 8¿g/mL. O teste foi realizado três vezes em diferentes dias, e as médias e desvios‐padrão estão indicados. Foi encontrada uma diferença estatisticamente significativa (p ≥ 0,05). As concentrações inibitórias mínimas (CIMs) de defensina para cada cepa são consideradas as menores necessárias para inibir o crescimento de>90% do controle. Os valores das CIMs estão indicados conforme determinado após 24 horas de exposição à defensina‐beta 2 humana.
De acordo com o CLSI, o controle da Canamicina em uma concentração de 30¿g no disco deve produzir um halo de inibição de 18‐25mm em comparação à E.coli ATCC 25922.17 Em nosso estudo, o controle apresentou uma inibição de 20mm (tabela 1). Obviamente, não há uma medida padrão de diâmetro para inibição pela defensina. Contudo, observamos fortes propriedades bactericidas em relação a todos os sete isolados obtidos das fezes diarreicas com diâmetros acima de 18mm.
Além disso, a hBD2 mostrou atividade antimicrobiana em relação a três cepas representativas de espécies bacterianas envolvidas em infecções nosocomiais. Obtivemos CIMs de 0,25¿g/mL e 0,5¿g/mL para S. marcescen e P. aeruginosa. Obtivemos uma MIC relativamente maior (4¿g/mL) em comparação a um isolado clínico de uma cepa multirresistente (MDR) de A.baumannii.
DiscussãoOs atrasos no desenvolvimento do sistema imunológico em neonatos são compensados pela glândula mamária, fornecendo assim a proteção necessária. A lactação fornece não apenas nutrição, mas também proteção vital contra patógenos ambientais. Mesmo com variabilidade interindividual em níveis de diferentes fatores de proteção relacionados ao leite, a amamentação fornece proteção contra enterocolite necrosante,4 infecção gastrointestinal3 e infecções respiratórias2 no recém‐nascido. Este artigo abordou a produção de hBD2 em doadoras de leite venezuelanas e explorou o possível efeito de proteção da hBD2 contra isolados enteropatógenos obtidos das fezes diarreicas das crianças.
Wang et al. relataram que os níveis de hBD2 em mães chinesas diferiram entre colostro e leite maduro.18 No colostro, os intervalos de concentração de hBD2 foram 0,31‐19,12 ng/mL, em comparação a 52,65‐182,29 pg/mL encontrados no leite maduro. De acordo com Wang et al., também encontramos maiores níveis de hBD2 no colostro que no leite maduro; contudo, ambos os grupos de amostras das mulheres venezuelanas mostraram maiores níveis de hBD2 que o grupo chinês.18 As diferenças entre os níveis de expressão de hBD2 entre ambos os resultados dos estudos são surpreendentes. Ambos os relatos possuem igual número de doadoras, portanto, essas diferenças podem ser atribuídas à etnia dos grupos envolvidos. Um artigo recente de Burch et al. destacou que a raça/etnia parece ter influência sobre o nível de fatores imunológicos no leite materno,19 e nossos resultados parecem comprovar esses achados. Até onde sabemos, nosso estudo constitui o primeiro relato da caracterização dos níveis de defensina no leite materno em mulheres da América Latina, e esses achados ajudam a reforçar a recomendação de amamentação exclusiva, visando proteger a saúde de crianças em risco. Foram encontradas defensinas em uma concentração de 1‐10mg/mL em grânulos de neutrófilos20,21 e concentração de 20‐100mg/mL no epitélio da língua de suínos.22 Acredita‐se que menores concentrações (0,1‐1mg/mL) de ¿‐defensinas podem induzir quimiotaxia,23,24 e nossos resultados mostram uma faixa semelhante de concentração.
De acordo com nossos resultados, Castellote et al.25 relataram que a concentração de fatores imunológicos nas amostras de colostro é maior no leite de transação ou maduro. Eles sugerem que o índice elevado de fatores ativos em neonatos prematuros e suas correlações inversas ao peso ao nascer podem indicar que sua concentração no leite é modulada pelas necessidades do neonato. Os mecanismos responsáveis pelas diferenças na composição do leite entre os estágios de lactação ainda não foram estabelecidos.
Foi relatada a atividade bactericida in vitro das defensinas humanas 2 em comparação a enteropatógenos e cepas nosocomiais.26 De fato, cada defensina‐beta caracterizada até o momento tem a capacidade de matar ou inibir in vitro diversas bactérias. Essa atividade varia, principalmente, com concentrações de sal e proteínas do plasma no teste.21 Assim, a comparação direta da CIM pode não ser determinante. Contudo, é notável que a concentração na qual essa defensina mostra atividade antimicrobiana é a mesma que no leite materno; fato que não apenas nos impressiona, mas também indica sua função fisiológica.
O papel desse peptídeo na fisiologia intestinal do recém‐nascido tem sido antimicrobiano. A diarreia bacteriana é uma das principais causas de infecção na infância. Portanto, é importante determinar a atividade da hBD2 em isolados de casos clínicos diarreicos. Neste estudo, utilizamos quatro diferentes isolados de E.coli e três de Salmonella spp. Em todos os casos, encontramos atividade inibitória do crescimento, em comparação aos parâmetros de referência da canamicina (com cepa de referência dos isolados E.coli ATCC 25922). Kapel et al.13 descreveram níveis fecais elevados de hBD2 em pacientes pediátricos com colite ulcerativa (CU) e doença de Crohn (DC), em comparação a controles saudáveis. Eles encontraram um aumento de três a quatro vezes nos níveis fecais de hBD2 em crianças com DC, diferentemente do aumento > 10 nos níveis fecais de hBD2 para CU. Notavelmente, Barrera et al.11 relataram que as células epiteliais do intestino aumentaram a secreção de hBD2 após tratamento com anticorpos catalíticos com atividade de protease purificada do leite materno. Portanto, deve ser considerado que o índice de hBD2 nas amostras fecais corresponde à soma da produção de peptídeos intestinais mais a ingestão direta por meio do leite materno. Ademais, Hiratsuka et al.27 indicaram redução da atividade das defensinas‐beta na fibrose cística, sugerindo que as defensinas‐beta podem desempenhar um papel importante no processo patológico de infecção crônica do trato respiratório. Além de sua atividade antimicrobiana, foram relatadas outras atividades da hBD2. Os achados de Gambichler et al.28 mostraram padrões de expressão alterados da hBD2 no carcinoma basocelular não ulcerado, sugerindo que a hBD2 também desempenha um papel na patogênese desse câncer de pele não melanoma. Recentemente, Li et al.29 indicaram que a terapia genética com hBD2 pode mediar a imunidade antitumoral e os efeitos antitumorais locais. Adicionalmente, a hBD2 apresentou atividade quimiotática para monócitos, macrófagos, neutrófilos e células dendríticas imaturas.15
Por fim, determinamos a atividade antimicrobiana da hBD2 recombinante em três bactérias gram‐negativas (S. marcescen, P. aeruginosa, A. baumannii) que podem ser patógenos oportunistas em seres humanos, afetando pessoas com sistema imunológico comprometido. Um fator importante em sua proeminência como patógenos é a resistência intrínseca a antibióticos e desinfetantes que possuem, que os tornam importantes indivíduos no campo de infecção nosocomial. A hBD2 recombinante apresentou crescimento inibido em todas as bactérias testadas. A susceptibilidade da HBD2 mostrada pela cepa da MDR A. Baumannii está de acordo com o relatado por Routsias et al.26 Eles sugeriram que, além de mutações que conferem resistência a determinados antibióticos, essas bactérias sofrem mutações que afetam a geração de energia necessária para a manutenção da integridade de suas membranas ou afetam a própria estrutura das membranas, levando a uma maior susceptibilidade à hBD2. A ação lítica dos PAMs ocorre por meio de um evento vinculante, com o qual os peptídeos positivamente carregados interagem com as membranas plasmáticas aniônicas dos micro‐organismos alvo. Sabe‐se que a atividade antimicrobiana da hBD2 e de outros PAMs é altamente sensível à presença de catiões bivalentes, soro e macromoléculas aniônicas, como os glicosaminoglicanos. Contudo, vários desses PAMs ainda conseguem conferir proteção nessas doenças. Nesse sentido, outras propriedades imunomoduladoras, como migração celular, sobrevida, proliferação e indução de mediadores imunológicos, provavelmente podem ter mais relevância em seus mecanismos de combate a doenças.30
O uso inadequado de antibióticos levou à transferência horizontal de genes entre micróbios e estimulou seu potencial evolutivo de desenvolver resistência contra antimicrobianos convencionais. Em consequência, a resistência bacteriana aos antibióticos é um problema crescente no tratamento médico moderno de doenças infecciosas, conforme mostrado pelo crescente número de pacientes imunocomprometidos com infecções nosocomiais. Para superar temporariamente o problema da resistência, são necessárias novas abordagens terapêuticas. Como os peptídeos antimicrobianos são produtos da evolução de longo prazo por natureza, o estudo dessa família pode nos fornecer uma solução viável.
Em suma, a amostra de população de mulheres neste estudo apresentou níveis elevados de defensina 2 no leite, sugerindo que a raça/etnia pode influenciar o nível de fatores imunológicos no leite materno. Os níveis elevados de peptídeo encontrados no colostro sugerem a importância desse fator imunológico inato nos primeiros dias de vida. O peptídeo hBD2 mostrou atividade antimicrobiana em relação a várias bactérias, inclusive patógenos comuns que causam diarreia em neonatos e gram‐negativos, relevantes em infecções nosocomiais. A atividade e o elevado índice da hBD2 no leite materno enfatizam a superioridade da amamentação na nutrição de neonatos.
Conflitos de InteresseOs autores declaram não haver conflitos de interesse.
Este artigo recebeu bolsa do Instituto Venezolano de Investigaciones Científicas (IVIC). Este estudo fez parte da dissertação de mestrado de Joanna Baricelli no Centro de Estudos Avançados (CEA‐IVIC).
Como citar este artigo: Baricelli J, Rocafull MA, Vázquez D, Bastidas B, Báez‐Ramirez E, Thomas LE. ¿‐defensin‐2 in breast milk displays a broad antimicrobial activity against pathogenic bacteria. J Pediatr (Rio J). 2015;91:36–43.
Este artigo recebeu bolsa do Instituto Venezolano de Investigaciones Científicas (IVIC), Caracas, Venezuela.