To identify factors that contribute to the increased susceptibility and severity of COVID‐19 in obese children and adolescents, and its health consequences.
SourcesStudies published between 2000 and 2020 in the PubMed, MEDLINE, Scopus, SciELO, and Cochrane databases.
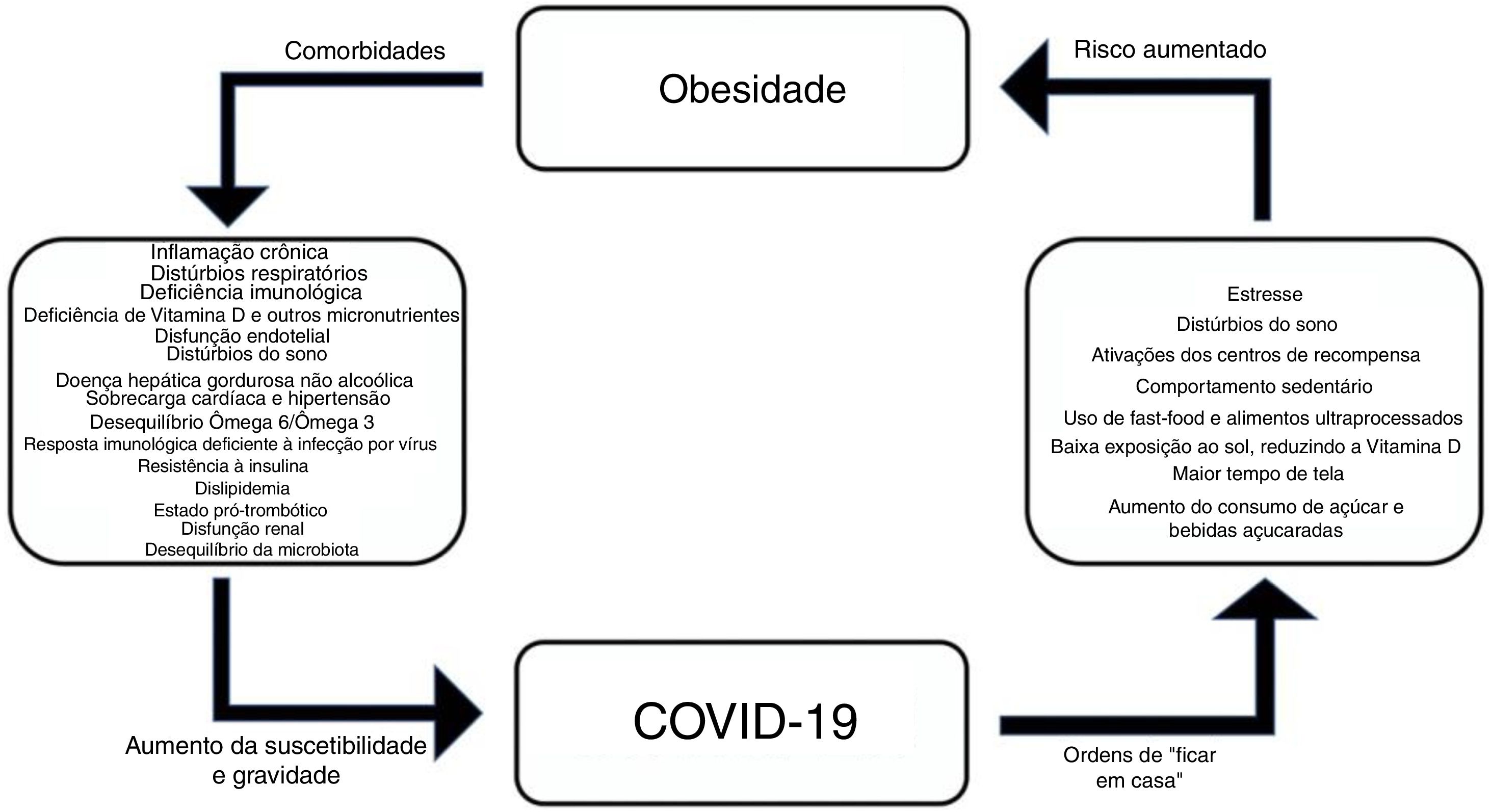
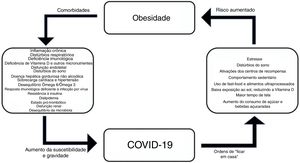
Summary of findingsObesity is a highly prevalent comorbidity in severe cases of COVID‐19 in children and adolescents; social isolation may lead to increase fat accumulation. Excessive adipose tissue, deficit in lean mass, insulin resistance, dyslipidemia, hypertension, high levels of proinflammatory cytokines, and low intake of essential nutrients are factors that compromise the functioning of organs and systems in obese individuals. These factors are associated with damage to immune, cardiovascular, respiratory, and urinary systems, along with modification of the intestinal microbiota (dysbiosis). In severe acute respiratory syndrome coronavirus 2 infection, these organic changes from obesity may increase the need for ventilatory assistance, risk of thromboembolism, reduced glomerular filtration rate, changes in the innate and adaptive immune response, and perpetuation of the chronic inflammatory response.
ConclusionsThe need for social isolation can have the effect of causing or worsening obesity and its comorbidities, and pediatricians need to be aware of this issue. Facing children with suspected or confirmed COVID‐19, health professionals should 1) diagnose excess weight; 2) advise on health care in times of isolation; 3) screen for comorbidities, ensuring that treatment is not interrupted; 4) measure levels of immunonutrients; 5) guide the family in understanding the specifics of the situation; and 6) refer to units qualified to care for obese children and adolescents when necessary.
Identificar fatores que contribuem para o aumento da suscetibilidade e gravidade da COVID‐19 em crianças e adolescentes obesos e suas consequências para a saúde.
Fontes de dadosEstudos publicados entre 2000 e 2020 nas bases de dados PubMed, Medline, Scopus, SciELO e Cochrane.
Síntese dos dadosA obesidade é uma comorbidade altamente prevalente em casos graves de COVID‐19 em crianças e adolescentes e o isolamento social pode levar ao aumento do acúmulo de gordura. Tecido adiposo excessivo, déficit de massa magra, resistência à insulina, dislipidemia, hipertensão, altos níveis de citocinas pró‐inflamatórias e baixa ingestão de nutrientes essenciais são fatores que comprometem o funcionamento dos órgãos e sistemas no indivíduo obeso. Esses fatores estão associados a danos nos sistemas imunológico, cardiovascular, respiratório e urinário, juntamente com a modificação da microbiota intestinal (disbiose). Na infecção por SARS‐CoV‐2, essas alterações orgânicas causadas pela obesidade podem aumentar a necessidade de assistência ventilatória, risco de tromboembolismo, taxa de filtração glomerular reduzida, alterações na resposta imune inata e adaptativa e perpetuação da resposta inflamatória crônica.
ConclusõesA necessidade de isolamento social pode ter o efeito de causar ou agravar a obesidade e suas comorbidades e pediatras precisam estar cientes desse problema. Diante de crianças com suspeita ou confirmação de COVID‐19, os profissionais de saúde devem 1) diagnosticar o excesso de peso; 2) aconselhar sobre cuidados de saúde em tempos de isolamento; 3) fazer a triagem de comorbidades, garantindo que o tratamento não seja interrompido; 4) medir os níveis de imunonutrientes; 5) orientar a família respeitando as especificidades da situação; e 6) encaminhamento a unidades qualificadas para cuidar de crianças e adolescentes obesos, quando necessário.
Em dezembro de 2019, o mundo foi surpreendido com o aparecimento, na China, de uma pneumonia grave causada por um novo tipo de coronavírus, uma infecção que se espalhou rapidamente pelos países. Foi considerada uma pandemia três meses depois e a doença recebeu o nome de COVID‐19.1,2 Como em adultos, mas com menor frequência, crianças com comorbidades – doenças renais e pulmonares crônicas, malignidades, diabetes, obesidade, anemia falciforme, distúrbios imunológicos, anormalidades cromossômicas, doenças cardíacas e malformações congênitas – são mais propensas a desenvolver condições graves causadas pela COVID‐19.3–6 A presente revisão tem como objetivo identificar os fatores que contribuem para o aumento da suscetibilidade e gravidade da COVID‐19 em crianças e adolescentes obesos e suas consequências para a saúde, para colaborar para um melhor cuidado clínico desses pacientes.
Coronavírus da síndrome respiratória aguda grave 2 (SARS-CoV-2)Embora com menos frequência, a COVID‐19 tem afetado a faixa etária pediátrica. Alguns estudos indicam que a incidência da COVID‐19 em crianças e adolescentes pode atingir 5% dos casos confirmados,7 é um pouco mais elevada no sexo masculino.3,8 Além disso, a doença também se apresentou com menor gravidade em relação aos pacientes adultos. Nos EUA, em março de 2020, as taxas de hospitalização entre menores de 17 anos variaram de 0,1 a 0,3/100.000 habitantes.9 Da mesma forma, a mortalidade em crianças e adolescentes mostrou‐se baixa. Um estudo epidemiológico na China, com 2.135 indivíduos menores de 18 anos, descreveu apenas uma morte; os lactentes apresentaram, proporcionalmente, um número maior de casos graves e críticos.8 Em uma revisão sistemática10 que envolveu 2.228 pacientes menores de 16 anos, foram encontradas duas mortes, uma das quais foi a mesma relatada no estudo chinês.8
Crianças e adolescentes parecem adquirir SARS‐CoV‐2 principalmente através do contato com parentes infectados.4,11–13 Por outro lado, o papel das crianças e adolescentes na transmissão permanece incerto;12 entretanto, a presença de SARS‐CoV‐2 na orofaringe e nas fezes de indivíduos assintomáticos e sintomáticos tem sido descrita14–16 e a carga viral não difere da dos adultos.17 A transmissão vertical parece ser rara, com poucos casos descritos.18–20 Até o momento, nenhuma partícula viral viável foi identificada no leite materno, embora o RNA do SARS‐CoV‐2 tenha sido detectado em três amostras.21 Um estudo relatou a presença de Anti‐SARS‐CoV2 IgA no leite materno de mulheres que se recuperaram da COVID‐19.22 Os testes para identificar o vírus no cordão umbilical, placenta e líquido amniótico também foram negativos.23–26
O período de incubação observado em uma série de 11 estudos que envolveu indivíduos com menos de 16 anos foi de 2 a 25 (média = 7) dias.13 A maioria das crianças e adolescentes afetados pela COVID‐19 apresenta sintomas leves a moderados, com uma porcentagem significativa de pacientes assintomáticos. Pacientes:13,27 naqueles com sintomas graves, uma pequena porcentagem exige cuidados intensivos13 e a maior proporção parece estar concentrada em crianças com menos de um ano.28 Uma revisão sistemática constatou que, em 13 recém‐nascidos infectados com SARS‐CoV‐2 durante o período perinatal, a maioria permaneceu assintomática ou apresentou sintomas leves.29 Os sintomas mais comuns da infecção por SARS‐CoV‐2 em crianças e adolescentes são tosse e febre; dor de garganta, espirros, mialgia, chiado no peito, fadiga, rinorreia, obstrução nasal, diarreia e vômito; hipóxia e dispneia são achados incomuns.10,11,13,27,30 Em um estudo chinês com indivíduos menores de 16 anos com infecção por SARS‐CoV‐2, 28,7% apresentaram taquipneia.4 Alterações discretas, como leucocitose, leucopenia, linfopenia e pequena elevação de proteínas da fase aguda, foram as alterações laboratoriais mais comuns.4,13,30,31 As alterações radiográficas são geralmente menos pronunciadas do que nos adultos, destaca‐se a opacificação irregular unilateral ou bilateral em algumas séries de casos.3,4,13,31 Em uma revisão sistemática que analisou a tomografia computadorizada do tórax empacientes menores de 18 anos, a opacificação em “vidro fosco” foi observada em 37,8% dos exames, geralmente unilateral, nos lobos inferiores e consideradas leves.32
As razões para a menor gravidade da COVID‐19 em indivíduos na faixa etária pediátrica permanecem sem resposta. Algumas hipóteses foram levantadas: menor exposição ao SARS‐CoV‐2 devido ao isolamento social e fechamento das escolas; menor frequência de comorbidades e exposição ao tabagismo quando comparados aos adultos; e maior capacidade de regeneração pulmonar.33,34 As crianças apresentam menor expressão da ECA‐2 do que os adultos, o que torna o processo de internalização do vírus menos eficiente,35 e podem ter uma imunidade inata treinada mais eficaz, que é uma resposta inata de memória de duração média, devido ao aumento da exposição a vírus e vacinas.33,34,36 Esse fenômeno tem sido usado para explicar as menores taxas de mortalidade por COVID‐19 em países que fazem a vacinação universal com BCG, em comparação com aqueles que não adotam essa estratégia.33,34,37 Além disso, crianças e adolescentes não teriam a chamada “imunosenescência” observada em idosos, fenômeno caracterizado por, entre outras características, um estado inflamatório crônico.33,34,38 Por fim, particularidades da expressão da ECA‐2 em indivíduos mais jovens, como observado em modelos animais,39 poderiam limitar as consequências da diminuição da expressão dessa enzima causada pela invasão de pneumócitos pelo SARS‐CoV‐2,34 principalmente aquelas relacionadas à elevação da angiotensina II.40
Fisiopatologia da obesidade e sua relação com COVID‐19A relação entre a obesidade e doenças virais tem sido estudada há vários anos. Durante a epidemia do H1N1, essa área ganhou particular interesse, pois observou‐se que pacientes obesos apresentavam maior risco de desenvolver a doença, maior permanência na UTI e maior mortalidade.41 Esse fato foi demonstrado mesmo em crianças, com comprometimento da resposta imune, principalmente celular, ao vírus da influenza e também resposta vacinal inadequada em indivíduos obesos.42 Durante a recente epidemia de COVID‐19 no Canadá, a obesidade foi o terceiro fator demográfico mais prevalente entre as crianças internadas na UTI, atrás apenas daquelas com doenças associadas graves, imunossupressão e câncer.6 Em Nova York, a obesidade foi a comorbidade mais prevalente entre os 50 casos graves de COVID‐19 e afeta crianças e adolescentes.43
COVID‐19 e riscos relacionados à obesidade em adultosEm relação à COVID‐19, observações no início da pandemia demonstraram a existência de fatores de risco, como hipertensão arterial, doenças cardiovasculares, diabetes, doenças respiratórias crônicas e câncer;44 entretanto, a obesidade foi incluída posteriormente nessa lista.45 Em março de 2020, Wu etal.46 descreveram características de 280 pacientes chineses e encontraram uma diferença estatisticamente significante entre o IMC de pacientes com doença leve e moderada (23,6kg/m2) e grave (25,8kg/m2), mas esse fato não atraiu a atenção desses pesquisadores, pois não conseguiram demonstrar o IMC como fator de risco independente. Simonet et al.,47 em abril de 2020, mostraram a alta prevalência de obesidade em pacientes com COVID‐19 expostos à ventilação mecânica. Além disso, a proporção de pessoas que necessitaram dessa intervenção aumentou de acordo com o IMC, atingiu 85,7% quando o IMC estava acima de 35kg/m2.47 Afinal, eles descobriram que a obesidade era um fator de risco, independentemente da idade, sexo ou presença de diabetes ou hipertensão, e o risco de necessitar de ventilação mecânica invasiva foi 7,36 vezes maior quando pacientes com IMC > 35kg/m2 foram comparados àqueles com IMC < 25kg/m2.47 Outros estudos confirmaram esses achados: Bhatraju et al.44 relataram os primeiros casos na região de Seattle (EUA) e encontraram um IMC médio de 33,2kg/m2 em 24 pacientes críticos internados na UTI. Entre os italianos hospitalizados por COVID‐19, Busetto et al.48 descobriram que aqueles com sobrepeso e obesidade, mesmo quando mais jovens, precisavam de ventilação assistida e terapia intensiva com mais frequência do que pacientes com peso normal. Dados de Nova York, referentes a 770 pacientes, mostraram que as pessoas obesas eram mais propensas a ter febre, tosse e dispneia, além de taxas significativamente mais altas de internação na UTI ou morte.49 Mais recentemente, com dados acumulados de três populações diferentes, uma revisão sistemática confirmou a obesidade como fator de risco independente para maior gravidade da COVID‐19, inclusive internação na UTI. Por fim, uma informação muito relevante foi a demonstração, por Yates et al.,50 de que o risco de adquirir a doença é maior entre os obesos.
COVID‐19 e riscos relacionados à obesidade em crianças e adolescentesAinda não é possível explicar por que o número de crianças afetadas e suas manifestações variam de acordo com diferentes locais.51 Os efeitos da obesidade pediátrica na presença de COVID‐19 ainda não foram adequadamente estudados e alguns dados são inferências devido à falta de um número considerável de trabalhos publicados sobre esse assunto nessa faixa etária. Os três principais fatores de risco que vinculam a obesidade à COVID‐19 demonstrados em adultos52 também estão presentes em crianças e adolescentes: inflamação subclínica crônica, resposta imune deficiente e doenças cardiorrespiratórias subjacentes. Praticamente todas as comorbidades encontradas em adultos podem ser observadas na infância e adolescência53 e a criança obesa tem respostas imunes inadequadas a outras infecções, como pneumonia bacteriana,54 uma complicação grave e comum da COVID‐19.
Estudos em modelos animais mostraram que ratos alimentados com uma dieta rica em gordura apresentaram aumento da expressão da ECA‐2 nos pulmões, o que pode ajudar a explicar a maior gravidade da doença nos indivíduos obesos.55 Zhang et al. mostraram que a obesidade predispõe à alta mortalidade por COVID‐19, mesmo em pacientes jovens, com 14 anos ou mais velhos56 e considera‐se que é precisamente a alta prevalência de obesidade entre jovens que pode mudar a curva etária da mortalidade em países onde a prevalência de excesso de peso é maior nesse grupo.57 Os mecanismos envolvidos incluem vários aspectos relacionados à obesidade em si e também às suas comorbidades6 e deve‐se enfatizar que os riscos podem estar presentes mesmo nos casos mais leves de obesidade.58 Cada um deles será abordado abaixo, em detalhes.
Resistência à insulina e dislipidemiaNa infância e adolescência, mesmo na presença de obesidade, o diabetes mellitus tipo 2 é relativamente incomum.59 A alta capacidade pancreática de produção de insulina, característica de indivíduos mais jovens, permite que ocorra uma compensação como resultado do hiperinsulinismo, que tem uma alta prevalência associada com a obesidade.60 Embora a glicemia frequentemente permaneça em níveis normais, todo o processo fisiopatológico está presente, leva a várias repercussões na saúde, como dislipidemia, hipertensão arterial, esteatohepatite não alcoólica, deficiências de micronutrientes, aumento do estresse oxidativo e hiperuricemia. Em situações de intensa atividade metabólica, como durante a resposta imune à infecção por coronavírus, as células beta são levadas a produzir uma quantidade alta de insulina, o que pode não ser alcançado quando elas já estão trabalhando no limite;61 o SARS‐CoV‐2 também pode levar à ruptura da célula beta, através da interação com a ECA‐2, o que agrava ainda mais esse processo.61 Além disso, a resistência à insulina leva a uma redução da fosfoinositidil 3‐quinase, prejudica os efeitos vaso protetores e anti‐inflamatórios do óxido nítrico.62
Dislipidemias são altamente prevalentes em crianças e adolescentes obesos60 e baixas concentrações de HDL‐colesterol e aumento do LDL‐colesterol são fatores de risco comprovados para progressão da disfunção endotelial e aterosclerose.63
Sistema respiratórioEm Nova York, a obesidade foi o fator de risco mais importante para a necessidade de suporte respiratório entre os 50 casos pediátricos de COVID‐19.43 A fisiologia respiratória normal está geralmente prejudicada em pacientes obesos, inclusive crianças e adolescentes.64 Como o pulmão é um dos principais alvos e leva a maiores riscos para pacientes com COVID‐19, esse aspecto sempre deve ser considerado. De fato, a hematose está prejudicada na obesidade, o que se torna ainda mais relevante quando as áreas de troca estão reduzidas devido à ação do coronavírus.65 A pressão exercida pela adiposidade abdominal nos pulmões, através do diafragma, também atua para limitar o movimento dos músculos respiratórios, com menor saturação de oxigênio,66 assim piora a apresentação clínica em relação ao menor volume pulmonar de pacientes obesos.67 Além disso, algumas comorbidades ligadas à obesidade podem contribuir para um maior risco de infecções pulmonares, como a presença de asma, que é altamente prevalente em crianças obesas,68 e apneia obstrutiva do sono.69 Em relação à asma, os mesmos mecanismos, de origem inflamatória, ligados à leptina e IL‐2, que explicam a alta prevalência e gravidade dessa doença em crianças obesas,70 também estão envolvidos na gravidade da COVID‐19. Por fim, além de aspectos relacionados à deficiência da função pulmonar, crianças obesas apresentam baixa tolerância ao exercício, o que fecha um círculo vicioso.71
Sistema cardiovascularAs alterações da anatomia cardíaca associadas à obesidade são reconhecidas mesmo em crianças muito pequenas, nas quais é observada hipertrofia do ventrículo esquerdo, relacionada ao grau de obesidade e pressão arterial, entre outras alterações estruturais.72 Crianças e adolescentes obesos apresentam maior pressão arterial, o que aumenta a lesão endotelial em potencial, uma das bases da fisiopatologia da COVID‐19.72 Crianças, especialmente as obesas, tratadas com fármacos anti‐hipertensivos que inibem a enzima conversora de angiotensina ou bloqueiam os receptores de angiotensina, apresentam aumento da expressão da ECA‐2, o que aumenta sua suscetibilidade ao coronavírus.73 A obesidade infantil aumenta o risco de doença cardiovascular mais tarde na idade adulta e a explicação para esse fenômeno está no fato de que as disfunções endoteliais, associadas à resistência à insulina, se iniciam efetivamente na infância.74 A camada íntima das artérias apresenta espessamento em crianças obesas, prenuncia a aparecimento de aterosclerose, o que ocorre muito precocemente.75 A disfunção endotelial ocorre mesmo nos casos mais leves de obesidade.76 O endurecimento das artérias, associado ao comprometimento do desempenho do nitrogênio e ao estresse oxidativo crônico, tem sido implicado em alterações relacionadas à gravidade da COVID‐19, como inflamação do endotélio, miocardite, falência múltipla de órgãos, síndrome respiratória aguda grave e tromboembolismo venoso.62 Dados recentes de estudos anatomopatológicos em autópsias mostram a inclusão de estruturas do coronavírus nas células endoteliais, possivelmente através do uso de receptores ACE‐2 no endotélio pelo vírus; nesses casos, foram encontrados acúmulo de células inflamatórias, congestão venosa em pequenas veias pulmonares e inflamação do endotélio na circulação intestinal.77 A leptina, que geralmente é elevada em pessoas obesas, danifica o endotélio, leva à menor produção de óxido nítrico e aumento da expressão da proteína quimioatraente de monócitos‐1, contribui para o infiltrado inflamatório nas células vasculares.62 O tecido adiposo perivascular contribui para a vasoconstrição e disfunção endotelial através da produção de mediadores inflamatórios, estresse oxidativo e redução na produção de óxido nítrico.62
Inflamação subclínicaUm dos aspectos mais relevantes para a compreensão da gravidade do COVID‐19 em pacientes obesos está relacionado a problemas inflamatórios.78 Após a contaminação pelo coronavírus, a maioria dos pacientes desenvolve mecanismos de defesa imunológica, que incluem processos relacionados à inflamação, e isso ocorre de maneira modulada, para que o organismo hospedeiro não seja prejudicado. Entretanto, um processo descontrolado é desencadeado em alguns pacientes, conhecido como “tempestade de citocinas”, que causa danos nos tecidos e intensa desregulação homeostática, causa danos em diversas funções orgânicas, especialmente na área respiratória.79 Sabe‐se que os obesos apresentam inflamação subclínica crônica, caracterizada por um estado inflamatório permanente, embora de intensidade leve.80 As altas concentrações séricas de proteína C‐reativa e IL‐6 comprovam esse processo,61 que pode começar precocemente. Acredita‐se que, pelo menos em parte, esse processo seja causado por citocinas, principalmente as adipocinas, com propriedade inflamatória produzida pelo tecido adiposo61 e também à queda de adiponectina, que tem propriedades anti‐inflamatórias.81
CoagulaçãoIndivíduos obesos, inclusive crianças e adolescentes, com COVID‐19 correm maior risco de desenvolver coagulopatia associada a desfechos clínicos ruins. A inflamação crônica leva à regulação negativa das proteínas anticoagulantes (inibidor da via do fator tecidual, antitrombina e sistema de anticoagulação da proteína C). Por outro lado, isso leva à regulação positiva de fatores pró‐coagulantes (inibidor da via do fator tecidual) e moléculas de adesão (P‐selectina), além de aumentos na geração de trombina e maior ativação plaquetária, o que aumentando o risco de trombose.62 Nas infecções graves por SARS‐CoV‐2, o risco de tromboembolismo venoso é importante, pois uma porcentagem significativa de pacientes apresenta níveis elevados de D‐dímeros, enquanto outros atendem aos critérios clínicos para coagulação intravascular disseminada (CID).62 Infecções graves e sepse são uma das causas principais de CID e a ativação pró‐inflamatória e imune observada em COVID‐19 grave é provavelmente suficiente para desencadear a CID.82
Sistema renalA obesidade causa várias alterações estruturais, metabólicas e hemodinâmicas nos rins, leva a uma menor reserva funcional desse órgão.83 A deposição ectópica de gordura no seio renal é responsável por seu aumento de peso e volume. As alterações hemodinâmicas levam ao aumento do fluxo plasmático renal e da taxa de filtração glomerular, maior absorção de água e sódio pelos túbulos proximais, estresse glomerular, hipertrofia tubular e glomerulomegalia, que por sua vez causam proteinúria e esclerose glomerular secundária, culminam em doença renal crônica.84 O aumento no peso corporal e a consequente redução do pH urinário predispõem à litíase urinária devido ao aumento da excreção de oxalato urinário, sódio, fosfato e ácido úrico e a obesidade também pode favorecer o aparecimento de alguns tipos de neoplasia no tecido renal.85 A desregulação do metabolismo lipídico e respostas hormonais também desempenham um papel na deterioração da função renal. O estresse oxidativo causado pelo aumento da deposição de gordura promove inflamação, hipertrofia celular, aumento da matriz mesangial, apoptose, disfunção endotelial e fibrose renal.86 Os ácidos graxos liberados pelos adipócitos estimulam a secreção de TNF‐alfa pelos macrófagos, o que resulta em maior secreção de IL6 nos adipócitos, e aumentam a inflamação no tecido renal. Enquanto o TNF‐alfa desempenha um papel fundamental na progressão da fibrose renal, o aumento dos lipídios intracelulares tem um efeito nefrotóxico (culmina na glomerulosclerose), compromete a estrutura e o funcionamento das mitocôndrias, o que contribui para a progressão da doença renal.87 O aumento da produção de insulina e da resistência à insulina contribui para a expansão mesangial e fibrose renal e é observada a ativação do sistema renina‐angiotensina‐aldosterona, já que o efeito vasoconstritor da angiotensina II nas arteríolas renais leva ao aumento da produção de endotelina‐1, estimula a proliferação da matriz mesangial, retenção de sódio e vasoconstrição das arteríolas renais.88 O coronavírus pode causar danos renais agudos em até 15% dos casos, o que contribui para a mortalidade. A agressão ocorre devido ao efeito citotrópico direto induzido pelo vírus através da enzima conversora de angiotensina 2 (ECA2), altamente expressa no rim,89 e pela resposta inflamatória causada pelas citocinas devido à ativação do sistema renina‐angiotensina‐aldosterona.90,91 Além disso, necrose tubular aguda e os efeitos trombóticos secundários à disfunção endotelial também são observados na COVID‐19.92
Microbiota intestinalA microbiota intestinal é um ecossistema complexo, com milhares de filos bacterianos e várias espécies distribuídas pelo trato digestivo. É composta principalmente por microrganismos anaeróbicos e cerca de 90% das bactérias fecais pertencem a duas linhagens filogenéticas: firmicutes e bacteroidetes.93 A colonização ocorre desde o nascimento e é individualmente diferente, muda ao longo do tempo e pode ser influenciada por hábitos alimentares ou doenças, como obesidade e síndrome metabólica. Vários estudos demonstraram uma correlação entre a razão firmicutes/bacteroidetes em crianças e adultos obesos, o que sugere disbiose intestinal.94 Em relação aos pacientes com COVID‐19, há relatos de disbiose intestinal e uma diminuição nas populações intestinais de lactobacillus e bifidobactérias e alguns pacientes hospitalizados foram tratados com probióticos para regular o equilíbrio da microbiota e reduzir o risco de infecção secundária à translocação bacteriana.95
Sistema imuneA obesidade na infância e adolescência altera todo o sistema imunológico, altera as concentrações de citocinas e proteínas e o número e a função das células imunológicas. Esse desequilíbrio leva a um estado pró‐inflamatório, resulta no aparecimento ou exacerbação de várias doenças, como asma, alergia, dermatite atópica e apneia do sono.96 Em relação à COVID‐19, cujas condições graves evoluem com uma reação inflamatória sistêmica intensa e grave (“tempestade de citocinas”), o desequilíbrio do sistema imunológico observado na obesidade pode contribuir para um pior desfecho clínico.79 As adipocinas, especialmente a leptina, desempenham um papel importante nesse processo, pois influenciam o número e a função das células imunesatravés de efeitos diretos sobre o metabolismo celular. Nesse contexto, pode haver um aumento nas células T citotóxicas e efetoras (Th1 e Th7) e macrófagos M1 e, paralelamente, uma redução nas células Treg e nos macrófagos M2. Entretanto, outras moléculas que são influenciadas pelo estado nutricional também atuam na imunidade, que podem estar aumentadas (IL‐1β, IL‐6, IL‐8, IL‐10, IL‐1RA, resistina, visfatina, TNF‐α, MCP‐ 1, MIF, MIP1 alfa e beta) ou reduzidas (adiponectina, IL‐33) em pacientes obesos.62 Além disso, o desequilíbrio entre as ações dos linfócitos Treg e CD17+ também contribui para o estado pró‐inflamatório observado na obesidade.97 Além disso, na obesidade, as células dos macrófagos constituem cerca de 40 a 60% das células do sistema imunológico derivadas do tecido adiposo visceral; esses macrófagos são em sua maior parte ativados (M1) e secretam grandes quantidades de TNF‐alfa, IL‐6, IL‐12, Il‐1b, MCP‐1 e óxido nítrico.97
Nutrição e imunonutrientesA nutrição desempenha um papel importante na resposta imune e inflamatória, uma vez que alguns nutrientes modulam os sistemas de defesa celular e humoral, modificam a formação de mediadores inflamatórios ou interferem nas vias de transdução de sinal celular. Os nutrientes têm uma ação imunomoduladora, estimulam a resposta mediada por células, modificam o equilíbrio entre citocinas pró‐inflamatórias e anti‐inflamatórias e atenuam a depleção de nutrientes nos tecidos.98 A resposta imune depende do suprimento suficiente de nutrientes e o estado nutricional adequado foi considerado um elemento importante para a resposta da capacidade do coronavírus. Zhang & Liu,99 em uma revisão sistemática, mostraram que alguns nutrientes são fundamentais para uma resposta adequada ao coronavírus: vitaminas A, C, D e E; ácidos graxos ômega‐3; e os minerais zinco e ferro. Um suprimento qualitativo e quantitativo adequado permite manter e reparar os sistemas de defesa, que requerem energia e suporte estrutural adequados.100 A obesidade tem peculiaridades que podem prejudicar a resposta imune, porque a dieta geralmente tem características que podem levar à “fome oculta”. Isso ocorre porque, apesar de comer acima das necessidades energéticas, a qualidade não é adequada e vários estudos indicam a presença de deficiências de vitaminas e minerais com excesso de peso.101
Dentre as deficiências nutricionais mais comuns, destaca‐se a hipovitaminose D, não apenas ligada à sua ingestão insuficiente, mas também, e principalmente, ao deslocamento de parte do pool orgânico para o tecido adiposo devido à afinidade lipídica dessa vitamina.102 Além disso, sabe‐se que um estilo de vida sedentário é característico da criança obesa, faz com que a prática de atividades físicas ao ar livre – o que aumentaria a exposição ao sol e a formação de vitamina D na pele – seja reduzida nesse grupo.102 Vários estudos relacionaram a hipovitaminose D a um risco aumentado de COVID‐19 grave,78 o que torna essa questão particularmente relevante na população pediátrica obesa, na qual a prevalência dessa deficiência é alta.103 A vitamina D (VD) tem efeitos imunomoduladores e linfócitos T ativados e células que apresentam antígenos, como macrófagos e células dendríticas, expressam o receptor da VD em suas membranas, levam a efeitos antiproliferativos e imunossupressores nas células do sistema imunológico. Ela inibe a secreção de IL‐12 por macrófagos, uma citocina fundamental na diferenciação de linfócitos T CD4+ nas células Th1.104 Ao diminuir a ativação da resposta de Th1 e a produção de citocinas pró‐inflamatórias (IL‐2, interferon‐γ, TNF‐α), a VD contribui para o direcionamento e a ativação da resposta de Th2, favorece maior secreção de anti‐inflamatórios, como a IL‐4.104 Esse mecanismo de imunossupressão é importante para minimizar os efeitos deletérios em transplantes, doenças autoimunes e inflamatórias. Embora a VD induza a resposta de Th2, ela também induz a expressão de peptídeos antimicrobianos em neutrófilos e monócitos, além de promover um aumento na capacidade fagocítica e rápida liberação de espécies reativas de oxigênio.104 A indução de catelicidinas e defensinas, causada pela VD, reduz a reprodução viral e a concentração de citocinas pró‐inflamatórias com potencial de lesão pulmonar nos casos de COVID‐19.105 Além disso, a hipovitaminose D tem repercussões em distúrbios com potencial impacto na COVID‐19, como hipertensão arterial, esteatose hepática e hiperuricemia.106
Os ácidos graxos ômega‐3 são considerados lípides essenciais para os seres humanos. Os ácidos graxos eicosapentaenoico (EPA) e docosaexaenoico (DHA) são imunomoduladores biologicamente mais potentes que o ácido alfa‐linolênico. O EPA e o DHA diminuem a atividade dos fatores de transcrição nuclear que promovem a transcrição de genes que codificam proteínas com ação pró‐inflamatória, como TNF‐α e IL‐1β.107 Além disso, o EPA e o DHA competem com o ácido araquidônico (ômega‐6) na constituição de fosfolípides da membrana plasmática e, consequentemente, pelo metabolismo da ciclooxigenase na membrana celular, modulam a produção de prostaglandinas e leucotrienos.108 Concentrações mais altas de EPA e DHA favorecem a síntese de prostaglandinas da série 3 e leucotrienos da série 5, que atenuam os processos inflamatórios e inibem a produção de prostaglandinas da série 2 e leucotrienos da série 4, que deprimem a atividade citotóxica de macrófagos, linfócitos e células NK (do inglês Natural Killer Cell),109 com uma consequente redução na síntese de citocinas pró‐inflamatórias como IL‐1, IL‐6 e TNF.107 A imunomodulação exercida depende da razão ômega‐3/ômega‐6: uma razão de 1: 5 não prejudica a resposta imune; entretanto, as dietas ocidentais fornecem uma razão de 1:15 a 1:50, com efeitos pró‐inflamatórios.110 O consumo de ácidos graxos ômega‐3, especialmente DHA, é baixo na maioria dos países do mundo, inclusive o Brasil.111 Embora os precursores do ômega‐3 3 estejam presentes nos óleos vegetais, sua conversão em DHA é baixa e o excesso de consumo do ômega‐6 desvia as enzimas conversoras, prejudica ainda mais a formação de DHA e contribui para uma alta prevalência de deficiência. Uma razão inadequada de ômega 3/ômega 6, comum em crianças obesas,112 leva à perda de modulação da resposta imune, o que pode contribuir para a exacerbação das reações inflamatórias, além de agravar os riscos cardiometabólicos.113
As vitaminas A, E e C são encontradas essencialmente em frutas e legumes, geralmente pouco consumidos por crianças e adolescentes, inclusive os obesos.114 O estado nutricional deficiente dessas vitaminas pode afetar a resposta imune.115 As células imunológicas estão em risco constante de dano oxidativo pelos radicais livres, o que pode prejudicar permanentemente sua capacidade de responder a patógenos. Quantidades aumentadas de radicais livres nos macrófagos ativados fazem parte da resposta normal. A vitamina E (VE) atua como antioxidante e protege a membrana celular contra espécies reativas de oxigênio.114 Estudos em animais demonstraram que a suplementação de VE aumenta a resistência a infecções, inclusive o vírus influenza.116 A vitamina A (VA) garante a regeneração das barreiras mucosas danificadas pela infecção e melhora a função protetora de macrófagos, neutrófilos e células NK.117 Ela também é necessária para a imunidade adaptativa e desempenha um papel no desenvolvimento das células T e B. Assim como a VD, a VA pode impedir a produção de citocinas IL‐12 por macrófagos, diminui a ativação da resposta de Th1 e aumenta a de Th2.117 A deficiência de VA prejudica a resposta de Th2, que culmina na falta de IL‐4 e falha na indução de IgA, prejudica a resposta de IgA salivar à infecção pelo vírus influenza e resposta intestinal à toxina da cólera.117 A vitamina C (VC) contribui para a integridade da barreira epitelial e se acumula nas células fagocíticas, como neutrófilos, o que melhora a quimiotaxia; a fagocitose; a produção de espécies reativas de oxigênio; e induz a morte microbiana.118 Ela também contribui para a apoptose e remoção de neutrófilos, que sofreram morte celular, dos locais de infecção, reduz a necrose e os possíveis danos teciduais.118 A VC parece promover a diferenciação e proliferação de células B e T, provavelmente devido ao seu efeito regulador genético.118,119 Sua deficiência também prejudica a capacidade citotóxica de neutrófilos e linfócitos T.114 A suplementação de VC parece ser capaz de prevenir e tratar infecções respiratórias e sistêmicas,118,119 e uma revisão recente destaca a VC, bem como o zinco e a VD, como micronutrientes com as mais fortes evidências de seu papel na imunidade.120
Em relação ao ferro, crianças obesas correm risco de anemia por deficiência de ferro121 devido à baixa qualidade nutricional e baixa biodisponibilidade de ferro da dieta122 e a anemia já foi amplamente demonstrada nesse grupo.123 Além da ingestão inadequada, a hepcidina, principal controladora de absorção do ferro, tem sua expressão aumentada em indivíduos obesos, contribui para a condição ao reduzir a absorção de ferro pelos enterócitos e sua exportação por macrófagos e hepatócitos, aumenta os sequestros esplênicos e hepáticos.124
Pelo fato de terem fontes nutricionais semelhantes, acredita‐se que a deficiência de zinco também esteja presente em crianças obesas da mesma forma que a deficiência de ferro e isso foi demonstrado em estudos na faixa etária pediátrica.125 É importante ressaltar que, além do seu papel imunológico, o zinco também participa do metabolismo da insulina e da leptina, o que pode agravar as desregulações metabólicas de crianças obesas, contribuir para uma resposta inflamatória inadequada.126 O zinco atua como cofator da enzima superóxido dismutase, que reduz o estresse oxidativo celular e diminui a ativação das vias de sinalização que promovem uma resposta inflamatória.127 Ele induz os monócitos a produzirem IL‐1, IL‐6 e inibe a produção de TNF‐α, e também está envolvido na regulação dos receptores ativados por proliferadores de peroxissoma (PPARs, do inglês peroxisome proliferator‐activated receptors), cuja ativação está positivamente correlacionada com a diminuição da resposta inflamatória. A influência direta do zinco no sistema imunológico se deve à sua capacidade de estimular a atividade de enzimas envolvidas na mitose.128 A deficiência de zinco está relacionada à diminuição da produção de citocinas e interferon‐α pelos leucócitos, atrofia do timo e de outros órgãos linfoides e alterações nos proporção de linfócitos.128
Repercussões psicossociais da COVID‐19 na obesidadeSe, por um lado, os pacientes obesos apresentam COVID‐19 com características particulares, por outro a pandemia também levou a mudanças socioeconômicas que podem afetar a obesidade infantil,129 especialmente entre os mais pobres.130 Nesse sentido, um importante estudo projetou o impacto da pandemia de COVID‐19 na prevalência de obesidade infantil nos EUA, de acordo com diferentes cenários:131 fechamento das escolas por dois meses; fechamento das escolas por dois meses associado a uma queda de 10% na atividade física nos dois meses subsequentes do verão; adicionando mais dois meses subsequentes de escolas fechadas; adicionando mais dois meses subsequentes de fechamento das escolas. O aumento da prevalência de obesidade seria de 0,640, 0,972, 1,676 e 2,373 pontos percentuais, respectivamente. Na Itália, Pietrobelli et al.132 acompanharam 41 crianças e adolescentes obesos durante três semanas de confinamento em Verona e não encontraram mudanças no consumo de vegetais, mas observaram um aumento no consumo de frutas, batatas fritas, carne vermelha e bebidas açucaradas; o tempo gasto em atividades esportivas foi reduzido em duas horas e meia por semana e, em contraste, o período de sono aumentou 0,65 horas/dia; e os dados mais impactantes referem‐se ao tempo de tela, que aumentou 4,85 horas/dia. Um aspecto interessante é a ideia frequentemente disseminada em textos leigos de que a atividade física deve ser evitada para proteger a imunidade e, que, supostamente, o exercício pode reduzir as defesas do corpo, fato que não foi demonstrado cientificamente, mesmo entre os atletas.133 Por outro lado, a atividade física é importante para a formação adequada da vitamina D quando feita ao ar livre.102 De fato, diante de situações relacionadas ao estilo de vida sedentário, como assistir TV ou jogar videogame, ocorrem alterações relacionadas ao maior risco de obesidade, como alto consumo de bebidas adoçadas com açúcar e fast‐food,134 além de distúrbios do sono.135 Em relação a esse último aspecto, a pandemia de COVID‐19 traz altos riscos à saúde, pois vários fatores podem contribuir para que a qualidade e a duração do sono sejam insatisfatórias, como: estresse diante da doença, interrupção das atividades de manhã, tempo disponível para uso na tela etc.132 Nesse sentido, além de predispor ao ganho de peso e à adiposidade abdominal, os distúrbios do sono têm outras repercussões na saúde, como resistência à insulina, deterioração da qualidade dos alimentos, mau desempenho escolar e sedentarismo.136
Viver com estresse durante a pandemia de COVID‐19, além de trazer riscos de deterioração da imunidade,137 pode ter consequências para a saúde pediátrica, principalmente para as áreas nutricionais e emocionais.138 Uma delas refere‐se à pioria da qualidade do sono, discutida acima. Além disso, o estresse aumenta o consumo de alimentos, ativa centros de recompensa cerebral que aumentam o interesse por alimentos altamente palatáveis (açúcar, sal e lípides), aumenta a instabilidade emocional e piora a qualidade de vida.138 Devido ao prolongado tempo de isolamento social, outro aspecto demonstrado nos EUA foi a queda na adesão aos programas de imunização, devido ao medo de levar as crianças para serem vacinadas.139 Por fim, um estudo brasileiro mostrou uma alta incidência de mortalidade periobstétrica por COVID‐19 140 e esse fato, nos casos em que o parto é viável, pode levar a um grande número de bebês privados de aleitamento materno, conhecido como fator de proteção contra a obesidade.141
Considerações finais e complicações do tratamentoA presente revisão tem duas limitações importantes. A primeira é que atualmente não é possível fazer uma revisão sistemática da literatura com o rigor esperado na classificação de artigos, uma vez que a maioria dos dados publicados é baseada em observações feitas há menos de um ano e, geralmente, referem‐se a estudos observacionais e transversais. A segunda é que existem poucas publicações referentes à faixa etária pediátrica, o que significa que algumas informações são, de fato, inferências sobre a abordagem da doença em crianças e adolescentes, com base no que é observado em adultos.
Quando o paciente apresenta condições leves de COVID‐19, o tratamento é apenas sintomático e a recuperação é geralmente completa,142 varia de medidas de suporte para condições leves (isolamento, higiene, repouso, hidratação e atenção à ingestão de alimentos) até os procedimentos hospitalares mais invasivos, como ventilação mecânica. O período deconvalescença pode variar de uma a 3 semanas, em condições leves, ou até seis semanas nos casos mais graves.143
As crianças não obesas são geralmente assintomáticas e até menos suscetíveis à infecção.144 Nesses casos, foi proposto o uso de opções de telemedicina para ajudar as famílias a receber orientações adequadas sem a necessidade de ir aos locais de atendimento.129 Entretanto, para aqueles que desenvolvem as formas mais graves, a coexistência da obesidade pode dificultar a terapia e piorar o prognóstico, já que a condição inflamatória é tão grave quanto nos adultos.145 Além disso, o extenso envolvimento do sistema cardiopulmonar é frequente146 e distúrbios respiratórios como a síndrome de Pickwick, apneia obstrutiva e disfunções do surfactante podem estar presentes.147 Há também questões técnicas, como o fato de muitos equipamentos dentro das unidades não se adaptarem adequadamente ao paciente obeso148 e a maior dificuldade de intubação em pacientes obesos, o que pode levar à ocorrência de lesões e períodos mais longos de hipóxia enquanto o procedimento não pode ser concluído.148 O cuidado da enfermagem é sempre mais difícil: possibilidade de higiene mais precária e contaminação secundária, punção venosa mais difícil e mais propensa a causar lesões; procedimentos de controle, como medição da pressão arterial e ausculta cardíaca, são mais difíceis e mais propensos a erros; e o risco de escaras durante a permanência na unidade de terapia intensiva é sempre maior quanto maior o peso do paciente.149
Para as famílias, são essenciais medidas de suporte que possam fornecer informações e orientações de boa qualidade para ajudá‐las a tomar decisões sobre medicamentos, a necessidade de ir ao pronto‐socorro e a forma de fazer o atendimento de emergência quando necessário.129 Para os adolescentes, informações adequadas geralmente podem ajudar a minimizar comportamentos extremos, tanto no aspecto do medo excessivo, para alguns, quanto ao sentido de invulnerabilidade, para outros.150 A figura 1 mostra uma breve sinopse sobre as associações entre obesidade e COVID‐19.
Em conclusão, a obesidade na infância e adolescência pode ser considerada um fator de risco para maior suscetibilidade e gravidade da COVID‐19 e está associada a alterações nutricionais, cardíacas, respiratórias, renais e imunológicas, que podem potencializar as complicações da infecção por SARS‐CoV‐2. A necessidade de isolamento social pode ter o efeito de causar ou agravar a obesidade e suas comorbidades e os pediatras precisam estar cientes dessaquestão. É necessário que os profissionais de saúde, diante do cuidado de crianças com suspeita ou confirmação de COVID‐19, façam a avaliação do estado nutricional para diagnosticar sobrepeso; preocupem‐se com orientações sobre cuidados, em períodos de isolamento, com o estado geral de saúde, inclusive as áreas de nutrição, imunização e aspectos psicossociais; rastreiem comorbidades associadas à obesidade, garantam que seu tratamento não seja interrompido; rastreiem os níveis de imunonutrientes para avaliar a necessidade de suplementação; forneçam informações às famílias respeitando as especificidades da condição; e determinem, quando necessário, o encaminhamento para unidades hospitalares adequadas ao atendimento de crianças e adolescentes obesos.
Conflitos de interesseOs autores declaram não haver conflitos de interesse.
Como citar este artigo: Nogueira‐de‐Almeida CA, Ciampo LA, Ferraz IS, Ciampo IRL, Contini AA, Ued FV. COVID‐19 and obesity in childhood and adolescence: a clinical review. J Pediatr (Rio J). 2020;96:546.
Estudo vinculado à Universidade Federal de São Carlos, Departamento de Medicina, São Carlos, SP, Brasil.