To evaluate the prevalence of abnormalities in plasma lipid and glucose profiles among overweight and obese children and adolescents, and to assess the presence of a correlation between body mass index Z‐scores and indicators of comorbidities related to both profiles.
MethodsThis was a multicenter cross‐sectional study conducted at two outpatient clinics. The study included all 417 comers for the first visit from 2008 to 2012, aged between 7 and 18 years, with BMI above the Z‐score+1. Anthropometry and blood sampling were obtained. The prevalence of dyslipidemias, hyperglycemia, and insulin resistance were evaluated, together with the correlations of these variables with the increase of Z‐BMI.
ResultsDyslipidemia was observed in 43.4% of the boys and 66.1% of the girls, with no difference between genders. High glucose levels were detected in 6.2% of the individuals. Insulin resistance was present in 32.3% and 41.7% of the cases, with no statistical significance between boys and girls. Correlations between the Z‐BMI were noted for triglycerides in the entire group and among girls; for HDL‐c, only among girls; for glucose, a correlation was observed for the entire group, but not when stratified by gender. The indicators of insulin resistance were all correlated with Z‐BMI, even when corrected for age.
ConclusionsOverweight and obesity give origin to a high prevalence of dyslipidemia and insulin resistance. BMI Z‐scores showed a weak positive correlation with glucose and triglyceride, and negative with HDL‐c. In turn, the strongest positive correlation was found with insulin resistance indicators.
Avaliar a prevalência de anormalidades nos perfis lipídico e glicêmico entre crianças e adolescentes com sobrepeso e obesidade e também verificar se existe correlação entre os escores‐z de índice de massa corporal (z‐IMC) e indicadores de comorbidades ligados a esses perfis.
MétodosEstudo de corte transversal multicêntrico, incluiu 417 pacientes entre 7 e 18 anos e IMC acima do escore‐z>+1 que fizeram a consulta de caso novo entre 2008 e 2012. Antropometria e coleta de sangue foram realizadas. As prevalências de dislipidemia, hiperglicemia e resistência insulínica foram avaliadas, juntamente com as correlações entre essas variáveis e o z‐IMC.
ResultadosDislipidemia foi encontrada em 43,4% dos meninos e 66,1% das meninas, sem diferença entre os sexos. Hiperglicemia foi encontrada em 6,2% dos indivíduos. Resistência insulínica esteve presente entre 32,3 e 41,7% dos casos, sem diferença estatística entre os sexos. Foi observada correlação com z‐IMC para triglicerídeos quando considerado o grupo todo e entre as meninas; e para HDL‐c apenas entre as meninas. A glicemia apresentou correlação quando considerado o grupo todo, mas não quando separados por sexo. Os indicadores de resistência insulínica estiveram todos correlacionados com IMC, mesmo quando se executou correção para a idade.
ConclusõesSobrepeso e obesidade levam a prevalências elevadas de dislipidemia e resistência insulínica. Os escores‐z de IMC mostraram discreta correlação positiva com glicose e triglicerídeos e negativa com HDL‐c. Por outro lado, correlação positiva mais forte foi observada com os indicadores de resistência insulínica.
A prevalência cada vez maior de obesidade na infância e adolescência exige dos pesquisadores e interessados em saúde pública o estabelecimento de critérios para priorizar ações que visem a abordar esse problema.1 Diferentes autores demonstraram a presença de fatores de risco cardiovascular associados a obesidade, principalmente dislipidemia2 e resistência à insulina3, porém os números variam muito e a prevalência ainda não é conhecida.4 Para estudos populacionais, o índice de massa corporal (IMC) foi usado como indicador e ele consegue refletir a adiposidade corporal;5 a partir do escore‐z de+1, que define sobrepeso, pode‐se entender que quanto maior o valor, mais grave é a situação.6 Nesse sentido, é relevante saber não somente a prevalência, mas também como as comorbidades relacionadas ao sobrepeso se comportam caso a situação piore e quais são as diferenças entre meninos e meninas. Alguns autores avaliaram essa questão. Ricco et al.7 estudaram 34 indivíduos com sobrepeso e 50 com obesidade entre seis e 18 anos para comparar pressão arterial, glicemia de jejum, glicemia de duas horas, colesterol total, HDL‐C, LDL‐C e triglicerídeos. Apenas a HDL‐C foi ligeiramente maior em pacientes com sobrepeso (p=0,048), demonstrou que, para os parâmetros avaliados, o fato de ter IMC mais elevado não substancialmente afeta as comorbidades. Lima et al.8 também não encontraram impacto sobre o perfil lipídico em comparação com crianças e adolescentes com sobrepeso e obesidade. Por outro lado, quando analisado como um continuum (avaliado por meio da elevação dos escores‐z de IMC), os resultados foram diferentes. Bell et al.9 demonstraram uma correlação entre aumento da obesidade e acanthosis nigricans, depressão, ansiedade, dor de cabeça, dor muscular e apneia do sono. Também foram demonstradas as correlações com dislipidemia,10 resistência à insulina11 e esteatose.12
Este estudo visou a avaliar a prevalência de anomalias nos perfis glicêmico e lipídico entre crianças e adolescentes com sobrepeso e obesidade e também se é vista uma correlação entre os escores‐z de IMC e os indicadores de comorbidades com relação aos dois perfis.
MétodosEstudo transversal multicêntrico feito em duas clínicas ambulatoriais: o Centro de Estudos em Saúde e Nutrologia Infantojuvenil na Universidade de Ribeirão Preto (Cesni) e o Ambulatório de Obesidade Infantojuvenil do Serviço de Nutrologia do Hospital de Clínicas da Universidade Federal do Rio Grande do Sul (AmO). Os dois são serviços acadêmicos, nos quais a coleta de dados segue uma metodologia rigorosamente padronizada. O trabalho foi aprovado pelo comitê de ética em pesquisa da Universidade de Ribeirão Preto (n° 94/2003) e do Hospital de Clínicas de Porto Alegre (n° 07/258).
Os critérios de inclusão foram: todos os novos casos de pacientes que passaram pelo local para consulta pela primeira vez entre janeiro de 2008 e dezembro de 2012, idade entre sete e 18 anos e índice de massa corporal acima do escore‐z+1 (n=489 elegíveis).
Os critérios de exclusão foram: recusa a assinar o consentimento informado (n=2), impossibilidade de fazer antropometria (n=3), diabetes mellitus tipo 1 (n=0), hipotireoidismo (n=0), erros inatos do metabolismo (n=1), impossibilidade de coletar testes de laboratório (n=41), problemas médicos especiais, por exemplo, doença celíaca (n=0), uso de terapias médicas ou hormônios (n=0) e dados incompletos no prontuário médico (n=25). Ao seguir os critérios acima, 417 indivíduos foram incluídos no estudo, dos quais 241 foram vistos no Cesni e 176 no AmO.
Todos os indivíduos foram orientados a jejuar por 12 horas e os dados antropométricos e sangue foram coletados no momento da primeira visita do paciente. Dois tubos de 4mL de sangue foram coletados em um recipiente sem aditivos e enviado para o laboratório até duas horas para processamento da amostra e análise bioquímica e hormonal. O material biológico foi separado em uma centrífuga (Bio Eng®, modelo BR 4000, SP, Brasil) em funcionamento por cinco minutos a 3.500rpm entre uma e duas horas e meia após a coleta (tempo suficiente para coagulação do sangue). A insulina bioquímica foi dosada em uma das alíquotas no mesmo dia da coleta, pelo método quimioluminescência automatizado no analisador Immulitte DPC (Medlab®, SP, Brasil). A glicose foi medida pelo método enzimático de hexoquinase com o equipamento de automação Cobas Mira Plus (Roche®, SP, Brasil). A determinação da avaliação do modelo de homeostase – resistência à insulina (HOMA‐IR) foi feita ao aplicar a equação proposta por Matthews et al.: glicose plasmática (mol/dL) x insulina plasmática (uUI/mL)/22,5.13
Quando a concentração de insulina plasmática estava acima de 15μU/mL10, considerou‐se hiperinsulinismo, usado como um marcador para resistência à insulina. Outro método de diagnóstico para resistência à insulina foi HOMA‐IR, considerado alto quando acima de 3,16.11 Os valores de corte usados para definir a presença de dislipidemia e hiperglicemia foram:13 colesterol total (CT) ≥ 150 mg/dL; LDL‐C ≥ 100 mg/dL; HDL‐C ≤ 45 mg/dL; triglicerídeos ≥ 100 mg/dL; glicemia>99 mg/dL.
Para a análise estatística, foi usado o programa de computador Graphpad Prism 5 (GraphPad Prism versão 7.00 para Windows, CA, EUA). O teste exato de Fisher foi usado para comparar as frequências de valores normais/anormais entre os gêneros. As correlações simples foram avaliadas pelo teste de Spearman e foi usada a regressão múltipla para avaliar a correlação entre o escore‐z de IMC e insulina e HOMA corrigida para a idade, pois esses dois indicadores variam de acordo com a faixa etária.14,15 Para todas as análises, foi considerado um nível de significância de 5%.
ResultadosOs valores médios para toda a população foram: idade (anos): 11,3 (± 0,1); escore‐z de IMC:+2,4 (± 0,9); CT (mg/dL): 164,1 (± 1,6); LDL‐c (mg/dL): 97,7 (± 1,5); HDL‐c (mg/dL): 46,0 (± 0,6); TG (mg/dL): 105,1 (± 2,8); glicemia (mg/dL): 87,5 (± 0,5); insulinemia (μU/mL): 16,0 (± 0,7); HOMA‐IR: 3,5 (± 0,2). Não houve diferenças entre meninos e meninas.
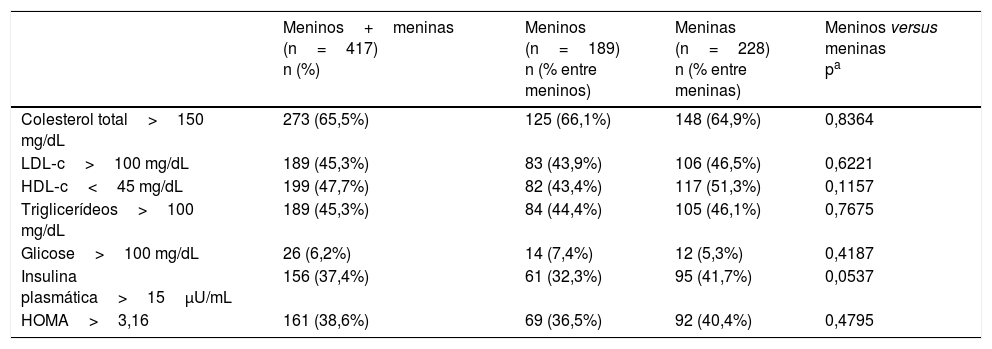
A tabela 1 mostra a prevalência de valores anormais de acordo com os pontos de corte estabelecidos, bem como comparação entre sexos. Os diferentes tipos de dislipidemia sempre foram muito prevalentes, com valores entre 43,4 e 66,1%, sem diferença entre meninos e meninas. Os altos níveis de glicose foram a alteração menos prevalente entre os indicadores estudados, atingiram um máximo de 7,4%, encontrados entre meninos, também sem diferença estatística entre os sexos. Deve‐se observar que apenas um indivíduo, uma menina de 15 anos, apresentou níveis de glicose acima de 125 mg/dL (160 mg/dL, não mostrado na tabela). Resistência à insulina, conforme avaliada pelos dois indicadores, insulina plasmática e HOMA‐IR estiveram presentes em 32,3 e 41,7% dos casos, sem diferença estatística entre meninos e meninas.
Prevalência de anomalias nos indicadores estudados
| Meninos+meninas (n=417) n (%) | Meninos (n=189) n (% entre meninos) | Meninas (n=228) n (% entre meninas) | Meninos versus meninas pa | |
|---|---|---|---|---|
| Colesterol total>150 mg/dL | 273 (65,5%) | 125 (66,1%) | 148 (64,9%) | 0,8364 |
| LDL‐c>100 mg/dL | 189 (45,3%) | 83 (43,9%) | 106 (46,5%) | 0,6221 |
| HDL‐c<45 mg/dL | 199 (47,7%) | 82 (43,4%) | 117 (51,3%) | 0,1157 |
| Triglicerídeos>100 mg/dL | 189 (45,3%) | 84 (44,4%) | 105 (46,1%) | 0,7675 |
| Glicose>100 mg/dL | 26 (6,2%) | 14 (7,4%) | 12 (5,3%) | 0,4187 |
| Insulina plasmática>15μU/mL | 156 (37,4%) | 61 (32,3%) | 95 (41,7%) | 0,0537 |
| HOMA>3,16 | 161 (38,6%) | 69 (36,5%) | 92 (40,4%) | 0,4795 |
HDL‐C, Lipoproteína de Alta Densidade‐Colesterol; HOMA, Avaliação do Modelo de Homeostase; LDL‐C, Lipoproteína de Baixa Densidade‐Colesterol.
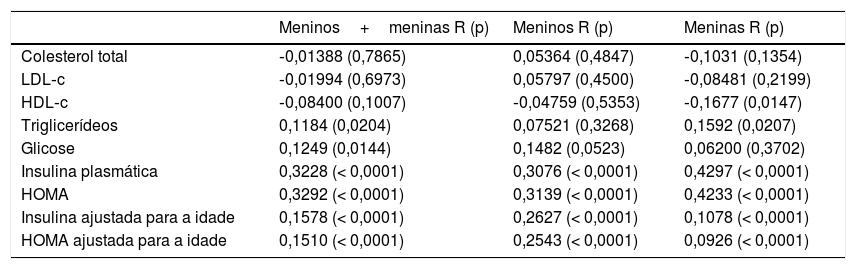
A tabela 2 mostra as correlações entre os escores‐z de IMC e os indicadores estudados. Em geral, as correlações estiveram presentes, porém de forma branda. Com relação aos lipídios, foi vista correlação para triglicerídeos, encontrada no grupo como um todo e entre as meninas; para HDL‐C, apenas entre meninas. Foi encontrada correlação para glicose em todo o grupo, porém não quando separada por sexo. Por outro lado, os indicadores de resistência à insulina foram todos correlacionados com IMC, mesmo quando correlacionados com idade. Não houve diferenças entre meninos e meninas.
Correlações entre os escores Z de IMC e os indicadores estudados
| Meninos+meninas R (p) | Meninos R (p) | Meninas R (p) | |
|---|---|---|---|
| Colesterol total | ‐0,01388 (0,7865) | 0,05364 (0,4847) | ‐0,1031 (0,1354) |
| LDL‐c | ‐0,01994 (0,6973) | 0,05797 (0,4500) | ‐0,08481 (0,2199) |
| HDL‐c | ‐0,08400 (0,1007) | ‐0,04759 (0,5353) | ‐0,1677 (0,0147) |
| Triglicerídeos | 0,1184 (0,0204) | 0,07521 (0,3268) | 0,1592 (0,0207) |
| Glicose | 0,1249 (0,0144) | 0,1482 (0,0523) | 0,06200 (0,3702) |
| Insulina plasmática | 0,3228 (< 0,0001) | 0,3076 (< 0,0001) | 0,4297 (< 0,0001) |
| HOMA | 0,3292 (< 0,0001) | 0,3139 (< 0,0001) | 0,4233 (< 0,0001) |
| Insulina ajustada para a idade | 0,1578 (< 0,0001) | 0,2627 (< 0,0001) | 0,1078 (< 0,0001) |
| HOMA ajustada para a idade | 0,1510 (< 0,0001) | 0,2543 (< 0,0001) | 0,0926 (< 0,0001) |
HDL‐C, Lipoproteína de Alta Densidade‐Colesterol; HOMA, Avaliação do Modelo de Homeostase; IMC, Índice de Massa Corporal; LDL‐C, Lipoproteína de Baixa Densidade‐Colesterol.
Teste de Spearman e regressão múltipla ajustada para a idade.
A obesidade é uma doença multifatorial completa com componentes genéticos, epigenéticos e ambientais. Portanto, espera‐se que a forma como ela afeta a saúde das crianças seja muito variável. É relevante saber em que medida o aumento do excesso de peso também implica o surgimento e pioria das comorbidades. Um estudo anterior7 já demonstrou que, em comparação com crianças com sobrepeso ou obesidade, não havia praticamente diferença com relação aos parâmetros avaliados, ou seja, de certa forma, as comorbidades já estavam presentes na fase de sobrepeso. Apesar de o resultado ter sido importante, a simples divisão das crianças com sobrepeso em duas categorias, sobrepeso e obesidade, pode mascarar o aspecto contínuo da variável, ou seja, o modelo usado não conseguiu mostrar uma correlação ocasional entre IMC e os parâmetros avaliados; esse foi exatamente o aspecto que tentamos avaliar neste estudo.
Conforme mostrado na tabela 1, quando as crianças com sobrepeso e obesidade são agrupadas, a prevalência das comorbidades é bastante alta. Quase metade delas, independentemente do sexo, tem algum tipo de dislipidemia. LDL‐C elevado, que afetou 45,3% dos indivíduos, é altamente preocupante devido ao risco associado a aterosclerose. De fato, Garcia et al.16 demonstraram, em um estudo recente que mesmo as crianças em idade escolar já tinham espessamento médio‐intimal da artéria carótida comum, o que indica processo aterosclerótico inicial; Caixe et al.17 também demonstraram mudanças na geometria do coração nessa faixa etária, causadas pelo aumento do esforço no miocárdio para ultrapassar a alta resistência periférica devido ao espessamento das paredes arteriais. Graças à forte capacidade compensatória dos pâncreas jovens, mesmo entre crianças com importante resistência à insulina, níveis elevados de glicemia não são frequentes.14,18 Neste estudo, apenas 6,2% apresentaram níveis de glicose acima de 100 mg/dL e apenas um indivíduo apresentou nível acima de 125 mg/dL. Por outro lado, a presença de resistência à insulina foi alta, encontrada em mais de 1/3 dos pacientes. Os dois indicadores usados, insulina plasmática e HOMA‐IR, ambos com pontos de corte fixos, levaram a resultados semelhantes, possivelmente devido ao fato, conforme evidenciado pelos outros autores,18 de que a variável que determina o valor da HOMA‐IR em crianças é basicamente insulina plasmática, pois há pouca variação nos níveis de glicose. Sabe‐se que a resistência periférica à insulina está altamente correlacionada com a síndrome metabólica,2,3 é, possivelmente, o elemento causador dessa doença. Portanto, entre as crianças estudadas, é possível considerar que, além da dislipidemia demonstrada e do alto risco de diabetes futura – progressão natural da resistência à insulina – outros aspectos, como hipertensão arterial, doença hepática gordurosa não alcoólica, síndrome do ovário policístico, aterosclerose, hiperuricemia, dentre outros, também poderão estar presentes.19
Estudos recentes mostraram que o IMC é o melhor indicador antropométrico para identificar fatores de risco cardiovascular em crianças.20 De Onis et al.21 demonstraram que o aumento no IMC é acompanhado por redução da HDL‐C e elevação de insulina plasmática, HOMA, triglicerídeos e LDL‐C. Bell et al.,11 com grupos de percentil, mostraram um aumento em todos os grupos de percentil nos dois sexos. Foi encontrado um aumento para HDL‐C, porém misturado, e, diferentemente de nosso estudo, foram encontrados resultados não relacionados a sexo para triglicerídeos e glicose. Skinner et al.,10 que usaram grande número de dados do Levantamento Nacional de Exames de Saúde e Nutrição (NHANEs), também encontraram diferenças entre sexo, com valores mais elevados de colesterol total, triglicerídeos e glicose entre homens; com quatro classes de graus de sobrepeso, eles encontraram também valores mais elevados de colesterol total, triglicerídeos e glicose e valores menores de HDL‐C entre as crianças mais obesas. No presente estudo, a avaliação das correlações entre IMC e os indicadores estudados demonstrou diferentes resultados para perfis lipídicos e glicêmicos. Colesterol total e LDL‐C não mostraram correlação positiva com escore‐z de IMC. Quando esses dados são analisados em conjunto com a prevalência de colesterol total e LDL‐C acima dos níveis de ponto de corte, pode‐se entender que as crianças com sobrepeso e obesidade são gravemente afetadas. Com relação à HDL‐C, a lógica é basicamente a mesma, com a exceção de que, entre as meninas, foi observada uma fraca correlação negativa, mostrou que a HDL‐C tende a ser ligeiramente menor quanto maior o IMC. Em geral, considera‐se que, no perfil lipídico, triglicerídeo é o indicador que mais muda em crianças obesas. Apesar de isso não ter sido encontrado em termos de prevalência, foi encontrada uma fraca correlação positiva entre o escore‐z de IMC e triglicerídeo, particularmente evidente entre meninas.
Não avaliamos o estado puberal, pois os valores do ponto de corte de lipídicos e glicose são os mesmos em todas as idades incluídas e o perfil insulinêmico depende mais da idade do que do estado puberal.22 Os valores de glicose apresentaram fraca correlação positiva com IMC, sem, contudo, atingir os valores do ponto de corte na maior parte dos pacientes. Por outro lado, os indicadores de resistência à insulina apresentaram as correlações mais fortes entre os indicadores estudados; os valores de insulina plasmática e HOMA‐IR apresentaram correlação positiva com os escores‐z de IMC. Resultados semelhantes foram demonstrados por Mieldazis et al.18 e Silva et al.23 Conforme demonstrado anteriormente,14,15 os valores da insulina plasmática e HOMA‐IR são influenciados por idade, apresentam aumento significativo com pico próximo ao surto de crescimento. Por esse motivo, foi feita regressão múltipla apenas para esse indicador, para controlar os resultados para a idade, e, apesar de os valores da correlação terem reduzido, eles persistiram estatisticamente significativos. Deve‐se observar que os valores da correlação para insulina plasmática e HOMA‐IR são muito semelhantes, independentemente do controle para a idade. Isso corrobora o fato de que, na infância e adolescência, devido às limitações relacionadas à dificuldade de avaliar a presença de resistência à insulina no laboratório, caso a opção seja usar um dos dois indicadores estudados, medir a insulina é suficiente e a variação da HOMA‐IR basicamente reflete a variação na insulina plasmática.
O estudo tem algumas limitações: trata‐se de um estudo transversal, então, não é possível determinar a causa e o efeito. As composições dietéticas e corporais não foram avaliadas. A amostra foi obtida de todos os pacientes que passaram pela primeira consulta nos dois centros durante o período do estudo, porém não é possível extrapolar os resultados de toda a população de crianças e adolescentes com sobrepeso e obesidade, pois usamos uma amostra de conveniência.
Sobrepeso e obesidade levaram à alta prevalência de dislipidemia e resistência à insulina em meninos e meninas. Os escores‐z de IMC mostraram fraca correlação positiva com glicose e triglicerídeos e correlação negativa com HDL‐C. Por outro lado, foi encontrada forte correlação positiva com os indicadores de resistência à insulina, mesmo quando ajustados para a idade.
Conflitos de interesseOs autores declaram não haver conflitos de interesse.
Como citar este artigo: Nogueira‐de‐Almeida CA, Mello ED. Correlation of body mass index Z‐scores with glucose and lipid profiles among overweight and obese children and adolescents. J Pediatr (Rio J). 2018;94:308–12.
Estudo feito na Universidade Federal de São Carlos (UFSCAR), São Carlos, SP; e na Universidade Federal do Rio Grande do Sul (UFRGS), Porto Alegre, RS, Brasil.