Cystic fibrosis diagnosis is dependent on the chloride ion concentration in the sweat test (≥60mEq/mL – recognized as the gold standard indicator for cystic fibrosis diagnosis). Moreover, the salivary glands express the CFTR protein in the same manner as sweat glands. Given this context, the objective was to verify the correlation of saliva chloride concentration and sweat chloride concentration, and between saliva sodium concentration and sweat sodium concentration, in patients with cystic fibrosis and healthy control subjects, as a tool for cystic fibrosis diagnosis.
MethodsThere were 160 subjects enrolled: 57/160 (35.70%) patients with cystic fibrosis and two known CFTR mutations and 103/160 (64.40%) healthy controls subjects. Saliva ion concentration was analyzed by ABL 835 Radiometer® equipment and, sweat chloride concentration and sweat sodium concentration, respectively, by manual titration using the mercurimetric procedure of Schales & Schales and flame photometry. Statistical analysis was performed by the chi‐squared test, the Mann–Whitney test, and Spearman's correlation. Alpha=0.05.
ResultsPatients with cystic fibrosis showed higher values of sweat chloride concentration, sweat sodium concentration, saliva chloride concentration, and saliva sodium concentration than healthy controls subjects (p‐value<0.001). The correlation between saliva chloride concentration and sweat chloride concentration showed a positive Spearman's Rho (correlation coefficient)=0.475 (95% CI=0.346 to 0.587). Also, the correlation between saliva sodium concentration and sweat sodium concentration showed a positive Spearman's Rho=0.306 (95% CI=0.158 to 0.440).
ConclusionsSaliva chloride concentration and saliva sodium concentration are candidates to be used in cystic fibrosis diagnosis, mainly in cases where it is difficult to achieve the correct sweat amount, and/or CFTR mutation screening is difficult, and/or reference methods for sweat test are unavailable to implement or are not easily accessible by the general population.
O diagnóstico da fibrose cística depende do valor da concentração de íons de cloreto no teste do suor (≥ 60 mEq/mL – reconhecido como o indicador‐padrão para o diagnóstico da doença). Além disso, as glândulas salivares expressam a proteína RTFC igualmente às glândulas sudoríparas. Nesse contexto, nosso objetivo foi verificar a correlação da concentração de cloreto na saliva e a concentração de cloreto no suor e entre a concentração de sódio na saliva e a concentração de sódio no suor em pacientes com fibrose cística e indivíduos controles saudáveis, como uma ferramenta para diagnóstico de fibrose cística.
MétodosContamos com a participação de 160 indivíduos [57/160 (35,70%) com fibrose cística e duas mutações no gene RTFC conhecidas e 103/160 (64,40%) indivíduos controles saudáveis]. A concentração de íons na saliva foi analisada pelo equipamento ABL 835da Radiometer® e a concentração de cloreto no suor e sódio no suor, respectivamente, por titulação manual utilizando o método mercurimétrico de Schales & Schales e fotometria de chama. A análise estatística foi realizada pelo teste qui‐quadrado, pelo teste de Mann‐Whitney e pela correlação de Spearman. Alpha=0,05.
ResultadosOs pacientes com fibrose cística apresentaram maiores valores na concentração de cloreto no suor,concentração de sódio no suor,concentração de cloreto na saliva e concentração de sódio na saliva do que os indivíduos‐controle saudáveis (valor de p<0,001). A correlação entre as concentrações de cloreto na saliva e cloreto no suor mostrou Rho de Spearman (coeficiente de correlação) positivo=0,475 (IC de 95%=0,346 a 0,587). Além disso, a correlação entre concentração de sódio na saliva e concentração de sódio no suor mostrou Rho de Spearman positivo=0,306 (IC de 95%=0,158 a 0,440).
ConclusõesA concentração de cloreto na saliva e a concentração de sódio na saliva são candidatas a ser usadas como diagnóstico de fibrose cística, principalmente em casos em que é difícil atingir a quantidade correta de suor, e/ou o exame da mutação RTFC é difícil e/ou o método de referência para o teste do suor não se encontra disponível ou não é de fácil acesso ao público em geral.
O diagnóstico de fibrose cística (FC) (OMIM, Base de Dados On‐line da Herança Mendeliana no Homem: #219700) tem como base a quantidade de concentração de cloreto atingida no teste do suor (TS) – ≥ 60 mEq/mL, é reconhecido como o indicador‐padrão de base no diagnóstico de FC.1 Contudo, há uma variabilidade no TS, principalmente nos valores de cloreto no suor, que é um reflexo de muitos fatores e de sua interação, e como exemplo citamos: peso do suor, idade, sexo, etnia, mutações RTFC (regulador da condutância transmembrana da fibrose cística), índice de massa corporal e composição corporal, genes modificadores e a influência de outros canais iônicos, por exemplo, canais de potássio, sódio e canais de cloreto alternativos.2–4 Historicamente, o TS é o padrão de base para diagnosticar FC; contudo, muitas ferramentas são estudadas para melhorar o diagnóstico, inclusive evaporímetro, biópsias retais, diferença de potencial nasal, dosagem de cloreto na saliva, dosagem de cloreto na saliva e exame da mutação RTFC.5–14 Na literatura, o uso da saliva como um teste de diagnóstico não é bem elucidado e deve ser mais bem analisado.9,15
Curiosamente, muitas doenças sistêmicas podem afetar o funcionamento das glândulas salivares e a produção de saliva, o que pode afetar as propriedades físicas e químicas da saliva, é uma ferramenta útil de diagnóstico.9,14–17 Nesse contexto, nosso objetivo foi verificar a correlação entre a concentração de cloreto na saliva (ClSa) e a concentração de cloreto no suor (ClSu) e entre a concentração de sódio na saliva (NaSa) e a concentração de sódio no suor (NaSu) em pacientes com FC e indivíduos saudáveis de controle, como uma ferramenta para diagnóstico de FC. Além disso, em hipótese, acreditamos que o ClSu e o ClSa apresentaram uma correlação positiva entre si e o mesmo deve ocorrer entre o NaSu e o NaSa. Nesse caso, a concentração de íons na saliva pode ser uma ferramenta útil no diagnóstico de FC, principalmente em casos em que é difícil atingir a quantidade correta de suor (peso do suor ≥ 75 mEq/L), e/ou o exame da mutação RTFC é difícil e/ou o método de referência para o teste do suor não se encontra disponível ou não é de fácil acesso ao público em geral.
MétodosContamos com a participação de pacientes com FC e duas mutações RTFC conhecidas e indivíduos saudáveis de controle.
Dosagem da concentração de íons na saliva9A coleta de saliva foi feita após se enxaguar a boca com água por um minuto para eliminar contaminação e estimular as glândulas salivares. A coleta foi feita no mesmo horário do dia (tarde) para os dois grupos – pacientes com FC e indivíduos saudáveis de controle – para evitar possíveis interferências fisiológicas e ambientais.
As amostras de saliva foram coletadas com um Salivette® (Sardest‐Alemanha – http://www.sarstedt.com) ao mastigar rolos de algodão estéril por um minuto na boca. As amostras foram imediatamente centrifugadas a 1.800rpm durante 15 minutos após a coleta e foi medida a quantidade de saliva (escala de μL).
O NaSa e ClSa foram determinados em um analisador a gases ABL 500 (modelo 835, Radiometer®, Dinamarca) com 400μL de saliva pela técnica de eletrodo de íons seletivos (http://www.radiometer.com).
Os procedimentos feitos no artigo para dosagem da concentração de íons na saliva tiveram como base um estudo anterior publicado pelo mesmo grupo.9
Dosagem da concentração de íons no suor1O método de Gibson e Cooke foi feito em dois estágios do TS: indução e coleta. A indução do suor foi feita com pilocarpina e um dispositivo próprio criado em nosso centro. Além disso, foi feita a dosagem dos íons de cloreto e sódio, respectivamente, por titulação manual com o procedimento de nitrato de mercúrio de Schales e Schales e por fotometria de chama.
Foram adotadas as distâncias de 2cm e 5cm entre os eletrodos para os recém‐nascidos e os outros participantes, respectivamente. Para minimizar o risco de queimadura, a gaze foi mantida completamente úmida com pilocarpina e o eletrodo foi posicionado na gaze com um elástico para evitar o deslocamento do eletrodo no braço.
No TS, foram usados 10min e 30min para indução e coleta do suor. Com o TS, os seguintes dados foram avaliados: peso do suor (mg), quantidade suficiente de suor obtido durante o suor induzido (peso superior a 75mg) e os parâmetros de diagnóstico da FC por concentração de cloreto (mEq/L): indivíduos saudáveis de controle <30 mEq/L; indivíduos limítrofes ≥ 30 mEq/L a <60 mEq/L; pacientes com FC ≥ 60 mEq/L.1
Triagem genotípica do RTFCAs mutações RTFC foram analisadas pelas técnicas de reação em cadeia da polimerase para F508del e a digestão enzimática para G542X, R1162X, R553X, G551D e N1303K. Outras mutações no RTFC também foram identificadas por sequenciamento ou com o uso da técnica SALSA MPLA (Amplificação de Múltiplas Sondas Dependentes de Ligação) Kit P091‐C1 CFTR‐MRC‐Holland com MegaBace1000®, 3500, (GE Healthcare Biosciences, Pittsburgh, EUA) e ABI 3500 (Biossistemas Aplicados – Thermo Fisher Scientific, São Paulo, Brasil).18 A classificação da mutação RTFC está de acordo com a literatura.19 Além disso, usamos a base de dados do RTFC2 [A Tradução Clínica e Funcional do RTFC (RTFC)] para determinar se algumas mutações foram causadas pela FC.20
Divulgação éticaTodos os procedimentos feitos neste estudo envolveram participantes humanos e estavam de acordo com os padrões éticos do comitê institucional e/ou nacional em pesquisa e com a Declaração de Helsinque de 1964 e suas alterações posteriores ou padrões éticos comparáveis. Além disso, o Comitê de Ética em Pesquisa aprovou o estudo e o consentimento informado por escrito foi obtido de todos os indivíduos incluídos no estudo e/ou, quando menores, de um pai ou responsável.
Análise estatísticaFoi usada uma análise descritiva com o número de observações, valor médio, desvio‐padrão, mediana, valores mínimos e máximos e intervalo de confiança de 95% para a média das variáveis contínuas. Para as variáveis categóricas, os dados serão apresentados por frequências e percentuais.
A análise estatística foi feita com teste de Mann‐Whitney (para comparar a diferença entre os pacientes com FC e os indivíduos saudáveis de controle, considerando os valores de ClSu, ClSa, NaSu, NaSa e idade) e pela correção de Rho de Spearman (para mostrar a correlação entre ClSu e ClSa ou NaSu e NaSa, considerando os grupos de pacientes com FC e os indivíduos saudáveis de controle). Além disso, usamos o teste qui‐quadrado para comparar a associação entre os grupos e o sexo. A análise estatística foi feita com a versão 23.0 do Pacote Estatístico para as Ciências Sociais (SPSS Inc., Chicago, IL). O valor de alfa foi 0,05. Além disso, o poder da amostra foi estimado com o programa Árvores de Decisão (Australia and New Zealand Melanoma Trials Group – ANZMTG) para a correlação de Rho de Spearman e a versão 3.1.9.2 do software G* Power para o teste de Mann‐Whitney. O cálculo indica um poder da amostra de 0,978, considerando a menor correlação positiva atingida (Ró = 0,306; alfa = 0,05; amostra = 160). Além disso, para o teste de Mann‐Whitney estipulamos como um tamanho ideal da amostra o valor de 150 (proporção de atribuição – N1 = 50 pacientes com FC; N2 = 150 indivíduos saudáveis de controle) para o teste bicaudal, tamanho de efeito d de 0,5; erro alfa de 0,05; poder de 0,80.
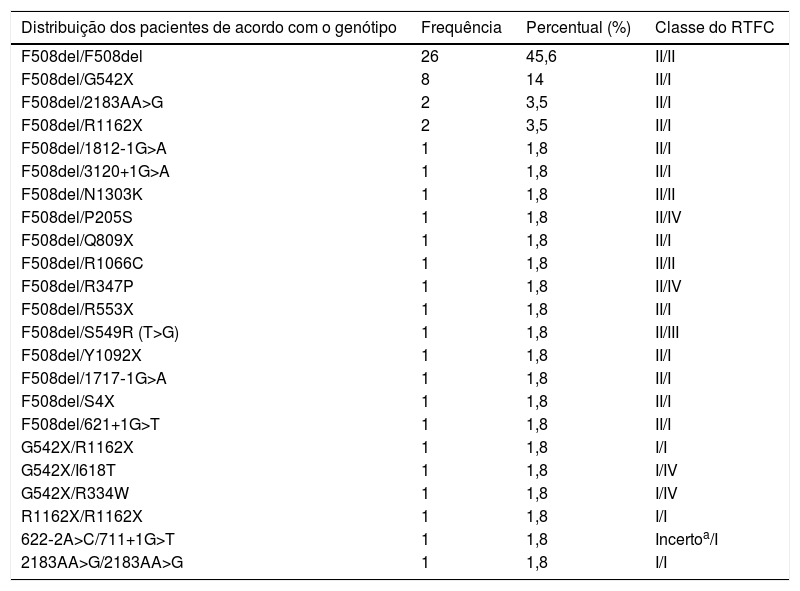
ResultadosO estudo incluiu 160 pacientes com FC [57/160 (35,7%)] e duas mutações RTFC conhecidas. Além disso, houve ∼50% de mulheres nos dois grupos e os pacientes com FC eram mais novos em comparação com os indivíduos de controle saudáveis (valor de p = 0,005) (tabela 1). Os genótipos das mutações RTFC conhecidas encontradas nos pacientes com FC são apresentados na tabela 2. Na tabela, podemos observar que todos os pacientes com FC apresentaram duas mutações RTFC conhecidas identificadas e as mutações foram consideradas mutações causadoras de FC de acordo com o CFTR2, exceto para a mutação 622‐2A> C (c.490‐2A> G, rs397508735), que não foi incluída na lista do CFTR2 e foi considerada por nós uma mutação de classe I –uma variante de recomposição.
Dados descritivos dos pacientes com fibrose cística e indivíduos de controle saudáveis que participaram do estudo
Genótipo RTFC e classes das mutações identificadas
| Distribuição dos pacientes de acordo com o genótipo | Frequência | Percentual (%) | Classe do RTFC |
|---|---|---|---|
| F508del/F508del | 26 | 45,6 | II/II |
| F508del/G542X | 8 | 14 | II/I |
| F508del/2183AA>G | 2 | 3,5 | II/I |
| F508del/R1162X | 2 | 3,5 | II/I |
| F508del/1812‐1G>A | 1 | 1,8 | II/I |
| F508del/3120+1G>A | 1 | 1,8 | II/I |
| F508del/N1303K | 1 | 1,8 | II/II |
| F508del/P205S | 1 | 1,8 | II/IV |
| F508del/Q809X | 1 | 1,8 | II/I |
| F508del/R1066C | 1 | 1,8 | II/II |
| F508del/R347P | 1 | 1,8 | II/IV |
| F508del/R553X | 1 | 1,8 | II/I |
| F508del/S549R (T>G) | 1 | 1,8 | II/III |
| F508del/Y1092X | 1 | 1,8 | II/I |
| F508del/1717‐1G>A | 1 | 1,8 | II/I |
| F508del/S4X | 1 | 1,8 | II/I |
| F508del/621+1G>T | 1 | 1,8 | II/I |
| G542X/R1162X | 1 | 1,8 | I/I |
| G542X/I618T | 1 | 1,8 | I/IV |
| G542X/R334W | 1 | 1,8 | I/IV |
| R1162X/R1162X | 1 | 1,8 | I/I |
| 622‐2A>C/711+1G>T | 1 | 1,8 | Incertoa/I |
| 2183AA>G/2183AA>G | 1 | 1,8 | I/I |
RTFC, regulador da condutância transmembrana da fibrose cística.
Além disso, nenhuma mutação RTFC ou concentração de cloreto acima de 30 mEq/L foi encontrada nos indivíduos de controle saudáveis.
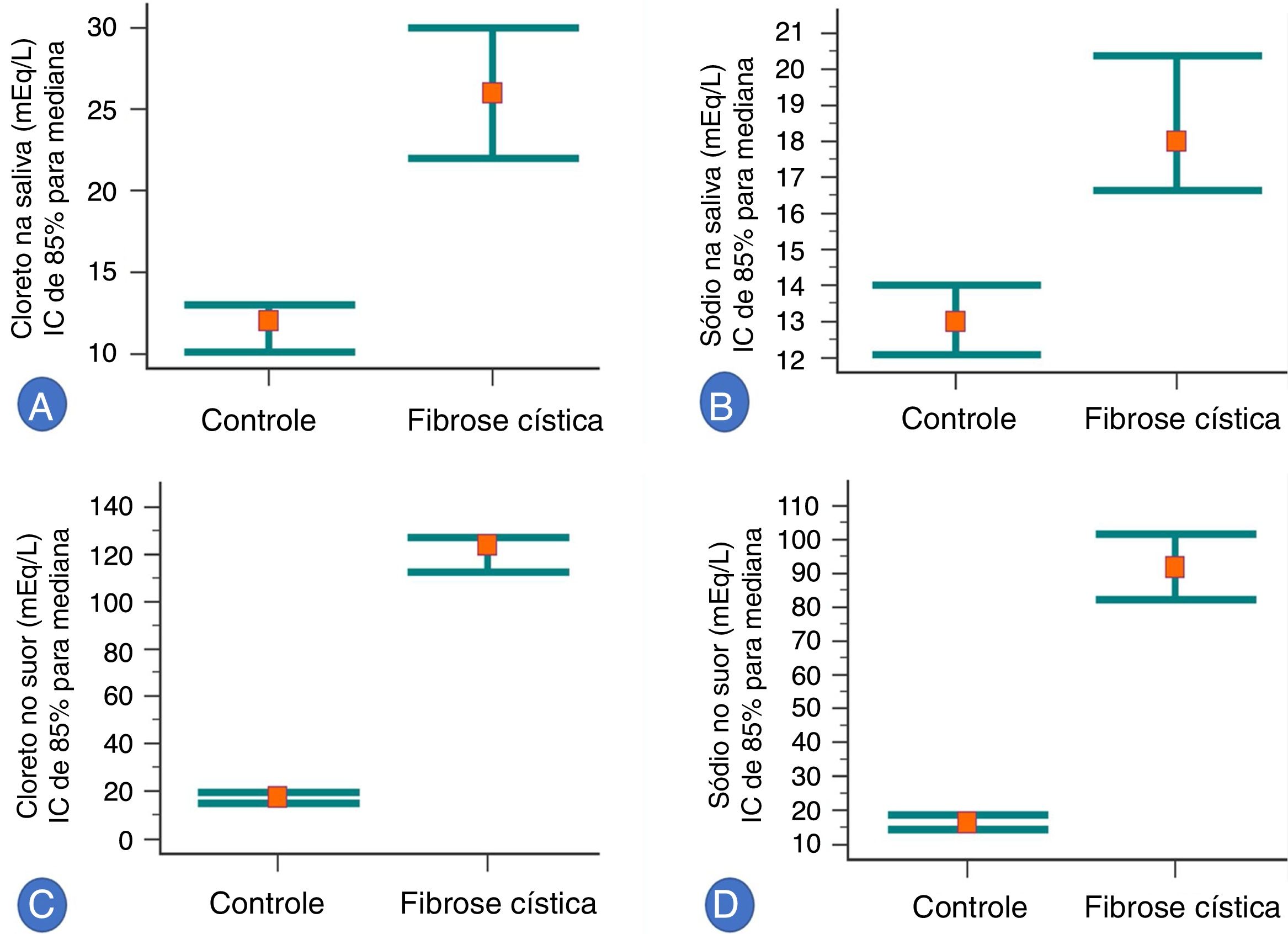
Na análise de associação, os pacientes com FC apresentaram maiores valores de ClSu, NaSu, ClSa e NaSa do que os indivíduos de controle saudáveis (valor de p <0,001) (figura 1). Resumidamente, incluímos a análise em quatro experimentos [os dados são apresentados como média ± desvio‐padrão; mediana (mínima e máxima); intervalo de confiança de 95% para a média]: (i) indivíduos saudáveis de controle em comparação com pacientes com fibrose cística para ClSa: (indivíduos saudáveis de controle) 12,87 ± 5,85; 12 (6 a 35); 11,73 a 14,02 em comparação com (pacientes com fibrose cística) 28,98 ± 14,18; 26 (12 a 89); 25,22 a 32,75; (ii) indivíduos saudáveis de controle em comparação com pacientes com fibrose cística para NaSa: (indivíduos saudáveis de controle) 14,37 ± 6,5; 13 (6 a 52); 13,1 a 15,64; (pacientes com fibrose cística) 21,09 ± 9,29; 18 (8 a 48); 18,62 a 23,55; (iii) indivíduos saudáveis de controle em comparação com pacientes com fibrose cística para ClSu: (indivíduos saudáveis de controle) 17,57 ± 6,15; 17,54 (7,35 a 28,99); 16,37 a 18,77; (pacientes com fibrose cística) 120,85 ± 24,89; 123,89 (63,7 a 185,71); 114,25 a 127,45; (iv) indivíduos saudáveis de controle e pacientes com fibrose cística para NaSu: (indivíduos saudáveis de controle) 17,67 ± 7,58; 16,37 (5,03 a 36); 16,18 a 19,15; (pacientes com fibrose cística) 95,62 ± 28,38; 91,73 (32,2 a 172,81); 88,09 a 103,15. Além disso, curiosamente, oito pacientes com fibrose cística mostraram valor de cloreto no suor acima de 160 mEq/L, como segue: 161,29, 164,51, 167,97, 168,47, 173,20 e 185,71.
Associação entre o grupo de controle saudável (103 indivíduos) e os pacientes com fibrose cística (57 indivíduos) com relação à concentração de íons na saliva e à concentração de íons no suor (mEq/L). A. Associação entre o grupo de controle saudável e os pacientes com fibrose cística com relação à concentração de íons de cloreto na saliva. (Grupo de controle) 12,87 ± 5,85; 12 (6 a 35); 11,73 a 14,02. (Pacientes com fibrose cística) 28,98 ± 14,18; 26 (12 a 89); 25,22 a 32,75. B. Associação entre o grupo de controle saudável e os pacientes com fibrose cística com relação à concentração de íons de sódio na saliva. (Grupo de controle) 14,37 ± 6,5; 13 (6 a 52); 13,1 a 15,64. (Pacientes com fibrose cística) 21,09 ± 9,29; 18 (8 a 48); 18,62 a 23,55. C. Associação entre o grupo de controle saudável e os pacientes com fibrose cística com relação à concentração de íons de cloreto no suor. (Grupo de controle) 17,57 ± 6,15; 17,54 (7,35 a 28,99); 16,37 a 18,77. (Pacientes com fibrose cística) 120,85 ± 24,89; 123,89 (63,7 a 185,71); 114,25 a 127,45. D. Associação entre o grupo de controle saudável e os pacientes com fibrose cística com relação à concentração de íons de sódio no suor. (Grupo de controle) 17,67 ± 7,58; 16,37 (5,03 a 36); 16,18 a 19,15. (Pacientes com fibrose cística) 95,62 ± 28,38; 91,73 (32,2 a 172,81); 88,09 a 103,15. Todos os valores de p foram <0,001. A análise estatística foi feita com o teste de Mann‐Whitney. Alfa = 0,05. As medianas e o intervalo de confiança de 95% estão representados nos gráficos. Além disso, nas legendas, a média ± desvio‐padrão; mediana (mínima e máxima); intervalo de confiança de 95% da média. Oito pacientes com fibrose cística mostraram valor de cloreto no suor acima de 160 mEq/L, como segue: 161,29, 164,51, 167,97, 168,47, 173,20 e 185,71.
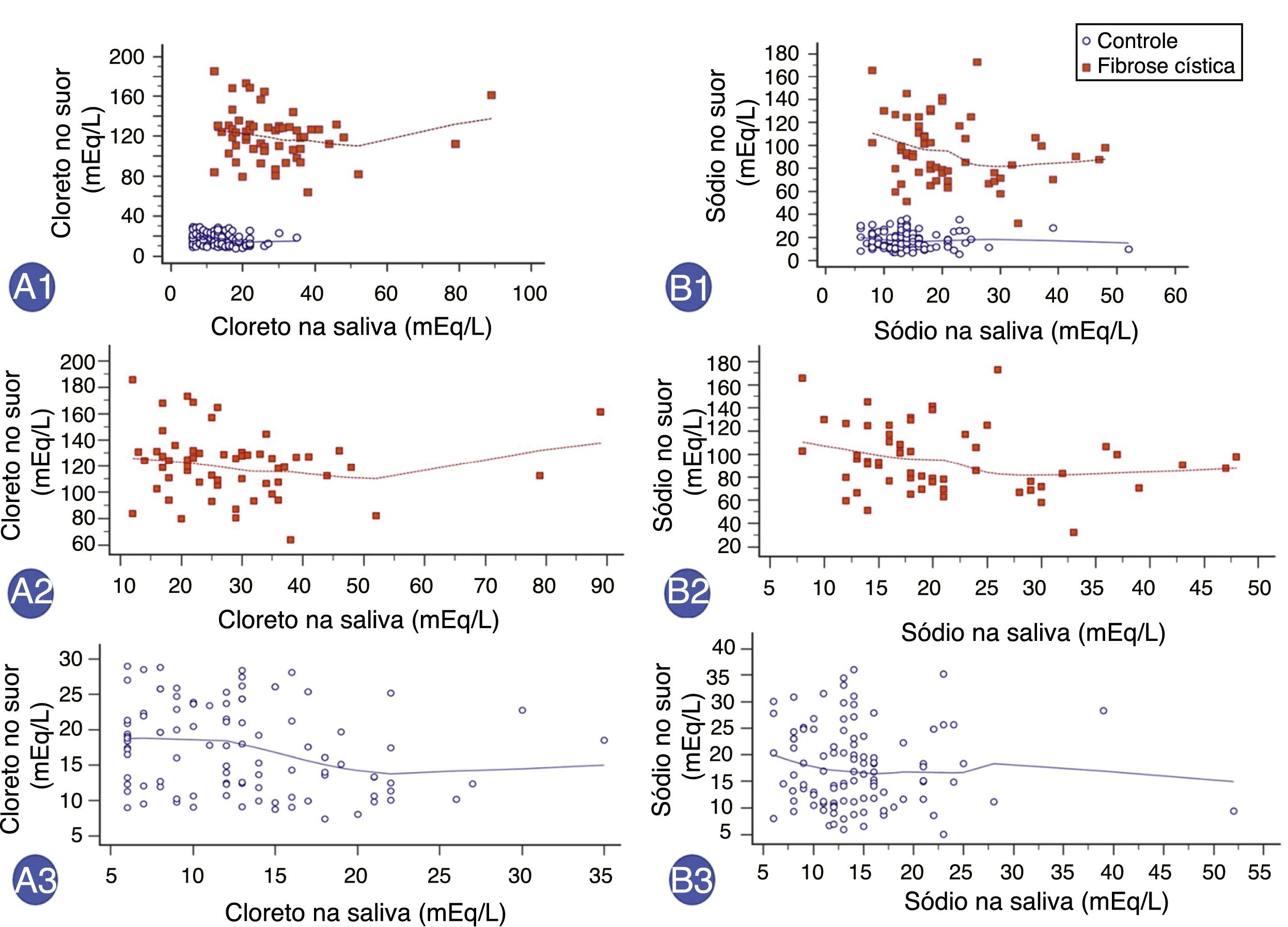
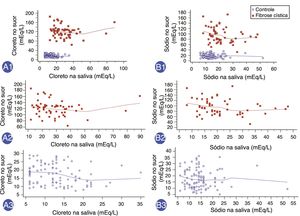
Por fim, houve uma correlação positiva entre as concentrações de ClSu e ClSa com o Rho de Spearman (coeficiente de correlação) de = 0,475 (IC de 95% = 0,346 a 0,587) e outra correlação positiva entre a concentração de NaSu e NaSa do Rho de Spearman de 0,306 (IC de 95% = 0,158 a 0,440) (figura 2). Porém, não foi observado Rho de Spearman significativo: (i) ClSu e ClSa em pacientes com fibrose cística – Ró de Spearman = ‐0,185; IC de 95% = ‐0,425 a 0,079 (valor de p = 0,168); (ii) ClSu e ClSa em indivíduos saudáveis de controle – Ró de Spearman = ‐0,226; IC de 95% = ‐0,402 a ‐0,034 (valor de p = 0,022); (iii) NaSu e NaSa em pacientes com fibrose cística – Ró de Spearman = ‐0,251; IC de 95% = ‐0,48 a 0,012 (valor de p = 0,06); (iv) NaSu e NaSa em indivíduos saudáveis de controle – Ró de Spearman = ‐0,062; IC de 95% = 0,252 a 0,133 (valor de p = 0,534).
Correlação entre os valores da concentração de íons na saliva e íons no suor (mEq/L) com relação a indivíduos saudáveis de controle e os pacientes com fibrose cística. A1. Correlação entre a concentração de cloreto no suor (ClSu) e a concentração de cloreto na saliva (ClSa) em todos os indivíduos no mesmo horário. N = 160 indivíduos. Rho de Spearman = 0,475; intervalo de confiança de 95% (IC de 95%) = 0,346 a 0,587; valor de p <0,001. A2. A correlação entre ClSu e ClSa em pacientes com fibrose cística. N = 57 indivíduos. Rho de Spearman = ‐0.185; IC de 95% = 0,425 a 0,079; valor de p = 0,168. A3. Correlação entre ClSu e ClSa em indivíduos saudáveis de controle. N = 103 indivíduos. Rho de Spearman = ‐0,226; IC de 95% = 0,402 a ‐0,034; valor de p = 0,022. B1. Correlação entre a concentração de sódio no suor (NaSu) e a concentração de sódio na saliva (NaSa) em todos os indivíduos no mesmo horário. N = 160 indivíduos. Rho de Spearman = ‐0,306; IC de 95% = 0,158 a 0,440; valor de p = 0,0001. B2. Correlação entre NaSu e NaSa em pacientes com fibrose cística. N = 57 indivíduos. Rho de Spearman = ‐0,251; IC de 95% = 0,48 a 0,012; valor de p = 0,06. B3. Correlação entre NaSu e NaSa em indivíduos saudável de controle. N = 103 indivíduos. Rho de Spearman = ‐0,062; IC de 95% = 0,252 a 0,133; valor de p = 0,534. Vermelho, pacientes com fibrose cística; azul, indivíduos de controle saudáveis. A análise estatística foi feita pelo teste de correlação de Spearman. Alfa = 0,05.
O sexo não influenciou a concentração de ClSu, NaSu, ClSa e NaSa, independentemente do grupo (pacientes com fibrose cística ou indivíduos saudáveis de controle).
DiscussãoApós décadas da implantação do TS no diagnóstico de FC, ainda lidamos com alguns problemas relacionados ao diagnóstico de FC.3,4,21 Nesse contexto, algumas técnicas foram incluídas, porém mostraram algumas limitações, como custos, nível de comprovação, muitos procedimentos, necessidade de uma equipe multidisciplinar com alto nível de qualificação para fazer um único procedimento. Porém, em algumas condições, como a saliva, temos baixos custos e uma ferramenta fácil que deve ser estudada como um novo método para diagnóstico da FC. Nosso estudo está de acordo com o artigo de Camargo et al.,22 que comprova que alguns “aspectos simples” podem promover um maior benefício, como a indicação do TS, e para reduzir custos associados a outras ferramentas.22
Considerando a saliva como uma ferramenta de diagnóstico para FC, precisamos conhecer os princípios por trás do processo salivar. Nesse contexto, a secreção salivar é um processo que envolve duas etapas: a primeira ocorra nos ácinos e a segunda no duto salivar. Os ácinos produzem uma secreção primária que contém ptialina e/ou mucina em uma solução iônica com concentrações próximas ao fluido extracelular típico. Não obstante, como a secreção primária flui pelos dutos, há dois grandes processos de transporte ativos que modificam a composição iônica da saliva. Em todos os dutos salivares os íons de sódio são reabsorvidos ativamente, ao passo que os íons de potássio são secretados. Portanto, a concentração de íons de sódio na saliva é baixa, ao passo que a concentração de íons de potássio é alta. Durante a salivação, a concentração de íons na saliva sofre mudanças drásticas, pois a formação da secreção salivar primária por ácinos pode aumentar até 20 vezes. Consequentemente, a rápida passagem de secreções pelos dutos acinares reduz a absorção de íons da secreção nos dutos. Portanto, quando grande quantidade de saliva é secretada, o ClSa e o NaSa aumentam cerca de metade a dois terços da concentração plasmática, ao passo que a concentração de potássio cai quatro vezes.21‐26 Nesse contexto, podemos visualizar que a concentração de íons na saliva depende da atividade da proteína RTFC expressa nos dutos salivares. Além disso, as mutações RTFC levam a uma concentração anormal de íons na saliva, igual à concentração de íons no suor, atuam principalmente nos valores de cloreto e sódio. Ademais, acreditamos que precisamos de outros estudos para concluir sobre o uso da saliva como método de diagnóstico de FC, porém tivemos um conceito fisiologista, em nossas mentes, de igualdade entre o ClSu e o ClSa (ou NaSu e NaSa).
Além de nossos achados, acreditamos que muitas limitações podem ser discutidas em nossos dados/estudo, inclusive: (i) baixo número de pacientes com FC e mutações RTFC da classe IV, V ou VI para fazer uma análise estatística entre diferentes classes de mutações RTFC e as duas técnicas (suor em comparação com saliva); (ii) não tivemos a intenção de associar os marcadores clínicos à saliva e ao suor, porém, no futuro, os valores iônicos poderiam ser comparados com o uso desses dados; (iii) os pais dos pacientes com FC podem ser incluídos para nos informar sobre os indivíduos, com uma cópia do alelo RTFC mutado e a influência na quantidade final de íons na saliva e no suor; (iv) outras ferramentas de diagnóstico podem ser comparadas entre os grupos e correlacionadas à amostra de saliva; (v) um maior número de indivíduos deve ser incluído para analisar a influência da idade sobre o ClSa e o NaSa, também em cada faixa etária, para determinar uma curva de acompanhamento; (vi) o ClSu é reconhecido como padrão de base no diagnóstico de FC. Contudo, na saliva, percebemos valores alterados quando comparamos pacientes com FC e indivíduos saudáveis de controle. Porém, nenhum valor de referência de ClSa foi publicado até este momento.
Em conclusão, a concentração de íons na saliva pode ser um método opcional para diagnosticar FC. Ademais, a concentração de íons na saliva pode validar os TSs limítrofes e melhorar a análise da resposta à medicina de precisão/personalizada – principalmente se considerarmos a resposta individual aos medicamentos.27 De fato, o mapeamento genético não está disponível a todos os pacientes com FC e a concentração de íons na saliva pode ajudar a diagnóstico FC. Além disso, a saliva é de fácil acesso e tem menor custo para ser analisada, em comparação com o TS. Por fim, atingimos valores semelhantes à diferença de concentração de íons de cloreto e concentração de íons de sódio entre os pacientes com FC e os indivíduos saudáveis de controle com relação à saliva e ao suor. Devem ser feitos novos estudos com uma população maior de pacientes com FC e controles saudáveis para criar uma curva normal para a concentração de íons na saliva. Além disso, a saliva pode ser usada em casos em que o TS não é fácil de ser atingido ou para confirmar a triagem neonatal, é, como um segundo teste, fácil de ser administrado. Resumindo, o ClSa e o NaSa são candidatos a ser usados como diagnóstico de FC, principalmente em casos em que é difícil atingir a quantidade correta de suor, e/ou o exame da mutação RTFC é difícil e/ou o método de referência para o teste do suor não se encontra disponível ou não é de fácil acesso ao público em geral.
FinanciamentoFundação de Amparo à Pesquisa do Estado de São Paulo (Fapesp) pelo apoio a FAML (#2015/12858‐5) e a ALG (#2014/00611‐2).
Conflitos de interesseOs autores declaram não haver conflitos de interesse.
Ao Laboratório Multiusuário de Genética Médica, por contribuir para a triagem genotípica do RTFC (http://www.laboratoriomultiusuario.com.br/); a Stéphanie Villa‐Nova Pereira, Priscila Dentini, Luciana Montes Rezende, Luciana Cardoso Bonadia, Maria Ângela Gonçalves de Oliveira Ribeiro, Maria de Fátima Corrêa Pimenta Servidoni, Andressa Oliveira Peixoto, Adyléia Aparecida Contrera Dalbo Toro, Renan Marrichi Mauch, Roberto José Negrão Nogueira, Eulália Sakano, Natasha Matsunaga, Alfonso Eduardo Alvarez, Carla Cristina de Souza Gomez, Elizete Aparecida Lomazi, Paloma Lopes Francisco Parazzi, Larissa Lazzarini Furlan, Emília Cristina Gonçalves, Milena Baptistella Grotta Silva, André Moreno Morcillo, Jaqueline Mores, Mariana Zorrón Mei Hsia Pu, Arthur Henrique Pezzo Kmit, Adriana Mendes Vinagre, Maura Mikie Fukujima Goto, Gabriel Hessel e Aléthea Guimarães Faria, que contribuíram para os estudos sobre fibrose cística em nosso centro de referência.
Como citar este artigo: Gonçalves AC, Marson FA, Mendonça RM, Bertuzzo CS, Paschoal IA, Ribeiro JD, et al. Chloride and sodium ion concentrations in saliva and sweat as a method to diagnose cystic fibrosis. J Pediatr (Rio J). 2019;95:443–50.