Given the importance of incorporating simple and low-cost tools into the pediatric clinical setting to provide screening for insulin resistance, the present study sought to investigate whether waist-to-height ratio is comparable to biochemical markers for the discrimination of insulin resistance in children and adolescents.
MethodsThis cross-sectional study involved students from nine public schools. In total, 296 children and adolescents of both sexes, aged 8–14 years, composed the sample. Waist-to-height ratio, triglycerides/glucose index, and triglycerides-to-HDL-C ratio were determined according to standard protocols. Insulin resistance was defined as homeostatic model assessment for insulin resistance with cut-off point ≥ 3.16.
ResultsAge, body mass index, frequency of overweight, waist circumference, waist-to-height ratio, insulin, glucose, homeostatic model assessment for insulin resistance, triglycerides, triglycerides/glucose index, and triglycerides-to-HDL-C were higher among insulin resistant boys and girls. Moderate correlation of all indicators (waist-to-height ratio, triglycerides/glucose index, and triglycerides-to-HDL-C ratio) with homeostatic model assessment for insulin resistance was observed for both sexes. The areas under the receiver operational characteristic curves ware similar between waist-to-height ratio and biochemical markers.
ConclusionThe indicators provided similar discriminatory power for insulin resistance. However, taking into account the cost-benefit ratio, we suggest that waist-to-height ratio may be a useful tool to provide screening for insulin resistance in pediatric populations.
Considerando a importância de incorporar ferramentas simples e de baixo custo no cenário clínico-pediátrico para a triagem de resistência à insulina, o presente estudo buscou investigar se a razão cintura/estatura é comparável a marcadores bioquímicos na discriminação de resistência à insulina em crianças e adolescentes.
MétodosEste estudo transversal envolveu estudantes de nove escolas públicas. No total, 296 crianças e adolescentes, de ambos os sexos, com idades entre 8 e 14 anos, compuseram a amostra. A razão cintura/estatura, o índice triglicerídeos/glicose e a razão triglicerídeos/HDL-C foram determinados de acordo com protocolos padrão. A resistência à insulina foi definida por meio do modelo de avaliação homeostática para resistência insulínica, com ponto de corte ≥ 3.16.
ResultadosIdade, índice de massa corporal, frequência de excesso de peso, circunferência da cintura, razão cintura/estatura, insulina, glicemia, modelo de avaliação homeostática para resistência insulínica, triglicerídeos, índice triglicerídeos/glicose e razão triglicerídeos/HDL-C foram maiores entre meninos e meninas com resistência à insulina. Também foram observadas, em ambos os sexos, correlações moderadas de todos os indicadores (razão cintura/estatura, índice triglicerídeos/glicose e razão triglicerídeos/HDL-C) com o modelo de avaliação homeostática para resistência à insulina. As áreas sob as curvas ROC foram semelhantes entre a razão cintura/estatura e os marcadores bioquímicos.
ConclusãoOs indicadores forneceram poder discriminatório similar para a resistência à insulina. No entanto, levando em conta o custo-benefício, sugerimos que a razão cintura/estatura pode ser uma ferramenta útil para a triagem de resistência à insulina em populações pediátricas.
A resistência à insulina (RI) é definida como a redução da resposta tecidual a ações celulares mediadas pela insulina e é o inverso da sensibilidade à insulina.1 Em adultos, a RI tem sido associada a obesidade, síndrome metabólica, hipertensão e doença cardiovascular.2 Além disso, é reconhecida como uma doença determinante para o desenvolvimento de diabetes mellitus tipo 2 (DT2). O cenário é semelhante entre as crianças, pois os estudos mostraram que a RI está significativamente associadas a obesidade e risco cardiometabólico.3
A avaliação da RI é clinicamente relevante e pode ser feita por vários métodos. O clamp euglicêmico hiperinsulinêmico é o teste‐padrão de base para diagnosticar RI. Contudo, ele é caro, invasivo e não se encontra facilmente disponível em configurações clínicas.4 Um método opcional e amplamente usado na prática clínica é a avaliação do modelo homeostático para resistência insulínica (HOMA‐RI). Contudo, a HOMA‐RI também depende da coleta de sangue em jejum e do ensaio de insulina plasmática, que é caro e não está disponível em muitas clínicas dedicadas aos cuidados primários.5 Assim, foram propostos biomarcadores mais baratos, como o índice de triglicerídeos/glicose (índice TyG)6 e a razão triglicerídeos/HDL‐C.7
Os valores de corte para HOMA‐RI em populações pediátricas é muito variável.8 De acordo com os resultados de uma análise sistemática, de todos os estudos que estabeleceram pontos de corte com a curva ROC, os menores pontos de corte para HOMA‐RI relatados na literatura foram 1,65 e 1,95 para meninas e meninos, respectivamente, ao passo que os maiores foram 3,82 e 5,22.9 Ademais, um estudo coreano feito com dados de 3.313 crianças e adolescentes, entre 1 e 18 anos, estabeleceu valores de corte ideais para HOMA‐RI e o índice TyG para fazer o exame de resistência à insulina de acordo com três diferentes critérios.10 A depender do critério para síndrome metabólica, os pontos de corte para HOMA‐RI variaram de 2,96 a 3,69 para meninas e 2,86 a 3,54 para meninos.
Apesar de obter frações lipídicas e níveis de glicose ser algo relativamente mais barato do que obter níveis de insulina para calcular a HOMA‐RI, exames bioquímicos sempre exigem algum custo, além da necessidade de coleta de sangue em jejum.
São poucos os estudos na literatura sobre a eficácia dos marcadores bioquímicos em comparação com os indicadores antropométricos para fazer o exame de RI. Portanto, considerando a importância de incorporar ferramentas simples e de baixo custo à configuração clínica pediátrica para fazer um exame de RI, o presente estudo buscou investigar se a razão cintura/estatura (RCE) é comparável com marcadores bioquímicos na discriminação de RI em crianças e adolescentes.
MétodosModelo do estudo e populaçãoA amostra deste estudo foi obtida de nove escolas públicas de Vitória, capital do Estado do Espírito Santo, na Região Sudeste do Brasil. Todos os alunos entre 8 e 14 anos foram convidados diretamente pelos pesquisadores a participar do estudo, que abrange uma pesquisa sobre o estilo de vida, bem como exames clínicos e laboratoriais.
O tamanho da amostra calculado para detectar uma diferença de 0,50 no valor da HOMA‐RI com 5% de erro e 90% de poder foi 269. De julho de 2016 a fevereiro de 2017, os alunos participaram da Clínica de Investigação Cardiovascular no Hospital Universitário para serem submetidas a exames clínicos e laboratoriais. Todos os dados foram coletados em uma única visita por investigadores treinados previamente certificados pelo investigador sênior. Todos os procedimentos clínicos foram feitos por um único investigador para evitar viés entre observadores.
Para a presente investigação, todos os indivíduos que tinham dados válidos de exames biométricos e antropométricos foram incluídos na análise final, 296 crianças e adolescentes.
O projeto foi aprovado pelo Comitê de Ética Institucional (protocolo 1.471.441/1.565.490) e foi feito de acordo com as disposições da Declaração de Helsinque. O consentimento informado por escrito foi obtido dos pais ou responsáveis legais antes da participação.
Estado puberalO estado puberal foi autorrelatado com a escala de Tanner. As categorias (pré‐puberal, puberal e pós‐puberal) foram formadas considerando os critérios validados para ambos os sexos.11,12 Resumidamente, a classificação de maturidade sexual foi definida por uma combinação entre os cinco estágios de desenvolvimento das mamas e pelos pubianos entre meninas e desenvolvimento genital e de pelos pubianos entre os meninos. A título de exemplo, uma menina de 13 anos que se autoidentificou como estágio 3 para seu desenvolvimento das mamas e estágio 3 para pelos pubianos foi classificada como pubescente pelo observador. Apesar da limitação dos estágios de Tanner, a maturação sexual autorrelatada foi validada com relação aos marcadores de hormônio sérico.13
AntropometriaO peso foi obtido com uma balança eletrônica calibrada e os indivíduos descalços, somente com roupas íntimas. A estatura foi obtida com uma balança de parede. O IMC foi calculado como razão entre peso e estatura ao quadrado (kg/m2). A circunferência da cintura (CC) foi medida no ponto médio entre a menor margem costal e o nível da crista ilíaca anterior superior. A razão cintura/estatura (RCE) foi calculada ao dividir‐se a CC em centímetros pela altura em centímetros.
Sobrepeso foi definido ao categorizar o escore z do IMC para a idade > +1 de acordo com os padrões da Organização Mundial de Saúde (OMS).14
Medição da pressão arterialA pressão arterial (PA) foi medida no braço esquerdo com um dispositivo automático validado (Omrom 705CP, Intellisense, Japão) após um período de descanso de cinco minutos na posição sentado.15 Foram feitas três leituras consecutivas em cada indivíduo com um intervalo mínimo de um minuto entre as medições. Em um caso de variação de mais de 5mmHg entre 2 e 3, foi feita uma quarta medição e calculamos a média das duas medições mais próximas em 5mmHg. A pressão arterial sistólica (PAS) e a pressão arterial diastólica (PAD) foram calculadas como a média aritmética das duas medições com diferença inferior a 5mmHg.16
Exame bioquímicoA coleta de sangue foi obtida por flebotomia após jejum noturno (8‐14h) e o mesmo enviado para um laboratório central (Laboratório Tommasi, Vitória, Brasil) para determinar as concentrações séricas de colesterol total (CT), colesterol de lipoproteína de alta densidade (HDL‐C), triglicerídeos (TG), glicose e ácido úrico.
O colesterol de lipoproteína de baixa densidade (LDL‐C) foi calculado pela equação de Friedwald para aqueles com triglicerídeos ≤ 400mg/dL.17 Os níveis de insulina no soro foram medidos com um imunoensaio de eletroquimioluminescência e todas as dosagens foram feitas com kits comercialmente disponíveis. O razão de triglicerídeo/HDL‐C (TG/HDL‐C) foi calculada ao dividir TG (mg/dL) por HDL‐C (mg/dL). O índice TyG foi calculado com a fórmula (1) Ln [TG (mg/dL) x glicemia de jejum (mg/dL)/2].7
A RI foi estimada com o índice HOMA‐RI: (2) [insulina de jejum (U/mL) x glicemia de jejum (mmol/L)/22,5].18 Neste estudo, a presença de RI foi definida com o ponto de corte 3,16 para HOMA‐RI, conforme estabelecido anteriormente para meninos e meninas.19
Análise estatísticaAs variáveis contínuas foram apresentadas como média e desvio‐padrão e as variáveis categóricas foram apresentadas como percentuais. A comparação entre os sexos para as variáveis contínuas foi feita com o teste t de Student não pareado e a comparação das proporções foi feita com o teste qui‐quadrado.
As variáveis antropométrica, hemodinâmica e bioquímica foram comparadas entre os meninos e meninas com resistência à insulina e sem resistência à insulina com a análise de covariância (Ancova), com ajuste para a idade.
Os coeficientes de correlação parciais ajustados para a idade foram usados para estimar as associações entre a HOMA‐RI e os indicadores antropométricos/bioquímicos.
As curvas da característica de operação do receptor (ROC) foram desenhadas para cada um dos indicadores e a área sob a curva (AUC) foi usada para analisar o poder discriminatório para RI. O pacote Epi do software R foi usado para fornecer ajuste para a idade.
As análises estatísticas foram feitas com o software SPSS (versão 19.0, Chicago, IL, EUA), com nível de relevância estabelecido em 5%.
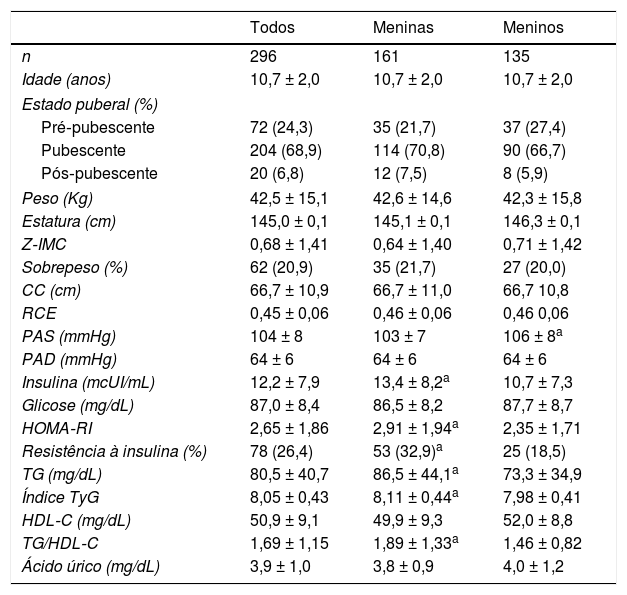
ResultadosOs dados clínicos, demográficos, antropométricos e bioquímicos estratificados por sexo estão resumidos na tabela 1. TG, razão TG/HDL‐C, índice TyG, insulina, HOMA‐RI e percentual de RI foram maiores nas meninas, ao passo que a PAS foi maior nos meninos. Além disso, a proporção de RI observada foi 32,9% entre meninas e 18,5% entre meninos (p < 0,001).
Características gerais da amostra
| Todos | Meninas | Meninos | |
|---|---|---|---|
| n | 296 | 161 | 135 |
| Idade (anos) | 10,7 ± 2,0 | 10,7 ± 2,0 | 10,7 ± 2,0 |
| Estado puberal (%) | |||
| Pré‐pubescente | 72 (24,3) | 35 (21,7) | 37 (27,4) |
| Pubescente | 204 (68,9) | 114 (70,8) | 90 (66,7) |
| Pós‐pubescente | 20 (6,8) | 12 (7,5) | 8 (5,9) |
| Peso (Kg) | 42,5 ± 15,1 | 42,6 ± 14,6 | 42,3 ± 15,8 |
| Estatura (cm) | 145,0 ± 0,1 | 145,1 ± 0,1 | 146,3 ± 0,1 |
| Z‐IMC | 0,68 ± 1,41 | 0,64 ± 1,40 | 0,71 ± 1,42 |
| Sobrepeso (%) | 62 (20,9) | 35 (21,7) | 27 (20,0) |
| CC (cm) | 66,7 ± 10,9 | 66,7 ± 11,0 | 66,7 10,8 |
| RCE | 0,45 ± 0,06 | 0,46 ± 0,06 | 0,46 0,06 |
| PAS (mmHg) | 104 ± 8 | 103 ± 7 | 106 ± 8a |
| PAD (mmHg) | 64 ± 6 | 64 ± 6 | 64 ± 6 |
| Insulina (mcUI/mL) | 12,2 ± 7,9 | 13,4 ± 8,2a | 10,7 ± 7,3 |
| Glicose (mg/dL) | 87,0 ± 8,4 | 86,5 ± 8,2 | 87,7 ± 8,7 |
| HOMA‐RI | 2,65 ± 1,86 | 2,91 ± 1,94a | 2,35 ± 1,71 |
| Resistência à insulina (%) | 78 (26,4) | 53 (32,9)a | 25 (18,5) |
| TG (mg/dL) | 80,5 ± 40,7 | 86,5 ± 44,1a | 73,3 ± 34,9 |
| Índice TyG | 8,05 ± 0,43 | 8,11 ± 0,44a | 7,98 ± 0,41 |
| HDL‐C (mg/dL) | 50,9 ± 9,1 | 49,9 ± 9,3 | 52,0 ± 8,8 |
| TG/HDL‐C | 1,69 ± 1,15 | 1,89 ± 1,33a | 1,46 ± 0,82 |
| Ácido úrico (mg/dL) | 3,9 ± 1,0 | 3,8 ± 0,9 | 4,0 ± 1,2 |
CC, circunferência da cintura; CT, colesterol total; HDL‐C, colesterol de lipoproteína de alta densidade; HOMA‐RI, avaliação do modelo homeostático para resistência insulínica; índice TyG, índice de triglicerídeos/glicose; LDL‐C, colesterol de lipoproteína de baixa densidade; PAD, pressão arterial diastólica; PAS, pressão arterial sistólica; RCE, razão cintura/estatura; Resistência à insulina: HOMA‐RI ≥ 3,16; Sobrepeso: escores z do IMC para idade > + 1; TG, triglicerídeos; TG/HDL‐C, razão triglicerídeos/HDL‐C; Z‐IMC, escores z do IMC para a idade.
Os dados contínuos são expressos como média ± desvio‐padrão e a variável categórica é expressa como número (percentual).
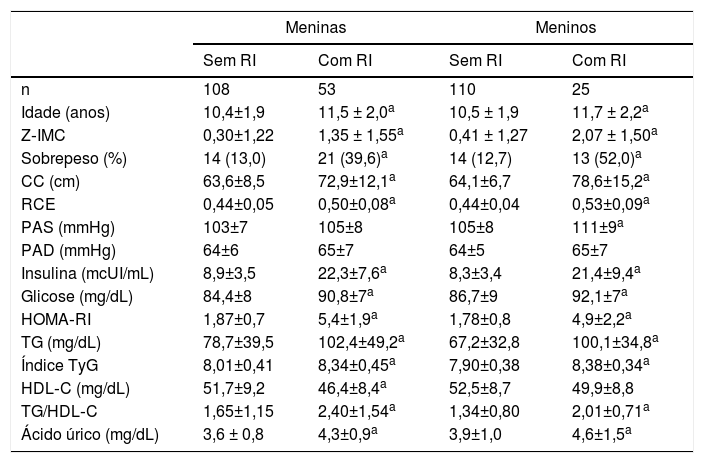
A tabela 2 mostra os dados clínicos, demográficos, antropométricos e bioquímicos estratificados por estado de RI para ambos os sexos. A proporção de sobrepeso, PAS, TG, razão TG/HDL‐C, índice TyG, insulina de jejum, glicose, HOMA‐RI e ácido úrico foram maiores naqueles com resistência à insulina de ambos os sexos.
Características clínicas de acordo com o estado de resistência à insulina
| Meninas | Meninos | |||
|---|---|---|---|---|
| Sem RI | Com RI | Sem RI | Com RI | |
| n | 108 | 53 | 110 | 25 |
| Idade (anos) | 10,4±1,9 | 11,5 ± 2,0a | 10,5 ± 1,9 | 11,7 ± 2,2a |
| Z‐IMC | 0,30±1,22 | 1,35 ± 1,55a | 0,41 ± 1,27 | 2,07 ± 1,50a |
| Sobrepeso (%) | 14 (13,0) | 21 (39,6)a | 14 (12,7) | 13 (52,0)a |
| CC (cm) | 63,6±8,5 | 72,9±12,1a | 64,1±6,7 | 78,6±15,2a |
| RCE | 0,44±0,05 | 0,50±0,08a | 0,44±0,04 | 0,53±0,09a |
| PAS (mmHg) | 103±7 | 105±8 | 105±8 | 111±9a |
| PAD (mmHg) | 64±6 | 65±7 | 64±5 | 65±7 |
| Insulina (mcUI/mL) | 8,9±3,5 | 22,3±7,6a | 8,3±3,4 | 21,4±9,4a |
| Glicose (mg/dL) | 84,4±8 | 90,8±7a | 86,7±9 | 92,1±7a |
| HOMA‐RI | 1,87±0,7 | 5,4±1,9a | 1,78±0,8 | 4,9±2,2a |
| TG (mg/dL) | 78,7±39,5 | 102,4±49,2a | 67,2±32,8 | 100,1±34,8a |
| Índice TyG | 8,01±0,41 | 8,34±0,45a | 7,90±0,38 | 8,38±0,34a |
| HDL‐C (mg/dL) | 51,7±9,2 | 46,4±8,4a | 52,5±8,7 | 49,9±8,8 |
| TG/HDL‐C | 1,65±1,15 | 2,40±1,54a | 1,34±0,80 | 2,01±0,71a |
| Ácido úrico (mg/dL) | 3,6 ± 0,8 | 4,3±0,9a | 3,9±1,0 | 4,6±1,5a |
CC, circunferência da cintura; CT, colesterol total; HDL‐C, colesterol de lipoproteína de alta densidade; HOMA‐RI, avaliação do modelo homeostático para resistência insulínica; índice TyG, índice de triglicerídeos/glicose; LDL‐C, colesterol de lipoproteína de baixa densidade; PAD, pressão arterial diastólica; PAS, pressão arterial sistólica; RCE, razão cintura/estatura; Resistência à insulina: HOMA‐RI ≥ 3,16; Sobrepeso: escores z do IMC para idade > + 1; TG, triglicerídeos; TG/HDL‐C, razão triglicerídeos/HDL‐C; Z‐IMC, escores z do IMC para a idade.
Os dados contínuos são expressos como média ± desvio‐padrão e a variável categórica é expressa como número (percentual).
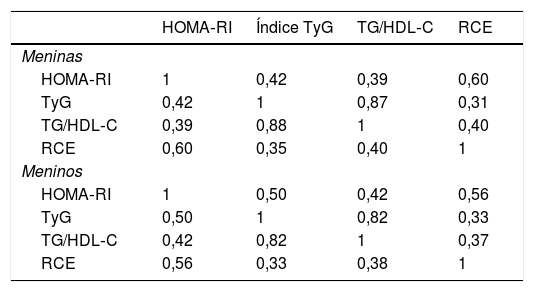
Os coeficientes de correlação parciais estão resumidos na tabela 3. Em meninas, a HOMA‐RI foi mais fortemente correlacionada com RCE do que com o índice TyG e TG/HDL‐C (r = 0,60 em comparação com r = 0,42 e r = 0,39, respectivamente). Em meninos, a HOMA‐RI foi pouco correlacionada a TG/HDL‐C e correlacionada moderadamente a RCE e índice TyG (r = 0,56 e r = 0,50, respectivamente).
Matriz de correlação entre os indicadores de resistência à insulina
| HOMA‐RI | Índice TyG | TG/HDL‐C | RCE | |
|---|---|---|---|---|
| Meninas | ||||
| HOMA‐RI | 1 | 0,42 | 0,39 | 0,60 |
| TyG | 0,42 | 1 | 0,87 | 0,31 |
| TG/HDL‐C | 0,39 | 0,88 | 1 | 0,40 |
| RCE | 0,60 | 0,35 | 0,40 | 1 |
| Meninos | ||||
| HOMA‐RI | 1 | 0,50 | 0,42 | 0,56 |
| TyG | 0,50 | 1 | 0,82 | 0,33 |
| TG/HDL‐C | 0,42 | 0,82 | 1 | 0,37 |
| RCE | 0,56 | 0,33 | 0,38 | 1 |
HOMA‐RI, modelo de avaliação da homeostase de resistência à insulina; índice TyG, índice triglicerídeos/glicose; RCE, razão cintura/estatura; TG/HDL‐C, razão triglicerídeos/HDL‐C.
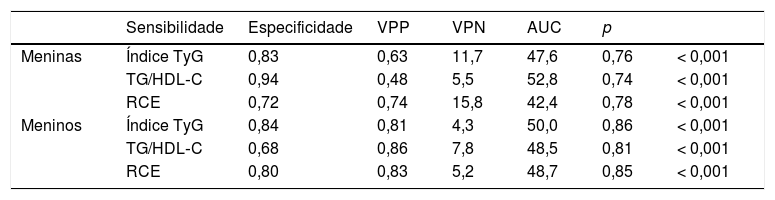
Sensibilidade, especificidade, valor preditivo positivo (VPP), valor preditivo negativo (VPN) e AUC são mostrados para ambos os sexos na tabela 4. Em meninas, a maior taxa positiva verdadeira (sensibilidade) foi obtida pela razão TG/HDL‐C. Por outro lado, a taxa negativa verdadeira (especificidade) da razão TG/HDL‐C foi a menor entre os índices. Diferentemente em meninos, a RCE e o índice atingiram sensibilidade e especificidade mais equilibradas em comparação com a razão TG/HDL‐C. Para meninos e meninas, o poder discriminatório para RI foi semelhante entre o índice TyG, a razão TG/HDL‐C e a RCE.
Resultados dos testes de diagnóstico para resistência à insulina
| Sensibilidade | Especificidade | VPP | VPN | AUC | p | ||
|---|---|---|---|---|---|---|---|
| Meninas | Índice TyG | 0,83 | 0,63 | 11,7 | 47,6 | 0,76 | < 0,001 |
| TG/HDL‐C | 0,94 | 0,48 | 5,5 | 52,8 | 0,74 | < 0,001 | |
| RCE | 0,72 | 0,74 | 15,8 | 42,4 | 0,78 | < 0,001 | |
| Meninos | Índice TyG | 0,84 | 0,81 | 4,3 | 50,0 | 0,86 | < 0,001 |
| TG/HDL‐C | 0,68 | 0,86 | 7,8 | 48,5 | 0,81 | < 0,001 | |
| RCE | 0,80 | 0,83 | 5,2 | 48,7 | 0,85 | < 0,001 |
AUC, área sob a curva ROC; IC, intervalo de confiança; índice TyG, índice de triglicerídeos/glicose; RCE, razão cintura/estatura; TG/HDL‐C, razão triglicerídeos/HDL‐C; VPN, valor preditivo negativo; VPP, valor preditivo positivo.
O principal achado deste estudo foi que o índice TyG, a razão TG/HDL‐C e a RCE mostraram poder discriminatório semelhante para RI. Além disso, nossos dados mostraram que as meninas e meninos com sobrepeso têm maior probabilidade de desenvolver resistência à insulina e dislipidemia do que aqueles com peso normal.
Estudos mostraram que a RI é um fator de risco para o desenvolvimento de DT2 e doença cardiovascular em crianças e adolescentes.1,3 Em nosso estudo, a frequência de sobrepeso foi maior em meninas e meninos com resistência à insulina do que os sem resistência à insulina. Além disso, aqueles com resistência à insulina apresentaram maiores valores de IMC, CC, RCE, TG, razão TG/HDL‐C, índice TyG, insulina de jejum e glicose, ácido úrico sérico e HOMA‐RI. Corroborando nossos achados, Kang et al.,20 ao estudar 221 adolescentes coreanos, relataram maiores valores de IMC, CC, TG, razão TG/HDL‐C, índice TyG, insulina de jejum e glicose e HOMA‐RI. Além disso, menores níveis de HDL‐C nos indivíduos diagnosticados com RI. Da mesma forma, Iwani et al.21 relataram maiores valores de TG, LDL‐C, razão TG/HDL‐C, IMC e CC em crianças e adolescentes com sobrepeso e obesas com resistência à insulina.
Nos últimos anos, a OMS recomendou o uso de indicadores antropométricos para identificar indivíduos com risco cardiometabólico. Nesse sentido, Behboudi‐Gandevani et al. mostraram recentemente que a RCE foi um bom fator de predição para resistência à insulina e síndrome metabólica em mulheres com síndrome do ovário policístico, o que pode corroborar o fato de a RCE ser uma ferramenta de exame promissora para essa doença.22 Especificamente em uma população pediátrica, Ibarra‐Reynoso et al.23 estudaram os fatores associados a RI em todo o corpo e hepática, conforme estimulado pelo fator de crescimento semelhante à insulina tipo 1 (IGFBP‐1) em crianças entre 6‐11 anos. Nesse estudo, a obesidade foi classificada de acordo com o IMC, a adiposidade visceral e a RCE. Curiosamente, para as crianças obesas, os preditores de HOMA‐RI (RI em todo o corpo) foram os mesmos, independentemente do indicador usado para fornecer o diagnóstico de obesidade. Ademais, foi estimada uma redução de 2,15 ng/mL nos valores do IGFBP‐1 para cada 1cm de aumento na RCE, indicou‐se, assim, que a RCE foi uma forte variável preditora de RI hepática.
Em nosso conhecimento, o presente estudo foi o primeiro a comparar a eficácia da RCE para examinar a RI em uma população pediátrica. Nossos resultados mostraram que todos apresentaram correlação moderada com a HOMA‐RI em ambos os sexos (tabela 3). Corroborando esses achados, Guerrero‐Romero et al.7 ao estudar a população geral de Guadalajara, relataram correlação moderada entre o índice TyG e HOMA‐RI (r = 0,39). No estudo de Kang et al.,20 uma correlação moderada também foi observada no índice TyG e na razão TG/HDL‐C com HOMA‐RI (r = 0,41 e r = 0,40, respectivamente). Esses resultados indicam que o índice TyG e a razão TG/HDL‐C são igualmente associados à HOMA‐RI em populações pediátricas de diferentes idades. Em nosso estudo, a RCE mostrou correlação mais forte com a HOMA‐RI do que os outros indicadores, principalmente entre meninas.
Com relação à análise da curva ROC, nenhum indicador se destacou dos outros na comparação da AUC, indicou‐se, assim, poder discriminatório semelhante para RI entre RCE e os índices com base em marcadores bioquímicos, mesmo ajustados para a idade. Corroborando em parte nossos achados, Kang et al.20 observaram poder discriminatório semelhante para RI em comparação com o índice TyG e a razão TG/HDL‐C. Contudo, nosso estudo foi o primeiro a mostrar que a RCE foi semelhante ao índice TyG e à razão TG/HDL‐C para discriminar RI em uma população pediátrica.
Comprovações compatíveis documentaram o papel dos depósitos de gordura abdominal na patogênese de doenças metabólicas, inclusive resistência à insulina.24 Nesse sentido, os preditores bioquímicos de RI, que têm como base lipídios sanguíneos alterados, provavelmente são colineares à adiposidade abdominal. Corroborando essa assunção, Silva et al.25 mostraram que a RCE foi mais fortemente correlacionada (r = 0,78) a gordura no tronco, conforme medida por DEXA, do que outros indicadores antropométricos, inclusive circunferência da cintura e razão cintura/quadril. Além disso, Mazidi et al.26 abordaram recentemente a complexa relação entre homeostase da glicose‐insulina e ácido úrico sérico. Com o uso de uma análise de regressão com um modelo de equação estrutural, os autores descobriram que os fatores de adiposidade, como tecido adiposo visceral, índice de massa corporal e circunferência da cintura, são mediadores da associação entre resistência à insulina e ácido úrico sérico. No presente estudo, as meninas e os meninos no quartil mais alto da RCE apresentaram maior HOMA‐RI em comparação com os nos quatis mais baixos, como com o índice TyG e também a razão TGC/HDL‐C (tabela complementar 1). De fato, essa comprovação indireta corrobora a RCE como uma indicação de gordura corporal regional, pelo menos na população estudada. Essa informação é muito relevante para o sistema público de saúde, pois a RCE é fácil de ser feita na configuração clínica. Além disso, ao contrário dos marcadores bioquímicos, a RCE pode ser usada na falta de exames laboratoriais de jejum invasivos, fornece resultados instantâneos e é gratuita e relativamente fácil de usar.
Nosso estudo tem algumas limitações. Primeira, todos os voluntários são de nove escolas públicas de Vitória, então esses resultados não podem ser extrapolados para a população geral de crianças e adolescentes do Brasil. Segunda, a HOMA‐RI é um método validado amplamente usado na prática clínica para o diagnóstico de RI; contudo, seria importante se pudéssemos avaliar o poder discriminatório dos indicadores com o clamp euglicêmico hiperinsulinêmico como referência (teste‐padrão de base). Um tamanho adequado da amostra, que possibilitou alto poder estatístico, e o fato de que as medidas antropométricas foram obtidas por um único investigar foram os principais pontos fortes deste estudo.
Concluindo, a RCE atingiu poder discriminatório semelhante aos marcadores bioquímicos para RI em crianças e adolescentes. Assim, considerando a relação de custo‐benefício, sugerimos que a RCE possa ter se tornado uma ferramenta útil para examinar RI em populações pediátricas.
FinanciamentoPró‐Reitoria de Pesquisa e Pós‐Graduação da Universidade Federal do Espírito Santo (Programa Institucional Fundo de Apoio à Pesquisa – 2015); Fundação de Amparo à Pesquisa do Estado do Espírito Santo/Programa Pesquisa para o SUS (Fapes/PPSUS), número da bolsa 65854420/2014; Fundação Vale; Laboratório Thommasi, de Vitória, que financiou parte dos exames bioquímicos. Os financiadores não tiveram participação com relação ao modelo do estudo, à coleta e à análise de dados, à decisão de publicar ou à preparação do manuscrito.
Conflitos de interesseOs autores declaram não haver conflitos de interesse.
A Andréa Roseli Vançan Russo Horimoto e Marcelo Perim Baldo pelo apoio nas análises estatísticas.
Como citar este artigo: Alvim RO, Zaniqueli D, Neves FS, Pani VO, Martins CR, Peçanha MA, et al. Waist‐to‐height ratio is as reliable as biochemical markers to discriminate pediatric insulin resistance. J Pediatr (Rio J). 2019;95:428–34.