This large study with a long‐term follow‐up aimed to evaluate the clinical presentation, laboratory findings, histological profile, treatments, and outcomes of children and adolescents with autoimmune hepatitis.
MethodsThe medical records of 828 children and adolescents with autoimmune hepatitis were reviewed. A questionnaire was used to collect anonymous data on clinical presentation, biochemical and histological findings, and treatments.
ResultsOf all patients, 89.6% had autoimmune hepatitis‐1 and 10.4% had autoimmune hepatitis‐2. The female sex was predominant in both groups. The median age at symptom onset was 111.5 (6; 210) and 53.5 (8; 165) months in the patients with autoimmune hepatitis 1 and autoimmune hepatitis‐2, respectively. Acute clinical onset was observed in 56.1% and 58.8% and insidious symptoms in 43.9% and 41.2% of the patients with autoimmune hepatitis‐1 and autoimmune hepatitis‐2, respectively. The risk of hepatic failure was 1.6‐fold higher for autoimmune hepatitis‐2. Fulminant hepatic failure occurred in 3.6% and 10.6% of the patients with autoimmune hepatitis‐1 and autoimmune hepatitis‐2, respectively; the risk was 3.1‐fold higher for autoimmune hepatitis‐2. The gamma globulin and immunoglobulin G levels were significantly higher in autoimmune hepatitis‐1, while the immunoglobulin A and C3 levels were lower in autoimmune hepatitis‐2. Cirrhosis was observed in 22.4% of the patients; biochemical remission was achieved in 76.2%. The actuarial survival rate was 93.0%. A total of 4.6% underwent liver transplantation, and 6.9% died (autoimmune hepatitis‐1: 7.5%; autoimmune hepatitis‐2: 2.4%).
ConclusionsIn this large clinical series of Brazilian children and adolescents, autoimmune hepatitis‐1 was more frequent, and patients with autoimmune hepatitis‐2 exhibited higher disease remission rates with earlier response to treatment. Patients with autoimmune hepatitis‐1 had a higher risk of death.
Este estudo com acompanhamento de longo prazo visou a avaliar o quadro clínico, os achados laboratoriais, o perfil histológico, os tratamentos e os resultados de crianças e adolescentes com hepatite autoimune.
MétodosForam analisados os prontuários médicos de 828 crianças e adolescentes com HAI. Foi usado um questionário para coletar os dados anônimos sobre o quadro clínico, os achados bioquímicos e histológicos e os tratamentos.
ResultadosDe todos os pacientes, 89,6% tinham hepatite autoimune‐1 e 10,4% hepatite autoimune‐2. O sexo feminino foi predominante nos dois grupos. A idade média no início dos sintomas foi 111,5 (6; 210) e 53,5 (8; 165) meses nos pacientes com hepatite autoimune‐1 e hepatite autoimune‐2, respectivamente. Foi observado início clínico agudo em 56,1% e 58,8% e sintomas insidiosos em 43,9% e 41,2% dos pacientes com hepatite autoimune‐1 e hepatite autoimune‐2, respectivamente. A probabilidade de insuficiência hepática foi 1,6 vezes maior para hepatite autoimune‐2; 3,6% e 10,6% dos pacientes com hepatite autoimune‐1 e hepatite autoimune‐2, respectivamente, apresentaram insuficiência hepática fulminante; o risco foi 3,1 vezes maior para hepatite autoimune‐2. Os níveis de gamaglobulina e imunoglobulina G foram significativamente maiores nos pacientes com hepatite autoimune‐1, ao passo que os níveis de imunoglobulina A e C3 foram menores em pacientes com hepatite autoimune‐2; 22,4% dos pacientes apresentaram cirrose e a remissão bioquímica foi atingida em 76,2%. A taxa de sobrevida atuarial foi de 93,0%. Um total de 4,6% pacientes foram submetidos a transplante de fígado e 6,9% morreram (hepatite autoimune‐1: 7,5%; hepatite autoimune‐2: 2,4%).
ConclusõesNesta grande série clínica de crianças e adolescentes brasileiros, a hepatite autoimune‐1 foi mais frequente e os pacientes com hepatite autoimune‐2 mostraram maiores taxas de remissão da doença com respostas mais rápidas aos tratamentos. Os pacientes com hepatite autoimune‐1 apresentaram maior risco de óbito.
A hepatite autoimune (HAI) é uma doença hepática crônica normalmente progressiva e caracterizada histologicamente por inflamação periportal, necrose em ponte, formação de rosetas (rosetting) nas células hepáticas e infiltração de células plasmáticas. Apesar de a etiologia ser desconhecida, sua patogênese tem com base, no mínimo parcialmente, a autorreatividade aberrante. O fenótipo clássico foi caracterizado por alguns marcadores sorológicos, principalmente anticorpos antinucleares, anticorpos do músculo liso (SMAs) e anticorpos contra a fração microssomal de fígado e rim tipo 1 (anti‐LKM1s), independentemente da associação com os anticorpos anticitosol hepático tipo 1, hipergamaglobulinemia, aumento nos níveis de imunoglobulina no soro (Ig)G, hepatite de interface no exame histológico e resposta à terapia com corticosteroides.1–3
Foram publicados estudos sobre a epidemiologia e o histórico natural da HAI pediátrica,4,5 o que é importante, considerando que a maior parte do conhecimento sobre HAI provém de estudos em adultos. Os estudos limitados em crianças demonstraram as peculiaridades dessa doença em pacientes pediátricos. Visamos a avaliar o quadro clínico, os achados laboratoriais, o perfil histológico, os tratamentos e os resultados de crianças e adolescentes com HAI na América do Sul em um grande estudo com acompanhamento de longo prazo.
MétodosEste estudo multicêntrico retrospectivo foi feito para avaliar os resultados clínicos de 828 crianças e adolescentes com histórico de HAI bem documentado e de longo prazo de acordo com os critérios do Grupo Internacional de Estudo da HAI.1 Os dados foram coletados de relatórios de centros únicos. Um questionário avaliou os dados anônimos sobre as características demográficas, o quadro clínico, os achados bioquímicos e histológicos e os tratamentos. Os pacientes foram acompanhados de 1983 a 2015 em 17 centros de gastroenterologia/hepatologia pediátrica em todo o Brasil. Este estudo foi aprovado pelos comitês de ética relacionados (número CAAE 53562116.5.1001.0068).
Todas as crianças e adolescentes foram submetidas a um protocolo clínico e laboratorial, inclusive avaliação dos parâmetros bioquímicos, como alanina aminotransferase, aspartato aminotransferase, gamaglutamiltranspeptidase (GGTP), fosfatase alcalina (ALP), albumina, gamaglobulina, razão normalizada internacional (INR), bilirrubina total e direta (DB), glicose sérica, triiodotironina, tiroxina e hormônio estimulante da tireoide medidos com radioimunoensaio. Os níveis séricos de Ig e complementos foram medidos com nefelometria, que foram expressos em g/L e variaram por centro. Os resultados foram registrados como normal, aumentado ou reduzido.
Todos os pacientes foram examinados na apresentação para anticorpos antinucleares, anti‐SMA, anti‐LKM1 e antimitocôndria. As amostras de soro foram tituladas até 1/320. Os títulos > 1:40 e 1/20 foram considerados positivos para anti‐SMA e anti‐LKM1, respectivamente. Além disso, os pacientes apresentaram achados negativos para o vírus da hepatite A, B e C, vírus da imunodeficiência humana, citomegalovírus e vírus Epstein‐Barr. Eles não apresentaram histórico de uso de drogas ou álcool nem exposição a medicamentos hepatotóxicos. Foram excluídos os pacientes com deficiência de alfa‐1 antitripsina e doença de Wilson.
O exame de colangiografia foi feito por colangiopancreatografia por ressonância magnética (CPRM) ou por endoscopia em pacientes que não responderam aos medicamentos imunossupressores ou apresentaram níveis aumentos de GGTP durante o monitoramento da doença.
Foi feita biópsia hepática em 664 (80,2%) pacientes antes do tratamento imunossupressor, por meio de biópsia por agulha percutânea com uma agulha Tru‐Cut ou cirurgia; 253 crianças foram submetidas a mais de uma biópsia durante o acompanhamento para documentar recaídas ou como um critério de interrupção da terapia por dois anos, em casos de remissões clínicas e bioquímicas. As seções embebidas em parafina fixadas em formalina foram inspecionadas por coloração hematoxilina‐eosina, corante ácido periódico de Schiff após digestão diastásica, impregnação pela prata para reticulina e coloração de Masson em todos os casos. As características histológicas foram registradas de acordo com o estadiamento, com um sistema de pontuação semiquantitativa de quatro pontos (ou seja, ausente, mínimo, moderado e grave). Os parâmetros incluíram alterações arquitetônicas; infiltrados portais e periportais; dano celular hepático e necrose, como necrose lítica focal (irregular) e hepatite de interface periportal ou periseptal (necrose fragmentada); necrose confluente; necrose em ponte e necrose submaciça.6 Também foram avaliadas outras características, como lesão do ducto biliar e reação ductular.
A terapia imunossupressora incluiu uma combinação de prednisona (1‐1,5mg/kg/dia, máximo de 60mg/dia) e azatioprina (1‐1,5mg/kg/dia). Foi feita monoterapia com prednisona sempre que houve trombocitopenia grave. A dose de prednisona foi reduzida em cada visita até a dose de manutenção de 2,5‐5mg ser atingida, ao mesmo tempo em que mantendo parâmetros clínicos e laboratoriais estáveis. A resposta completa e recidiva foram definidas de acordo com os critérios do Grupo Internacional de Estudo da HAI.1
Análise estatísticaFoi usada a versão 24 do SPSS para a análise estatística (IBM SPSS Estatística para Windows, Versão 24.0. NY, EUA:). Todos os dados estão resumidos nas tabelas 1‐3. O teste de Kolmogorov‐Smirnov foi usado para verificar a distribuição normal de dados. Para verificar a existência de associações entre os grupos e todas as variáveis categóricas, foi usado a regressão logística com a função de ligação logit. Foram estimadas as razões de chance e apresentados os respectivos intervalos de confiança de 95%. O teste de Mann‐Whitney foi usado para comparar os dois tipos de HAI com relação às variáveis quantitativas. O nível de significância foi estabelecido em p ≤ 0,05. As variáveis categóricas foram expressas como contagens e percentuais e as variáveis contínuas foram expressas como valores medianos (mínimo; máximo).
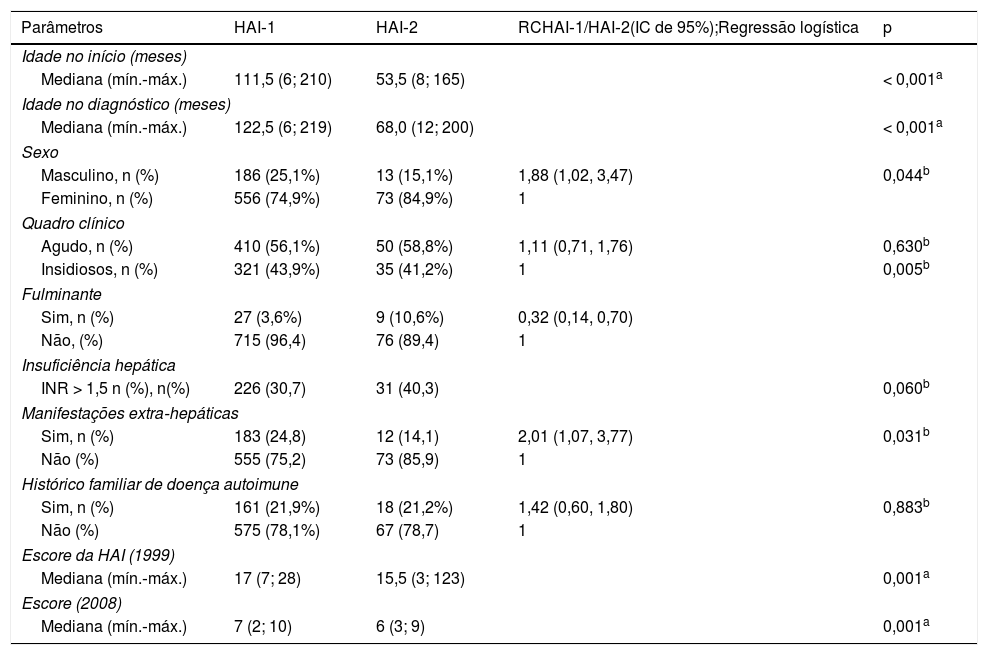
Dados demográficos e clínicos dos pacientes com HAI‐1 e HAI‐2
| Parâmetros | HAI‐1 | HAI‐2 | RCHAI‐1/HAI‐2(IC de 95%);Regressão logística | p |
|---|---|---|---|---|
| Idade no início (meses) | ||||
| Mediana (mín.‐máx.) | 111,5 (6; 210) | 53,5 (8; 165) | < 0,001a | |
| Idade no diagnóstico (meses) | ||||
| Mediana (mín.‐máx.) | 122,5 (6; 219) | 68,0 (12; 200) | < 0,001a | |
| Sexo | ||||
| Masculino, n (%) | 186 (25,1%) | 13 (15,1%) | 1,88 (1,02, 3,47) | 0,044b |
| Feminino, n (%) | 556 (74,9%) | 73 (84,9%) | 1 | |
| Quadro clínico | ||||
| Agudo, n (%) | 410 (56,1%) | 50 (58,8%) | 1,11 (0,71, 1,76) | 0,630b |
| Insidiosos, n (%) | 321 (43,9%) | 35 (41,2%) | 1 | 0,005b |
| Fulminante | ||||
| Sim, n (%) | 27 (3,6%) | 9 (10,6%) | 0,32 (0,14, 0,70) | |
| Não, (%) | 715 (96,4) | 76 (89,4) | 1 | |
| Insuficiência hepática | ||||
| INR > 1,5 n (%), n(%) | 226 (30,7) | 31 (40,3) | 0,060b | |
| Manifestações extra‐hepáticas | ||||
| Sim, n (%) | 183 (24,8) | 12 (14,1) | 2,01 (1,07, 3,77) | 0,031b |
| Não (%) | 555 (75,2) | 73 (85,9) | 1 | |
| Histórico familiar de doença autoimune | ||||
| Sim, n (%) | 161 (21,9%) | 18 (21,2%) | 1,42 (0,60, 1,80) | 0,883b |
| Não (%) | 575 (78,1%) | 67 (78,7) | 1 | |
| Escore da HAI (1999) | ||||
| Mediana (mín.‐máx.) | 17 (7; 28) | 15,5 (3; 123) | 0,001a | |
| Escore (2008) | ||||
| Mediana (mín.‐máx.) | 7 (2; 10) | 6 (3; 9) | 0,001a | |
DP, desvio‐padrão; HAI, hepatite autoimune; IC, intervalo de confiança; máx., máximo; min., mínimo; RC, razão de chance.
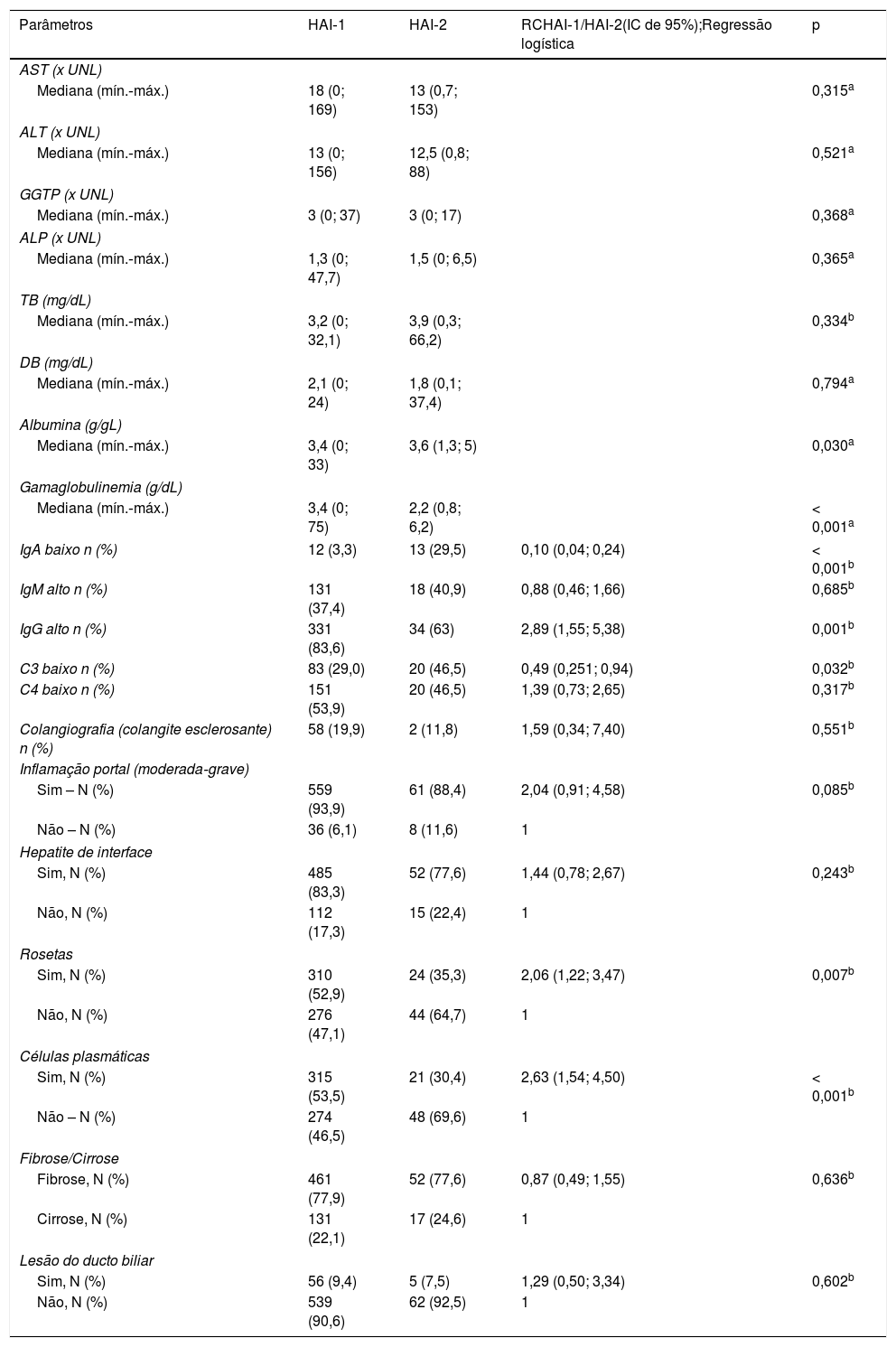
Achados no teste de diagnóstico complementar dos pacientes com HAI‐1 e HAI‐2
| Parâmetros | HAI‐1 | HAI‐2 | RCHAI‐1/HAI‐2(IC de 95%);Regressão logística | p |
|---|---|---|---|---|
| AST (x UNL) | ||||
| Mediana (mín.‐máx.) | 18 (0; 169) | 13 (0,7; 153) | 0,315a | |
| ALT (x UNL) | ||||
| Mediana (mín.‐máx.) | 13 (0; 156) | 12,5 (0,8; 88) | 0,521a | |
| GGTP (x UNL) | ||||
| Mediana (mín.‐máx.) | 3 (0; 37) | 3 (0; 17) | 0,368a | |
| ALP (x UNL) | ||||
| Mediana (mín.‐máx.) | 1,3 (0; 47,7) | 1,5 (0; 6,5) | 0,365a | |
| TB (mg/dL) | ||||
| Mediana (mín.‐máx.) | 3,2 (0; 32,1) | 3,9 (0,3; 66,2) | 0,334b | |
| DB (mg/dL) | ||||
| Mediana (mín.‐máx.) | 2,1 (0; 24) | 1,8 (0,1; 37,4) | 0,794a | |
| Albumina (g/gL) | ||||
| Mediana (mín.‐máx.) | 3,4 (0; 33) | 3,6 (1,3; 5) | 0,030a | |
| Gamaglobulinemia (g/dL) | ||||
| Mediana (mín.‐máx.) | 3,4 (0; 75) | 2,2 (0,8; 6,2) | < 0,001a | |
| IgA baixo n (%) | 12 (3,3) | 13 (29,5) | 0,10 (0,04; 0,24) | < 0,001b |
| IgM alto n (%) | 131 (37,4) | 18 (40,9) | 0,88 (0,46; 1,66) | 0,685b |
| IgG alto n (%) | 331 (83,6) | 34 (63) | 2,89 (1,55; 5,38) | 0,001b |
| C3 baixo n (%) | 83 (29,0) | 20 (46,5) | 0,49 (0,251; 0,94) | 0,032b |
| C4 baixo n (%) | 151 (53,9) | 20 (46,5) | 1,39 (0,73; 2,65) | 0,317b |
| Colangiografia (colangite esclerosante) n (%) | 58 (19,9) | 2 (11,8) | 1,59 (0,34; 7,40) | 0,551b |
| Inflamação portal (moderada‐grave) | ||||
| Sim – N (%) | 559 (93,9) | 61 (88,4) | 2,04 (0,91; 4,58) | 0,085b |
| Não – N (%) | 36 (6,1) | 8 (11,6) | 1 | |
| Hepatite de interface | ||||
| Sim, N (%) | 485 (83,3) | 52 (77,6) | 1,44 (0,78; 2,67) | 0,243b |
| Não, N (%) | 112 (17,3) | 15 (22,4) | 1 | |
| Rosetas | ||||
| Sim, N (%) | 310 (52,9) | 24 (35,3) | 2,06 (1,22; 3,47) | 0,007b |
| Não, N (%) | 276 (47,1) | 44 (64,7) | 1 | |
| Células plasmáticas | ||||
| Sim, N (%) | 315 (53,5) | 21 (30,4) | 2,63 (1,54; 4,50) | < 0,001b |
| Não – N (%) | 274 (46,5) | 48 (69,6) | 1 | |
| Fibrose/Cirrose | ||||
| Fibrose, N (%) | 461 (77,9) | 52 (77,6) | 0,87 (0,49; 1,55) | 0,636b |
| Cirrose, N (%) | 131 (22,1) | 17 (24,6) | 1 | |
| Lesão do ducto biliar | ||||
| Sim, N (%) | 56 (9,4) | 5 (7,5) | 1,29 (0,50; 3,34) | 0,602b |
| Não, N (%) | 539 (90,6) | 62 (92,5) | 1 | |
DP, desvio‐padrão; HAI, hepatite autoimune; IC, intervalo de confiança; máx., máximo; min., mínimo; RC, razão de chance.
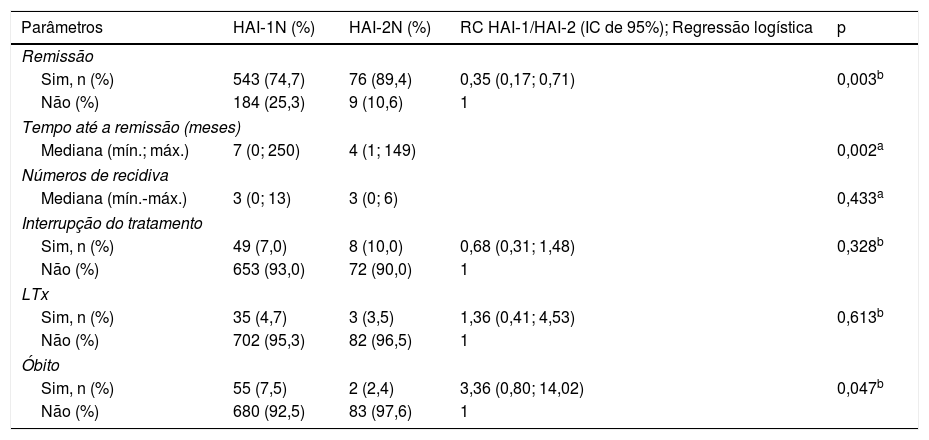
Resposta ao tratamento e resultados em pacientes com HAI‐1 e HAI‐2
| Parâmetros | HAI‐1N (%) | HAI‐2N (%) | RC HAI‐1/HAI‐2 (IC de 95%); Regressão logística | p |
|---|---|---|---|---|
| Remissão | ||||
| Sim, n (%) | 543 (74,7) | 76 (89,4) | 0,35 (0,17; 0,71) | 0,003b |
| Não (%) | 184 (25,3) | 9 (10,6) | 1 | |
| Tempo até a remissão (meses) | ||||
| Mediana (mín.; máx.) | 7 (0; 250) | 4 (1; 149) | 0,002a | |
| Números de recidiva | ||||
| Mediana (mín.‐máx.) | 3 (0; 13) | 3 (0; 6) | 0,433a | |
| Interrupção do tratamento | ||||
| Sim, n (%) | 49 (7,0) | 8 (10,0) | 0,68 (0,31; 1,48) | 0,328b |
| Não (%) | 653 (93,0) | 72 (90,0) | 1 | |
| LTx | ||||
| Sim, n (%) | 35 (4,7) | 3 (3,5) | 1,36 (0,41; 4,53) | 0,613b |
| Não (%) | 702 (95,3) | 82 (96,5) | 1 | |
| Óbito | ||||
| Sim, n (%) | 55 (7,5) | 2 (2,4) | 3,36 (0,80; 14,02) | 0,047b |
| Não (%) | 680 (92,5) | 83 (97,6) | 1 | |
HAI, hepatite autoimune; IC, intervalo de confiança; LTx, transplante de fígado; RC, razão de chance.
Dos 828 pacientes, 742 (89,6%) apresentaram HAI‐1 e 86 (10,4%) apresentaram HAI‐2.
Dados demográficos e clínicos (tabela 1)O sexo feminino foi predominante entre os pacientes (HAI‐1: 74,9%, HAI‐2: 84,9%). A idade média no início dos sintomas foi 111,5 (6; 210) e 53,5 (8; 165) meses para os pacientes com HAI‐1 e HAI‐2, respectivamente (p < 0,001).
As crianças com achados positivos para LKM1 eram significativamente mais novas (p < 0,001). Os pacientes apresentaram um escore mediano de HAI, de acordo com os Sistemas Internacionais de Classificação da HAI de 1999 e 2008, de 17 (7; 28) e 7 (2; 10) para HAI‐1 e 15,5 (3; 123) e 6 (3; 9) para HAI‐2, respectivamente, revelaram uma diferença significativa entre os grupos (p = 0,001).
Foi observado início clínico agudo em 410 (56,1%) e 50 (58,8%) pacientes com HAI‐1 e HAI‐2, respectivamente. Foram observados sintomas clínicos insidiosos em 321 (43,9%) e 35 (41,2%) crianças com HAI‐1 e HAI‐2, respectivamente (tabela 2). O risco para essas duas manifestações clínicas não foi significativamente diferente (p = 0,630). Foi observada insuficiência hepática (INR de > 1,5) em 226 (30,7%) e 31 (40,3%) pacientes com HAI‐1 e HAI‐2, respectivamente. O risco de insuficiência hepática foi 1,6 vez maior no grupo de HAI‐2, que foi somente marginalmente significativo (p = 0,060); 27 (3,6%) crianças com HAI‐1 e nove (10,6%) crianças com HAI‐2 apresentaram insuficiência hepática fulminante na manifestação inicial e a diferença foi significativa entre os grupos (p = 0,005). Além disso, o risco foi 3,1 vezes maior no grupo com HAI‐2. Foi observado histórico familiar de doença autoimune, inclusive diabetes, doença da tiroide, doença de Behçet e vitiligo, em 161 (21,9%) pacientes com HAI‐1 e 18 (21,2%) pacientes com HAI‐2 (p = 0,883).
Manifestações autoimunes extra‐hepáticas estiveram presentes em 183 (24,8%) 12 (14,1%) pacientes com HAI‐1 e HAI‐2, respectivamente, com uma diferença significativa entre os grupos (p = 0,031). O risco de manifestações autoimunes extra‐hepáticas foi duas vezes maior nos pacientes com HAI‐1. As doenças autoimunes associadas incluíram lúpus eritematoso sistêmico, paniculite de Weber, diabetes tipo 1, doença da tiroide, doença celíaca, doença inflamatória intestinal, glomerulopatias e artrite.
Achados laboratoriais e radiológicos (tabela 2)Com relação aos testes de laboratório, não foi observada diferença significativa entre os grupos para os níveis de bilirrubina direta no soro, aminotransferase, GGTP e ALP. Contudo, os níveis de albumina, gamaglobulina e/ou IgG foram significativamente maiores nos pacientes com HAI‐1 do que nos com HAI‐2 (p = 0,030 e p < 0,001, respectivamente); os níveis de IgA foram menores nos pacientes com HAI‐2 (p = 0,001). Foram observados níveis de C3 significativamente menores nas crianças com HAI‐2 (p = 0,032) e nenhuma diferença significativa (p = 0,317) foi observada nos níveis de C4.
Foi feita CPRM/colangiografia em 309 crianças e adolescentes e os resultados foram compatíveis com colangite esclerosante autoimune (CEA) em 60 pacientes (58 com HAI‐1 e dois com AIH‐2).
Achados histológicos (tabela 2)Com base nos resultados das biópsias hepáticas feitas antes do tratamento imunossupressor, as rosetas de hepatócitos e as células plasmáticas foram mais prevalentes nos pacientes com HAI‐1 (p = 0,007 e p < 0,001; risco aumentado em 2,1 vezes e 2,6, respectivamente). Houve lesão do ducto biliar em 61 pacientes; fibrose em 513 pacientes e cirrose em 148 pacientes, sem uma diferença significativa entre os grupos.
Tratamentos e resultados (tabela 3)Em 94,1% dos 828 pacientes, o tratamento inicial para HAI foi uma combinação de prednisona e azatioprina. Um tratamento combinado que incluiu ácido ursodesoxicólico foi administrado em 30,3% dos pacientes, micofenolato de mofetila em 3,7% e ciclosporina em 6,3%. A duração do acompanhamento foi de até 23,8 anos (média, 7,08 anos; mediana, 6,4 anos).
Após início da imunossupressão, a remissão bioquímica foi atingida em 76,2% de todos os pacientes (HAI‐1: 74,7%; HAI‐2: 89,4%; p = 0,003). O tempo mediano até a remissão bioquímica foi sete (0; 250) e quatro (1; 149) meses para HAI‐1 e HAI‐2, respectivamente (p = 0,002).
O tratamento foi interrompido em pacientes após a remissão completa; 13 pacientes apresentaram recidiva pós‐suspensão e retomamos o tratamento com medicamentos imunossupressores. Todos os pacientes com HAI‐2 que interromperam o tratamento o fizeram por sua conta ou, caso por motivos médicos, antes da recomendação de não interrupção do tratamento, que atualmente existe, de acordo com o consenso internacional.7
Os números medianos das recidivas bioquímicas foram 3 (0; 13) e 3 (0; 6) nos pacientes com HAI‐1 e HAI‐2, respectivamente, durante o tratamento, sem diferença entre eles (p = 0,433).
Os efeitos adversos durante o tratamento, inclusive alopecia, síndrome de Cushing, obesidade, diabetes tipos 1 e 2, embolia pulmonar, estrias, infecções (infecções do trato urinário e respiratório superior), pneumonia, recidivas de amigdalite e meningite, foram observados em 38,8% (n = 322) dos pacientes.
Ficaram grávidas 37 adolescentes (4,5%) e nenhuma delas apresentou complicações durante a gestação ou após o parto. Todos os bebês nasceram vivos sem complicações. A azatioprina foi interrompida durante a gravidez e a dose de prednisona não foi alterada. Após o parto, somente aquelas que amamentaram não receberam azatioprina. Não houve recidiva nas 37 pacientes.
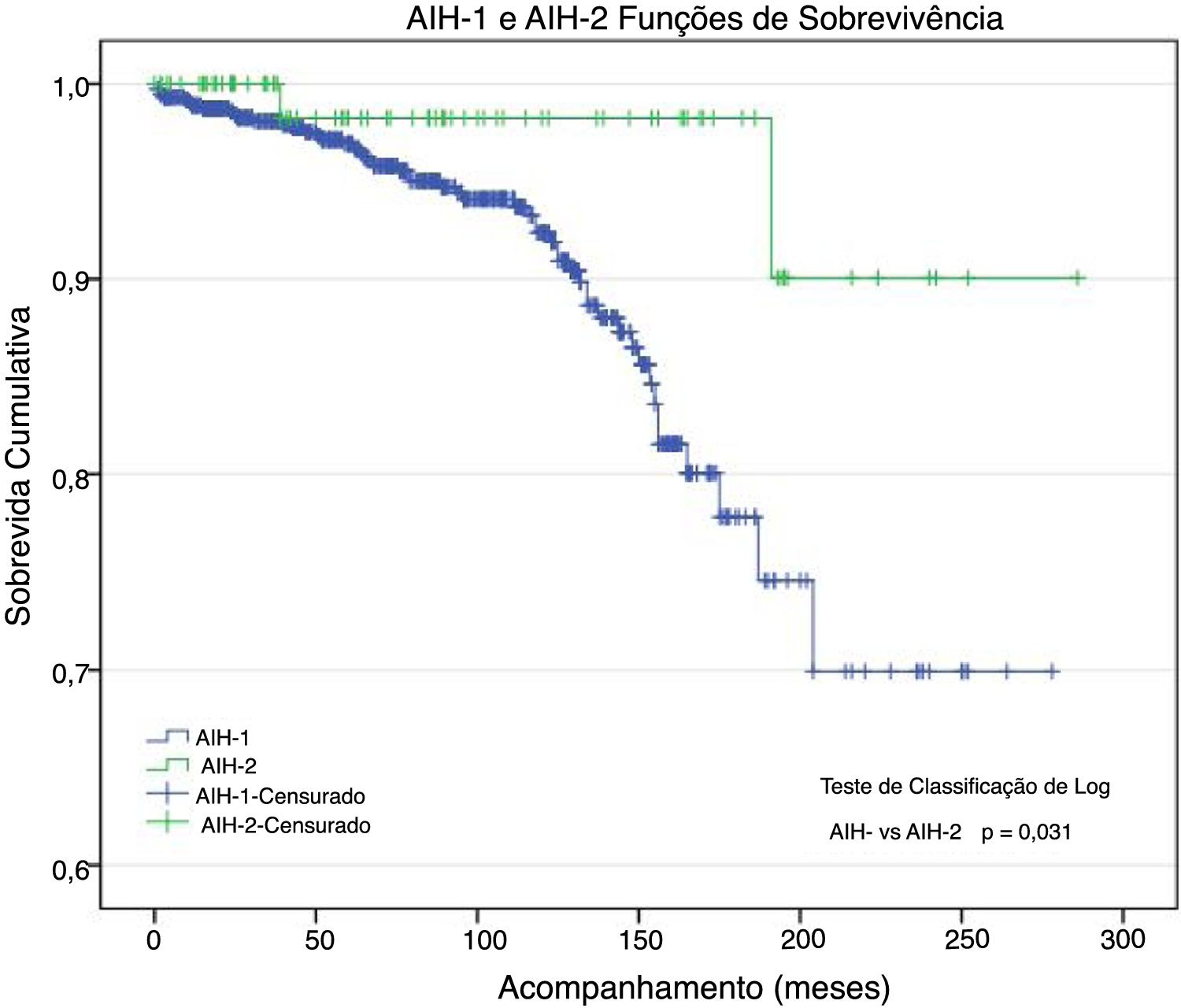
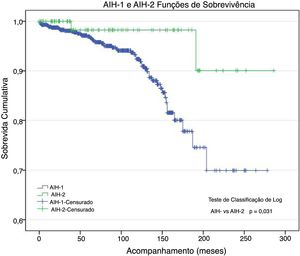
Morbidez e mortalidade (tabela 3)Foram submetidos 38 pacientes a transplante de fígado (LTx): 35 (4,7%) com HAI‐1 e três (3,5%) com HAI‐2; 55 pacientes morreram: 55 (7,5%) com HAI‐1 e dois (2,4%) com HAI‐2 (p = 0,047). Os óbitos estavam relacionados à HAI e suas comorbidades. A taxa de sobrevida atuarial foi 92,5% e 97,6% nos pacientes com HAI‐1 e HAI‐2, respectivamente (fig. 1); aos 96 meses de acompanhamento, essas probabilidades foram ∼94% e 98%. Aos 150 meses, as probabilidades foram 86% e 98%. No fim do acompanhamento (HAI‐1: 278 meses; HAI‐2: 286 meses), as probabilidades de sobrevida foram ∼70% e 90%, respectivamente. A curva de sobrevida dos pacientes com HAI‐1 foi quase igual à curva de sobrevida geral, pois houve somente dois óbitos entre os 84 pacientes com HAI‐2.
DiscussãoEste constitui o maior estudo clínico de crianças e adolescentes com HAI já publicado. Nesse grupo do estudo brasileiro, a HAI‐1 foi mais frequente. Além disso, os pacientes com HAI‐1 apresentaram risco mais elevado de serem submetidos a Ltx e de óbito.
O início mais precoce da doença para HAI‐2 neste estudo é semelhante ao encontrado na literatura.8–10 A distribuição por sexo feminino/masculino para HAI também corresponde ao da literatura, ou seja, predominância do sexo feminino, principalmente entre as pacientes com HAI‐1.
As manifestações clínicas da HAI‐1 e HAI‐2 foram análogas, exceto o tipo fulminante. A hepatite fulminante é uma manifestação muito rara da doença e, quando ocorre, está mais associada à HAI‐2. Neste estudo, a manifestação fulminante ocorreu com mais frequência na presença da positividade anti‐LKM1, o que é compatível com Di Giorgio et al.11 e outros na literura.10–14
As manifestações extra‐hepáticas associadas à HAI são variáveis em frequência e prevalência. As doenças da tiroide são descritas com mais frequência, semelhantemente às manifestações extra‐hepáticas relatadas no estudo de Bittencourt et al.15 e Gregorio et al., inclusive tireoidite, vitiligo, diabetes tipo 1 e doença inflamatória intestinal, em 20% das crianças com HAI.13 Nossos achados são diferentes dos de Gregorio et al., que podem corresponder às diferenças regionais e à susceptibilidade genética.16
Os escores (1999 e 2008) dos dois tipos de HAI foram compatíveis com os de outros estudos.1,2,17 Os pacientes não submetidos a biópsia no diagnóstico atenderam aos critérios internacionais para HAI e não mostraram discrepâncias nos escores em nosso estudo. Mileti et al.17 examinaram a eficácia de diagnóstico do escore em crianças. Inicialmente, a população pediátrica não foi avaliada de acordo com os critérios de 1999. Posteriormente, dois estudos apresentaram resultados controversos com relação ao uso dos dois escores.18,19 Mileti et al.17 observaram alta sensibilidade e especificidade com o uso dos escores na população pediátrica; contudo, também foram observadas algumas limitações. A resposta terapêutica continua um critério de diagnóstico fundamental, principalmente em pacientes sem marcadores de autoimunidade, mesmo se eles não atingirem um escore que indique um diagnóstico definitivo de HAI.20–22
Os níveis de albumina reforçaram a gravidade da doença, principalmente em pacientes com HAI‐1, com pioria da função hepática. Níveis elevados de gamaglobulina, principalmente em pacientes com HAI‐1, são um sinal significativo no diagnóstico diferenciado entre os tipos de HAI. Esse teste é um importante marcador no diagnóstico da HAI‐1 e o resultado pode ser normal em pacientes com HAI‐2, o que reforça a diferença entre os grupos.
Nenhuma diferença ou aumentos significativos foram encontrados em nossos pacientes. Esses dados diferem dos de Di Giorgio et al.,11 que encontraram níveis elevados de IgM sem uma explicação real.11
Diagnosticar colangite esclerosante continua um desafio. Apesar de a detecção de lesão do ducto não indicar CEA de forma definitiva, alterações histológicas ou na CPRM compatíveis com colangite esclerosante não são sempre observadas em pacientes afetados. Níveis de GGTP persistentemente elevados sugerem envolvimento do trato biliar e o acompanhamento de longo prazo ou avaliação de explante possibilita o diagnóstico. Não foi feita colangiografia em todos os pacientes. Diversos fatores contribuíram para a difícil execução desse exame, por exemplo necessidade de anestesia e os custos. Como o estudo teve um modelo retrospectivo e não havia recomendação na literatura, vários serviços foram feitos somente quando o nível de GGTP não caiu ou quando não houve resposta terapêutica aos imunossupressores. Assim, pode haver um viés neste estudo com relação à prevalência de CEA, o que faz parte dos estudos retrospectivos; contudo, os resultados continuam importantes, devido ao grande número de pacientes incluídos. O Comitê de Hepatologia ESPGHAN recomenda buscar síndrome de reposição em pacientes com HAI.7
Neste estudo, alguns pacientes não foram submetidos a biópsia hepática devido às contraindicações, como coagulopatia (INR alta), ascite ou trombocitopenia grave. Contudo, todos esses pacientes se enquadram na classificação para HAI de acordo com os critérios internacionais, mesmo sem uma histologia de classificação. Além disso, os achados da biópsia do fígado não foram avaliados por um único patologista, pois o estudo foi um estudo retrospectivo que coletou dados de vários centros, porém seguiu os critérios de consenso dos patologistas brasileiros. O exame do tecido hepático antes do tratamento é um importante componente de diagnóstico e as diretrizes recomendam sua feitura na apresentação.7 Apesar disso, a necessidade de exame do tecido hepático antes do tratamento foi contestada em crianças, pois elas geralmente apresentam disfunção hepática significativa e coagulopatia.22 Björnsson et al.23 mencionaram a importância da histologia no diagnóstico típico de HAI e concluíram que a maior parte dos pacientes com características de HAO é mais propensa a ter histologias hepáticas compatíveis. Em adultos, a presença de cirrose no quadro clínico inicial claramente piora a doença, leva a uma taxa de sobrevida de 10 anos de ∼60% em comparação com 80% dos pacientes sem cirrose.23 Contudo, Radhakrishnan et al.24 observaram que a presença de cirrose não afeta a sobrevida de longo prazo em crianças. A cirrose foi o achado predominante na manifestação inicial dos dois tipos de HAI; contudo, essa observação difere dos dados obtidos por Gregorio et al.16 e Saadah et al.,25 que relataram uma prevalência de cirrose de 69% e 38% entre os pacientes com HAI‐1 e HAI‐2, respectivamente. No estudo atual, foram observadas diferenças nos resultados histopatológicos do fígado entre os grupos de HAI, com uma maior prevalência de rosetas e células plasmáticas em pacientes com HAI‐1, o que não foi relatado na literatura. A presença de cirrose na primeira manifestação da doença mostra a gravidade da HAI.
A resposta terapêutica é um dos melhores parâmetros para determinar se o perfil clínico da hepatite pode ser atribuído a uma causa imunológica. A remissão da doença é sempre o principal objetivo do tratamento imunossupressor. Em geral, a resposta terapêutica é mais de 70% em pacientes com HAI‐1 e 85% nos com HAI‐2,16,26 semelhante aos achados neste estudo.
Este estudo revelou um tempo reduzido de remissão nos pacientes com HAI‐2. Esse achado é incompatível com os de Gregorio et al.16
Uma preocupação importante são os comportamentos de não adesão ao tratamento, principalmente entre adolescentes.13 Neste estudo, o tratamento foi interrompido nos dois grupos pelo médico e o tratamento também foi interrompido em alguns pacientes devido à não adesão. Ferreira et al.14 estudaram crianças que atingiram remissão clínica‐laboratorial após imunossupressão por 24 meses e observaram uma indecência de 54,5% de recidiva da doença após o tratamento, mesmo na presença de remissão histológica. Eles não identificaram os fatores preditivos associados à recidiva.
LTx é necessário para tratamento de HAI em ∼10% dos casos26,27 e foi feito em 10% dos pacientes pediátricos com HAI e 23% dos pacientes com colangite esclerosante.26 Neste estudo, foi feito transplante em 4,7% e 3,5% dos pacientes com HAI‐1 e HAI‐2, respectivamente, indicou‐se que a doença foi bem controlada com imunossupressores.
Os fatores de limitação deste estudo incluem o fato de ele ser retrospectivo e, consequentemente, haver a possibilidade de vieses e dados incompletos de alguns pacientes; contudo, é importante notar que ele incluiu pacientes de vários centros secundários e terciários de referência e constitui o maior estudo de crianças e adolescentes com HAI já publicado. Os dados apresentados não representam a prevalência real dos pacientes pediátricos com hepatite autoimune no Brasil.
Em resumo, neste grande estudo clínico de crianças e adolescentes brasileiros com HAI: a HAI‐1 foi mais frequente; a HAI‐2 afetou crianças mais novas, apresentou taxas de remissão mais elevadas e se manifestou mais precocemente que a HAI‐1; e os pacientes com HAI‐1 apresentaram maior risco de serem submetidos a LTx e óbito.
Conflitos de interesseOs autores declaram não haver conflitos de interesse.
Como citar este artigo: Porta G, Carvalho E, Santos JL, Gama J, Borges CV, Seixas RB, et al. Autoimmune hepatitis in 828 Brazilian children and adolescents: clinical and laboratory findings, histological profile, treatments, and outcomes. J Pediatr (Rio J). 2019;95:419–27.