To systematize information about vitamin E concentration in human milk and the variables associated with this composition in order to find possible causes of deficiency, supporting strategies to prevent it in postpartum women and infants.
SourcesStudies published between 2004 and 2014 that assayed alpha‐tocopherol in human milk of healthy women by high performance liquid chromatography were evaluated. The keywords used were “vitamin E”, “alpha‐tocopherol”, “milk, human”, “lactation”, “infant, newborn” equivalents in Portuguese, in the BIREME, CAPES, PubMed, SciELO, ISI Web of Knowledge, HighWire Press, Ingenta, and Brazilian Digital Library of Theses and Dissertations databases.
Summary of the findingsOf the 41 publications found on the subject, 25 articles whose full text was available and met the inclusion criteria were selected. The alpha‐tocopherol concentrations found in milk were similar in most populations studied. The variable phase of lactation was shown to influence vitamin E content in milk, which is reduced until the mature milk appears. Maternal variables parity, anthropometric nutritional status, socioeconomic status, and habitual dietary intake did not appear to affect the alpha‐tocopherol levels in milk. However, the influence of the variables maternal age, gestational age, biochemical nutritional status in alpha‐tocopherol, and maternal supplementation with vitamin E had conflicting results in the literature.
ConclusionAlpha‐tocopherol concentration in milk decreases during lactation, until the mature milk appears. To confirm the influence of some maternal and child variables on milk vitamin E content, further studies with adequate design are needed.
Sistematizar informações sobre a concentração de vitamina E no leite humano e variáveis associadas a essa composição, a fim de encontrar possíveis causas de deficiência, subsidiando estratégias para prevenção desta em puérperas e lactentes.
Fonte dos dadosForam avaliados estudos publicados entre 2004 e 2014 que determinaram o alfa‐tocoferol no leite humano de mulheres saudáveis por Cromatografia Líquida de Alta Eficiência. Os descritores utilizados foram “leite humano”, “alfa‐tocoferol”, “vitamina E”, “lactação” e seus equivalentes em inglês, nas bases de dados BIREME, Periódicos CAPES, PubMed, SciELO, ISI Web of Knowledge, HighWire Press, Ingenta e Biblioteca Digital Brasileira de Teses e Dissertações.
Síntese dos dadosDas 41 publicações encontradas sobre a temática, 25 foram selecionadas, por possuirem texto completo disponível e se encaixarem nos critérios de inclusão. As concentrações encontradas de alfa‐tocoferol no leite foram semelhantes na maioria das populações estudadas. A variável fase de lactação mostrou influenciar o conteúdo dessa vitamina no leite, que vai sendo reduzido até o leite maduro. As variáveis maternas paridade, estado nutricional antropométrico, condição socioeconômica e ingestão dietética habitual parecem não afetar os níveis de alfa‐tocoferol no leite. Entretanto, a influência das variáveis idade materna, idade gestacional, estado nutricional bioquímico em alfa‐tocoferol e suplementação materna com vitamina E possui resultados conflitantes na literatura.
ConclusãoA concentração de alfa‐tocoferol no leite diminui durante a lactação, até chegar ao leite maduro. Para confirmar a influência de algumas variáveis maternas e da criança sobre a vitamina E do leite ainda são necessários mais estudos, com desenho adequado.
O alfa‐tocoferol, componente principal do grupo de compostos denominado vitamina E, é um potente antioxidante, constituindo a principal vitamina lipossolúvel responsável pela proteção das membranas celulares contra a peroxidação. Por ser um composto lipofílico, se acumula nas lipoproteínas circulantes, membranas celulares e depósitos adiposos, onde reage com o oxigênio molecular e radicais livres, protegendo os ácidos graxos poli‐insaturados (PUFAs) e as lipoproteínas da peroxidação.1,2
Essa vitamina é extremamente importante nos estágios iniciais da vida, desde a concepção até o desenvolvimento pós‐natal. Durante a gestação, a transferência placentária de vitamina E para o feto é limitada, tornando o leite materno a única fonte desse nutriente para os lactentes em aleitamento materno exclusivo. Essa ingestão representa uma importante forma de suprir o recém‐nascido com uma essencial defesa antioxidante e estimular o desenvolvimento do seu sistema imunológico.3
Frente à importância da vitamina E para o recém‐nascido, diversos estudos objetivaram determinar os níveis de alfa‐tocoferol no leite materno. Entretanto, alguns dados conflitantes são encontrados na literatura a respeito dessa concentração, a exemplo de Schweigert et al.,4 na Alemanha, que obtiveram quantidade de alfa‐tocoferol no colostro duas vezes maior que o encontrado em mulheres de Bangladesh.5
Tais diferenças podem ser geradas por alguns fatores capazes de causar alterações na concentração de alfa‐tocoferol do leite. Nascimento e Issler6 ressaltam que variações na composição nutricional do leite dependem do estágio de lactação, hora do dia, tempo decorrido desde a última refeição, nutrição e idade da mãe, idade gestacional do recém‐nascido, entre outros aspectos individuais da lactante.
Estudos sobre a associação de variáveis ao conteúdo de alfa‐tocoferol do leite humano vêm sendo realizados. Portanto, em vista da importância da vitamina E e do leite materno para o recém‐nascido e da existência de conclusões divergentes na literatura a respeito dessa temática, o objetivo desta revisão foi sistematizar informações sobre os níveis de alfa‐tocoferol no leite humano e as variáveis associadas a essa concentração, a fim de esclarecer que fatores influenciam a composição de vitamina E do leite.
MétodosForam pesquisados trabalhos publicados entre janeiro de 2004 e fevereiro de 2014 nas bases de dados BIREME, Periódicos CAPES, PubMed, SciELO, ISI Web of Knowledge, HighWire Press, Ingenta e Biblioteca Digital Brasileira de Teses e Dissertações. A fim de encontrar os estudos referentes ao assunto de interesse, foram utilizados descritores específicos durante a pesquisa: leite humano, alfa‐tocoferol, vitamina E, lactação e seus equivalentes em inglês.
Foram selecionadas para leitura integral somente as publicações cujo título ou resumo diziam se tratar de estudos sobre os níveis de alfa‐tocoferol no leite humano. Foram incluídos na revisão apenas os trabalhos que utilizaram como método de determinação a Cromatografia Líquida de Alta Eficiência (CLAE). Foram excluídos estudos desenvolvidos com mulheres não saudáveis e aqueles encontrados sobre o tema que, apesar de divulgarem os níveis de alfa‐tocoferol obtidos pela análise do leite humano, tinham como principal objetivo estudar processos de perda da vitamina, métodos de determinação, entre outros, e não a concentração desse micronutriente no leite.
As variáveis consideradas para a revisão sobre sua associação ao conteúdo de alfa‐tocoferol do leite foram identificadas por meio da revisão de literatura. Assim, as variáveis selecionadas foram aquelas mais frequentes nos estudos: fase da lactação (leite colostro, de transição ou maduro); idade materna; condição socioeconômica materna; paridade; idade gestacional do recém‐nascido; estado nutricional bioquímico em vitamina E materno; estado nutricional antropométrico materno; ingestão dietética habitual e suplementação materna com vitamina E.
Fase de lactaçãoO leite colostro é a primeira secreção láctea, que permanece até o 7° ou 10° dia pós‐parto. É um líquido espesso, de alta densidade e, geralmente, possui coloração amarelada, devido ao seu alto teor de carotenoides. Esse leite também é rico em anticorpos, protegendo o recém‐nascido contra infecções, e tem a propriedade de facilitar o estabelecimento de uma flora intestinal predominantemente bífida e com efeito laxativo, que auxilia na eliminação do mecônio.6 Estudos mostram o efeito protetor da amamentação com o leite colostro na primeira hora de vida no combate à mortalidade neonatal e aponta para a importância de se adotar essa prática imediatamente após o parto.7
Por volta do 8° até o 15° dia pós‐parto, o leite passa a ser chamado de “leite de transição”, e as alterações na composição láctea continuam ocorrendo, até que cerca de duas semanas após o parto a composição do leite torna‐se mais estável, passando este a ser caracterizado como maduro.6
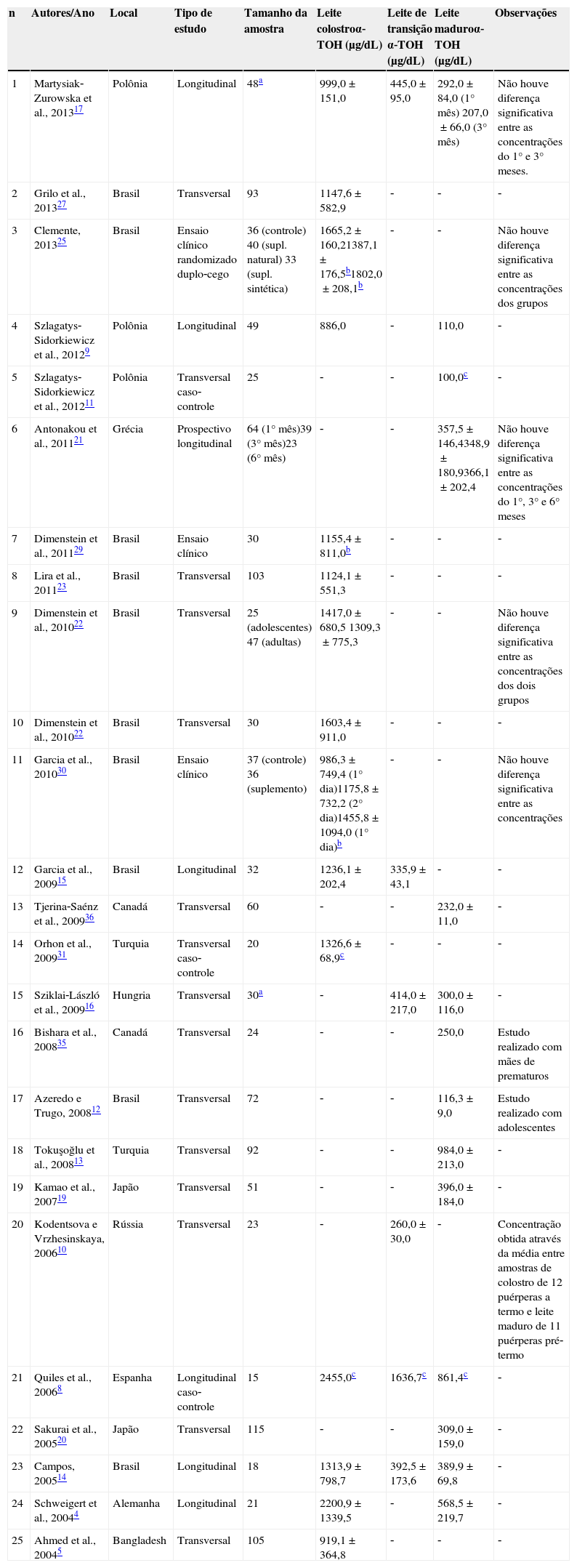
A concentração de alfa‐tocoferol no leite colostro, na maioria das populações estudadas, é semelhante; entretanto, alguns resultados se afastam da média encontrada nos demais, a exemplo de estudos na Alemanha4 e Espanha,8 nos quais os valores da vitamina no colostro foram bastante superiores aos encontrados em Bangladesh5 e na Polônia,9 por exemplo. Nos dois primeiros estudos, entretanto, destaca‐se que o número amostral foi pequeno, e no estudo de Schweigert et al.4 foi encontrada uma variação na composição de alfa‐tocoferol do leite, evidenciada pelo desvio‐padrão apresentado (tabela 1). Portanto, para confirmar tais valores, seria interessante um estudo com um maior número de lactantes.
Estudos sobre a concentração de alfa‐tocoferol (μg/dL) no leite materno nas diferentes fases de lactação publicados no período de 2004 a 2014, ordenados de acordo com o ano de publicação
| n | Autores/Ano | Local | Tipo de estudo | Tamanho da amostra | Leite colostroα‐TOH (μg/dL) | Leite de transição α‐TOH (μg/dL) | Leite maduroα‐TOH (μg/dL) | Observações |
|---|---|---|---|---|---|---|---|---|
| 1 | Martysiak‐Zurowska et al., 201317 | Polônia | Longitudinal | 48a | 999,0±151,0 | 445,0±95,0 | 292,0±84,0 (1° mês) 207,0±66,0 (3° mês) | Não houve diferença significativa entre as concentrações do 1° e 3° meses. |
| 2 | Grilo et al., 201327 | Brasil | Transversal | 93 | 1147,6±582,9 | ‐ | ‐ | ‐ |
| 3 | Clemente, 201325 | Brasil | Ensaio clínico randomizado duplo‐cego | 36 (controle) 40 (supl. natural) 33 (supl. sintética) | 1665,2±160,21387,1±176,5b1802,0±208,1b | ‐ | ‐ | Não houve diferença significativa entre as concentrações dos grupos |
| 4 | Szlagatys‐Sidorkiewicz et al., 20129 | Polônia | Longitudinal | 49 | 886,0 | ‐ | 110,0 | ‐ |
| 5 | Szlagatys‐Sidorkiewicz et al., 201211 | Polônia | Transversal caso‐controle | 25 | ‐ | ‐ | 100,0c | ‐ |
| 6 | Antonakou et al., 201121 | Grécia | Prospectivo longitudinal | 64 (1° mês)39 (3° mês)23 (6° mês) | ‐ | ‐ | 357,5±146,4348,9±180,9366,1±202,4 | Não houve diferença significativa entre as concentrações do 1°, 3° e 6° meses |
| 7 | Dimenstein et al., 201129 | Brasil | Ensaio clínico | 30 | 1155,4±811,0b | ‐ | ‐ | ‐ |
| 8 | Lira et al., 201123 | Brasil | Transversal | 103 | 1124,1±551,3 | ‐ | ‐ | ‐ |
| 9 | Dimenstein et al., 201022 | Brasil | Transversal | 25 (adolescentes) 47 (adultas) | 1417,0±680,5 1309,3±775,3 | ‐ | ‐ | Não houve diferença significativa entre as concentrações dos dois grupos |
| 10 | Dimenstein et al., 201022 | Brasil | Transversal | 30 | 1603,4±911,0 | ‐ | ‐ | ‐ |
| 11 | Garcia et al., 201030 | Brasil | Ensaio clínico | 37 (controle) 36 (suplemento) | 986,3±749,4 (1° dia)1175,8±732,2 (2° dia)1455,8±1094,0 (1° dia)b | ‐ | ‐ | Não houve diferença significativa entre as concentrações |
| 12 | Garcia et al., 200915 | Brasil | Longitudinal | 32 | 1236,1±202,4 | 335,9±43,1 | ‐ | ‐ |
| 13 | Tjerina‐Saénz et al., 200936 | Canadá | Transversal | 60 | ‐ | ‐ | 232,0±11,0 | ‐ |
| 14 | Orhon et al., 200931 | Turquia | Transversal caso‐controle | 20 | 1326,6±68,9c | ‐ | ‐ | ‐ |
| 15 | Sziklai‐László et al., 200916 | Hungria | Transversal | 30a | ‐ | 414,0±217,0 | 300,0±116,0 | ‐ |
| 16 | Bishara et al., 200835 | Canadá | Transversal | 24 | ‐ | ‐ | 250,0 | Estudo realizado com mães de prematuros |
| 17 | Azeredo e Trugo, 200812 | Brasil | Transversal | 72 | ‐ | ‐ | 116,3±9,0 | Estudo realizado com adolescentes |
| 18 | Tokuşoğlu et al., 200813 | Turquia | Transversal | 92 | ‐ | ‐ | 984,0±213,0 | ‐ |
| 19 | Kamao et al., 200719 | Japão | Transversal | 51 | ‐ | ‐ | 396,0±184,0 | ‐ |
| 20 | Kodentsova e Vrzhesinskaya, 200610 | Rússia | Transversal | 23 | ‐ | 260,0±30,0 | ‐ | Concentração obtida através da média entre amostras de colostro de 12 puérperas a termo e leite maduro de 11 puérperas pré‐termo |
| 21 | Quiles et al., 20068 | Espanha | Longitudinal caso‐controle | 15 | 2455,0c | 1636,7c | 861,4c | ‐ |
| 22 | Sakurai et al., 200520 | Japão | Transversal | 115 | ‐ | ‐ | 309,0±159,0 | ‐ |
| 23 | Campos, 200514 | Brasil | Longitudinal | 18 | 1313,9±798,7 | 392,5±173,6 | 389,9±69,8 | ‐ |
| 24 | Schweigert et al., 20044 | Alemanha | Longitudinal | 21 | 2200,9±1339,5 | ‐ | 568,5±219,7 | ‐ |
| 25 | Ahmed et al., 20045 | Bangladesh | Transversal | 105 | 919,1±364,8 | ‐ | ‐ | ‐ |
α‐TOH, alfa‐tocoferol.
No caso de Bangladesh, a concentração observada pode ser decorrente das características da população estudada, que são mulheres em situação de extrema pobreza e com péssimos indicadores de saúde, o que as torna mais propensas ao desenvolvimento de deficiências nutricionais. No entanto, apesar dos menores níveis do nutriente no leite dessas mulheres, o estudo mostra que essa quantidade é suficiente para alcançar o requerimento nutricional do lactente. Segundo Ahmed et al.,5 esse fato pode ser explorado na promoção da alimentação através do colostro em países em desenvolvimento como Bangladesh, onde é registrada certa rejeição desse leite.
No leite de transição, os valores encontrados nas diferentes populações também foram semelhantes, com exceção de um estudo na Rússia,10 no qual a média foi menor e, novamente, do estudo de Quiles et al.,8 cujos valores continuaram superiores aos demais. Kodentsova e Vrzhesinskaya,10 porém, utilizaram amostras de mulheres que se encontravam ente o 3° e o 10° dias de lactação juntamente com outras que estavam entre o 14° e 20° dias, o que pode ter influenciado nos resultados.
No leite maduro, estudos poloneses9,11 também obtiveram valores abaixo dos demais. O mesmo foi observado em um grupo de adolescentes brasileiras, o que, segundo os autores, mostra que a idade influencia o conteúdo de vitamina E no leite materno.12 Outra observação em relação ao leite maduro refere‐se ao estudo de Tokuşoğlu et al.,13 realizado na Turquia, que obteve quantidade de alfa‐tocoferol semelhante à de um leite colostro. Quiles et al.,8 na Espanha, também mostram resultados acima da média para esse leite; porém, este dado é referente a apenas 15 mulheres, podendo esse pequeno número amostral ter influenciado nos resultados.
Os dados apresentados na tabela 1 mostram que há uma tendência de decréscimo do conteúdo de alfa‐tocoferol secretado no leite materno com o decorrer das fases de lactação, sendo maior no colostro.4,8,9,14–17 Segundo Debier,3 essas mudanças se dão pelo aumento dos glóbulos de gordura à medida que o leite amadurece. Após os primeiros dias de lactação, a síntese de triglicerídeos na glândula mamária e sua secreção no leite aumentam, sem aumento proporcional da secreção de fosfolipídios e outros componentes da membrana do glóbulo. Assim, há uma significante redução na quantidade de alguns componentes do glóbulo de gordura, entre eles o alfa‐tocoferol, uma vez que a maior parte da vitamina E é secretada como constituinte da membrana desses glóbulos.
Embora a quantidade de alfa‐tocoferol ofertada ao lactente seja reduzida da fase de leite colostro para a de transição, e desta para a de leite maduro, ocorre um aumento do volume de leite consumido pelo recém‐nascido com o decorrer do tempo, para suprir o seu requerimento nutricional. Entretanto, Garcia et al.15 destacam que a concentração de alfa‐tocoferol, considerando a necessidade do lactente (4mg/dia)18 e o consumo diário de 780mL/dia de leite, aponta para uma aparente inadequação nutricional do leite de transição em seu estudo, feito no Nordeste do Brasil. Considerando esse dado, pode‐se perceber que em outros estudos encontrados também é visto esse possível suprimento insuficiente ao analisar o conteúdo de alfa‐tocoferol nos leites de transição e maduro.
Alguns autores têm estudado o conteúdo de alfa‐tocoferol no leite materno a fim de auxiliar no estabelecimento da IDR (Ingestão Dietética de Referência) para lactentes.19,20 Sabe‐se que recomendação de 4mg/dia de vitamina E para crianças de 0 a 6 meses de idade foi estimada de acordo com a média de ingestão desse nutriente por meio do consumo do próprio leite humano pelos lactentes. Além disso, trata‐se de uma Ingestão Adequada (AI), que é um valor médio estimado quando ainda não foi estabelecida a Ingestão Dietética Recomendada (RDA).18 Traber1 afirma que a quantidade de vitamina E recomendada para consumo diário ainda é controversa, e várias organizações têm proposto valores diferentes. Assim, existe a necessidade de revisão das recomendações dessa vitamina, a fim de verificar se não está ocorrendo uma superestimação das necessidades, uma vez que o leite materno é considerado um alimento nutricionalmente completo, e não se observam sinais clínicos de deficiência de vitamina E em crianças a termo sadias em aleitamento materno exclusivo.
Na fase de leite maduro, quando essa secreção deixa de sofrer variações maiores de composição, os níveis de alfa‐tocoferol parecem se manter constantes ao longo do tempo. Essa constatação foi feita na Polônia17 e na Grécia,21 onde foram realizadas coletas de leite maduro em diferentes meses após o parto, obtendo‐se valores de alfa‐tocoferol que não diferiram significativamente (tabela 1).
Idade e condição socioeconômica maternaO consumo de vitaminas por adolescentes é bastante deficiente, principalmente de vitaminas lipossolúveis.14 Adolescentes são particularmente susceptíveis a riscos nutricionais devido a hábitos alimentares inadequados, uma vez que dão preferência à ingestão de alimentos de alto valor energético e baixo conteúdo de micronutrientes; e a aspectos da fisiologia da mulher na fase da adolescência.12 Além disso, a gestante adolescente tem que acrescentar suas próprias necessidades de crescimento às demais necessidades impostas pela gravidez.22
Portanto, quando a gravidez e lactação subsequente ocorrem na fase da adolescência, os riscos nutricionais associados com esta condição podem aumentar. Nasce daí a hipótese de o leite de adolescentes ter menores quantidades de alfa‐tocoferol que o de adultas.12
No estudo de Dimenstein et al.,22 não houve diferença (p=0,50) entre os valores de alfa‐tocoferol no colostro de puérperas adolescentes e adultas brasileiras (tabela 1). Os autores ressaltam, no entanto, que a média de idade encontrada para as puérperas adolescentes foi 17,2±1,4 anos, o que minimiza as repercussões da menarca sobre o estado nutricional destas, visto que é a proximidade entre a menarca e a gestação que potencializa tais repercussões. Entretanto, outros estudos também não encontraram essa associação.5,13,23
Apenas Azeredo e Trugo,12 ao analisarem o conteúdo de alfa‐tocoferol do leite maduro de adolescentes do sudeste do Brasil, concluíram que a concentração dessa vitamina no seu leite é menor, equivalendo a menos da metade do relatado para o leite de adultas em países em desenvolvimento. Porém, este estudo não utilizou um grupo controle de mulheres adultas, apenas comparou seus resultados aos de estudos com leite maduro de puérperas adultas.
A condição socioeconômica materna também parece não estar relacionada com a concentração de alfa‐tocoferol no leite. A relação entre essas variáveis foi estudada por alguns autores, que observaram que renda e nível educacional maternos não se associaram ao conteúdo de vitamina E do leite.5,13
No entanto, caso fossem realizados estudos em distintas localidades, comparando os extremos da categorização da condição socioeconômica, essas diferenças talvez pudessem aparecer, uma vez que em populações de extrema carência social a média de alfa‐tocoferol no leite é inferior quando comparada a populações com melhores condições de vida (tabela 1).
Paridade e idade gestacional do recém‐nascidoOs termos primípara e multípara são utilizados para designar nenhum parto anterior e pelo menos um parto anterior, respectivamente. Em alguns mamíferos, o número de partos está diretamente relacionado com o aumento dos níveis de vitamina E no leite. Uma possível explicação para este fato é a maior mobilização dos tecidos que contêm o alfa‐tocoferol, como o adiposo.4
Alguns autores sugerem que a paridade pode influenciar os níveis de vitaminas como o retinol no leite materno quando a lactação prévia proporciona uma alta mobilização de suas reservas e alta transferência à glândula mamária. Essa mobilização também é influenciada pela adiposidade materna em multíparas, podendo contribuir para um maior conteúdo da vitamina no leite dessas mulheres.24 Tal hipótese pode ser estendida para o alfa‐tocoferol, uma vez que este, como o retinol, é uma vitamina lipossolúvel que fica estocada no tecido adiposo.
A maioria dos estudos encontrados sobre a relação entre a paridade e a concentração de alfa‐tocoferol no leite materno não encontraram associação entre essas variáveis.5,23,25 Porém, Campos,14 no Brasil, encontrou maiores quantidades no leite de transição de primíparas. Já no leite maduro, as multíparas apresentaram maior concentração da vitamina. Entretanto, são necessários mais estudos para esclarecer essa relação, uma vez que esse estudo foi realizado com um pequeno número amostral (nove primíparas e nove multíparas).
Outra variável cuja relação com a composição nutricional do leite humano foi estudada é a idade gestacional do recém‐nascido. Neonatos prematuros (abaixo de 37 semanas de gestação) estão mais expostos ao risco de desenvolvimento da deficiência de vitamina E porque necessitam de uma maior oferta de nutrientes antioxidantes, devido à exposição ao estresse oxidativo causado por infecções, oxigênio, ventilação mecânica e nutrição intravenosa. O lactente prematuro com deficiência de vitamina E apresenta baixos níveis de hemoglobina, alterações morfológicas, como anisocitose e eritrócitos fragmentados, resposta reticulocitária, aumento do número de plaquetas e hiperbilirrubinemia.26
Apesar da hipótese de haver diferenças na concentração de vitamina E dependendo da duração da gestação, estudos não encontraram esse resultado.10,23,27 Quiles et al.,8 entretanto, em seu estudo com mulheres da Espanha, observaram que o leite de mães de neonatos a termo possuía quantidades significativamente maiores da vitamina, em todas as fases de lactação (p<0,05).
Esses dados conflitantes mostram a necessidade de realização de mais estudos a respeito da concentração de vitamina E no leite de mães de recém‐nascidos pré‐termo, uma vez que a transferência placentária dessa vitamina durante a gestação é limitada.28 Essa limitação torna ainda mais essencial o suprimento de alfa‐tocoferol através do leite, principalmente para prematuros, cujo tempo de gestação e, portanto, de transferência de nutrientes para o feto através da placenta, é ainda menor.
Estado nutricional bioquímico em alfa‐tocoferol e estado nutricional antropométrico maternoA maioria dos estudos que avaliaram a relação entre a concentração de alfa‐tocoferol no sangue e leite maternos mostra que essa correlação não existe no leite colostro e leite maduro,12,15,23,29–32 apontando para uma provável limitação da transferência da vitamina do plasma para a glândula mamária.
No Brasil, Dimenstein et al.32 analisaram a associação entre o alfa‐tocoferol do soro e colostro em condições de jejum e pós‐prandial e concluíram que a correlação entre o alfa‐tocoferol do colostro em jejum e no pós‐prandial e a ausência de correlação entre soro e colostro exclui a existência de mecanismos de transferência passiva durante a passagem da vitamina E para o leite. De acordo com os autores, provavelmente existem mecanismos de transporte distintos dessa vitamina para a glândula mamária, que independem da concentração plasmática.
Apesar de os mecanismos envolvidos na absorção do alfa‐tocoferol pela glândula mamária não estarem completamente esclarecidos, acredita‐se que parte do alfa‐tocoferol chegue ao leite através da via de receptores para LDL, e outra parte pode ser transportada através de receptores de superfície celular (SR‐B1) que ligam HDL e LDL sem internalização da lipoproteína. Existe ainda a sugestão da via da lipase lipoproteica (LPL), como observado em experimentos com ratos.3,33 Além disso, um estudo com vacas mostrou que a secreção de alfa‐tocoferol para o leite segue a cinética de Michaelis‐Menten, isto é, a sua passagem do sangue para o leite ocorre por meio de transporte ativo através de membranas, não havendo aumento adicional da secreção dessa vitamina no leite uma vez que a capacidade de secreção máxima tenha sido alcançada.34
Dimenstein et al.29 ressaltam que a sugestão de mecanismos de transporte distintos e o fato de não haver relação entre o alfa‐tocoferol do soro e do colostro em condições de suplementação reforçam a hipótese de que a glândula mamária pode expressar a proteína alfa‐TPP, transportadora de alfa‐tocoferol. Azeredo e Trugo12 também sugerem que o transporte de vitamina E para o leite pode envolver receptores de membrana e intracelulares para alfa‐TTP no epitélio mamário.
No estudo de Garcia et al.,15 entretanto, foi encontrada correlação positiva entre o estado nutricional bioquímico em alfa‐tocoferol e sua concentração no leite de transição (r=0,456, p=0,009), evidenciando a importância de um adequado estado nutricional materno. Um estudo realizado na Rússia também mostrou essa correlação.10 Entretanto, tal relação foi estudada apenas no leite de mães de recém‐nascidos pré‐termo e o número amostral foi pequeno (13 mulheres).
Segundo Garcia et al.,15 a presença de relação entre o alfa‐tocoferol do soro e do leite somente na fase de transição indica que os mecanismos de transporte da vitamina para o colostro são mais complexos, envolvendo, provavelmente, outras vias de transporte além daquelas que são predominantes no leite de transição e maduro. Nota‐se que há um campo aberto para estudos que avaliem a associação entre a concentração de vitamina E no plasma e leite maternos, principalmente no colostro e leite maduro.
Em relação ao estado nutricional antropométrico materno durante a gestação, o indicador mais utilizado para verificar sua associação com o alfa‐tocoferol do leite é o Índice de Massa Corpórea (IMC). A hipótese de que o IMC materno possa estar relacionado ao conteúdo da vitamina no leite parte do princípio de que este indicador, na maioria das vezes, é proporcional ao conteúdo de gordura corporal. Portanto, sendo o tecido adiposo um local de reserva de alfa‐tocoferol, a vitamina armazenada neste tecido e, consequentemente, liberada no leite, poderia ser maior quanto maior fosse a adiposidade da lactante.
Entretanto, nenhum estudo revelou relação entre a variável IMC e a vitamina no leite materno.5,12,13,23 Assim, os resultados encontrados mostram que os níveis de alfa‐tocoferol no leite parecem ser independentes da massa corpórea materna.
Ingestão dietética habitual e suplementação materna com vitamina EUma variável amplamente estudada por pesquisadores que analisaram a vitamina E no leite é a ingestão dietética materna do micronutriente, com objetivo de entender se a dieta influencia na composição nutricional do leite materno.
Antonakou et al.,21 na Grécia, questionaram mulheres no pós‐parto sobre o consumo de alimentos que são fontes de vitamina E através de três recordatórios alimentares. Os resultados indicaram que a ingestão de vitamina E parece não ter efeito sobre a sua concentração no leite materno, o que é corroborado pelo fato de que, apesar da ingestão média da vitamina pelas mulheres ter sido menor que a recomendada, o conteúdo do micronutriente no leite mostrou alcançar as recomendações para lactentes.
No Canadá, Bishara et al.35 utilizaram um questionário de frequência do consumo alimentar semiquantitativo para avaliação da ingestão de vitamina E de mães de recém‐nascidos prematuros de baixo peso. Nesse estudo, também não foi encontrada relação entre a ingestão de alfa‐tocoferol e sua concentração no leite.
Szlagatys‐Sidorkiewicz et al.,9 baseados em um diário nutricional de três dias feito por 49 mulheres polonesas, observaram que a concentração de vitamina E no leite materno não foi correlacionada com sua respectiva ingestão dietética. Nesse estudo, a concentração de vitamina E no leite também não foi maior em mulheres que receberam suplementos vitamínicos recomendados para gestantes e lactantes, em comparação àquelas que não receberam (p=0,332). Também na Polônia, Martysiak‐Zurowska et al.17 obtiveram resultados semelhantes, não havendo correlação entre a ingestão dietética de vitamina E e o uso de suplementos com a concentração de alfa‐tocoferol no leite materno.
Outro estudo, ao analisar o leite materno de mulheres da Rússia que utilizaram complexos de vitaminas contendo alfa‐tocoferol na gestação e lactação, também não encontrou diferença na concentração da vitamina no leite dessas mulheres, em comparação àquelas que não usaram multivitamínicos.10 No entanto, um estudo no Canadá concluiu que houve uma correlação positiva entre a vitamina E encontrada no leite e a suplementação multivitamínica relatada pelas participantes da pesquisa.36
Dimenstein et al.,29 ao analisarem o tocoferol no leite de 30 mulheres adultas no Nordeste do Brasil, viram que a suplementação com uma cápsula contendo vitamina E sintética (49,4mg de dl‐alfa‐tocoferol) não levou a um aumento na concentração da vitamina no colostro 24 horas após a suplementação. Segundo os autores, isso indica que a passagem dessa vitamina é limitada e levanta a questão da validade de se ofertar suplementos contendo vitamina E com misturas racêmicas.
No entanto, em seu estudo na mesma população brasileira, Garcia et al.,30 utilizando um grupo suplementado e outro não suplementado, observaram que 24 horas após a suplementação com a cápsula supracitada houve um aumento significativo na quantidade de alfa‐tocoferol do colostro do grupo suplementado (p=0,04), o que não ocorreu no controle. Assim, o fato de Dimenstein et al.29 não terem encontrado influência da suplementação pode ter sido causado pela ausência de grupo controle no estudo, uma vez que o conteúdo de alfa‐tocoferol no colostro tende a diminuir ao longo dos primeiros dias de lactação. Portanto, a concentração da vitamina no leite no dia posterior à suplementação deveria ter sido comparada à concentração referente ao mesmo período de um grupo controle não suplementado, e não à concentração do mesmo grupo no dia anterior à suplementação, que é normalmente maior.
A cápsula ofertada às mulheres dos dois estudos acima citados continha também uma superdose de vitamina A. De acordo com Green et al.,37 em situações de suplementação, a transferência de vitamina A para a glândula mamária também ocorre via quilomícrons e depende do sítio de ligação destes e da lipólise dos triacilgliceróis, via ação da LPL. Garcia et al.30 supõem, portanto, que esse aumento de quilomícrons circulantes, com o aumento da atividade da LPL na glândula mamária, favoreceu também a captação do alfa‐tocoferol presente na cápsula ou do tocoferol dietético, por aumentar sua biodisponibilidade.
Clemente25 também encontrou quantidades significativamente maiores de alfa‐tocoferol no colostro de puérperas brasileiras suplementadas no pós‐parto, tanto com alfa‐tocoferol natural quanto sintético, quando comparou a um grupo controle não suplementado. É importante destacar que 24 horas após a suplementação, as mulheres suplementadas com a forma natural tiveram 101% mais vitamina no colostro do que as mulheres do grupo controle, enquanto as puérperas do grupo que recebeu a suplementação sintética tinham apenas 51,6% a mais, mostrando uma maior eficácia da suplementação natural em relação à sintética.
A partir dos resultados dos estudos citados, pode‐se concluir que a ingestão dietética materna de vitamina E através da dieta habitual não afeta a concentração da vitamina no leite das lactantes. Entretanto, em situações de suplementação, estudos mostram um aumento dos níveis de alfa‐tocoferol no leite materno (principalmente quando esta é feita no pós‐parto), enquanto outros autores não observaram essa relação.
Assim, os reais efeitos da suplementação sobre a concentração de tocoferol do leite materno ainda são desconhecidos, existindo uma grande necessidade de novos estudos que investiguem essa relação. Além disso, é importante observar qual o tipo de suplemento ofertado, uma vez que, dependendo da forma química, a absorção pode ser ou não favorecida.
Considerações finaisO conhecimento dos fatores que podem exercer influência sobre o conteúdo de vitamina E do leite humano pode fornecer embasamento importante para a prevenção da sua deficiência em puérperas e lactentes, uma vez que algumas dessas variáveis podem ser controladas.
A partir desta revisão, foi visto que a concentração de alfa‐tocoferol tende a diminuir à medida que o leite vai se tornando maduro. A paridade, o estado nutricional antropométrico, a condição socioeconômica e a ingestão dietética habitual de vitamina E da mãe parecem não afetar os níveis desse micronutriente no leite materno. Entretanto, variáveis como: idade materna, estado nutricional bioquímico em alfa‐tocoferol, idade gestacional e suplementação materna com vitamina E ainda demonstram controvérsias no que diz respeito à sua relação com o conteúdo de vitamina E do leite humano, havendo a necessidade de mais estudos.
No entanto, é importante destacar que, na maioria dos estudos onde foi encontrada associação entre essas variáveis, esta não ocorreu no leite colostro, mas nos leites de transição e maduro. Isso aponta para uma possível homeostasia do leite durante a secreção do colostro, no qual, na maioria dos casos, a concentração de alfa‐tocoferol não varia, independentemente dos fatores influenciantes. Esse fato destaca a essencialidade da alimentação do recém‐nascido nos primeiros dias pós‐parto, o que irá fornecer uma importante defesa antioxidante e garantir o bom desenvolvimento do seu sistema imunológico, pois o colostro possui alta concentração de alfa‐tocoferol. Além disso, a redução do conteúdo da vitamina no leite de transição e maduro apontam para a necessidade de se rever as recomendações de ingestão de vitamina E para lactentes, uma vez que as recomendações atuais não são atingidas pelos leites nessas fases da lactação em algumas populações estudadas.
Conflitos de interesseOs autores declaram não haver conflitos de interesse.
A Heleni Aires Clemente, pelas contribuições e sugestões de aperfeiçoamento deste trabalho.
Como citar este artigo: Lima MS, Dimenstein R, Ribeiro KD. Vitamin E concentration in human milk and associated factors: a literature review. J Pediatr (Rio J). 2014;90:440–8.
Estudo realizado na Universidade Federal do Rio Grande do Norte (UFRN), Natal, RN, Brasil.