To evaluate the effectiveness of videothoracoscopic surgery in the treatment of complicated parapneumonic pleural effusion and to determine whether there is a difference in the videothoracoscopic surgery outcome before or after the chest tube drainage.
MethodsThe medical records of 79 children (mean age 35 months) undergoing videothoracoscopic surgery from January 2000 to December 2011 were retrospectively reviewed. The same treatment algorithm was used in the management of all patients. Patients were divided into two groups: in group 1, videothoracoscopic surgery was performed as the initial procedure; in group 2, videothoracoscopic surgery was performed after previous chest tube drainage.
ResultsVideothoracoscopic surgery was effective in 73 children (92.4%); the other six (7.6%) needed another procedure. Sixty patients (75.9%) were submitted directly to videothoracoscopic surgery (group 1) and 19 (24%) primarily underwent chest tube drainage (group 2). Primary videothoracoscopic surgery was associated with a decrease of hospital stay (p = 0.05), time to resolution (p = 0.024), and time with a chest tube (p < 0.001). However, there was no difference between the groups regarding the time until fever resolution, time with a chest tube, and the hospital stay after videothoracoscopic surgery. No differences were observed between groups regarding the need for further surgery and the presence of complications.
ConclusionsVideothoracoscopic surgery is a highly effective procedure for treating children with complicated parapneumonic pleural effusion. When videothoracoscopic surgery is indicated in the presence of loculations (stage II or fibrinopurulent), no difference were observed in time of clinical improvement and hospital stay among the patients with or without chest tube drainage before videothoracoscopic surgery.
Avaliar a eficácia da cirurgia torácica videoassistida no tratamento de derrame pleural parapneumônico complicado e determinar se há diferença no resultado da cirurgia torácica videoassistida realizada antes ou depois da drenagem torácica.
MétodosAnalisamos retrospectivamente prontuários médicos de 79 crianças (idade média de 35 meses) submetidas a cirurgia torácica videoassistida de janeiro de 2000 a dezembro de 2011. O mesmo algoritmo de tratamento foi utilizado no manejo de todos os pacientes. Os pacientes foram divididos em dois grupos: o Grupo 1 foi submetido a cirurgia torácica videoassistida como procedimento inicial; o Grupo 2 foi submetido a cirurgia torácica videoassistida após drenagem torácica prévia.
ResultadosA cirurgia torácica videoassistida foi eficaz em 73 crianças (92,4%); as outras seis (7,6%) necessitaram outro procedimento. Sessenta pacientes (75,9%) foram diretamente submetidos a cirurgia torácica videoassistida (Grupo 1) e 19 (24%) foram primeiramente submetidos a drenagem torácica (Grupo 2). A cirurgia torácica videoassistida primária foi associada à redução do tempo de internação (p = 0,05), do tempo para resolução (p = 0,024) e do tempo com o tubo torácico (p < 0,001). Contudo, não houve diferença entre os grupos a respeito do tempo até que não tivessem mais febre, do tempo com o tubo torácico e do tempo de internação após a cirurgia torácica videoassistida. Não foram observadas diferenças entre os grupos com relação à necessidade de cirurgia adicional e à presença de complicações.
ConclusõesA cirurgia torácica videoassistida é um procedimento altamente eficaz para tratar crianças com derrame pleural parapneumônico complicado. Quando a cirurgia torácica vídeoassistida é indicada na presença de loculações (fase II ou fibrinopurulenta) não há diferença no tempo de melhora clínica e no tempo de internação entre os pacientes com ou sem drenagem torácica antes da cirurgia torácica videoassistida.
Uma estimativa recentemente publicada pela Organização Mundial de Saúde (OMS)1 mostra o Brasil entre os 15 países com o maior número absoluto de novos casos de pneumonia por ano (1,8 milhão), com uma incidência estimada de 0,11 episódio por criança/ano. A pneumonia bacteriana em crianças normalmente é acompanhada de derrame pleural,2 presente em 40% dos casos,3 dos quais 5 a 10% poderão avançar para derrame pleural complicado e/ou empiema.4 Com base nesses dados, estima‐se que de 14.000 a 20.000 novos casos de derrame pleural complicado ocorram em crianças todo ano no Brasil.
O derrame pleural parapneumônico (DPP) é considerado complicado (DPPC) quando o tratamento apenas com antibióticos é insuficiente e um procedimento cirúrgico3 é necessário para uma drenagem adequada do espaço pleural infectado. O fluido pleural nessa condição é caracterizado por estudos bacterianos positivos, um nível de glicose abaixo de 40mg/dL, um pH abaixo de 7,0 e loculação progressiva do fluido pleural.5
A controvérsia permanece sobre o assunto do tratamento ideal de DPPC pediátrico.6,7 As opções de tratamento variam de drenagem torácica (DT) simples, com ou sem instilação de fibrinolítico, cirurgia torácica videoassistida (CTVA) menos invasiva até toracotomia e decorticação do pulmão mais invasivas, o tratamento intermediário é representado pela minitoracotomia.8 A escolha de intervenção cirúrgica normalmente depende do quadro clínico do paciente, da fase do DPPC no diagnóstico, da especialização e da experiência da equipe local.9 Seria considerado que a opção de tratamento tem implicações econômicas substanciais.10 A influência da escolha e do momento das diferentes opções terapêuticas na duração da doença e no tempo de internação ainda não está clara.11
A CTVA é uma opção eficaz para desbridamento pleural em casos de derrame loculado ou septado, permite a limpeza do espaço pleural infectado sob visão direta e completa expansão do pulmão, assim prevene a morbidez associada à toracotomia convencional. Quando indicada, ela se mostra eficaz no tratamento de empiema, com uma taxa de sucesso geral de 83 a 97%, é associada a menos dor no pós‐operatório, ao tempo de internação mais curto e a melhores resultados cosméticos.12,13 Contudo, a questão a respeito do momento ideal para fazer o procedimento permanece. Alguns autores sugerem que a CTVA deve ser feita logo após o diagnóstico de DPP,14 ao passo que outros sugerem esperar alguns dias.15 Outra opção de manejo é a DT, com ou sem fibrinolítico, como procedimento inicial, deixar a CTVA para os pacientes que não apresentarem evolução clínica favorável com a drenagem torácica.13,16–18
Este estudo tem como objetivo relatar a experiência com CTVA no tratamento de crianças com DPPC, para determinar sua eficácia e a influência ou não do uso de DT inicial no resultado da CTVA.
MétodosAnálise retrospectiva de prontuários médicos de todas as crianças entre um mês e 12 anos com diagnóstico de DPPC submetidas a CTVA no Hospital de Clínicas de Porto Alegre (HCPA) e no Hospital Moinhos de Vento (HMV), em Porto Alegre, sul do Brasil, entre janeiro de 2000 e dezembro 2011. O estudo foi aprovado pelo Conselho de Revisão Institucional do HCPA (número 100166) e do HMV (número 185999).
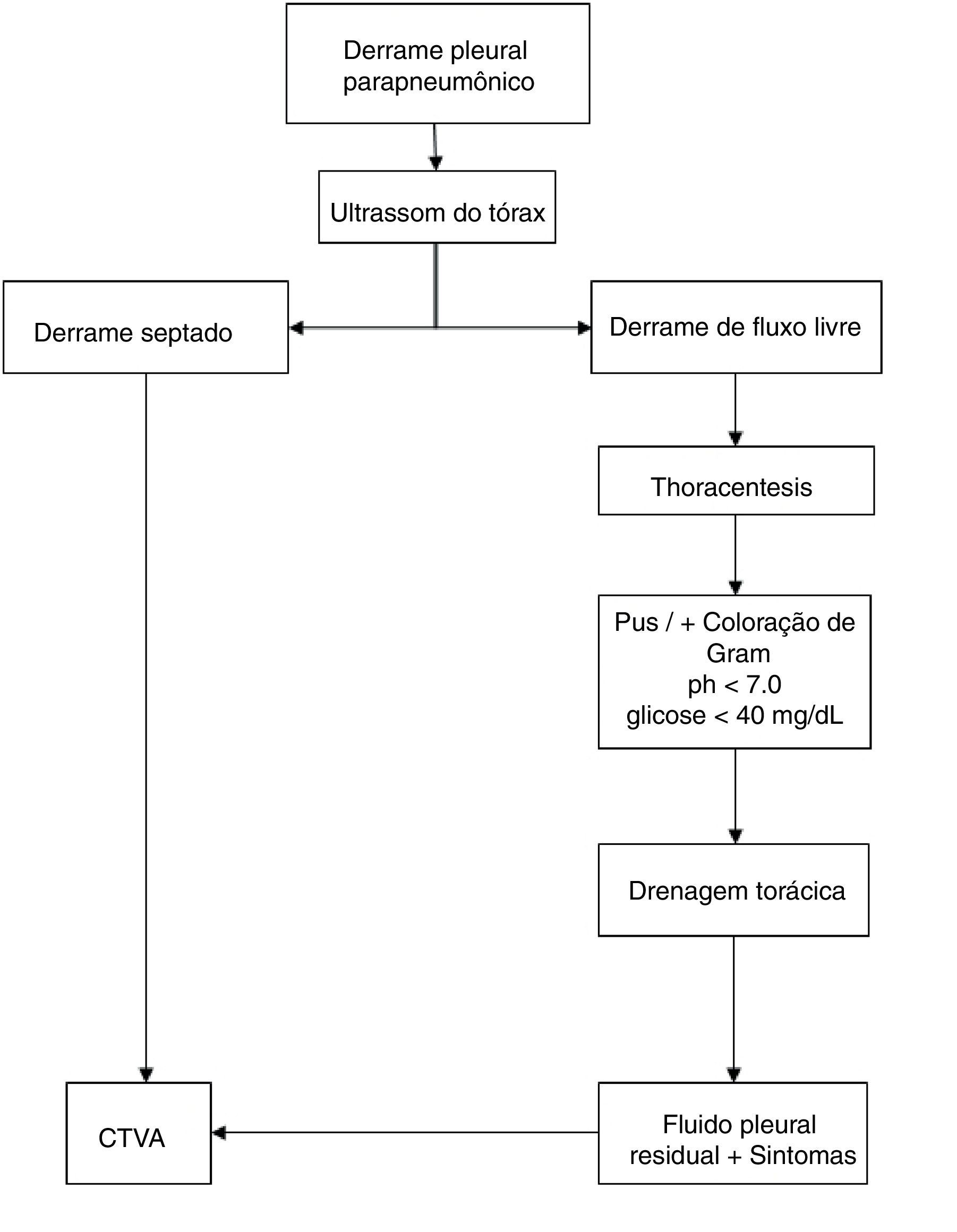
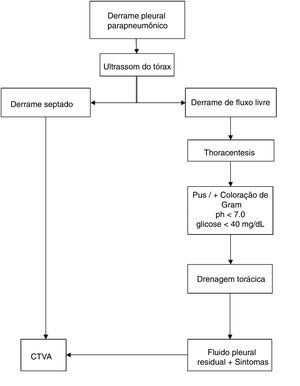
O diagnóstico de DPPC foi feito segundo bases clínicas (febre, dispneia ou deterioração do estado geral) e confirmado por meio de avaliação radiológica, toracocentese e estudos de ultrassom. O DPPC foi considerado quando havia pus na análise macroscópica, pela presença de septações ou loculações pleurais no ultrassom ou pela análise bioquímica que mostrou pH < 7,0 ou glicose < 40mg/dL e presença de bactérias na coloração e/ou cultura de Gram. O mesmo algoritmo de tratamento foi usado no manejo de DPPC (fig. 1)12 e todos os pacientes tomaram antibióticos intravenosos.
Crianças com imunodeficiência, derrame tuberculoso e paralisia cerebral grave associada a refluxo gastroesofágico e distúrbios de deglutição foram excluídas do estudo.
No estudo, os pacientes foram divididos em dois grupos: CTVA primária ou secundária. A indicação de DT primária foi DPPC com fluido pleural sem derrame septado ou loculado no ultrassom; a indicação de CTVA como procedimento inicial (primário) foi a presença de febre persistente ou pioria do estado do paciente, acompanhada de derrame pleural septado ou loculado no ultrassom. A indicação de CTVA secundária após DT foi a presença de fluido residual após a drenagem, acompanhada de sintomas de febre, pioria do estado ou da sepse do paciente, com septações ou loculações no ultrassom.
Um formulário de dados padronizado foi preenchido para cada paciente. O tempo para resolução foi calculado pela soma do intervalo (em dias) entre o diagnóstico de derrame pleural e a internação hospitalar com o tempo de internação. A falha no tratamento foi definida como a necessidade de intervenções cirúrgicas adicionais após a CTVA.
Todos os procedimentos cirúrgicos foram feitos ou supervisionados pelo mesmo cirurgião (JCF), de acordo com a técnica descrita anteriormente.12 Os analgésicos adequados foram administrados para todos os pacientes por meio de blocos do nervo intercostal e analgesia intravenosa com morfina.
Os dados quantitativos foram expressos como média ou mediana e as variáveis categóricas, como percentual. As variáveis foram comparadas pelo teste t de Student, teste de Wilcoxon‐Mann‐Whitney, teste exato de Fisher ou teste qui‐quadrado de Pearson. Os valores de p < 0,05 foram considerados estatisticamente significativos. Os dados foram analisados com o Pacote Estatístico para as Ciências Sociais (SPSS) (Stata Software de Estatística, versão 17. College Station, TX, EUA).
ResultadosForam incluídas na análise 79 crianças, 41 (51,9%) do sexo masculino e 38 (48,1%) do feminino. Sessenta e dois (78,5%) pacientes foram operados no HCPA e 17 (21,5%) no HMV. A idade variou de dois a 137 meses (média, 35 meses). A faixa de peso foi de 5,14 a 48kg (média, 15,0kg). Dez crianças (12,6%) apresentaram uma ou mais doenças associadas, a asma foi a mais comum. O intervalo entre o acometimento de sintomas e a internação hospitalar variou de um a 11 dias. Trinta e seis (45%) pacientes tomaram antibióticos antes da internação.
Quarenta e sete (60%) crianças apresentaram derrame do lado direito. Trinta e quatro (43%) pacientes tiveram derrames extensos (mais de 1/3 do hemitórax). Dos 79 pacientes analisados, dois (2,5%) não passaram por exame de ultrassom e oito (10%) precisaram de tomografia computadorizada (TC) do tórax. O exame bacteriológico do fluido pleural, a hemocultura e a cultura do fluido pleural foram feitos em todas as crianças. Um agente etiológico no fluido pleural foi detectado em 22 (27,8%) crianças; Streptococcus pneumoniae em 14 (17,7%); Staphylococcus aureus em sete (8,9%) e uma haste Gram‐negativa em um (1,3%).
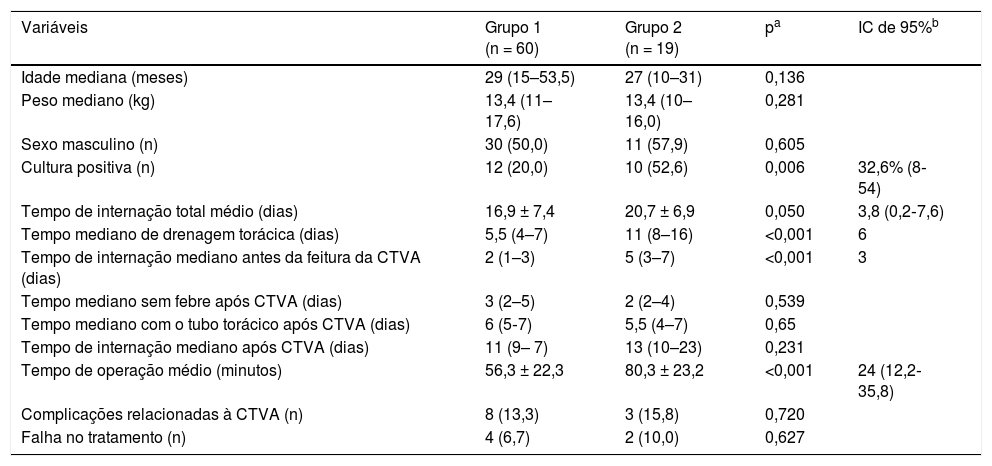
A tabela 1 apresenta a comparação entre a CTVA primária e a CTVA secundária (após DT). Sessenta pacientes (75,9%) foram submetidos diretamente à CTVA (Grupo 1). A CTVA primária reduziu o tempo de internação em 3,8 dias (p = 0,05), o tempo para resolução em 4,4 dias (p = 0,024) e o tempo da DT em seis dias (p < 0,001). A DT foi feita antes da CTVA (Grupo 2) em 19 crianças (24%). A DT feita antes da CTVA aumentou o tempo da operação em 24 minutos (p < 0,001) e resultou em um atraso de três dias na feitura da CTVA (p < 0,001). Contudo, ao avaliar o resultado após a CTVA, observamos que o tempo até o estado afebril, o tempo de drenagem torácica e o tempo de internação não apresentaram diferença significativa, com um comportamento semelhante nos resultados clínicos em ambos os grupos. As taxas de complicação e falha no tratamento foram semelhantes nos dois grupos.
Comparação entre crianças submetidas a CTVA primária (grupo 1) e secundária (grupo 2)
| Variáveis | Grupo 1 (n = 60) | Grupo 2 (n = 19) | pa | IC de 95%b |
|---|---|---|---|---|
| Idade mediana (meses) | 29 (15–53,5) | 27 (10–31) | 0,136 | |
| Peso mediano (kg) | 13,4 (11–17,6) | 13,4 (10–16,0) | 0,281 | |
| Sexo masculino (n) | 30 (50,0) | 11 (57,9) | 0,605 | |
| Cultura positiva (n) | 12 (20,0) | 10 (52,6) | 0,006 | 32,6% (8‐54) |
| Tempo de internação total médio (dias) | 16,9 ± 7,4 | 20,7 ± 6,9 | 0,050 | 3,8 (0,2‐7,6) |
| Tempo mediano de drenagem torácica (dias) | 5,5 (4–7) | 11 (8–16) | <0,001 | 6 |
| Tempo de internação mediano antes da feitura da CTVA (dias) | 2 (1–3) | 5 (3–7) | <0,001 | 3 |
| Tempo mediano sem febre após CTVA (dias) | 3 (2–5) | 2 (2–4) | 0,539 | |
| Tempo mediano com o tubo torácico após CTVA (dias) | 6 (5‐7) | 5,5 (4–7) | 0,65 | |
| Tempo de internação mediano após CTVA (dias) | 11 (9– 7) | 13 (10–23) | 0,231 | |
| Tempo de operação médio (minutos) | 56,3 ± 22,3 | 80,3 ± 23,2 | <0,001 | 24 (12,2‐35,8) |
| Complicações relacionadas à CTVA (n) | 8 (13,3) | 3 (15,8) | 0,720 | |
| Falha no tratamento (n) | 4 (6,7) | 2 (10,0) | 0,627 |
CTVA, cirurgia torácica videoassistida; IC de 95%, intervalo de confiança de 95%.
A CTVA foi eficaz em 73 (92,4%) crianças com DPPC. Seis (7,6%) pacientes precisaram de outros procedimentos cirúrgicos para resolução do DPPC. Duas crianças precisaram de uma drenagem pleural adicional e quatro precisaram de uma segunda CTVA. Três das crianças submetidas a uma segunda CTVA apresentaram boa resolução e uma precisou passar por toracotomia aberta. As crianças que precisaram passar por procedimentos cirúrgicos adicionais apresentaram tempo de internação e resolução prolongado, com duração média do tempo de internação de 30 dias (p < 0,001) e tempo adicional com tubo torácico duas vezes maior em comparação com pacientes sem falhas no tratamento (p = 0,011).
Onze (13,9%) pacientes apresentaram complicações relacionadas à CTVA: enfisema subcutâneo (n = 5), diminuição intraoperatória na saturação de oxigênio (n = 3), pequeno pneumotoráx pós‐operatório (n = 1), transfusão sanguínea intraoperatória (n = 1) e fístula broncopleural (n = 1). Todos se recuperaram muito bem e nenhuma morte foi observada durante o estudo e o acompanhamento pós‐operatório.
DiscussãoOs resultados demonstram que a CTVA é um procedimento seguro e eficaz em pacientes pediátricos com DPPC. A eficácia da CTVA foi de 92,4%, taxa dentro da faixa relatada na literatura.12,13,19–21 Kern & Rodgers22 foram os primeiros cirurgiões pediátricos a relatar a eficácia da CTVA no tratamento de crianças com empiema pleural. Desde então, a CTVA tem sido cada vez mais usada e atualmente desempenha um papel importante no tratamento de DPPC. Considerando a melhoria de materiais e técnicas cirúrgicas minimamente invasivas, a necessidade de fazer a toracotomia convencional tem diminuído, é usada apenas como um tratamento de resgate em casos complexos com aprisionamento pulmonar ou no tratamento de fístula broncopleural com piopneumotórax.23
A CTVA tem sido usada com sucesso como tratamento inicial de DPPC desde 1993,22 resulta na resolução completa do empiema e no tempo de internação mais curto do que no caso do tratamento feito apenas com drenagem torácica.14 Contudo, a indicação e o momento ideal da CTVA ainda são controversos. Kalfa et al.19 demonstraram que um intervalo de quatro dias entre o diagnóstico de DPPC e a cirurgia é o principal fator que contribui para a eficácia do tratamento de toracotomia de empiema pleural em crianças. Esse poderá ser considerado o momento ideal da CTVA porque, de acordo com a fisiopatologia do DPPC, corresponde ao início da fase fibrinopurulenta, na qual há deposição de fibrina no espaço pleural, que levando à septação e à formação de loculações.
Entretanto, algumas séries retrospectivas relataram resultados de sucesso com manejo primário não operatório.7 Além disso, foram publicados ensaios clínicos randomizados prospectivos que compararam opções de tratamento. Sonnappa et al.13 fizeram o primeiro ensaio clínico controlado e randomizado de DPPC pediátrico no Hospital Infantil Great Ormond Street, em Londres. Os autores então compararam a CTVA com drenagem torácica e infusão de uroquinase. Não encontraram diferença significativa no tempo de internação, nos dias com o tubo torácico nem na presença de febre após a intervenção. Resultados semelhantes foram obtidos por St Peter et al.16 nos Estados Unidos. Mais recentemente, na Espanha, Marhuenda et al.18 publicaram um ensaio clínico randomizado multicêntrico que compara 53 pacientes submetidos a CTVA e 50 pacientes tratados com infusão torácica e de uroquinase. Como nos estudos anteriores, não houve diferença no tempo de internação após a intervenção, no tempo de internação total, nos dias de febre após a intervenção nem na taxa de falha, porém foram observados menos dias de DT no grupo de CTVA em comparação com o grupo de uroquinase. Em 2011, na Turquia, Cobanoglu et al.,24 em um estudo randomizado, compararam 27 pacientes submetidos a CTVA com 27 pacientes com tubo de toracotomia e infusão de estreptoquinase. Constataram que os pacientes tratados com CTVA apresentaram um tempo de internação geral significativamente mais curto. Por fim, em 2016, um grande estudo de vigilância nacional prospectivo, na Alemanha,6 não observou diferença no tempo de internação e na taxa de falha após o diagnóstico de DPPC em crianças tratadas com terapia fibrinolítica intrapleural ou CTVA.
A evidência atual sugere que o manejo com CTVA e o manejo não operatório com DT e instilação de fibrinolítico têm igualmente apresentado sucesso, tanto que as diretrizes da Sociedade Torácica Britânica consideram ambas as abordagens como opções paralelas.3 Em uma pesquisa nacional muito recente feita nos Estados Unidos, também houve desacordo quanto ao método de drenagem ideal de primeira linha, quando indicado, com 37,1% entrevistados com preferência pelo tubo de toracotomia com um agente fibrinolítico, em comparação com 36,9% entrevistados com preferência pelo tubo de toracotomia com CTVA.9 Portanto, é razoável tratar pacientes com qualquer uma das estratégias de tratamento com base na especialização e nas taxas de sucesso locais.7
A CTVA é o procedimento que escolhemos no tratamento de DPPC devido a diversas vantagens. A CTVA permite, sob visão direta, o rompimento de loculações, desbridamento e drenagem do espaço pleural infectado, garante total expansão do pulmão.12 A CTVA foi comparada com a drenagem torácica no tratamento de DPPC, demonstrou tempo de internação mais curto, redução no uso de antibióticos e narcóticos, número menor de dias de drenagem torácica, além de custos hospitalares mais baixos e redução em procedimentos de imagem e intervenção.24–28 Além disso, no Brasil, a uroquinase não está comercialmente disponível e o alteplase (ativador do plasminogênio tecidual) é muito caro.
Em nossos resultados, ao comparar pacientes submetidos a CTVA primária ou secundária, não observamos diferença entre os grupos, exceto no tempo da operação, que foi maior no grupo de CTVA após DT. Assim, acreditamos que quando a CTVA é indicada na presença de loculações ou septações, o resultado tende a ser o mesmo, independentemente da DT ter sido feita inicialmente. Nossa impressão reside no fato de que indicamos o procedimento com base na evolução patofisiológica da doença, ou seja, CTVA na fase II (quando a DT não pode remover todo o material fibrinopurulento). A DT deve ser indicada na primeira fase de DPPC, com derrame de fluxo livre, sem loculação ou septação do fluido pleural. Acreditamos que esses critérios reflitam melhor a evolução do DPPC do que aspectos temporais isolados.
Uma limitação deste estudo é o fato de que os dados foram coletados retrospectivamente de duas instituições por um longo período. Contudo, o mesmo algoritmo de tratamento e a mesma técnica operativa foram usados no manejo de todos os pacientes. Como o grupo com falha no tratamento era pequeno, não foi possível identificar, devido à falta de poder estatístico, fatores preditivos de falha da CTVA. Apesar de as crianças no grupo 1 apresentarem significativamente mais cultura positiva, isso poderia indicar uma doença mais ativa no momento da inserção do tubo de DT. Isso poderá causar algum viés nos resultados com relação ao tempo para resolução e ao tempo de internação.
A comparação da CTVA para DPPC com ou sem DT prévia não mostrou diferença na eficácia da CTVA ou no período após a intervenção. Nossos dados não comprovam relatórios anteriores que afirmam que a CTVA no prazo de quatro dias é fundamental para a eficácia da CTVA. Acreditamos que quando há indicação padronizada de CTVA, como a presença de septações e/ou loculações, quaisquer diferenças relacionadas ao curso clínico desses pacientes não serão significativas.
Conflitos de interessesOs autores declaram não haver conflitos de interesses.
Como citar este artigo: Knebel R, Fraga JC, Amantéa SL, Isolan PB. Videothoracoscopic surgery before and after chest tube drainage for children with complicated parapneumonic effusion. J Pediatr (Rio J). 2018;94:140–145.
Trabalho desenvolvido na Universidade Federal do Rio Grande do Sul (UFRGS), Faculdade de Medicina, Programa de Pós‐Graduação em Medicina: Ciências Cirúrgicas, Porto Alegre, RS, Brasil.