This review aimed to organize and consolidate the latest knowledge about mutations and genetic polymorphisms related to hereditary thrombophilia and their potential association with pediatric stroke and cerebral palsy (CP).
SourcesScientific articles published from 1993 to 2013, written in Portuguese, English, French, and Spanish, were selected and reviewed. The publications were searched in electronic databases, and also in the collections of local libraries. The terms “hereditary thrombophilia”, “polymorphisms”, “mutation”, “pediatric strokes”, and “cerebral palsy” were used for the research.
Summary of the findingsThe search in databases and in the bibliographic references retrieved 75 articles for inclusion in this review. Studies that investigated hereditary thrombophilias and their associations to CP and arterial and venous pediatric stroke presented contradictory results. The meta‐analysis and case‐control studies that showed positive results for this association described only slightly increased relative risks and sometimes had questionable conclusions. The association of two or more hereditary thrombophilias, or the association between thrombophilia and other specific clinical risk factors, suggest a higher risk of CP and pediatric stroke than isolated hereditary thrombophilia.
ConclusionsLarger, multicenter studies should be developed in order to elucidate the role of mutations leading to hereditary thrombophilia and the development of CP and pediatric stroke. The complex and multifactorial etiology of CP and stroke makes this an arduous and difficult task; however, the benefits generated by these studies are immeasurable.
Sistematizar e integrar os últimos conhecimentos sobre mutações e polimorfismos genéticos relacionados às trombofilias hereditárias e suas potenciais associações com acidentes vasculares cerebrais pediátricos (AVC) e paralisia cerebral (PC).
MaterialArtigos científicos publicados de 1993 a 2013, escritos em português, inglês, francês e espanhol foram selecionados e revisados. As publicações foram pesquisadas nas bases de dados eletrônicas, como também nos acervos das bibliotecas locais. Os termos mutação, polimorfismos, trombofilias hereditárias, acidentes vasculares cerebrais pediátricos e paralisia cerebral foram usados para a pesquisa.
ResultadosA pesquisa nas bases de dados e nas referências bibliográficas identificou 75 artigos para inclusão nesta revisão. Os estudos que investigaram as trombofilias hereditárias e suas associações à PC e aos AVC pediátricos arteriais e venosos apresentaram resultados contraditórios. As metanálises e os estudos caso‐controle que demonstraram resultados positivos para essa associação descreveram riscos relativos discretamente aumentados e, algumas vezes, questionáveis. A associação de duas ou mais trombofilias hereditárias, ou a junção de trombofilias específicas com demais fatores de riscos clínicos, sugerem maior risco no aparecimento da PC e do AVC pediátrico do que as trombofilias hereditárias isoladas.
ConclusãoEstudos multicêntricos de grande porte devem ser conduzidos para elucidar o papel real das mutações que levam às trombofilias hereditárias e ao aparecimento da PC e AVC pediátricos. A etiologia multifatorial e complexa da PC e dos AVC torna essa tarefa árdua e difícil, porém, os benefícios gerados por esses estudos são incalculáveis.
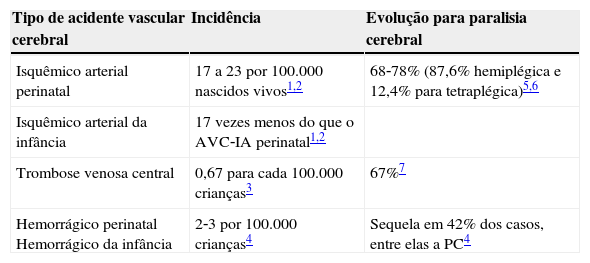
Mutações em genes associados à cascata da coagulação desencadeiam estados de hipercoagulabilidade (trombofilias hereditárias) que, em tese, aumentam o risco de acidentes vasculares cerebrais (AVC) e de paralisia cerebral (PC). Em crianças, a incidência dos diferentes tipos de AVC varia de 0,67 a 23 por 100.000 nascidos vivos e a evolução dessas lesões para a paralisia cerebral é bastante significativa1‐7 (tabela 1). A PC é a manifestação motora mais comum da infância e sua prevalência no Brasil é estimada em cerca de 30.000 a 40.000 novos casos por ano.8,9
Associação entre os AVC e a PC
| Tipo de acidente vascular cerebral | Incidência | Evolução para paralisia cerebral |
|---|---|---|
| Isquêmico arterial perinatal | 17 a 23 por 100.000 nascidos vivos1,2 | 68‐78% (87,6% hemiplégica e 12,4% para tetraplégica)5,6 |
| Isquêmico arterial da infância | 17 vezes menos do que o AVC‐IA perinatal1,2 | |
| Trombose venosa central | 0,67 para cada 100.000 crianças3 | 67%7 |
| Hemorrágico perinatal Hemorrágico da infância | 2‐3 por 100.000 crianças4 | Sequela em 42% dos casos, entre elas a PC4 |
As principais mutações associadas aos estados pró‐trombóticos são descritas no fator V Leiden, na protrombina G20210A, na metileno tetrahidrofolato redutase (C677T e A1298C), na proteína C, na proteína S, na antitrombina e na lipoproteína‐A.10 A fisiopatologia presumida para essas mutações está descrita na tabela 2.10‐12
Fisiopatologia presumida das mutações em genes relacionados à cascata de coagulação fatores de coagulação nos estados pró‐trombóticos
| Fatores | Fisiopatologia |
|---|---|
| Fator V Leiden | A mutação pontual do fator V torna‐o resistente à ação proteolítica da proteína C e leva a um aumento da geração da trombina. |
| PT G20210A | A mutação resulta em aumento nos níveis plasmáticos da protrombina, o que leva a um estado de hipercoagulabilidade. |
| MTHFR C677T | A mutação reduz a atividade da enzima e acarreta aumento nos níveis de homocisteína, que apresenta efeito pró‐trombótico. |
| Deficiência de ATIII | Serpina multifuncional que inibe enzimas da coagulação ativadas (IIa, iXa, Xa, XIa) na cascata da coagulação. |
| Deficiência de PROC | Proteína vitamina K dependente com ação anticoagulante. |
| Deficiência de PROS | Cofator da PROC, vitamina K dependente. |
| Elevação de lipoproteína‐A | Em função da sua homologia ao plasminogênio, esse reduz a geração da plasmina por competir com o plasminogênio para se ligar à fibrina. |
Fonte: Zadro & Herak, 201210. Adaptado.
O objetivo deste estudo foi revisar e integrar de forma sistemática as pesquisas que avaliaram as mutações e os polimorfismos em genes associados às trombofilias hereditárias e suas possíveis associações com os acidentes vasculares cerebrais pediátricos e a paralisia cerebral.
MetodologiaO estudo consistiu de uma revisão sistemática das principais publicações que descreveram mutações relacionadas às trombofilias hereditárias e suas potenciais associações com os acidentes vasculares cerebrais pediátricos e a paralisia cerebral.
As datas de publicação foram de 1993 a 2013 e os idiomas aceitos para leitura foram português, inglês, francês e espanhol. As pesquisas sobre o tema foram feitas nas bases de dados eletrônicas (Medline, PubMed, Scielo, Ovid, Web of Science, Elsevier Science Direct e Periódicos Capes) e nos acervos das bibliotecas da PUC‐Goiás e da Universidade Federal de Goiás. Os termos trombofilias hereditárias, mutações, polimorfismos, acidentes vasculares cerebrais pediátricos e paralisia cerebral foram usados para a pesquisa. A metodologia usada foi descrita por Green.13
Publicações do tipo metanálise, caso‐controle, estudos de séries e descrições de casos clínicos foram incluídas. As pesquisas nas bases de dados identificaram 1.731 artigos com potencial de inclusão na revisão. Após a leitura dos resumos foram selecionados 67 artigos para leitura integral, dos quais sete foram excluídos por não preencher os critérios de diagnóstico de PC ou por duplicidade. A busca das referências bibliográficas a partir dos estudos lidos resultou na inclusão de 15 novos artigos.
Os AVC pediátricos podem ser divididos em arteriais, isquêmicos e hemorrágicos e AVC venosos. Esses são também classificados em perinatais, quando ocorrem na gestação até 28 dias de vida, e da infância.1,2,14 De acordo com o Grupo Internacional de Trabalho para Definição e Classificação da Paralisia Cerebral de Maryland (2006), o termo paralisia cerebral (PC) descreve um grupo de desordens permanentes no desenvolvimento do movimento e da postura, que causa limitação de atividade, atribuída a distúrbios não progressivos que ocorreram no cérebro fetal ou infantil em desenvolvimento. As desordens motoras da paralisia cerebral são normalmente acompanhadas por distúrbios no sensório, percepção, cognição, comunicação e comportamento; e ainda, por epilepsia e problemas musculoesqueléticos secundários.15‐17
ResultadosA revisão bibliográfica selecionou artigos que investigaram potenciais associações entre as trombofilias hereditárias e a PC, ou entre as trombofilias hereditárias e os AVC pediátricos, incluindo AVC isquêmicos arteriais, AVC hemorrágicos e tromboses venosas cerebrais (TVC). A pesquisa resultou em diferentes tipos de estudos, porém, os estudos de caso‐controle e metanálise foram privilegiados, vez que apresentam maior impacto para o conhecimento da área, enquanto os estudos de casos clínicos e de séries de casos foram apenas brevemente mencionados.
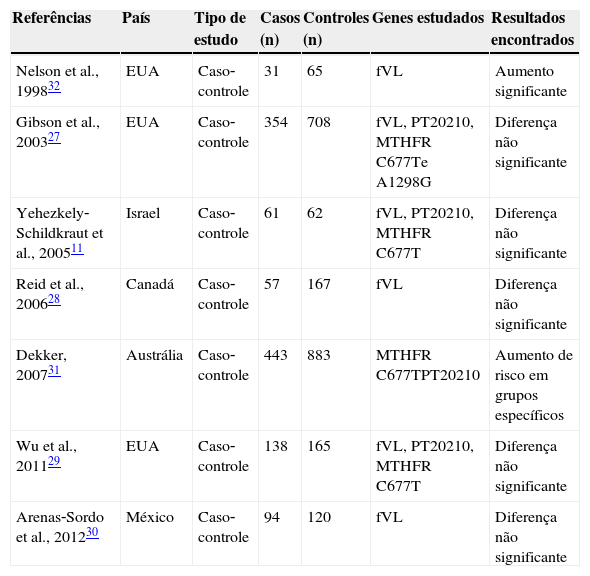
A revisão bibliográfica sobre os estudos de associação entre as trombofilias hereditárias e a PC resultou em cinco relatos de caso,18‐23 quatro estudos de séries14,24‐26 e sete estudos caso‐controle. Os resultados dos estudos caso‐controle estão sintetizados na tabela 3. Os estudos que objetivaram descrever uma associação entre as trombofilias hereditárias e a PC, em sua maioria, falharam na constatação desta associação.11,27‐30 Apenas dois estudos conseguiram estabelecer algum grau de relação, com destaque para o estudo de Dekker,31 que demonstrou maior risco de PC em prematuros com a mutação da MTHFR C677T, em homozigose, e em pacientes que acumulavam tanto polimorfismos da MTHFR C677T, em homozigose, como da PT G20210A, em heterozigose. O estudo de Nelson et al.32 foi o único que demonstrou associação significativa entre uma trombofilia congênita isolada (fVL) e a PC, sem estratificação da amostra.
Estudos que analisaram as associações diretas entre a PC e as trombofilias hereditárias (autor, ano, país, tipo de estudo e genes analisados)
| Referências | País | Tipo de estudo | Casos (n) | Controles (n) | Genes estudados | Resultados encontrados |
|---|---|---|---|---|---|---|
| Nelson et al., 199832 | EUA | Caso‐controle | 31 | 65 | fVL | Aumento significante |
| Gibson et al., 200327 | EUA | Caso‐controle | 354 | 708 | fVL, PT20210, MTHFR C677Te A1298G | Diferença não significante |
| Yehezkely‐Schildkraut et al., 200511 | Israel | Caso‐controle | 61 | 62 | fVL, PT20210, MTHFR C677T | Diferença não significante |
| Reid et al., 200628 | Canadá | Caso‐controle | 57 | 167 | fVL | Diferença não significante |
| Dekker, 200731 | Austrália | Caso‐controle | 443 | 883 | MTHFR C677TPT20210 | Aumento de risco em grupos específicos |
| Wu et al., 201129 | EUA | Caso‐controle | 138 | 165 | fVL, PT20210, MTHFR C677T | Diferença não significante |
| Arenas‐Sordo et al., 201230 | México | Caso‐controle | 94 | 120 | fVL | Diferença não significante |
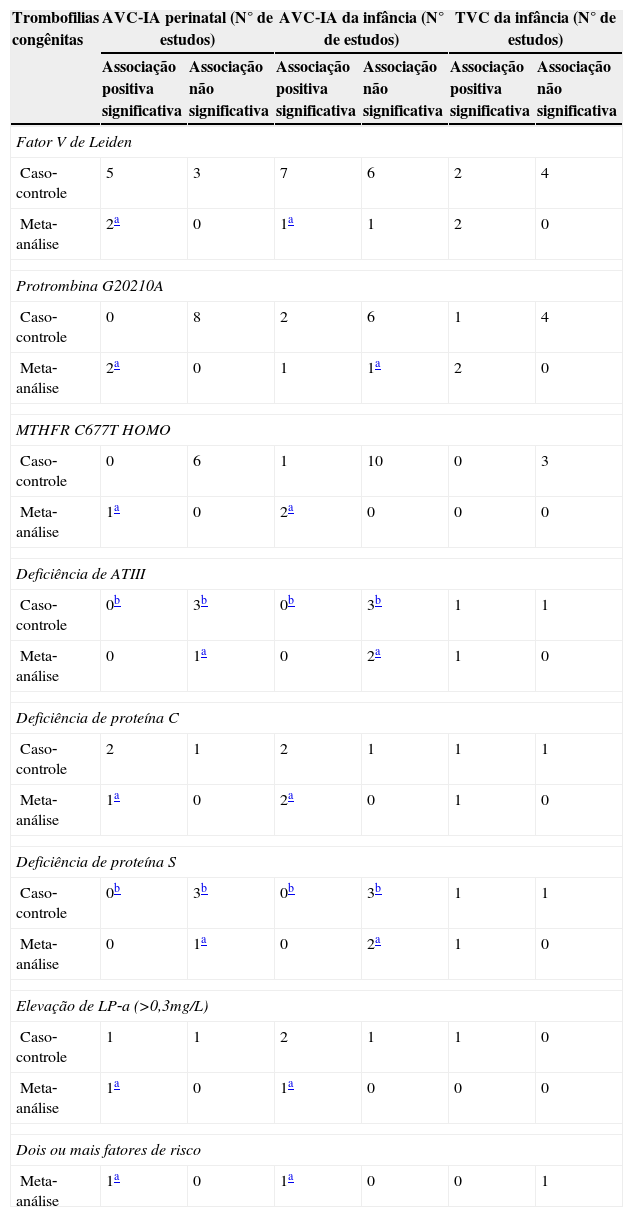
A revisão bibliográfica sobre a associação entre as trombofilias hereditárias e os AVC‐IA perinatais resultou em um relato de caso,33 oito estudos caso‐controle e duas metanálises. Os estudos sobre a associação entre as trombofilias hereditárias e os AVC‐IA na infância, obtidos nas bases de dados, totalizaram 16 estudos caso‐controle e duas meta‐análises. Os estudos caso‐controle publicados no período avaliado apresentaram resultados discordantes sobre a maior frequência de trombofilias hereditárias em pacientes com AVC‐IA perinatal (tabela 4).34‐42
Integração dos resultados dos estudos caso‐controle e meta‐análises sobre as possíveis associações entre trombofilias hereditárias e AVC‐IA perinatal, AVC‐IA da infância e TVC da infância
| Trombofilias congênitas | AVC‐IA perinatal (N° de estudos) | AVC‐IA da infância (N° de estudos) | TVC da infância (N° de estudos) | |||
|---|---|---|---|---|---|---|
| Associação positiva significativa | Associação não significativa | Associação positiva significativa | Associação não significativa | Associação positiva significativa | Associação não significativa | |
| Fator V de Leiden | ||||||
| Caso‐controle | 5 | 3 | 7 | 6 | 2 | 4 |
| Meta‐análise | 2a | 0 | 1a | 1 | 2 | 0 |
| Protrombina G20210A | ||||||
| Caso‐controle | 0 | 8 | 2 | 6 | 1 | 4 |
| Meta‐análise | 2a | 0 | 1 | 1a | 2 | 0 |
| MTHFR C677T HOMO | ||||||
| Caso‐controle | 0 | 6 | 1 | 10 | 0 | 3 |
| Meta‐análise | 1a | 0 | 2a | 0 | 0 | 0 |
| Deficiência de ATIII | ||||||
| Caso‐controle | 0b | 3b | 0b | 3b | 1 | 1 |
| Meta‐análise | 0 | 1a | 0 | 2a | 1 | 0 |
| Deficiência de proteína C | ||||||
| Caso‐controle | 2 | 1 | 2 | 1 | 1 | 1 |
| Meta‐análise | 1a | 0 | 2a | 0 | 1 | 0 |
| Deficiência de proteína S | ||||||
| Caso‐controle | 0b | 3b | 0b | 3b | 1 | 1 |
| Meta‐análise | 0 | 1a | 0 | 2a | 1 | 0 |
| Elevação de LP‐a (>0,3mg/L) | ||||||
| Caso‐controle | 1 | 1 | 2 | 1 | 1 | 0 |
| Meta‐análise | 1a | 0 | 1a | 0 | 0 | 0 |
| Dois ou mais fatores de risco | ||||||
| Meta‐análise | 1a | 0 | 1a | 0 | 0 | 1 |
As metanálises avaliaram em conjunto o risco relativo de trombofilias hereditárias para os pacientes com AVC‐IA perinatais e da infância. Renaud et al.43 observaram uma frequência maior da mutação do fVL e da mutação da PT G20210 nesses pacientes, quando comparados aos controles. Kenet et al.12 relataram maiores frequências para o fVL (OR/IC 95%: 3,70/2,82‐4,85), para a mutação PT G20210A (OR/IC 95%: 2,60/1,66‐4,08), para a mutação da MTHFR C677T, em homozigose (OR/IC 95%: 1,58/1,20–2,08), para a deficiência de PROC (OR/IC 95%: 11,0/5,13–23,59) e para o aumento da lipoproteína‐A (OR/IC 95%:6,53/4,46–9,55) no grupo de pacientes, quando comparados aos controles. A associação de duas ou mais trombofilias hereditárias também foi 18,75 vezes (IC 95%:6,49–54,14) maior nos pacientes avaliados. Esta metanálise não detectou aumento de risco relativo para a deficiência de antitrombina (OR/IC 95%: 3,29/0,70–15,48) e de proteína S (OR/IC 95%:1,49/0,32–6,92).
Dezesseis estudos caso‐controle investigaram as associações entre as trombofilias hereditárias e os AVC–IA da infância. Os resultados desses estudos foram divergentes e são apresentados na tabela 4.44–61 O levantamento bibliográfico resultou também em duas metanálises que avaliaram as prováveis associações entre mutações em genes ligados às trombofilias hereditárias e os acidentes vasculares cerebrais da infância.12,62 Haywood et al.62 avaliaram estudos caso‐controle publicados entre 1989 e 2000 e demonstraram maior frequência da deficiência de PROC (OR/IC 95%:11,0/5,1‐23,6) e da mutação MTHFR C677T (OR/IC 95%:1,70/1,23‐2,34) em pacientes com AVC‐IA infantil. Os autores não detectaram aumento de frequência para o fVL (OR/IC 95%:1,2/0,8‐1,9), para a mutação PT G20210A (OR/IC 95%: 1,1/0,5‐2,3), para a deficiência de antitrombina (OR/IC 95%:1,0/0,3‐3,7) e para deficiência de PROS (OR/IC 95%:1,1/0,3‐3,8) nos casos em relação aos controles.
A revisão bibliográfica sobre a associação entre as trombofilias hereditárias e a TVC pediátrica resultou em um relato de caso63 e uma série de casos.64 O levantamento também resultou em sete estudos caso‐controle,38,41,53,65–67 que mostraram resultados discordantes sobre a influência das trombofilias hereditárias nas TVC (tabela 4). As metanálises indicaram que, em portadores de TVC, observa‐se maior frequência para a mutação do fVL (2,7‐3,1X), a mutação da PT G20210A (1,9‐3,1X), a deficiência de proteína C (6,3X), a deficiência de proteína S (5,3X), a deficiência da ATIII (18,4X), além de níveis elevados de lipoproteína‐a (7,2X). Entretanto, esses achados não foram observados para a mutação da MTHFR C677T, em homozigose.12,41
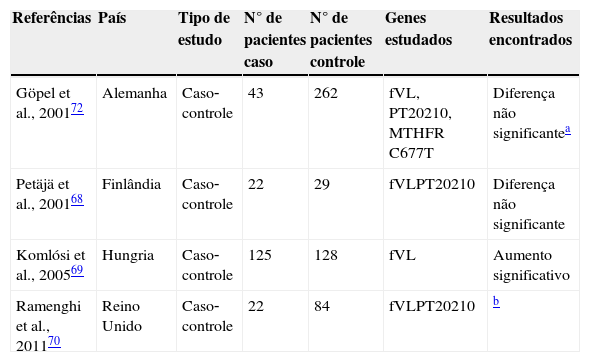
Quatro estudos caso‐controle60,68‐70 e um estudo de série71 que relacionavam as trombofilias hereditárias com os AVC hemorrágicos foram selecionados em nossa revisão. Todos os estudos se referiam às hemorragias no período neonatal do tipo hemorragia intraventricular da matriz germinal (GM‐HIV). Os dados condensados desses estudos podem ser vistos na tabela 5. Dois estudos caso‐controle selecionados nesta revisão não demonstraram maior risco relativo para as mutações do fVL, PT G20210A e MTHFR C677T nos pacientes com GM‐HIV, em relação aos controles.68,72 Göpel et al.72 observaram que as mutações do fVL e da PT G20210A conferiam um risco relativo negativo para as formas mais graves da GM‐HIV, o que sugeriu um efeito protetor contra o agravamento dos sangramentos por essas mutações. Uma possível explicação seria o estancamento mais rápido do sangramento em decorrência da trombofilia.
Estudos que analisaram as possíveis associações entre AVC hemorrágico e as trombofilias hereditárias
| Referências | País | Tipo de estudo | N° de pacientes caso | N° de pacientes controle | Genes estudados | Resultados encontrados |
|---|---|---|---|---|---|---|
| Göpel et al., 200172 | Alemanha | Caso‐controle | 43 | 262 | fVL, PT20210, MTHFR C677T | Diferença não significantea |
| Petäjä et al., 200168 | Finlândia | Caso‐controle | 22 | 29 | fVLPT20210 | Diferença não significante |
| Komlósi et al., 200569 | Hungria | Caso‐controle | 125 | 128 | fVL | Aumento significativo |
| Ramenghi et al., 201170 | Reino Unido | Caso‐controle | 22 | 84 | fVLPT20210 | b |
Komlósi et al.69 demonstraram uma maior frequência do fVL em pacientes com GM‐HIV prematuros comparados aos controles, porém esses resultados não foram confirmados para os pacientes nascidos a termo. Ramenghi et al.70 observaram uma maior frequência para a combinação do fVL e a mutação G20210A da protrombina em pacientes com GM‐HIV em relação aos controles. O agrupamento de diferentes trombofilias dificulta as conclusões sobre o papel fisiológico de cada tipo individual e, geralmente, é avaliado em amostras muito pequenas.
DiscussãoOs estudos que objetivaram descrever uma correlação direta entre as trombofilias hereditárias e a PC, em sua maioria, falharam na constatação dessa associação,11,27‐32 o que sugere um efeito secundário das trombofilias no aparecimento da PC.
Os resultados obtidos para os AVC‐IA são muito semelhantes para os dois períodos pediátricos (perinatal e da infância). A análise individual dos fatores genéticos relacionados às trombofilias apresenta um papel discreto no aparecimento da AVC isquêmico arterial pediátrico. A combinação de duas ou mais trombofilias hereditárias com outros fatores clínicos de risco parece apresentar maior importância na prática clínica do que o estudo de fatores genéticos isolados.12 Esse fato impede que o diagnóstico de mutações isoladas determine condutas clínicas de forma conclusiva, pois o risco/benefício do uso de anticoagulantes e outras medicações ainda não foi estabelecido.73
As conclusões obtidas sobre o papel das trombifilias hereditárias na etiologia dos AVC‐IA pediátricos também são válidas para o aparecimento da TVC na infância. As trombofilias exercem um aumento discreto e questionável no risco relativo da TVC. Esse fato, adicionado à baixa prevalência das TVC na infância, dificulta o uso dos resultados na prática médica.12 Nesta revisão apenas estudos sobre as trombofilias hereditárias e os AVC hemorrágicos perinatais (GM‐HIV) foram revistos. O número reduzido de pesquisas e, consequentemente, de casos avaliados dificulta a obtenção de conclusões sobre essa associação.68‐72
Algumas limitações influenciaram esta revisão sobre as possíveis associações entre as trombofilias hereditárias, a paralisia cerebral e os acidentes vasculares cerebrais. A primeira delas relaciona‐se aos pacientes estudados que apresentaram numerosos fatores adquiridos para o aparecimento dos acidentes vasculares cerebrais pediátricos, como sepse e desidratação, dentre outros.3 Além disso, sabe‐se que a dosagem de algumas proteínas envolvidas na coagulação pode ser influenciada por doenças diversas, como, por exemplo, a dosagem de proteína S, C e antitrombina, que são afetadas por doenças hepáticas, renais e infecciosas.74 Outra limitação importante advém do fato de a maioria dos estudos ter sido feita em populações da América do Norte e Europa. Como a frequência das trombofilias hereditárias varia significativamente de população para população, esses estudos devem ser replicados em diferentes regiões geográficas.62 Por fim, há que se ressaltar que alguns estudos avaliaram os acidentes cerebrovasculares de forma global e deixaram de classificá‐los em acidentes arteriais ou venosos, perinatais ou da infância. Esse fato pôde ser observado em duas das metanálises que avaliaram a associação entre as trombofilias hereditárias e os AVC‐IA e fizeram as análises dos dados do período neonatal e da infância em conjunto, o que prejudica a análise das conclusões obtidas.12,43
Conclusões e perspectivasNo que diz respeito ao possível efeito das mutações em genes associados às trombofilias hereditárias e suas associações com os acidentes vasculares cerebrais pediátricos e a paralisia cerebral, conclui‐se que discretos aumentos no risco relativo foram descritos nos estudos revisados, o que sugere um papel secundário dessas mutações no aparecimento dessas manifestações. A combinação de mais de uma mutação associada a fatores clínicos de risco sugere um papel de maior relevância na etiologia do acidente vascular cerebral pediátrico e da paralisia cerebral.
Estudos multicêntricos que avaliem um número maior de genes em conjunto devem ser conduzidos para elucidar o real papel das mutações associadas às trombofilias hereditárias na etiologia da PC/AVC pediátricos. A etiologia multifatorial e complexa da PC torna essa tarefa árdua e difícil, porém os benefícios gerados por esses estudos são incalculáveis.
Conflitos de interesseOs autores declaram não haver conflitos de interesse.
Como citar este artigo: Torres VM, Saddi VA. Systematic review: hereditary thrombophilia associated to pediatric strokes and cerebral palsy. J Pediatr (Rio J). 2015;91:22–9.