To assess spontaneous reports of suspected adverse drug reactions in children aged 0‐12 years from the Brazilian Health Regulatory Agency between 2008 and 2013.
MethodsA cross‐sectional study on suspected adverse drug reactions reports related to medicines and health products in children was carried out for a six‐year period (2008--2013).Year of report, origin of report by Brazilian state, gender, age, suspected drug, adverse reaction description and seriousness were included in the analysis. The data obtained was compared to the number of pediatric beds in health services and to global data from the VigiBase (World Health Organization).
ResultsA total of 3330 adverse drug reactions were reported in children in Brazil in the investi‐gated period (54% were in boys). About 28% of suspected adverse drug reactions reports involved 0 to 1‐year‐old children. Almost 40% of reports came from the Southeast region. Approximately 60% were classified as serious events. There was death in 75 cases. Nearly 30% of deaths involved off‐label use; 3875 medicines (465 active substances) were considered suspected drugs. Anti‐infective (vancomycin, ceftriaxone, oxacillin, and amphotericin), nervous system (metamizole) and alimentary tract and metabolism medicines were more frequent in reports.
ConclusionsThe distribution of suspected adverse drug reactions reports by sex and age group corresponded to the profile of children hospitalized in Brazil. Data about seriousness and medicines reported may be useful to encourage regulatory actions and improve the safe use of medicines in children.
Analisar relatos espontâneos de suspeitas de Reação Adversa a Medicamento (RAM) em crianças de 0 a 12 anos notificadas pela Agência Nacional de Vigilância Sanitária entre 2008 e 2013.
MétodosUm estudo transversal a partir de notificações de suspeitas de RAM relacionadas a medicamentos e produtos para a saúde em crianças foi realizado por um período de seis anos (2008‐2013). O ano da notificação, a origem do relato por estado brasileiro, sexo, idade, o medicamento suspeito, a descrição da reação adversa e a gravidade foram incluídos na análise, bem como o número de leitos nos serviços de saúde e dados global da VigiBase.
ResultadosUm total de 3330 reações adversas foram relatadas em crianças no Brasil no período investigado (54% em meninos). Cerca de 28% dos relatos de suspeitas de RAM envolveram crianças de 0 a 1 ano de idade. Quase 40% dos relatos vieram da região Sudeste. Aproximadamente 60% foram classificados como eventos graves. Houve ocorrência de morte em 75 casos. Quase 30% das mortes envolveram o uso off‐label dos medicamentos. Um total de 3875 medicamentos (465 substâncias ativas) foram considerados fármacos suspeitos. Medicamentos anti‐infecciosos (vancomicina, ceftriaxona, oxacilina e anfotericina), com ação no sistema nervoso (dipirona) e no trato digestivo foram os mais frequentemente notificados.
ConclusõesAs notificações de suspeitas de RAM por sexo e faixa etária corresponderam ao perfil de crianças hospitalizadas no Brasil. Os dados sobre gravidade e medicamentos relatados podem ser úteis para encorajar ações reguladoras e melhorar o uso seguro de medicamentos em crianças.
As crianças são vulneráveis a Reações Adversas a Medicamentos (RAM), com taxas de incidência que variam entre 0,6% a 16,8% das crianças expostas a um medicamento durante a internação hospitalar.1 Essas suscetibilidades são explicadas em parte por alterações fisiológicas durante o crescimento, influenciam a biodisponibilidade e as características do medicamento. A falta de informações provenientes de ensaios clínicos aumenta as incertezas sobre o perfil de risco‐benefício dos medicamentos comumente usados em pediatria.2,3
As RAM são definidas como uma resposta, nociva e não intencional, a um fármaco, e que ocorre em doses normalmente usadas em humanos para a profilaxia, o diagnóstico, o tratamento da doença ou modificação da função fisiológica.4 Atualmente são usados vários métodos e abordagens para a detecção de suspeitas de RAM e para recebimento e análise de relatos de alertas de segurança. Os relatos espontâneos de suspeitas de RAM, principal atividade dos Centros Nacionais de Farmacovigilância, são considerados uma estratégia acessível e barata que é especialmente útil para o descobrimento de reações raras e aquelas não relatadas anteriormente.4 Por outro lado, a subnotificação, a baixa qualidade dos relatos e a dificuldade de estimar frequências e taxas de suspeitas de RAM são algumas das suas limitações.5
Star et al. encontraram uma proporção maior de relatos que envolveram crianças da América Latina em comparação com relatos da Europa, América do Norte e Oceania, a partir da base de dados Global ICSR, da OMS, VigiBase.2 No Brasil – o maior país da América Latina com uma população multiétnica estimada em quase 200 milhões de habitantes – a coleta e o relato de dados têm sido planejados pela vigilância sanitária por quatro décadas. No entanto, a Agência Nacional de Vigilância Sanitária (Anvisa) só foi criada por lei em 1999. O Brasil foi admitido como o 62° Membro do International Program e seu Centro Nacional de Monitorização de Medicamentos foi estabelecido. em 2001, quando o censo nacional relatou mais de 170 milhões de habitantes. O sistema online brasileiro (Sistema Nacional de Vigilância Sanitária – Notivisa) para relatos de RAM foi criado em uma plataforma web em 2006.6,7 O Notivisa recebe relatos de suspeita de RAM vindos de profissionais da saúde, indústria e instituições de saúde. A maioria dos relatos origina‐se de gerentes de risco da Rede Sentinela, financiada por hospitais desde 2004 em todo o país, embora a distribuição de sites da rede seja desigual.8,9
Em comparação com as agências reguladoras de saúde dos Estados Unidos da América (EUA) e da Europa, o Brasil não tem regulamentações específicas ou iniciativas governamentais para melhorar a pesquisa clínica em crianças. A falta de iniciativas governamentais em pediatria cria um cenário propício para o uso não racional de medicamentos, como usos não liberados e off‐label, seguido por um aumento do risco de hospitalização de crianças.10,11
Considerando esses aspectos, bem como a necessidade de conhecer o perfil de suspeitas de RAM em crianças no Brasil, onde o uso de medicação é específico para os problemas de saúde pública neste país tropical e que apresenta diversidade social, este estudo tem por objetivo descrever e avaliar os relatos espontâneos de suspeita de Reação Adversa a Medicamento (RAM) em crianças até 12 anos obtidos do Notivisa.
MétodosOs autores fizeram um estudo transversal sobre notificações de suspeitas de RAM relacionadas a medicamentos e produtos para a saúde (exclusive vacinas) por profissionais da saúde, indústria farmacêutica e serviços de saúde entre 2008 e 2013 no Brasil. A Anvisa forneceu os dados dos relatos no site Notivisa em formato anônimo e desvinculado, em um arquivo do Microsoft Excel®.
Os dados de suspeita de RAM em crianças (até 12 anos) foram identificados e incluídos de duas maneiras: (i) combinação de variáveis de informação sobre a idade na data da ocorrência de evento adverso ou (ii) cálculo da diferença entre a data de início da suspeita de RAM e a data de nascimento do paciente. Não houve processos de ligação com outros bancos de dados. Registros nos quais a data de nascimento não foi informada foram excluídos do estudo
Um relato de suspeita de RAM foi considerado como a unidade analítica e a variável ordenada do estudo. As variáveis relacionadas ao paciente (sexo e idade), o medicamento suspeito (nome, dose administrada, forma de administração, frequência), a suspeita de RAM (descrição, duração e gravidade) e origem do relato (ano, cidade e estado) foram investigadas neste estudo.
Os medicamentos foram codificados pelo sistema de classificação Anatomic Therapeutic Chemical (ATC) e sua frequência foi analisada quanto ao grupo e subgrupo terapêutico. Informações sobre o uso off‐label de medicamentos em crianças foram verificadas a partir da lista eletrônica de bulas da Anvisa e complementada pelo Resumo das Características do Medicamento (RCM) e pela bula de informações ao paciente no Compêndio Eletrônico de Medicamentos e Agência Reguladora de Medicamentos e Produtos de Saúde (MHRA). As duas fontes contêm informações atualizadas e de fácil acesso sobre medicamentos licenciados para uso no Reino Unido (RU) e foram consideradas porque o Reino Unido tem políticas específicas de informações sobre medicamentos para crianças.
As suspeitas de RAM foram classificadas pela Terminologia de Reações Adversas da OMS (WHO‐ART). Todas as suspeitas de RAM foram classificadas em (i) grave: morte, risco de morte, hospitalização prolongada, anomalias congênitas, incapacidade persistente ou significativa, eventos de importância médica ou (ii) não grave.12
Dados da população pediátrica brasileira, perfil de morbidade e número de leitos pediátricos nos serviços de saúde dos estados foram coletados do Instituto Brasileiro de Geografia e Estatística (IBGE) e o Departamento de Informática do Sistema Único de Saúde (Departamento de Informática do SUS – Datasus)13 foi considerado para comparar os relatos de suspeita de RAM e a sua frequência relativa.
Os dados globais foram obtidos a partir da base de dados VigiAccess para acesso público ao VigiBase, banco de dados global da Organização Mundial da Saúde (OMS) para suspeitas de RAM, mantido pelo Uppsala Monitoring Center (UMC).14 O número de relatos globais de suspeitas de RAM em crianças até 11 anos entre 2008 e 2013 foi estimado a partir do total relatado durante o período multiplicado pelo percentual de suspeitas de RAM nesse grupo etário informado no VigiAccess.
Este estudo foi aprovado por um Comitê Brasileiro de Ética em Pesquisa (número de registro 931.400).
ResultadosEm 2013 havia 41.657.159 crianças até 12 anos no Brasil, de acordo com estimativas nacionais. As suspeitas de RAM nessa população (n = 3.330) representaram 10,4% do total de suspeitas de RAM do Notivisa entre 2008 e 2013. Cerca de 4% dos relatos não continham a data de nascimento do paciente e por isso foram excluídos.
O número anual de notificações em crianças até 12 anos variou de 365 a 644 no Brasil (tabela 1). Houve relatos de suspeitas de RAMs em todas as cinco regiões brasileiras. Quase 40% dos relatos aconteceram na região Sudeste. O Centro‐Oeste teve os piores resultados (tabela suplementar 1). Dois estados brasileiros (Roraima e Amapá) não relataram eventos em crianças. Roraima é o estado com a maior proporção de crianças no Brasil (45%). São Paulo (n = 908; 27,3%), Pará (n = 353; 10,6%), Santa Catarina (n = 329; 9,9%), Rio Grande do Sul (n = 318; 9,5%), Ceará (n = 305; 9,1%) e Minas Gerais (n = 217; 6,5%) foram os estados com maior número de relatos.
Distribuição dos Relatos de Suspeita de RAM em crianças (até 12 anos) por ano e faixa etária (Brasil, 2008‐2013)
| Ano | Número de relatos | % |
|---|---|---|
| 2008 | 366 | 11 |
| 2009 | 432 | 13 |
| 2010 | 649 | 20 |
| 2011 | 590 | 17 |
| 2012 | 649 | 20 |
| 2013 | 644 | 19 |
| Idade (em anos) | ||
| 0 | 942 | 28 |
| ≥ 1 ‐ ≥ 4 | 1056 | 32 |
| ≥ 5 ‐ ≥ 9 | 793 | 24 |
| ≥ 10 ‐ ≥ 12 | 539 | 16 |
| Total | 3330 | 100,0 |
RAM, Reação adversa a medicamento.
Cerca de 28% dos relatos de suspeitas de RAMs envolveram crianças até um ano. A média e a mediana das idades foram quatro e três anos, respectivamente (tabela 1). O número de relatos por sexo foi de 1.788 (53,7%) em meninos. Para 73 (2,2%) dos relatos, a variável sexo faltava. A distribuição dos relatos de suspeitas de RAM por sexo e faixa etária correspondeu ao perfil das crianças hospitalizadas no Brasil.13
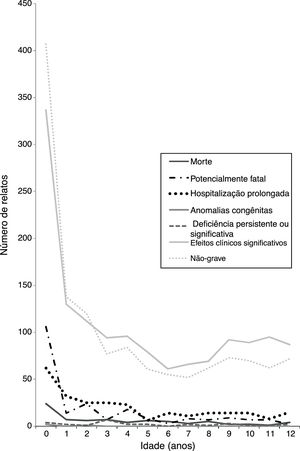
Aproximadamente 60% dos relatos foram classificados como suspeitas graves de RAM (fig. 1). Morte, risco de vida, hospitalização prolongada, anormalidades congênitas e incapacidade persistente ou significativa corresponderam a 18% dos relatos. Houve ocorrência de morte em 75 casos (2,3%) e eventos potencialmente fatais em 213 (6,4%). As mortes foram relacionadas a “outros” produtos para o trato digestivo e metabolismo, como enzimas, medicamentos antibacterianos para uso sistêmico e agentes antineoplásicos. Vinte e três dos casos de morte (30%) envolveram o uso off‐label. Crianças mais jovens tendem a apresentar suspeita de RAM mais grave (fig. 1 suplementar).
Foram identificados 3.875 medicamentos (465 substâncias ativas) em 3.330 notificações (média: 1,2 suspeita de fármaco por relato; variação de 1 a 14). Medicamentos anti‐infecciosos (41%), aqueles para o sistema nervoso (17%) e para o trato digestivo e o metabolismo (13%) foram os mais frequentes nos relatos (tabela 2).
Grupos de medicamentos (ATC) implicados nas suspeitas de RAM em crianças até 12 anos (Brasil, 2008‐2013)
| Códigos e descrição | N | % |
|---|---|---|
| A ‐ Aparelho digestivo e metabolismo | 506 | 13,06 |
| B ‐ Sangue e órgãos hematopoiéticos | 136 | 3,51 |
| C – Sistema cardiovascular | 90 | 2,32 |
| D – Medicamentos dermatológicos | 48 | 1,24 |
| G ‐ Aparelho genitourinário e hormônios sexuais | 6 | 0,15 |
| H ‐ Preparados hormonais sistêmicos, exclusive hormônios sexuais e insulinas | 81 | 2,09 |
| J ‐ Anti‐infecciosos para uso sistêmico | 1602 | 41,34 |
| L ‐ Agentes antineoplásicos e imunomoduladores | 300 | 7,74 |
| M ‐ Sistema musculoesquelético | 66 | 1,7 |
| N ‐ Sistema nervoso | 683 | 17,63 |
| P ‐ Produtos antiparasitários, inseticidas e repelentes | 51 | 1,32 |
| R – Aparelho respiratório | 110 | 2,84 |
| S ‐ Órgãos dos sentidos | 120 | 3,1 |
| V ‐ Vários | 70 | 1,81 |
| Indeterninado | 6 | 0,15 |
| Total | 3875 | 100 |
ATC, Anatomical Therapeutic Chemical Code; RAM, reação adversa a medicamento.
Fonte: Notivisa/Anvisa.
A vancomicina foi o medicamento mais frequentemente envolvido (352 relatos) em suspeita de RAM em crianças brasileiras (assim como nos eventos graves), seguida por ceftriaxona (217), oxacilina (211), dipirona (140) e anfotericina (130). As substâncias ativas mais frequentemente relatadas são mostradas pelo código ATC de quinto nível na tabela 3. De acordo com o Vigibase, entre 2008 e 2013 houve mais de 13.000 relatos que envolveram o uso de ibuprofeno, amoxicilina e ceftriaxona em crianças em todo o mundo (tabela 3).
Medicamentos mais implicados nas suspeitas de RAM relatadas em crianças (Brasil, 2008‐2013)
| Medicamentos | Código ATC | Brasil – Notivisa | Relatos de RAM no VigiAccess | Medicina essencial para criançasa | |
|---|---|---|---|---|---|
| Freq | % | ||||
| Vancomicina | J01XA01 | 352 | 9,08 | 1263 | Sim |
| Ceftriaxona | J01DD04 | 217 | 5,60 | 3057 | Sim |
| Oxacilina | J01CF04 | 211 | 5,45 | 107 | Não |
| Dipirona sódica | N02BB02 | 140 | 3,61 | 432 | Não |
| Anfotericina B | J02AA01 | 130 | 3,35 | 357 | Sim |
| Nitrato de prata | S01AX02 | 88 | 2,27 | 12 | Não |
| Morfina | N02AA01 | 70 | 1,81 | 303 | Sim |
| Cefepima | J01DE01 | 59 | 1,52 | 142 | Não |
| Amoxicilina | J01CA04 | 53 | 1,37 | 5617 | Sim |
| Oseltamivir | J05AH02 | 51 | 1,32 | 2022 | Sim |
| Fenobarbital | N03AA02 | 51 | 1,32 | 642 | Sim |
| Midazolam | N05CD08 | 48 | 1,24 | 348 | Sim |
| Metoclopramida | A03FA01 | 43 | 1,11 | 1593 | Sim |
| Meropenem | J01DH02 | 43 | 1,11 | 308 | UR |
| Ampicilina | J01CA01 | 42 | 1,08 | 1093 | Sim |
| Benzilpenicilina | J01CE01 | 41 | 1,06 | 721 | Sim |
| Asparaginase | L01XX02 | 41 | 1,06 | 767 | Sim |
| Fentanil | N01AH01 | 41 | 1,06 | 389 | Não |
| Cefuroxima | J01DC02 | 39 | 1,01 | 502 | Não |
| Metotrexato | L01BA01 | 37 | 0,95 | 1434 | Sim |
| Fenitoína | N03AB02 | 35 | 0,90 | 747 | Sim |
| Metronidazol | A01AB17 | 30 | 0,77 | 311 | Sim |
| Piperacilina e IE | J01CR05 | 29 | 0,75 | 48 | Não |
| Furosemida | C03CA01 | 28 | 0,72 | 209 | Sim |
| Imipenem e IE | J01DH51 | 28 | 0,72 | 63 | UR |
| Clindamicina | J01FF01 | 28 | 0,72 | 362 | Sim |
| Tramadol | N02AX02 | 27 | 0,70 | 240 | Não |
| Ibuprofeno | M01AE01 | 27 | 0,70 | 4616 | Sim |
ATC, Anatomical Therapeutic Chemical Code; IE, inibidor de enzima;RAM, reação adversa a medicamento; UR, uso restrito.
Esses medicamentos foram suspeitos em 5.155 reações (média de 1,56 reação por relato) e as reações foram classificadas em 662 códigos diferentes. Reações dermatológicas foram mais frequentemente relatadas. Os eventos relatados com maior frequência (frequência acima de 1%) são mostrados na tabela suplementar 2.
DiscussãoQue seja de nosso conhecimento, este é o primeiro trabalho sobre suspeita de RAM em crianças do sistema brasileiro de farmacovigilância.
O aumento de pacientes com suspeita de RAM foi observado em crianças e adultos e pode estar relacionado às ações da Anvisa e à consolidação da chamada Rede Sentinela no Brasil.6 As regulamentações sobre farmacovigilância para fabricantes de medicamentos e vigilância de fiscalização pós‐comercialização de medicamentos foram publicadas em 2009. Em seguida, as ações do Programa Nacional de Segurança do Paciente (PNSP) foram estabelecidas por lei. Desde 2010, no entanto, o número de pacientes não variou muito entre as crianças, continua a crescer entre os adultos, o que pode ser devido à estagnação no número de hospitais pediátricos na Rede Sentinela. Em sua fase inicial, a Rede Sentinela consistia em um projeto concentrado na capacitação dos profissionais dos 96 hospitais participantes, visava a promover a gestão de organização de riscos hospitalares à saúde. Havia 195 hospitais cadastrados na rede em 2013.15
Segundo a Anvisa, quase 80% das suspeitas de RAM para todas as idades no Brasil foram relatadas por hospitais.15 Nossos resultados mostraram isso, bem como uma baixa taxa de notificação da região Centro‐Oeste do Brasil, o que pode indicar a subnotificação. No entanto, a variação entre as regiões sugere que é possível melhorar o relato de suspeitas de RAM.
Entre os 215 hospitais cadastrados da Rede Sentinela, o maior número, 60 hospitais – 25% – estava localizado no Estado de São Paulo. Os estados de Minas Gerais e Rio de Janeiro (Sudeste) tinham o mesmo número de unidades de saúde (22), como o Paraná e o Rio Grande do Sul (região Sul) (12). Santa Catarina (Sul) 19, Ceará (Nordeste) e Pará (Norte) tinham 19, 9 e quatro hospitais cadastrados, respectivamente.15 Iniciativas pioneiras para implantar projetos de farmacovigilância ocorreram no Ceará, no Paraná e em São Paulo por volta da década de 1990.8
Diferenças entre os sexos também podem estar relacionadas ao perfil de hospitalização das crianças brasileiras durante o período do estudo, é mais frequente em pacientes do sexo masculino (55%).16 Moore et al. avaliaram a ocorrência de RAM em crianças menores de dois anos e constataram que os relatos em meninos representaram 57% do total. As RAM ocorreram com maior incidência em pacientes de menor idade.17
A idade parece influenciar a incidência de relatos graves. Estudos sobre segurança de medicamentos são menos comuns em crianças pequenas, apesar da farmacocinética específica encontrada em crianças até três anos, o que pode dificultar o monitoramento e o manejo de reações adversas.18
Mortes relacionadas a usos off‐label (30% das mortes associadas a uma suspeita de RAM) são um achado importante. Esse percentual não era esperado, se considerarmos certa relutância em relatar óbitos por suspeita de uso de prescrição off‐label ou não licenciada.19 No entanto, o maior dano potencial associado aos usos não licenciados e off‐label de medicamentos é o aumento de reações adversas a medicamentos.10
As principais classes de medicamentos suspeitos – grupo ATC J, N e A – são amplamente administradas em crianças hospitalizadas no Brasil e em países europeus.20,21 Diarreia, infecções de vias aéreas inferiores e outras são mais comuns em crianças e adolescentes brasileiros do que em países desenvolvidos.16
Uma revisão sistemática sobre suspeita de RAM em crianças constatou que os agentes anti‐infecciosos e antiepilépticos foram as classes de medicamentos mais comumente relatadas em 52 estudos.1 Entre os medicamentos da tabela 3, cinco deles (dipirona sódica, oxacilina, ceftriaxona, furosemida e fenobarbital) são os mais prescritos em unidades pediátricas de um hospital materno‐infantil em Brasília.22 Midazolam, dipirona sódica, fentanil, cefepima, vancomicina, diazepam e furosemida foram descritos como os medicamentos mais usados na unidade de terapia intensiva do Hospital das Clínicas de Porto Alegre.23 O uso de dipirona sódica também foi indicado em estudos recentes conduzidos nos estados de São Paulo e Minas Gerais,24,25 mas esse medicamento foi proibido nos Estados Unidos, Reino Unido, Suécia e Índia devido ao risco de agranulocitose.26 O ibuprofeno ainda é um fármaco comumente usado na Europa.21
Apesar das semelhanças entre as classes, os perfis dos medicamentos envolvidos nas suspeitas de RAM encontradas neste estudo foram diferentes dos dados de outros estudos pediátricos e do VigiAccess. Alguns fármacos (amoxicilina, ampicilina, metotrexato, furosemida e ibuprofeno) foram comumente relatados pela Anvisa (Brasil) e pelo Sistema de Relatos de Eventos Adversos (Adverse Event Reporting System – AERS) da Food and Drug Administration (FDA).27
A vancomicina e a oxacilina estão relacionadas à maior frequência de suspeitas de RAM em crianças hospitalizadas no Brasil e são amplamente usadas em cuidados de alta complexidade.28 A cloxacilina é a isoxazolil penicilina recomendada para crianças, mas não é registrada no Brasil.
Shalviri et al.29 analisaram os registros de suspeita de RAM em adultos e crianças no Irã durante dez anos (1999‐2008). Esses autores concluíram que a ceftriaxona foi o medicamento mais comum nas notificações (5,8%), correspondeu a 49 óbitos. O uso concomitante de ceftriaxona e soluções com cálcio parece resultar em reações graves.29 Bradley et al. descreveram nove casos suspeitos de reação adversa grave a medicamento relacionada à associação entre ceftriaxona e cálcio em crianças, principalmente neonatos.30
Alterações cutâneas e vômitos foram os principais relatos de suspeita de RAM no presente estudo, assim como em estudos semelhantes e revisões sistemáticas de RAM em crianças.1,27,28,31 A pele também foi o órgão mais afetado, de acordo com os relatos do Vigibase sobre crianças, e os autores sugerem que isso pode estar relacionado às diferenças na fisiologia, o que aumenta a predisposição às reações cutâneas.2
Embora todos os eventos tenham sido coletados da Anvisa, em alguns casos as informações estão incompletas, dificultam a análise de causalidade. A suspeita de subnotificação de RAM na literatura é estimada como maior do que 90%.32 Esse é um problema importante, já que impossibilita o conhecimento da frequência real.31 Outras limitações relacionadas às bases de dados secundárias para este estudo incluíram erros de codificação, impossibilidade de se relacionar os dados com dados dos pais e peso ao nascer, altura e peso atuais.33
A distribuição heterogênea de hospitais por regiões (70% nas regiões Sul e Sudeste) e o foco em casos de maior complexidade nesses serviços podem ter introduzido algum viés, uma vez que não é possível conhecer os eventos comuns na população geral. No entanto, está claro que os serviços hospitalares brasileiros geram um padrão específico de suspeita de RAM. É provável que a população em geral também tenha um padrão de RAM específico no Brasil e isso justifica um trabalho futuro.
Relatos que envolvem medicamentos como oxacilina, ceftriaxona e dipirona mostram a relevância de novos estudos que abordem a farmacoepidemiologia pediátrica e as diferenças de regulação do mercado. Existem algumas características distintas da prática no Brasil – como a indisponibilidade de cloxacilina e a disponibilidade da dipirona sem prescrição, por exemplo – que implicam a necessidade de farmacovigilância específica para o país e monitoramento cuidadoso do medicamento pediátrico. A saúde das crianças brasileiras não é adequadamente protegida por exigências legislativas de outros países como nos EUA e na Europa.
Finalmente, estudos sobre causalidade e evitabilidade de suspeitas de RAM graves também parecem ser extremamente importantes e precisam ser feitos no Brasil.
Essa investigação mostrou que a distribuição geral de relatos de suspeita de RAM por sexo e faixa etária correspondeu ao perfil de crianças internadas no Brasil no mesmo período.
Da mesma forma, as principais classes de medicamentos suspeitos – anti‐infecciosos (vancomicina, ceftriaxona, oxacilina e anfotericina), aqueles para o sistema nervoso (dipirona) e medicamentos para o trato digestivo e o metabolismo – são amplamente administradas em crianças hospitalizadas no Brasil e em países europeus.
Os resultados sugerem que os relatos de suspeita de RAM podem ser melhorados, especialmente na região Centro‐Oeste. Considerando a falta de regulamentação específica para medicamentos pediátricos no Brasil, sugerimos que este país desenvolva sua própria abordagem para a prática e política de farmacovigilância.
FinanciamentoConselho Nacional de Desenvolvimento Científico e Tecnológico (CNPq).
Conflitos de interesseOs autores declaram não haver conflitos de interesse.
Ao CNPq pelo financiamento da pesquisa e à Anvisa pelo apoio para o acesso aos dados.
Como citar este artigo: Lima EC, Matos GC, Vieira JM, Gonçalves IC, Cabral LM, Turner MA. Suspected adverse drug reactions reported for Brazilian children: cross‐sectional study. J Pediatr (Rio J). 2019;95:682–8.
Estudo vinculado à Universidade Federal do Rio de Janeiro, Faculdade de Farmácia, Rio de Janeiro, RJ, Brasil.