Children and adolescents often require sedation and analgesia in emergency situations. With the emergence of new therapeutic options, the obsolescence of others, and recent discoveries regarding already known drugs, it became necessary to review the literature in this area.
Data sourcesNon‐systematic review in the PubMed database of studies published up to December 2016, including original articles, review articles, systematic reviews, and meta‐analyses. References from textbooks, publications from regulatory agencies, and articles cited in reviews and meta‐analyses through active search were also included.
Data synthesisBased on current literature, the concepts of sedation and analgesia, the necessary care with the patient before, during, and after sedoanalgesia, and indications related to the appropriate choice of drugs according to the procedure to be performed and their safety profiles are presented.
ConclusionsThe use of sedoanalgesia protocols in procedures in the pediatric emergency room should guide the professional in the choice of medication, the appropriate material, and in the evaluation of discharge criteria, thus assuring quality in care.
Crianças e adolescentes necessitam frequentemente de sedação e analgesia em situações de emergência. Com o surgimento de novas opções terapêuticas, a obsolescência de outras e descobertas recentes das drogas já conhecidas, fez‐se necessário uma nova revisão da literatura nessa área.
Fontes dos dadosRevisão não sistemática na base de dados PubMed de estudos publicados até dezembro de 2016, inclusive artigos originais, artigos de revisão, revisões sistemáticas e metanálises. Também foram incluídos referências de livros‐texto, publicações de agências reguladoras, além de artigos citados nas revisões e metanálises através de busca ativa.
Síntese dos dadosCom base na literatura atual, são apresentados os conceitos de sedação e analgesia, os cuidados necessários com o paciente antes, durante e após a sedoanalgesia, além de indicações quanto à escolha apropriada dos fármacos de acordo com o procedimento a ser feito e o perfil de segurança desses.
ConclusõesO emprego de protocolos de sedoanalgesia em procedimentos no pronto‐socorro pediátrico deve orientar o profissional na escolha da medicação, do material adequado e na avaliação dos critérios de alta e garantir, assim, qualidade na assistência.
Crianças e adolescentes necessitam frequentemente de sedação e analgesia quando atendidos em situação de emergência. Procedimentos invasivos e não invasivos fazem parte das técnicas de diagnóstico e terapêutica em pediatria e frequentemente são desconfortáveis para a criança, seus pais e profissionais da saúde.1 Apesar de necessárias, a sedação e a analgesia podem ter efeitos adversos, há necessidade de manejo em ambiente adequado e por profissionais capacitados.2
A sedação para procedimento evoluiu e expandiu‐se nas últimas décadas, deixou de ser escopo exclusivo da anestesiologia, passou a ser usada rotineiramente pelas mais diversas especialidades médicas, como gastroenterologia, cardiologia, neurologia, radiologia, medicina de emergência e medicina intensiva pediátricas.3 Em estudo qualitativo com médicos da Irlanda e Reino Unido, McCoy et al. identificaram a falta de treinamento e educação nessa área como uma barreira significativa. A padronização das práticas de sedação e uniformização das diretrizes e recomendações ainda é um desafio.4 No Brasil, poucos artigos de revisão sobre o tema foram publicados nos últimos anos5,6 e em dois deles há sugestão de protocolos.6,7
A sedação reduz o estado de consciência, enquanto a analgesia reduz ou elimina a percepção da dor. Muitos analgésicos têm algum efeito sedativo, porém poucos sedativos detêm a propriedade da analgesia. O objetivo da sedação em pediatria difere da sedação do paciente adulto, pois é administrada para controlar o comportamento e permitir um término seguro do procedimento.2 Para crianças cooperativas, modalidades não farmacológicas devem ser levadas em consideração, como presença dos pais, hipnose, distração e anestésicos tópicos, pois podem reduzir a necessidade ou a profundidade da sedação farmacológica.8,9
Níveis de sedaçãoA sedação é descrita como um continuum, representada por estágios progressivos que vão de leve à anestesia geral. A cetamina, como exceção, é um agente dissociativo que tem como particularidade produzir uma sedação que não segue esse padrão, esteja o efeito presente ou ausente, com manutenção da respiração espontânea, dos reflexos protetivos e da estabilidade cardiovascular.10
Em 2002, a American Society of Anesthesiologists (ASA) definiu os quatro níveis de sedação:11
- •
Sedação mínima (ansiólise): estado induzido por meio de medicação no qual os pacientes respondem normalmente aos comandos verbais. Embora a função cognitiva e a coordenação possam estar prejudicadas, as funções ventilatórias e cardiovasculares não são afetadas.
- •
Sedação moderada: também chamada “sedação consciente”, é um estado de depressão da consciência induzido por medicamentos, no qual o paciente responde de forma proposital aos comandos verbais, isolados ou acompanhados de estímulos táteis leves. Nenhuma intervenção é necessária para manter a patência da via aérea e a ventilação espontânea é adequada. De uma forma geral, a função cardiovascular é usualmente mantida.
- •
Sedação profunda: é uma depressão da consciência induzida por medicamentos na qual os pacientes não podem ser facilmente acordados, mas respondem aos estímulos repetidos ou dolorosos. A habilidade de manter a função ventilatória de forma independente pode estar prejudicada. Pacientes podem necessitar de assistência para manter a patência das vias aéreas e a ventilação espontânea pode estar inadequada. A função cardiovascular, de forma geral, está mantida.
- •
Anestesia geral: é um estado de perda da consciência induzido por medicamentos durante o qual os pacientes não são despertados, mesmo com estímulos dolorosos. A habilidade de manter a função ventilatória está prejudicada e geralmente os pacientes necessitam de assistência para manter a via aérea pérvia e ventilação com pressão positiva. A função cardiovascular pode estar prejudicada.
Um dos aspectos importantes do alívio da dor em pediatria implica o entendimento dos métodos de avaliação da dor e de seu uso. A dor pode ser avaliada em crianças com uso de parâmetros fisiológicos, observação comportamental e autorrelato. O paciente com dor apresenta taquicardia, dilatação pupilar, sudorese e vasoconstricção periférica.12,13 Nenhuma avaliação da dor deve ser baseada apenas nesses parâmetros, aliam‐se a escalas validadas para sua adequada mensuração. As escalas de avaliação de dor foram validadas para o uso na pediatria, levam‐se em conta a fase de desenvolvimento da criança (idade verbal ou pré‐verbal) e sua capacidade cognitiva de relatar a dor.14
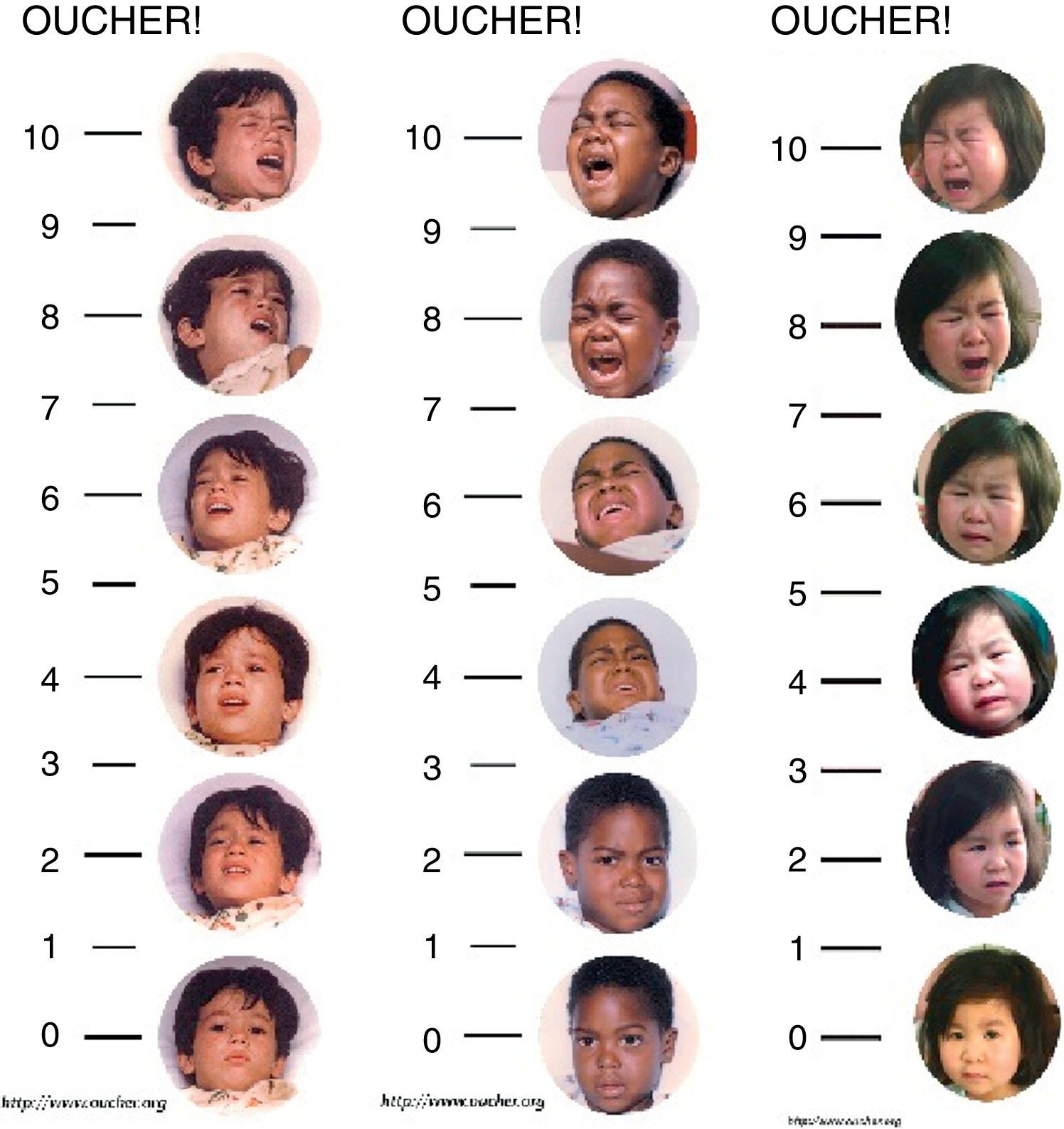
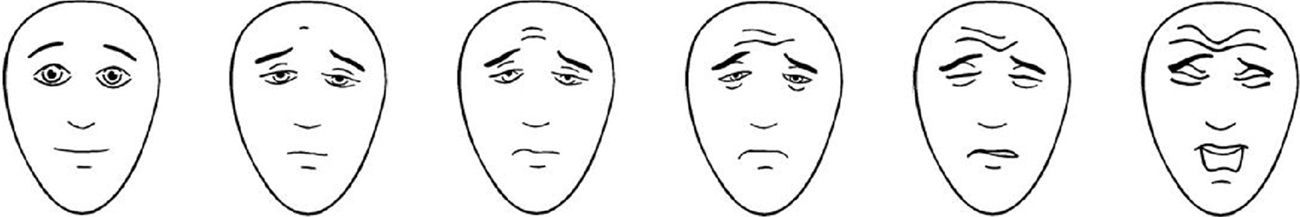
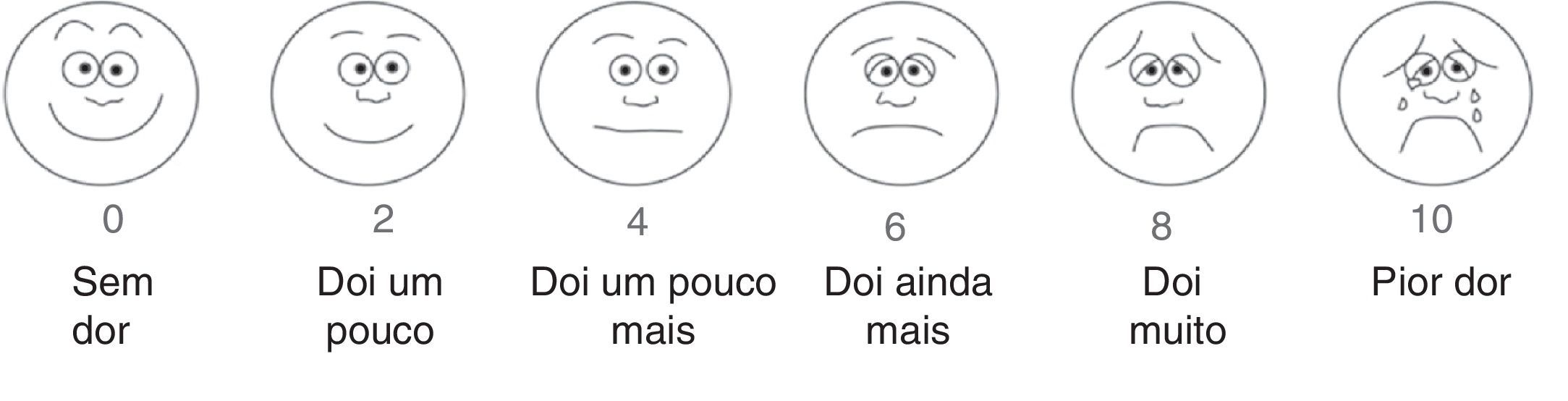
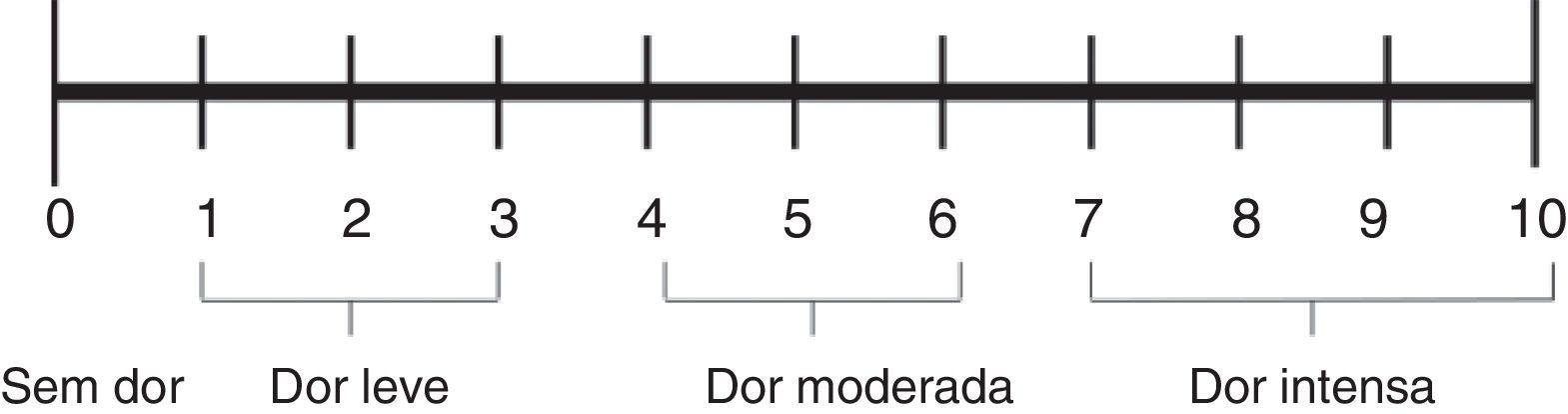
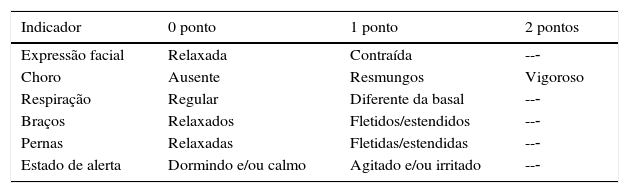
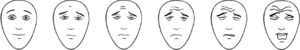
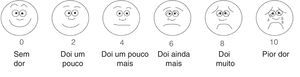
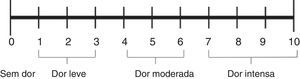
A Neonatal Infant Pain Scale (NIPS) foi desenvolvida para avaliar a resposta à dor dos pacientes no período neonatal, avalia seis parâmetros objetivos (tabela 1).15 A escala FLACC (Face, Legs, Activity, Cry, and Consolability) é validada para crianças entre dois meses e sete anos e pontua cinco reações à dor em uma escala de 0 a 2 (tabela 2).16,17 Em crianças menores, as escalas faciais baseadas em figuras são de fácil uso por não necessitarem de conhecimento numérico ou de certas palavras (figs. 1‐3).18–20 Crianças com idade superior a oito anos já são cognitivamente capazes de usar as escalas visuais analógicas (fig. 4).21
Neonatal Infant Pain Scale (NIPS)
| Indicador | 0 ponto | 1 ponto | 2 pontos |
|---|---|---|---|
| Expressão facial | Relaxada | Contraída | --‐ |
| Choro | Ausente | Resmungos | Vigoroso |
| Respiração | Regular | Diferente da basal | --‐ |
| Braços | Relaxados | Fletidos/estendidos | --‐ |
| Pernas | Relaxadas | Fletidas/estendidas | --‐ |
| Estado de alerta | Dormindo e/ou calmo | Agitado e/ou irritado | --‐ |
Presença de dor: pontuação > 3. Adaptado de Lawrence et al.15
Escala FLACC (Face, Legs, Activity, Cry, and Consolability)
| Categorias | 0 ponto | 1 ponto | 2 pontos |
|---|---|---|---|
| Face | Nenhuma expressão particular ou sorriso | Caretas ou franzir de sobrancelhas ocasionais, introversão, desinteresse | Caretas ou franzir de sobrancelhas frequentes, queixo tremendo, mandíbula cerrada |
| Pernas | Posição normal ou relaxada | Inquietas, agitadas, tensas | Chutando ou esticadas |
| Atividade | Quieta, posição normal, move‐se facilmente | Contorcendo‐se, movendo‐se para frente e para trás, tensa | Curvada, rígida ou com movimentos bruscos |
| Choro | Sem choro (acordada ou dormindo) | Gemidos ou choramingos, queixa‐se ocasionalmente | Choro contínuo, grito ou soluço; queixa‐se com frequência |
| Consolabilidade | Satisfeita, relaxada | Tranquilizadas por toques, abraços ou conversas; possível de distrair | Difícil de consolar ou confortar |
Adaptado de Merkel et al.16
Escala Oucher. Adaptado de Oucher.18 Explicar à criança para ressaltar que a intensidade da dor aumenta na escala na direção de baixo para cima e pedir que ela aponte qual a figura que demonstra a intensidade de dor que ela sente.
Escala facial de dor – Revisada. Adaptado de Faces Pain Scale ‐ Revised © 2001, International Association for the Study of Pain (www.iasp‐pain.org/FPSR). Uso com permissão. Explicar à criança para ressaltar a face escolhida como 0, 2, 4, 6, 8 ou 10, conta‐se da esquerda para a direita; 0=sem dor e 10=com muita dor. Não usar palavras como “alegre” ou “triste”. Essa escala tem por objetivo medir como as crianças se sentem internamente, e não como aparentam estar.
Escala visual analógica. Adaptado de McCaffery et al.21 Escala númerica simples. Pedir ao paciente que indique a intensidade do atual, do melhor e do pior nível de dor nas últimas 24 horas numa escala de 0 (sem dor) a 10 (pior dor imaginável).
A sedação e a analgesia para procedimentos devem levar a um estado de depressão do nível de consciência que permita ao paciente manter a via aérea pérvia de forma independente e contínua. Para isso, é importante a escolha correta de drogas, doses e formas de administração. Crianças mais novas e as gravemente enfermas geralmente requerem uma sedação mais profunda para procedimentos dolorosos.
Avaliação pré‐sedaçãoA ASA recomenda a classificação dos pacientes em seis categorias, de acordo com sua saúde basal (tabela 3). Pacientes ASA I e II são candidatos apropriados à sedação mínima, moderada ou profunda, enquanto crianças ASA III e IV, com necessidades especiais ou com anormalidades anatômicas de vias aéreas, requerem considerações adicionais no que implica sedação moderada ou profunda.11 Através do acrônimo mnemônico Sample, é possível lembrar os componentes essenciais do histórico médico do paciente que devem ser considerados na avaliação para sedação (tabela 4).
Classificação do estado de saúde basal do paciente segundo a American Society of Anesthesiologists
| Classe | Estado de saúde |
|---|---|
| I | Paciente normalmente saudável |
| II | Paciente com doença sistêmica leve |
| III | Paciente com doença sistêmica grave |
| IV | Paciente com doença sistêmica grave que ameaça a vida |
| V | Paciente moribundo, não se espera que sobreviva sem a intervenção |
| VI | Paciente com morte encefálica que terá os órgãos removidos para fins de doação |
Avaliação breve e sistemática do paciente submetido à sedação (Sample)
| Letra | Item avaliado |
|---|---|
| S | Sinais e sintomas da patologia atual |
| A | Alergia a medicação, alimentos ou látex |
| M | Medicação da qual faz uso, seja contínuo ou não |
| P | Passado médico – comorbidades, complicações prévias relacionadas aos agentes sedativos |
| L | Líquidos e sólidos – tempo de jejum e qual tipo de alimento ingerido |
| E | Eventos relacionados à necessidade da sedação |
Eventos adversos da via aérea, sistema cardiovascular e respiratório representam as causas principais de morbimortalidade associadas à sedoanalgesia na população pediátrica.22 Uma metanálise (2016) que incluiu 41 estudos com 13.883 procedimentos sob sedação em crianças identificou como complicações mais frequentes vômitos, agitação, hipoxia e apneia. Neste estudo, a incidência de eventos adversos respiratórios graves (laringoespasmo e necessidade de intubação) foi menor do que 0,5% e a depressão respiratória ocorreu em 1,5% das sedações, sem relato de broncoaspiração; 97% dos casos de laringoespasmo estavam associados ao uso da cetamina.23 Cravero et al. publicaram estudo multicêntrico em que relataram taxas de eventos adversos ainda menores, a incidência de laringoespasmo e aspiração foi de 0,3 e 4,3 para cada 10.000 casos, respectivamente.24 Uma metanálise que avaliou 9.652 adultos submetidos à sedação para procedimentos também encontrou reações adversas semelhantes às da população pediátrica.25
Os agentes sedativos apresentam o potencial de prejudicar os reflexos protetores das vias aéreas, particularmente durante a sedação profunda, o risco da aspiração pulmonar é um dos motivos para agir com prudência e avaliar o tempo de jejum antes de fazer um procedimento (tabela 5). As recomendações da American Society of Anesthesiologists de 2011 são baseadas na extrapolação de pacientes submetidos à anestesia geral no centro cirúrgico, não condizente com a realidade da sedoanalgesia no pronto‐socorro.26 A partir de 2014, o American College of Emergency Physicians (Acep) passou a recomendar que a sedação para procedimentos não deva ser adiada de acordo com o tempo de jejum por não haver evidência de que esse tenha relação com a redução no risco de aspiração ou vômitos.27–29 Clark et al. demonstraram que pacientes com menor tempo de jejum submetidos à sedação profunda para procedimentos eletivos fora do centro cirúrgico tiveram taxas de complicações semelhantes àqueles com tempo mais prolongado.30 Apesar das recomendações mais atuais da Acep, os autores deste artigo acreditam que o risco da sedação e a possibilidade de aspiração devam ser ponderados em relação aos benefícios potenciais do procedimento, já que o número de estudos em pronto‐socorro pediátrico é muito reduzido.
Tempo de jejum adequado para sedação segundo a American Society of Anesthesiologists
| Tipo de alimento | Tempo de jejum |
|---|---|
| Líquidos clarosa | 2h |
| Leite materno | 4h |
| Fórmula infantil e leite não humano | 6h |
| Refeição leve (torrada e líquidos) | 6h |
Ao fazer o exame físico, deve‐se ter atenção especial às anormalidades cardíacas, pulmonares, renais, hepáticas e genéticas, que possam alterar a resposta esperada da criança às medicações analgésicas e sedativas.31–34 Alguns autores evidenciaram um risco maior de eventos adversos associado à sedação de pacientes com comorbidades (ASA > 1).32–34 O exame das vias aéreas deve ser criterioso, com busca ativa de características que aumentem o risco de obstrução da via aérea durante o procedimento, como micrognatia, macroglossia, hipertrofia significante de amígdalas, abertura limitada de via aérea, obesidade extrema, pescoço curto, secreção excessiva ou diminuição dos reflexos protetores das vias aéreas.11 Algumas doenças genéticas e congênitas que cursam com malformações craniofaciais necessitam de uma abordagem mais cautelosa devido à via aérea difícil.35 (tabela 6)
Doenças genéticas e congênitas associadas à via aérea difícil
| Fenda labial e palatine |
| Trissomia do cromossomo 21 |
| Fibrodisplasia ossificante progressiva |
| Mucopolissacardiose |
| Malformações vasculares |
| Síndrome de Pierre Robin |
| Síndrome de Crouzon (disostose craniofacial) |
| Síndrome de Treacher‐Collins (disostose mandibulofacial) |
| Síndrome de Goldenhar (microssomia hemifacial) |
| Síndrome de Klippel‐Feil |
| Síndrome de Freeman‐Sheldon (displasia cranio‐carpo‐tarsal) |
Fonte: Butler et al.31
Em um estudo retrospectivo com 11.219 crianças submetidas a procedimentos sob anestesia geral com intubação traqueal, a laringoscopia foi considerada difícil em 1,35% dos eventos, com taxa mais alta em crianças menores de um ano quando comparadas com as maiores de um ano, com incidência de 4,7% e 0,7%, respectivamente. Foi identificado ainda um maior risco de laringoscopia difícil em pacientes classificados como ASA III e IV, com IMC (índice de massa corpórea) baixo, submetidos a cirurgias na cavidade oral, maxilofacial e cardíacas.36 Estudo semelhante analisou uma coorte de 102.305 casos de pacientes adultos submetidos à anestesia geral e encontrou uma incidência de laringoscopia difícil de 4,9%, três vezes a da população pediátrica geral.37
Os sinais vitais do paciente devem ser registrados antes do início da sedação, após cada dose de medicação, em intervalos regulares durante o procedimento, ao término, durante a fase de recuperação e por ocasião da alta.11 A Academia Americana de Pediatria (AAP) recomenda que o registro dos sinais vitais seja feito a cada 10 minutos em pacientes submetidos à sedação moderada e a cada cinco minutos na sedação profunda.38
Com exclusão da a sedação mínima, na qual a observação do nível de consciência é suficiente, a monitoração do paciente deve ser contínua e dispor de oxímetro de pulso, monitor cardíaco, respiratório e de pressão arterial.38 A capnografia pode ser usada em associação com o oxímetro de pulso, tem a capacidade de detectar apneia antes desse, é recomendada na sedação moderada e obrigatória na sedação profunda.11,27,38
Uma metanálise de 2011, baseada em estudos com população adulta submetida à sedação para procedimentos, identificou uma probabilidade 17,6 vezes maior de detectar depressão respiratória quando houve monitoração com capnografia.39 Langhan et al. randomizaram 154 crianças submetidas à sedação no departamento de emergência e verificaram que pacientes monitorizados com capnografia tiveram intervenções mais precoces em episódios de hipoventilação, o que levou a menor número de episódios de queda da saturação de oxigênio em relação ao grupo controle.40
Cuidado especial deve ser tomado ao cobrir a face e o tronco da criança, já que a observação da coloração das mucosas e do movimento da caixa torácica fica prejudicada. Em outras situações de observação prejudicada, como na ressonância magnética (RM), deve‐se usar equipamento de monitoração não invasiva contínua (monitor cardíaco, oxímetro, capnografia). Além de fontes e vias adequadas de oferta oxigênio e material de sucção, é obrigatório sempre ter à disposição um carrinho de emergência com desfibrilador, drogas de ressuscitação, antídotos e equipamento de via aérea difícil.11
É essencial a presença de um profissional treinado que saiba reconhecer quando há comprometimento da via aérea e intervir a fim de providenciar apoio ventilatório.41 A AAP recomenda que estejam presentes um profissional para monitoração do paciente e outro com treinamento em manejo e sucção de vias aéreas, ventilação bolsa‐máscara, acesso vascular e ressuscitação cardiopulmonar, ambos com treinamento em apoio avançado de vida em pediatria.38 Estudo do Pediatric Sedation Research Consortium analisou dados de 131.751 casos de sedação de pacientes pediátricos para procedimentos em hospitais dos Estados Unidos e observou que não houve diferença estatística nas taxas de eventos adversos graves quando a sedação foi feita por diferentes especialistas.42 O treinamento dos profissionais envolvidos com esse tipo de prática é importante para reduzir eventos adversos e promover melhor conforto e segurança ao paciente, pode ser efetuado em moldes tradicionais ou por simulações.43‐47 Um dos períodos de maior risco relacionado à sedação é a fase de recuperação. Assim, a monitoração durante esse período é obrigatória. O paciente estará elegível para alta se acordar facilmente, falar e sentar sem ajuda, ser capaz de seguir comandos apropriados para a idade, estar hidratado, com a função cardiovascular estável e as vias aéreas pérvias. Para crianças muito jovens ou com alguma desordem cognitiva nas quais há dificuldade de interação, o retorno ao nível de responsividade pré‐sedação deve ser almejado.38 O tempo de recuperação do estado de base varia com a droga e a dose usadas, mas a maioria dos pacientes apresenta condições de receber alta após 1‐2 horas. É recomendável que os pacientes não sejam submetidos a atividades que requeiram concentração ou habilidade motora nas primeiras horas após recuperação da sedação. Os cuidadores devem ser orientados a reportar qualquer evento adverso que ocorra nas primeiras 24 horas após a alta.41
Protocolos de sedação e analgesia no pronto‐socorro são essenciais. A implantação de um protocolo específico de sedação para procedimento em um hospital terciário do Canadá reduziu de 49 para 19 minutos o tempo médio entre a administração do sedativo e interrupção da monitoração do paciente, liberou recursos importantes em um departamento de emergência com demanda alta48 (tabela 7).
Etapas para sedação e analgesia
| Anamnese | Exame físico | Monitoração | Critérios de alta |
|---|---|---|---|
| Sinais e sintomas de alergia Medicação Passado médico Líquidos e sólidos Eventos | • Via aérea superior: abertura da boca, tamanho da mandíbula • Flexão do pescoço: habilidade de encostar o queixo no tórax (avaliar limitação), não aplicável para vítimas com potencial de trauma da coluna espinhal • Ausculta respiratória • Ausculta cardíaca • Perfusão distal: pulso, temperatura da pele, perfusão capilar | • Frequência cardíaca e traçado de eletrocardiograma • Frequência respiratória • Pressão Arterial • Oximetria de pulso • Nível de consciência • Escala de dor • Capnografia (sedação moderada e profunda) | • Via aérea, sinais vitais e oximetria de pulo estáveis e de volta ao nível de base • Capaz de obedecer a comandos apropriados para idade • Hidratado e tolerando ingesta oral de fluidos • Paciente despertável e no seu nível basal de capacidade verbal • Paciente consegue sentar sem ajuda (se apropriado para idade) |
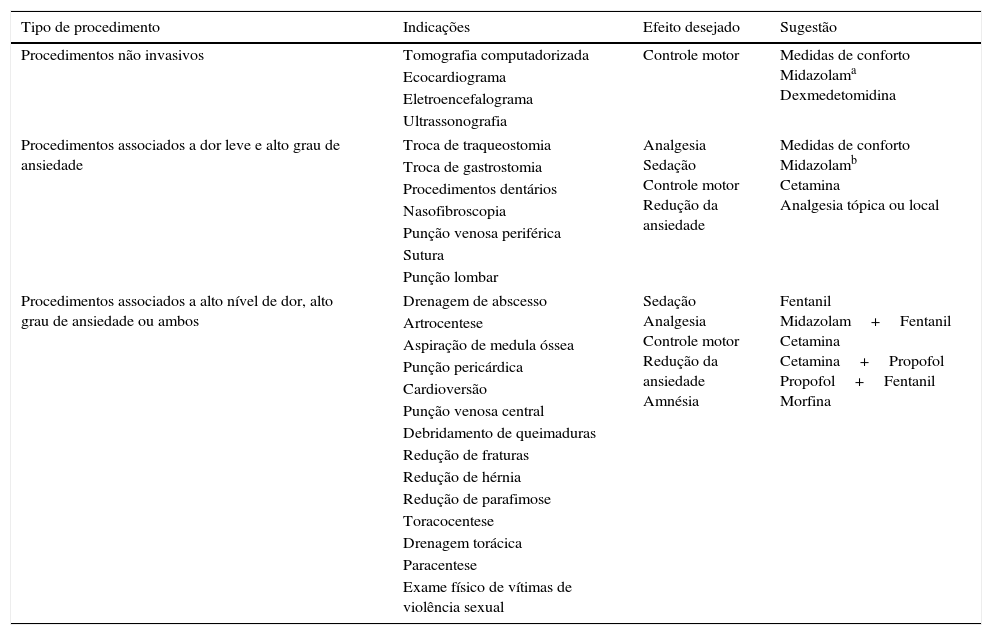
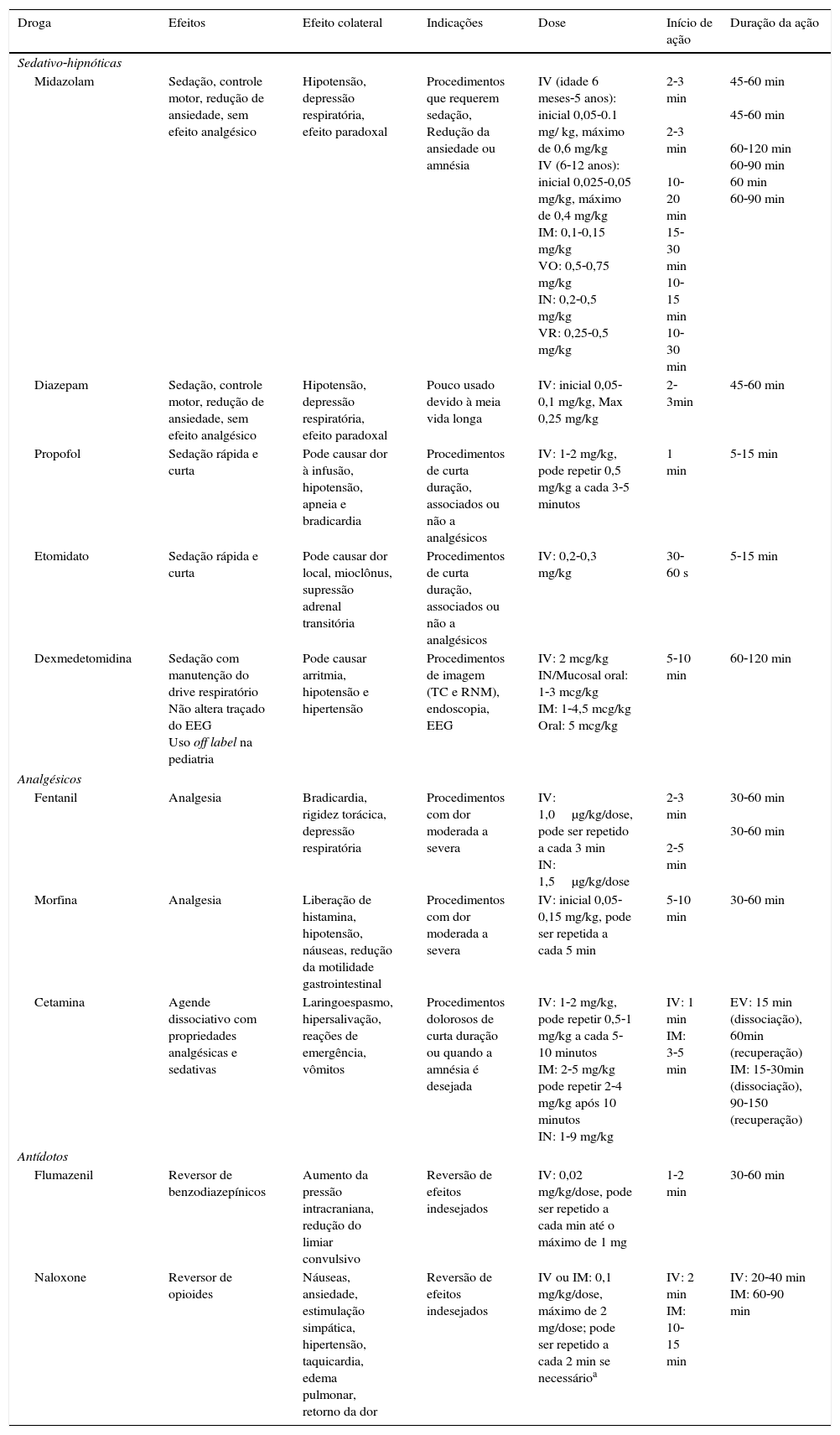
A escolha da medicação usada durante o processo de sedação e analgesia deve levar em conta critérios relacionados ao procedimento ao qual o paciente será submetido, bem como critérios relacionados ao quadro de base e comorbidades. A tabela 8 apresenta uma sugestão de medicações para diferentes tipos de procedimento. A seguir, serão descritas as principais drogas usadas no pronto‐socorro pediátrico. A tabela 9, no fim do capítulo, resume as diferentes características de cada droga.
Sedoanalgesia para procedimentos em pronto‐socorro
| Tipo de procedimento | Indicações | Efeito desejado | Sugestão |
|---|---|---|---|
| Procedimentos não invasivos | Tomografia computadorizada | Controle motor | Medidas de conforto Midazolama Dexmedetomidina |
| Ecocardiograma | |||
| Eletroencefalograma | |||
| Ultrassonografia | |||
| Procedimentos associados a dor leve e alto grau de ansiedade | Troca de traqueostomia | Analgesia Sedação Controle motor Redução da ansiedade | Medidas de conforto Midazolamb Cetamina Analgesia tópica ou local |
| Troca de gastrostomia | |||
| Procedimentos dentários | |||
| Nasofibroscopia | |||
| Punção venosa periférica | |||
| Sutura | |||
| Punção lombar | |||
| Procedimentos associados a alto nível de dor, alto grau de ansiedade ou ambos | Drenagem de abscesso | Sedação Analgesia Controle motor Redução da ansiedade Amnésia | Fentanil Midazolam+Fentanil Cetamina Cetamina+Propofol Propofol+Fentanil Morfina |
| Artrocentese | |||
| Aspiração de medula óssea | |||
| Punção pericárdica | |||
| Cardioversão | |||
| Punção venosa central | |||
| Debridamento de queimaduras | |||
| Redução de fraturas | |||
| Redução de hérnia | |||
| Redução de parafimose | |||
| Toracocentese | |||
| Drenagem torácica | |||
| Paracentese | |||
| Exame físico de vítimas de violência sexual | |||
Características farmacológicas das drogas usadas em sedação e analgesia
| Droga | Efeitos | Efeito colateral | Indicações | Dose | Início de ação | Duração da ação |
|---|---|---|---|---|---|---|
| Sedativo‐hipnóticas | ||||||
| Midazolam | Sedação, controle motor, redução de ansiedade, sem efeito analgésico | Hipotensão, depressão respiratória, efeito paradoxal | Procedimentos que requerem sedação, Redução da ansiedade ou amnésia | IV (idade 6 meses‐5 anos): inicial 0,05‐0.1 mg/ kg, máximo de 0,6 mg/kg IV (6‐12 anos): inicial 0,025‐0,05 mg/kg, máximo de 0,4 mg/kg IM: 0,1‐0,15 mg/kg VO: 0,5‐0,75 mg/kg IN: 0,2‐0,5 mg/kg VR: 0,25‐0,5 mg/kg | 2‐3 min 2‐3 min 10‐20 min 15‐30 min 10‐15 min 10‐30 min | 45‐60 min 45‐60 min 60‐120 min 60‐90 min 60 min 60‐90 min |
| Diazepam | Sedação, controle motor, redução de ansiedade, sem efeito analgésico | Hipotensão, depressão respiratória, efeito paradoxal | Pouco usado devido à meia vida longa | IV: inicial 0,05‐0,1 mg/kg, Max 0,25 mg/kg | 2‐3min | 45‐60 min |
| Propofol | Sedação rápida e curta | Pode causar dor à infusão, hipotensão, apneia e bradicardia | Procedimentos de curta duração, associados ou não a analgésicos | IV: 1‐2 mg/kg, pode repetir 0,5 mg/kg a cada 3‐5 minutos | 1 min | 5‐15 min |
| Etomidato | Sedação rápida e curta | Pode causar dor local, mioclônus, supressão adrenal transitória | Procedimentos de curta duração, associados ou não a analgésicos | IV: 0,2‐0,3 mg/kg | 30‐60 s | 5‐15 min |
| Dexmedetomidina | Sedação com manutenção do drive respiratório Não altera traçado do EEG Uso off label na pediatria | Pode causar arritmia, hipotensão e hipertensão | Procedimentos de imagem (TC e RNM), endoscopia, EEG | IV: 2 mcg/kg IN/Mucosal oral: 1‐3 mcg/kg IM: 1‐4,5 mcg/kg Oral: 5 mcg/kg | 5‐10 min | 60‐120 min |
| Analgésicos | ||||||
| Fentanil | Analgesia | Bradicardia, rigidez torácica, depressão respiratória | Procedimentos com dor moderada a severa | IV: 1,0μg/kg/dose, pode ser repetido a cada 3 min IN: 1,5μg/kg/dose | 2‐3 min 2‐5 min | 30‐60 min 30‐60 min |
| Morfina | Analgesia | Liberação de histamina, hipotensão, náuseas, redução da motilidade gastrointestinal | Procedimentos com dor moderada a severa | IV: inicial 0,05‐0,15 mg/kg, pode ser repetida a cada 5 min | 5‐10 min | 30‐60 min |
| Cetamina | Agende dissociativo com propriedades analgésicas e sedativas | Laringoespasmo, hipersalivação, reações de emergência, vômitos | Procedimentos dolorosos de curta duração ou quando a amnésia é desejada | IV: 1‐2 mg/kg, pode repetir 0,5‐1 mg/kg a cada 5‐10 minutos IM: 2‐5 mg/kg pode repetir 2‐4 mg/kg após 10 minutos IN: 1‐9 mg/kg | IV: 1 min IM: 3‐5 min | EV: 15 min (dissociação), 60min (recuperação) IM: 15‐30min (dissociação), 90‐150 (recuperação) |
| Antídotos | ||||||
| Flumazenil | Reversor de benzodiazepínicos | Aumento da pressão intracraniana, redução do limiar convulsivo | Reversão de efeitos indesejados | IV: 0,02 mg/kg/dose, pode ser repetido a cada min até o máximo de 1 mg | 1‐2 min | 30‐60 min |
| Naloxone | Reversor de opioides | Náuseas, ansiedade, estimulação simpática, hipertensão, taquicardia, edema pulmonar, retorno da dor | Reversão de efeitos indesejados | IV ou IM: 0,1 mg/kg/dose, máximo de 2 mg/dose; pode ser repetido a cada 2 min se necessárioa | IV: 2 min IM: 10‐15 min | IV: 20‐40 min IM: 60‐90 min |
IM, intramuscular; IN, intranasal; IV, intravenoso; VO, via oral; VR, via retal.
Os benzodiazepínicos são agentes sedativos hipnóticos. Seu mecanismo de ação se dá através de efeito inibitório no sistema nervoso central (SNC). Ligam‐se a receptores do ácido gama‐aminobutírico (Gaba) pós‐sinápticos e aumentam a permeabilidade a íons cloro, ocasionam hiperpolarização e estabilização da membrana neuronal. Sua metabolização é hepática e a eliminação é renal. Seus efeitos farmacológicos são sedação, hipnose, redução de ansiedade, amnésia, relaxamento muscular e anticonvulsivante. Esse grupo não tem efeito analgésico, deve ser associado a outros agentes, como opioides, se forem usados em procedimentos dolorosos.49 As duas principais drogas do grupo usadas para sedação em procedimentos são o diazepam e o midazolam.
O diazepam foi amplamente usado para sedação, porém pode causar sedações prolongas por ter meia vida longa e variável. Seu uso tem sido substituído pelo midazolam, desde que esse chegou ao mercado, devido à variabilidade de rotas de administração e à menor duração.1 Wright et al. em estudo prospectivo multicêntrico randomizado, compararam diazepam e midazolan para sedação em procedimentos em departamento de emergência, observaram que pacientes que receberam o midazolam obtiveram maior grau de sedação precoce, maior escore em 90 minutos na escala de alerta, menor necessidade de nova dose durante o procedimento e menos dor durante a infusão.50
MidazolamMidazolam é o sedativo intravenoso mais usado no departamento de emergência para adultos e crianças. Ilkhanipour et al. conduziram uma pesquisa em 80 programas de residência de emergência nos EUA e encontraram 82% das instituições que usavam o midazolam como droga de escolha para sedação de pacientes pediátricos no departamento de emergência.51 Estudo conduzido no Brasil por Sukys et al. em um pronto‐socorro pediátrico constatou que o midazolam foi o sedativo de escolha em 80% dos eventos de sequência rápidas de intubação.52 A justificativa para tal fato é o rápido início de ação, a curta duração, amnésia anterógrada e grande variedade de vias de administração.
O midazolam é metabolizado pelo citocromo p450, portanto o efeito de primeira passagem deve ser considerado como dependente da via de administração. Além disso, sua metabolização pode ser comprometida na presença de processos inflamatórios, hipoxemia ou uso de outras drogas metabolizadas pela mesma via. Tem alta afinidade proteica (97%). Assim, na presença de outras medicações com a mesma característica, há aumento da fração livre de midazolam circulante. Sua eliminação é 80% por via renal.49 Devido a essas características farmacológicas, deve ser administrado com cautela em pacientes hepatopatas e nefropatas. A meia‐vida do midazolam também pode estar aumentada em neonatos, devido à imaturidade da função renal e hepática.53
Pode ser usado nas vias oral (VO), retal (VR), intranasal (IN), intramuscular (IM) e intravenosa (IV). A apresentação IV (5mg/ml) pode ser usada em qualquer via de administração, porém tem efeito irritativo nas mucosas.54 A apresentação oral tem menor concentração (2mg/ml), é mais palatável, o que resulta em melhor aceitação pelos pacientes, segundo opinião de especialistas.55 Smith et al., em estudo randomizado com 77 pacientes pediátricos, observou menor desconforto quando lidocaína 4% atomizada IN foi usada como pré‐medicação.56 Chiaretti et al., em estudo com 46 crianças submetidas a sedação para procedimentos não dolorosos, não encontraram desconforto ou dor relacionados ao uso de midazolam IN quando em associação com lidocaína spray como pré‐medicação.57
Os principais efeitos colaterais são hipotensão, depressão respiratória e efeito paradoxal. O midazolam reduz a resistência vascular periférica e a ação do sistema nervoso simpático, o que diminui o débito cardíaco, com implicação principalmente em pacientes hipovolêmicos ou naqueles com cardiopatias cianogênicas. A depressão respiratória é dose‐dependente. No uso combinado com opioides, há maior risco de hipotensão e depressão respiratória. Por outro lado, o efeito paradoxal é reduzido nessa associação.1,58
FlumazenilO flumazenil é um antagonista de benzodiazepínicos de ação central, a administração é exclusivamente intravenosa. A reversão dos efeitos dos benzodiazepínicos é contrária ao seu aparecimento durante a sedação, ou seja, pequenas doses do midazolam são necessárias para gerar efeito ansiolítico, ao passo que doses mais altas do flumazenil são necessárias para reverter esse efeito. Por outro lado, altas doses do midazolam são necessárias para induzir sedação profunda, enquanto pequenas doses do flumazenil revertem esse efeito. Os efeitos colaterais são elevação da pressão intracraniana e diminuição do limiar convulsivo, por isso deve ser usado com cautela em pacientes que usem medicações que podem induzir convulsão (antidepressivos tricíclicos, cocaína, lítio, metilxantinas, isoniazida, inibidores da monoaminaoxidase, bupropiona, teofilina).59
OpioidesOs opioides modulam a percepção cortical da dor. Agem através da ligação a receptores μ, δ e κ centrais e periféricos, causam hiperpolarização celular, diminuem a liberação de neurotransmissores. Sua principal indicação é para alívio da dor moderada a grave.12,13 Morfina e fentanil são os opioides mais usados na prática clínica.
MorfinaA morfina é um opioide com início de ação demorado (5‐10 min) e duração prolongada (120‐180 min). O atraso no efeito clínico ocorre devido à solubilidade lipídica relativamente baixa. Sofre metabolismo de primeira passagem significativo. Assim, as doses orais devem ser seis vezes maiores do que as doses parenterais para obter o mesmo grau de analgesia.60,61 Está indicada em procedimentos em que se deseja manter analgesia por mais tempo, como, por exemplo, na fixação de fraturas. Barcelos et al. compararam morfina (0,1 mg/Kg) e cetamina (2 mg/Kg), ambas associadas ao midazolan (0,2 mg/Kg), para analgesia na redução de fraturas em 25 crianças em um departamento de emergência e não encontraram diferença estatística com relação à taxa de falha, ao tempo de início do procedimento, ao tempo de permanência no hospital, às escalas de dor ou à taxa de satisfação de pais e ortopedistas.62 Outro uso recorrente na prática clínica é no alívio da dor intensa aguda ou crônica, como no paciente com doença falciforme.63
A metabolização da morfina é hepática e extra‐hepática, os metabólitos são excretados na urina. Em pacientes menores de seis meses, os mecanismos de metabolização estão imaturos e há evidências de depuração diminuída em crianças com instabilidade cardiovascular.61,64 McRorie et al. observaram que as crianças que receberam morfina IV após cirurgia cardíaca atingiam os valores de depuração da morfina adultos aos seis meses.65 Em outro estudo, Lynn et al. identificaram valores de depuração de morfina de adulto nos lactentes por volta de um a três meses.66 A variabilidade de duração de morfina é alta, o que torna difícil prever a duração dos efeitos da morfina.
A morfina estimula a liberação de quantidades significativas de histamina e inibe respostas simpáticas compensatórias. Esse efeito pode causar broncoconstrição e ser deletério em asmáticos. A vasodilatação produzida pela histamina pode resultar em hipotensão, especialmente com a administração em infusão rápida.67
Efeitos colaterais gastrointestinais importantes também são observados com o uso de morfina, como náuseas e vômitos que podem ocorrer em até 40% dos pacientes, efeito que tende a diminuir com doses repetidas da medicação. Outro efeito, que é comum a todos os opioides, é o aumento do tônus e a redução da motilidade gastrointestinal.67
A descontinuação da infusão de morfina está associada a fenômenos de abstinência. Os sinais e sintomas incluem dilatação pupilar, lacrimejamento, sudorese, arrepios na pele, hipertensão, febre, vômitos, dor abdominal, diarreia, dores musculares e articulares e alterações comportamentais.68
FentanilO fentanil é um opioide sintético com cerca de 100 vezes a potência analgésica da morfina. É altamente lipossolúvel, o que explica seu rápido início de ação. Tem meia‐vida de 2‐4 horas na administração intermitente e de 21 horas após a infusão contínua prolongada. Essa diferença acontece devido à saturação dos receptores opiáceos nos tecidos periféricos lipofílicos.69,70
O metabolismo do fentanil ocorre quase exclusivamente no fígado, não tem metabólitos ativos e pequena fração é excretada inalterada na urina. Lactentes e crianças jovens têm uma maior depuração do que crianças mais velhas e adultos, que muitas vezes exigem doses mais frequentes. Singleton et al. avaliaram a concentração plasmática de fentanil em três grupos etários e encontraram uma concentração plasmática maior de fentanil nos adultos em relação às crianças e uma concentração menor ainda nos lactentes.71
Algumas propriedades do fentanil têm implicação clínica, por exemplo as alterações do pH no sangue podem alterar sua ionização e distribuição entre o plasma e SNC e pacientes com acidose podem ter um aumento da fração livre de fentanil, o que os coloca em maior risco de toxicidade.72
Estudos têm demonstrado que o fentanil administrado por vias opcionais é eficiente para alívio da dor. Miner et al., em estudo clínico randomizado feito com 41 crianças que receberam 1,5 mcg/Kg de fentanil IV ou 3 mcg/Kg de fentanil nebulizador, mostraram resultado semelhante no escore de melhoria da dor.73 Borland et al., em estudo que comparou fentanil IN na dose de 1,7 mcg/Kg com morfina IV na dose de 0,1 mg/Kg, demonstraram melhoria semelhante nos escores de dor nos dois grupos de pacientes pediátricos submetidos a redução de fraturas.74 Resultados semelhantes foram alcançados por Young et al., que compararam fentanil intranasal (1 mcg/Kg) com morfina IM (0,2 mg/Kg) na redução de fraturas em pacientes pediátricos, a tolerância à administração foi melhor no grupo do fentanil IN.75
O fentanil pode causar comprometimento hemodinâmico através da redução do débito cardíaco induzido pela bradicardia.58 Um efeito adverso amplamente descrito, embora raro, é a rigidez da parede torácica, que está associada com doses elevadas, acima de 5 mcg/kg administradas em bólus.60
Depressão respiratória é efeito colateral presente, comum a todos os opioides, e está relacionada à dose empregada. A incidência de depressão respiratória é significativamente maior quando os opioides são usados em combinação com benzodiazepínicos. Roback et al. analisaram a ocorrência de efeitos colaterais em 2.500 pacientes submetidos a sedação e analgesia em um departamento de emergência pediátrica nos EUA e encontraram taxa de eventos adversos respiratórios de 19,3% quando havia associação de midazolam e fentanil e de 5,8% quando midazolam era administrado isoladamente.59,76
As vantagens potenciais do fentanil em relação à morfina são: início de ação mais rápido, meia‐vida mais curta e o fato de não causar liberação de histamina, apresenta baixa incidência de náuseas, vômitos e prurido generalizado. Além disso, não há reação cruzada com a alergia a morfina.77
NaloxoneO naloxone é um antagonista do receptor de opioides. As vias de administração mais usadas são intravenosa e intramuscular, porém também pode ser administrado pelas vias subcutânea, sublingual e endotraqueal. A dosagem varia de acordo com o efeito desejado, ou seja, redução parcial do efeito dos opioide (0,01‐0,03 mg/Kg) ou reversão completa (0,1‐2 mg/Kg). Após administração observa‐se retorno da respiração em 1‐2 min, pode haver taquipneia transitória. As doses podem ser repetidas a cada dois minutos, caso o efeito esperado não seja obtido, ou a reversão tenha sido transitória, já que a meia‐vida do naloxone é menor do que a dos opioides.78
Efeitos colaterais possíveis são náuseas, ansiedade, estimulação simpática, hipertensão, taquicardia, edema pulmonar e retorno da dor. Em baixa dose, o naloxone parece reduzir a náusea causada pelos opioides. Metanálise conduzida por Barrons e Woods concluiu que o uso do naloxone reduz a ocorrência de náusea pós‐operatória, sem aumentar significativamente a necessidade de doses extras de opioides e sem aumento dos escores de dor. No entanto, não houve diminuição da ocorrência de vômitos.79
CetaminaA cetamina é um agente anestésico dissociativo que atua no receptor do N‐metil‐D‐aspartato‐glutamato, desconecta os sistemas límbico e talamocortical, dissocia o sistema nervoso central de estímulos externos. O estado cataléptico permite uma analgesia potente, sedação e amnésia, mantém a patência das vias aéreas, seus estímulos protetores e a estabilidade cardiovascular.10
É amplamente usada em procedimentos dolorosos de curta duração ou naqueles em que a amnésia é desejada, como para exame físico de pacientes vítimas de abuso.80 Não é recomendada para sedação para tomografia computadorizada (TC) de crânio ou RM, pois o estado dissociativo pode produzir movimentos inadequados e resultar em pior qualidade da imagem. Tem metabolismo hepático e excreção predominantemente urinária (91%).10
É tipicamente administrada por via intravenosa ou intramuscular, pode ainda ser administrada pelas vias intranasal e oral. A via IV permite uma recuperação mais rápida e menor tempo até a alta; enquanto a via IM é um preditor independente de êmese.81,82 Em um estudo randomizado, a administração de doses maiores de cetamina (1,5 e 2 mg/kg) em comparação com uma dose menor (1 mg/kg) diminuiu a necessidade de novas doses para atingir sedação adequada (2,9% e 5% contra 16%), sem aumento dos riscos de efeitos adversos (14,3% e 10% contra 10%) ou da duração da sedação em minutos (24,5 min e 23 min contra 23 min).83
A cetamina pode causar laringoespasmo e apneia transitórios, hipersalivação, vômitos e agitação na recuperação. Inibe a recaptação de catecolaminas, resulta em efeito simpatomimético que resulta em aumento da pressão arterial, frequência cardíaca e débito cardíaco. Um estudo prospectivo com 11 pacientes adultos com cardiopatia isquêmica demonstrou redução da função sistólica e diastólica do ventrículo esquerdo.84 A redução da pressão sistólica secundária à diminuição da fração de ejeção após a cetamina foi demonstrada em um pequeno grupo de pacientes na faixa etária pediátrica.85 Os efeitos catecolaminérgicos mascaram a depressão miocárdica. Ainda são necessários mais estudos para esclarecer os efeitos hemodinâmicos provocados por essa droga.
O fenômeno de emergência pós‐sedação com cetamina, raro na pediatria, pode manifestar‐se por choro, sonhos lúcidos, alucinações e mais raramente por delírio grave. É mais comum em adolescentes, quando a droga é administrada por via intramuscular ou em altas doses.86,87 Não há evidência de que a infusão de midazolam como pré‐medicação à cetamina reduza a incidência de fenômenos de emergência. Wathen et al. encontraram taxas semelhantes de fenômeno de emergência entre os pacientes pediátricos que receberam cetamina isoladamente (7,1%) e nos que a receberam em associação ao midazolam (6,2%).88 Outro estudo publicado por Sherwin et al. também não demonstrou benefício adicional do midazolam para prevenção de fenômenos de emergência.89
A cetamina é contraindicada em pacientes menores de três meses pelos riscos de complicações de vias aéreas e em pacientes esquizofrênicos pelo risco de estímulo psicótico.90 Os fatores de risco para eventos adversos de vias aéreas e respiração são doses intravenosas elevadas, idade menor de dois anos e maior de 13 e a coadministração de anticolinérgicos e benzodiazepínicos.91 O uso associado da atropina pode reduzir a hipersalivação, porém não reduz a frequência de eventos adversos.92 Dois estudos randomizados evidenciaram a redução da hipersalivação no uso profilático da atropina, sem impacto positivo na taxa de eventos adversos.93,94
O uso da cetamina deve ser evitado em pacientes cardiopatas, com patologias pulmonares ativas e anomalias do sistema nervoso central. Atualmente não há contraindicação ao seu uso em traumatismo cranioencefálico, pois não se observa o aumento do risco de hipertensão intracraniana ou complicações neurológicas, mesmo nos casos graves.95–98 Revisão sistemática não evidenciou diferença significativa da pressão de perfusão cerebral, no desfecho neurológico, no tempo de permanência em unidade de terapia intensiva (UTI) ou na mortalidade quando se comparou o uso da cetamina com outros sedativos.99 Entretanto, ainda permanece a contraindicação relativa em pacientes com massas intracranianas, alteração anatômica intracraniana e hidrocefalia.100
PropofolO propofol é um agente sedativo hipnótico com propriedades anestésicas de ação rápida e curta, corresponde ao 2,6‐ diisopropilfenol, que exerce sua ação hipnótica pela ativação do Gaba, um neurotransmissor central inibitório.101,102 Pode ser usado para procedimentos breves, associado ou não a agentes analgésicos, como fentanil e cetamina.103,104
Para procedimentos mais prolongados, como na sedação para RM, o propofol pode ser usado sob infusão contínua.105 Sebe et al. publicaram um estudo pediátrico prospectivo com uma coorte de 200 pacientes pediátricos submetidos a exames de imagem no qual o uso do propofol foi mais eficaz do que o do midazolam com relação à efetividade da sedação e ao menor tempo de recuperação, sem diferença estatística na taxa de eventos adversos entre as drogas.106 Estudos que compararam propofol, pentobarbital e dexmedetomidina na sedação para RM também foram favoráveis à primeira droga.107–109 Estudos de imagem mais complexos e demorados podem ser feitos de forma eficaz com infusão contínua, sem aumento do tempo de recuperação ou do risco de efeitos adversos.110
O metabolismo do propofol é hepático, a eliminação é bifásica (com uma fase inicial aos 40 minutos e terminal entre 4‐7 horas) e a excreção é urinária em sua maioria (88%). A administração é exclusivamente intravenosa, geralmente associada à dor durante a infusão, efeito que pode ser reduzido com o pré‐tratamento da veia com lidocaína, ou seja, administração de pequenas doses de opioide ou cetamina previamente ou infusão em veias de grandes calibres.111
O propofol tem efeitos cardiovasculares diversos, a hipotensão é o mais significante.112 Essa se deve à vasodilatação arterial pela diminuição do tônus simpático, mas também por afetar a contratilidade miocárdica e o débito cardíaco.113 Esses efeitos podem ser exacerbados em pacientes hipovolêmicos ou com cardiopatia preexistente ou com o uso concomitante de outras drogas cardiodepressoras. A administração de bólus de 20 mL/kg de soro fisiológico 0,9% previamente à infusão do propofol não reduziu o risco de hipotensão em pacientes pediátricos em relação ao grupo controle em um estudo randomizado publicado por Jager et al.114 A diminuição da resistência vascular sistêmica que a droga induz pode ser prejudicial em pacientes com cardiopatia congênita, entretanto a frequência cardíaca não sofre variações significativas. A apneia e a obstrução de vias aéreas é frequente, mesmo com doses habituais, já que o propofol deprime o SNC, pode reduzir a frequência respiratória e os volumes pulmonares.115 O risco de depressão respiratória aumenta proporcionalmente à rapidez da infusão, assim como o risco de bradicardia e hipotensão é associado a doses maiores.116,117 É contraindicado em pacientes com alergia a ovo, soja e seus derivados.118
Apesar dos efeitos adversos, o uso do propofol é seguro e eficaz quando feito com monitoramento adequado. Mallory et al., em estudo retrospectivo que analisou 25.433 episódios de sedação com propofol, evidenciaram uma taxa de eventos adversos graves, como obstrução de vias aéreas, apneia e queda de saturação de oxigênio, em 2,2%, sem relato de morte associada a essa droga.104 Chiaretti et al. revisaram 36.156 procedimentos e obtiveram taxa de complicações equivalentes ainda menor, de 0,75%.119
A síndrome da infusão do propofol é definida como uma bradicardia aguda refratária que progride para assistolia, acidose metabólica, rabdomiólise, hiperlipidemia e esteatose hepática, é descrita em pacientes pediátricos gravemente enfermos que fazem o uso contínuo dessa medicação por tempo prolongado (> 48 h) e em doses altas (> 4 mcg/kg/min).120
KetofolO uso da cetamina e propofol em associação, conhecido como “ketofol”, tem se tornado popular devido à possibilidade de contrabalancear os efeitos colaterais de cada uma das medicações, potencializar a sedação e aumentar a eficácia e a segurança.121 A cetamina mantém o drive respiratório, evita a hipotensão e a bradicardia, além de proporcionar analgesia, já o propofol reduz a incidência de náusea e vômitos, além de hipoteticamente prevenir reações de emergência.122
Quando comparado com o propofol como droga única, o uso do ketofol em pacientes pediátricos resultou em menos eventos adversos respiratórios, hipotensão e bradicardia, além de menor número de doses adicionais da droga.123 Uma metanálise com 932 pacientes evidenciou menos eventos adversos respiratórios com o grupo do ketofol comparado com o do propofol (29% vs. 35,4%) sem diferença significante na proporção de eventos adversos gerais (38,8% vs. 42,5%).124 Outra metanálise de Jalili et al. demonstrou que o ketofol reduziu significativamente as complicações respiratórias e cardiovasculares (hipotensão e bradicardia).125
Ainda não há consenso sobre qual a dose de cada droga deve ser usada quando em combinação, sugere‐se a dose inicial de 0,5 mg/kg de propofol e 1 mg/kg de cetamina. Não foi observada diferença na qualidade da sedação ou no perfil de segurança entre misturas nas proporções 1:1 e 1:4 de cetamina e propofol em adultos.126 Mais estudos sobre o uso do ketofol em pacientes pediátricos são necessários para elucidar suas vantagens e desvantagens como agente sedativo.127
DexmedetomidinaA dexmedetomidina (DEX) é um agonista alfa‐2 adrenérgico com ação não mediada pelo Gaba, que promove sedação sem diminuição do drive respiratório.128 Apesar do seu uso off‐label na pediatria, seu uso tem aumentado para procedimentos curtos e também para situações que demandam sedação prolongada.129 Pode ser usado como agente único ou combinado com midazolam, cetamina ou opioides.130,131 No departamento de emergência, é principalmente empregada para estudos de imagem.132,133 Devido à sua característica farmacológica única, a DEX é usada para indução de um padrão de eletroencefalograma (EEG) similar ao do sono natural.134,135 É uma opção eficaz ao midazolam na sedação durante endoscopia digestiva alta, com melhor potencial de sedação e menos efeitos adversos.136
Tem metabolismo hepático e excreção urinária (95%), as vias de administração são intravenosa, intranasal, mucosa oral e oral gástrica, essa última de menor biodisponibilidade.128 Pode causar hipotensão, bradicardia e arritmia sinusal.130,137 Por suas características farmacológicas e suas aplicações clínicas, a dexmedetomidina parece ser uma boa opção ao uso do hidrato de cloral nos departamentos de emergência de pediatria após a recente interrupção do uso desse no país.
Apesar de seu uso não ser liberado pela agência Food And Drug Administration para a pediatria pela falta de dados que demonstrem seu perfil de segurança, estudos já demonstraram que se trata de um sedativo seguro, principalmente no contexto da UTI adulto e pediátrica.138 Constantin et al. publicaram uma metanálise de 1994 pacientes adultos em UTI, evidenciaram uma redução no tempo de internação, tempo de ventilação mecânica e de ocorrência de delírio em 48 horas, porém se observou aumento de casos de bradicardia e hipotensão.139 Berkenbosch et al., em estudo pediátrico prospectivo, demonstraram eficácia e segurança da dexmedetomidina para procedimentos não invasivos.140
EtomidatoO etomidato é um derivado imidazólico usado como agente sedativo‐hipnótico de ação ultrarrápida que se liga a receptores Gaba no sistema nervoso central. Comumente usado na sequência rápida de intubação em crianças, pode ser empregado em procedimentos não dolorosos de curta duração, como TC de crânio, e em procedimentos dolorosos associados a uma droga analgésica. Tem pouca repercussão hemodinâmica e os efeitos respiratórios são raros.141,142
Trata‐se de droga altamente lipofílica, com metabolismo hepático e excreção urinária (75%). Tem administração exclusivamente intravenosa, pode haver irritação no local da infusão, é preferível usar em veias de maior calibre ou em associação com lidocaína.141 Pode causar mioclônus (sem repercussão ao EEG), náusea, vômito, apneia e hipoventilação.142,143 Di Liddo et al. compararam etomidato e midazolam na sedação de pacientes pediátricos submetidos à redução de fraturas e evidenciaram uma maior proporção de pacientes adequadamente sedados no grupo do etomidato (92% vs. 36%) e com menor tempo de indução e recuperação.144
Como o etomidato inibe a enzima 11‐beta‐hidroxilase, a qual participa da produção de hormônios adrenais, uma dose única pode suprimir a resposta induzida pelo estresse na produção de cortisol pode durar de 6‐8 h.145,146 Dessa forma, o uso dessa droga em pacientes sépticos ou criticamente enfermos, ainda que em dose única, permanece controverso.145 Por outro lado, o uso em pacientes saudáveis parece ser bem tolerado.147 Dois estudos prospectivos randomizados em adultos não demonstraram aumento da morbimortalidade ou do tempo de permanência hospitalar quando um bólus de etomidato foi administrado na sequência rápida de intubação.148
ConclusãoProcedimentos diagnósticos e terapêuticos dolorosos que frequentemente exigem a colaboração do paciente são frequentes na prática da urgência e emergência pediátrica. A indicação da analgesia e sedação para tais procedimentos deve ocorrer após avaliação criteriosa do paciente, considerar a finalidade, os riscos e os benefícios associados ao procedimento e ao uso de medicações. O emprego de protocolos para esse fim deve orientar o profissional na escolha da medicação, do material adequado e na avaliação dos critérios de alta e garantir, assim, a qualidade na assistência. Analgesia e sedação para procedimentos exigem treinamento das equipes de saúde, com vistas à segurança e efetividade. Estudos têm demonstrado quais as melhores escolhas farmacológicas para determinados procedimentos, levam‐se em conta a idade e o estado de saúde de cada paciente, o que torna a sedoanalgesia uma prática cada vez mais comum e mais segura no pronto‐socorro pediátrico.
Conflitos de interesseOs autores declaram não haver conflitos de interesse.
Como citar este artigo: Ramalho CE, Bretas PM, Schvartsman C, Reis AG. Sedation and analgesia for procedures in the pediatric emergency room. J Pediatr (Rio J). 2017;93:2–18.
Trabalho vinculado à Universidade de São Paulo (USP), Faculdade de Medicina, Hospital das Clínicas, Instituto da Criança, São Paulo, SP, Brasil.