To determine risk factors during neonatal hospital stay and follow‐up associated with failure to thrive in the first year of life of very low birth weight newborns.
MethodsStudy of preterm very low birth weight newborns followed from 2006 to 2013 in a public institutional hospital program. The study included newborns that attended at least one appointment in each of the three periods: Period I, up to 3 months of corrected age (CA); Period II, 4–6 months of CA; and Period III, 7–12 months of CA. The variables were analyzed by logistic regression with XLSTAT 2014 software (Microsoft®, WA, USA). Failure to thrive (Z‐score below −2 SD) was classified as a dichotomous dependent variable (0 – failure/1 – success), while the other variables were classified as explanatory variables for the hospitalization periods and for each of the follow‐up periods (I, II, and III).
ResultsChildren born adequate for gestational age increased the chance of Z‐score for weight at discharge>−2 SD (OR=10.217; 95% CI: 1.117–93.436). Metabolic bone disease and retinopathy of prematurity in Period I, as well as hospital readmissions in Periods II and III during follow‐up increased the chance of Z‐score<−2 SD.
ConclusionFailure to thrive is influenced by intrauterine factors and, subsequently, by several morbidities, both in the birth and hospitalization period, as well as in the post‐discharge period and thus, such variables should be prioritized in the follow‐up.
Determinar fatores de risco do período de internação neonatal e do seguimento ambulatorial associados à falha de crescimento no primeiro ano de vida de recém‐nascidos de muito baixo peso.
MétodosEstudo com crianças nascidas prematuras de muito baixo peso em acompanhamento de 2006 a 2013 em ambulatório de alto risco de um hospital‐escola. Incluídas aquelas que fizera pelo menos uma consulta em cada um dos três períodos assim determinados: Período I – até três meses de idade corrigida (IC); Período II – entre quatro e seis meses de IC; e Período III – entre sete e 12 meses de IC. As variáveis foram analisadas por regressão logística com o programa XLStat 2014 (Microsoft®, WA, EUA). A falha de crescimento (escore z abaixo de ‐−2 DP) foi classificada como variável dependente do tipo dicotômica (0 – falha/1 – sucesso) e as demais variáveis foram classificadas como variáveis explicativas para os períodos de internação e para cada um dos períodos de seguimento (I, II e III).
ResultadosNascer adequado para a idade gestacional aumenta a chance de apresentar escore Z do peso na alta hospitalar acima de −2 DP (OR=10,217; IC95% 1.117‐93,436). Doença metabólica óssea e retinopatia da prematuridade durante o Período I e reinternações nos Períodos II e III de seguimento aumentam a chance de escore z abaixo de −2 DP.
ConclusãoA falha de crescimento é influenciada por fatores intrauterinos e posteriormente por diversas morbidades, tanto no período da internação como no pós‐alta. Tais variáveis estudadas deveriam ter prioridade no seguimento.
Prejuízo no crescimento durante a primeira infância pode ter efeitos prejudiciais permanentes, especialmente em pacientes prematuros (PT).1 Visto que o crescimento principalmente dos nascidos de muito baixo peso (MBP) sofre influências de fatores intrauterinos, do nascimento, de variáveis durante a internação e do pós‐alta hospitalar,2 o que ocasiona problemas como alterações no neurodesenvolvimento3,4 e síndrome metabólica.5,6
Estudos abordam influências do período de internação e dos primeiros anos de vida após a alta no crescimento de crianças nascidas prematuras7–10 e demonstram que variáveis do nascimento (peso, relação peso/IG) e da internação (tempo de internação, presença de doença da membrana hialina) repercutem no crescimento em curto e longo prazo.11
Durante a internação o prematuro de muito baixo peso (PTMBP) apresenta restrição do crescimento, com taxas expressivamente inferiores às intrauterinas. A maioria desses PT nasce com peso entre os percentis 10 e 90da curva de crescimento intrauterino, considerados adequados à idade gestacional (IG) – AIG. No entanto, no momento da alta da Unidade de Terapia Intensiva Neonatal (UTIN) ou com 36 semanas de idade pós‐concepcional, encontram‐se abaixo do percentil 10da mesma curva, o que caracteriza o crescimento extrauterino restrito (CEUR). Essa situação influencia o prognóstico do PT, tanto em relação ao crescimento quanto ao desenvolvimento, e ocasiona déficit de crescimento na infância, baixa estatura e baixo peso, com repercussões na vida adulta.3,12 Fatores associados ao CEUR incluem: prática nutricional, sexo masculino, necessidade de assistência ventilatória no primeiro dia de vida, uso de suporte ventilatório por longos períodos, tempo de internação e intercorrências próprias do nascimento prematuro, como displasia broncopulmonar (DBP), enterocolite necrosante (ECN) e sepse tardia.13
O período pós‐alta hospitalar e de seguimento ambulatorial também pode ser acompanhado de complicações como DBP, que favorece intercorrências respiratórias frequentes e desencadeia internações recorrentes nos primeiros anos de vida; refluxo gastroesofágico; presença de déficits visuais e auditivos; atrasos no desenvolvimento neuropsicomotor e paralisia cerebral.14,15
Dadas as taxas atuais de sobrevivência de prematuros, especialmente aqueles PTMBP, torna‐se prudente a busca por melhores resultados em longo prazo. Constitui‐se o crescimento em ponto crítico a ser enfatizado no cuidado de recém‐nascidos prematuros. Assim, evidencia‐se a necessidade de identificar intercorrências do período de internação e pós‐alta hospitalar para compreender a dinâmica do crescimento do PT egresso da UTIN. Dessa forma, objetiva‐se, neste estudo, avaliar variáveis do período de internação na UTIN e período de seguimento ambulatorial que possam influenciar na ocorrência de falha de crescimento no PT MBP.
MétodosEstudo feito a partir de prontuários de crianças nascidas prematuras de muito baixo peso, acompanhadas em ambulatório de alto risco de um hospital‐escola do Oeste do Paraná, Brasil. Esse serviço atendeu nesse período 305 crianças egressas da UTIN. Desse total, 101 eram PTMBP, foco deste estudo.
Foram incluídos no estudo os PTMBP acompanhados de 2006 a 2013 que fizeram, após a alta hospitalar, pelo menos três consultas no Ambulatório de Alto Risco durante os primeiros 12 meses de vida, no mínimo uma consulta em cada período determinado no estudo, como segue: Período I – até três meses de idade corrigida (IC); Período II – entre quatro e seis meses de IC; e Período III – entre sete e 12 meses de IC. A IC foi considerada como a idade cronológica menos as semanas de idade gestacional ao nascimento subtraídas de 40 semanas.
Foram excluídos os pacientes com malformações congênitas graves, não internados ao nascimento na UTIN do hospital da pesquisa ou que foram a óbito durante o acompanhamento. Dos 101 PTMBP houve uma perda de 30. Desses, 22 (73%) apresentavam menos consultas ou em períodos diferentes dos determinados pelo estudo para avaliação do crescimento do RNPT. Desse modo, a amostra deste estudo foi composta de 71 PTMBP. Foi calculado pelo programa GPower 3.1, disponível em: http://www.gpower.hhu.de/en.html, o poder de análise de 0,84. Consideraram‐se na regressão logística o erro tipo 1 de 0,1; o erro tipo 2 de 0,2; e o risco relativo significativo de 2.
Para relacionar peso/IG e calcular o escore z das variáveis antropométricas peso, estatura e perímetro cefálico (PC) no nascimento e no momento da alta hospitalar foi usada a curva de Fenton e Kim (2013),1 com auxílio da Fenton Growth Chart Calculation, disponível em: http://www.ucalgary.ca/fenton/. O escore z das variáveis antropométricas dos períodos de seguimento foi calculado com a calculadora antropométrica do programa Anthro (2011), disponível em: http://www.who.int/childgrowth/software/en/. Quando havia mais consultas nos períodos estudados, era calculado o escore z de cada consulta e depois feita a média de cada período de seguimento.
Os dados foram inseridos no programa Microsoft Excel® versão 2010 (Microsoft®, WA, EUA) com o uso da a IC. Foram feitas estatísticas descritivas (mínimo, máximo, média, desvio padrão, frequência relativa). As variáveis foram analisadas quanto ao padrão de distribuição por meio do teste de Shapiro‐Wilk, seguido do teste de homogeneidade das variâncias por meio do teste F. As variáveis que se encontravam em acordo com os pressupostos de normalidade e homocedasticidade foram analisadas entre os grupos de crianças que seguiram os critérios de inclusão com aquelas que não estavam em acordo com os critérios (perdas), por meio do teste t para amostras independentes. As demais variáveis que não se encontravam em acordo com os pressupostos estatísticos foram avaliadas por meio do teste não paramétrico U de Mann‐Whitney.
As variáveis foram então analisadas por regressão logística. A falha de crescimento (escore z abaixo de −2) foi classificada como variável dependente do tipo dicotômica (0 – falha/1 – sucesso) e as demais variáveis foram classificadas como variáveis explicativas para os períodos de internação e para cada um dos períodos de seguimento (I, II e III). As variáveis explicativas do período de internação foram: gênero, classificação peso/IG; tempo de recuperação do peso de nascimento; porcentagem de peso perdido durante a internação; tempo de internação. Para o período de seguimento, as variáveis explicativas foram: refluxo gastroesofágico (RGE) – (considerado como presença de vômitos volumosos e frequentes após as mamadas); retinopatia da prematuridade (ROP – consideraram‐se os estágios 3, 4 e 5); DBP (definido como o uso de oxigênio aos 28 dias de vida); uso de oxigênio na alta hospitalar; doença metabólica óssea (DMO) – (consideradas como dosagens seriadas de fosfatase alcalina acima de 900mg/dL, cálcio e fósforo associados a critérios clínicos e radiológicos) e re‐hospitalização durante o período de seguimento pós‐alta.
Assim, foram criados modelos para os parâmetros antropométricos para o momento da alta e um modelo para cada período de seguimento após a alta da UTIN. As variáveis explicativas da internação e as pós‐natais foram aplicadas a cada modelo separadamente. Para aplicação da análise de regressão logística foi usado o modelo Logit, método stepwise foward, com tipo de resposta binária. Foi ajustada a curva ROC (receiver operating characteristic) com o modelo de Hosmer e Lemeshow. No fim do ajuste, foi calculada a sensibilidade (proporção de verdadeiros positivos) e a especificidade (proporção de verdadeiros negativos), bem como a área sob a curva ROC que representa a explicabilidade do ajuste do modelo, o que evidencia o quanto o modelo discrimina o desfecho (crescimento). Todas as análises estatísticas foram feitas com programa XLStat 2014 (disponível em: https://www.xlstat.com/en/).
O estudo foi aprovado pelo Comitê de Ética em Pesquisa em Seres Humanos da Universidade Estadual do Oeste do Paraná (Unioeste), sob o parecer número 385.407.
ResultadosForam avaliados 71 PTMBP, 36 do sexo masculino, com maioria nascida por parto cesáreo (59%) e IG média de 29,4 ± 2,8 semanas, com 70% das crianças classificadas como AIG. No momento da alta, 68 crianças (95,8%) estavam abaixo do percentil 10da curva de Fenton e Kim (2013).1 Na internação, 43 (61%) usaram nutrição parenteral (NP), em média por 21,38 ± 13,90 dias. A porcentagem de peso de nascimento perdido foi em média de 13,64 ± 6,18%. Essa perda de peso ocorreu em até 5,27 ± 2,60 dias e os PTMBP levaram em média 14,96 ± 5,82 dias para recuperar o peso de nascimento. O tempo de internação foi de 68,73 ± 27,26 dias. Na alta hospitalar, as médias de escore z para peso, comprimento e PC foram, respectivamente: −3,05 ± 1,21; −2,23 ± 1,14 e −1,5 ± 1,45.
Os 30 PTMBP não inclusos no estudo, por não preencher os critérios estabelecidos, apresentavam: IG média 29,33 ± 2,77 semanas (p = 0,895); 23 (73%) eram AIG (p = 0,541), peso médio de nascimento 1.154,16 ± 274,08g (p = 0,167); estatura 36,83 ± 2,47cm (p = 0,557), PC 27 ± 1,62cm (p = 0,288), escore Z peso de nascimento −1,0 ± 0,9 (p = 0,074). Observa‐se que quando comparadas as crianças excluídas com as incluídas no estudo apresentaram valores significativamente semelhantes.
Para os 71 PTMBP, as médias dos escores z dos períodos de seguimento I, II e III de cada variável antropométrica demonstrou que o peso variou de −2,4 ±1,3 a −1,2 ±1,3; o comprimento variou de −2,5 ±1,5 a −1,1 ±1,4 e o PC variou de −1,1 ±1,6 a −0,5 ±1,5 entre o primeiro e o terceiro períodos.
Ao nascimento, 12 (17%) PTMBP abaixo de –2 DP para o peso, 29% para a estatura e 13% para o PC. No momento da alta, 57 (80%) estavam abaixo de –2 DP para o peso. Durante o acompanhamento do Período I até o Período III houve diminuição da porcentagem de PT abaixo do escore z abaixo de –2 DP: em relação ao peso, de 49% para 27%, estatura de 61% para 25% e PC de 22% para 14% no Período III.
As morbidades mais frequentes do período de seguimento foram: RGE, ROP e DBP. A DMO foi observada nos Períodos I e II de seguimento ambulatorial. No Período I, 13 (18,3%) crianças foram re‐hospitalizidas e 12 (17%) nos Períodos II e III. A principal causa de re‐hospitalização foi por problema respiratório, pneumonia o mais frequente.
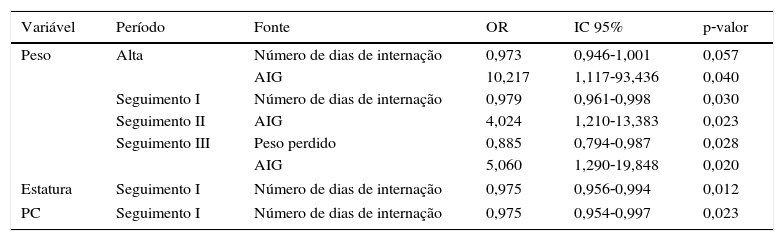
Na avaliação dos modelos preditivos, foi possível observar que o fato de ter nascido AIG faz com que as crianças tenham 10,3 vezes mais chance de apresentar escore z do peso na alta hospitalar acima de –2 (OR = 10,217; IC 95% 1,117‐93,436; p = 0,04). Além de aumentar em 4,024 e 5,060 vezes a chance de ocorrer o escore z acima de –2 do peso durante os Períodos II (OR = 4,024; IC 95% 1,210‐13,383; p = 0,023) e III (OR = 5,060; IC 95% 1,290‐19,848; p = 0,020) do seguimento ambulatorial, respectivamente (tabela 1).
Quanto maior tempo de internação do PTMBP, aumenta‐se em 1,027 vez a chance de o peso na alta hospitalar estar abaixo de –2 DP (OR = 0,973; IC 95% 0,946‐1,001; p = 0,057). Resultado semelhante foi observado para o escore z de peso, estatura e PC no Período I de seguimento ambulatorial. Quanto maior a porcentagem de peso perdido durante a internação na UTIN há 1,129 vez mais chance de falha no ganho de peso no Período III de seguimento (OR = 0,885; IC 95% 0,794‐0,987; p = 0,028) (tabela 1).
Variáveis do internamentoa e falha de crescimento no seguimento de prematuros de muito baixo peso
| Variável | Período | Fonte | OR | IC 95% | p‐valor |
|---|---|---|---|---|---|
| Peso | Alta | Número de dias de internação | 0,973 | 0,946‐1,001 | 0,057 |
| AIG | 10,217 | 1,117‐93,436 | 0,040 | ||
| Seguimento I | Número de dias de internação | 0,979 | 0,961‐0,998 | 0,030 | |
| Seguimento II | AIG | 4,024 | 1,210‐13,383 | 0,023 | |
| Seguimento III | Peso perdido | 0,885 | 0,794‐0,987 | 0,028 | |
| AIG | 5,060 | 1,290‐19,848 | 0,020 | ||
| Estatura | Seguimento I | Número de dias de internação | 0,975 | 0,956‐0,994 | 0,012 |
| PC | Seguimento I | Número de dias de internação | 0,975 | 0,954‐0,997 | 0,023 |
OR, odds ratio; IC 95%, intervalo de 95% de confiança; Período I, até três meses IC; Período II, quatro a seis meses IC; Período III, sete a 12 meses IC.
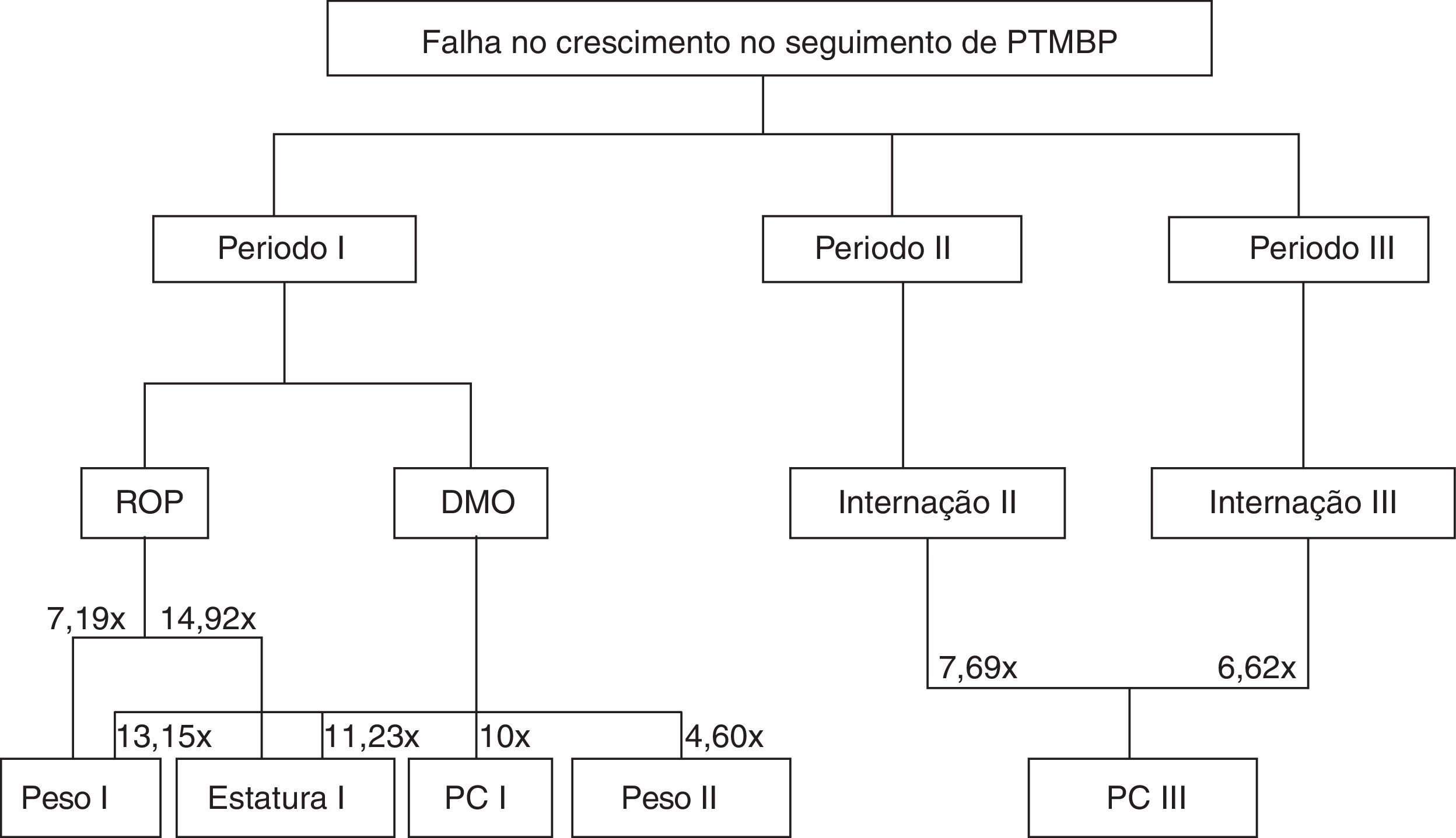
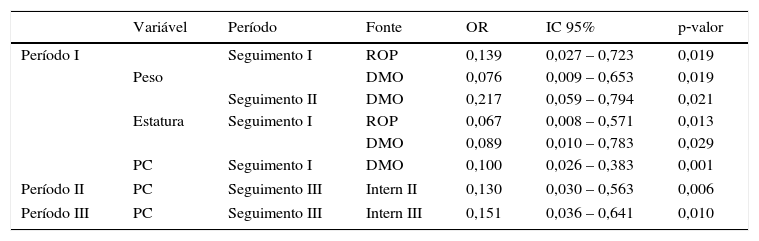
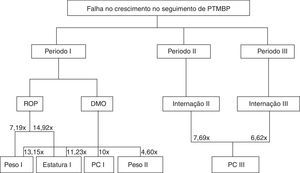
Presença de DMO no Período I aumenta o risco em mais de 10 vezes de se obter escore menor do que –2 DP no mesmo período para todos os parâmetros antropométricos avaliados. Ainda, ao longo do Período II há chance de 4,608 vezes para que o peso encontre‐se abaixo de –2 DP.
A ocorrência de ROP no Período I aumenta em 7,194 vezes o risco de falha no crescimento para peso (OR = 0,139; IC 95% 0,027‐0,723; p = 0,019) e em 14,925 vezes para estatura (OR = 0,067; IC 95% 0,008‐0,571; p = 0,013) (tabela 2).
Variáveis do seguimento ambulatoriala e falha de crescimento no seguimento de prematuros de muito baixo peso
| Variável | Período | Fonte | OR | IC 95% | p‐valor | |
|---|---|---|---|---|---|---|
| Período I | Seguimento I | ROP | 0,139 | 0,027 – 0,723 | 0,019 | |
| Peso | DMO | 0,076 | 0,009 – 0,653 | 0,019 | ||
| Seguimento II | DMO | 0,217 | 0,059 – 0,794 | 0,021 | ||
| Estatura | Seguimento I | ROP | 0,067 | 0,008 – 0,571 | 0,013 | |
| DMO | 0,089 | 0,010 – 0,783 | 0,029 | |||
| PC | Seguimento I | DMO | 0,100 | 0,026 – 0,383 | 0,001 | |
| Período II | PC | Seguimento III | Intern II | 0,130 | 0,030 – 0,563 | 0,006 |
| Período III | PC | Seguimento III | Intern III | 0,151 | 0,036 – 0,641 | 0,010 |
OR, odds ratio; IC 95%, intervalo de 95% de confiança; Período I, até três meses IC; Período II, quatro a seis meses IC; Período III, sete a 12 meses IC.
a Variáveis explicativas do período de seguimento ambulatorial até 12 meses de IC: RGE, ROP, DBP, oxigênio no momento da alta hospitalar, DMO e internação nos períodos de seguimento ambulatorial.
Re‐hospitalização no Período II aumentou em 7,692 vezes a chance de o PC estar abaixo de –2 DP no Período III (OR = 0,130; IC 95% 0,030‐0,563; p = 0,006). Assim como re‐hospitalização no Período III aumentou em 6,622 vezes o risco de escore z abaixo de –2 DP para PC (OR = 0,151; IC 95% 0,036‐0,641; p = 0,010).
Na figura 1 observa‐se um organograma da tabela 2, que demonstra as intercorrências referentes a cada período de seguimento e as falhas nas respectivas variáveis antropométricas.
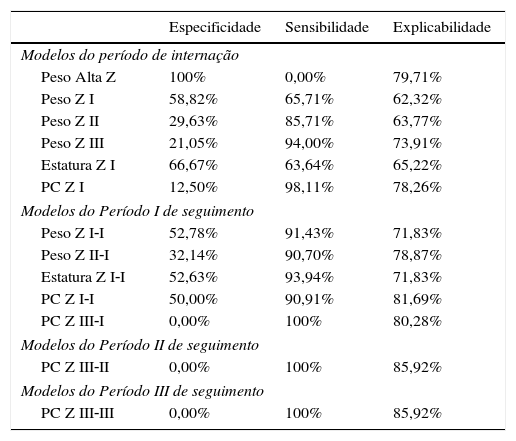
A partir da curva ROC determinou‐se a especificidade, sensibilidade e explicabilidade das variáveis do período de internação e dos três períodos de seguimento. O peso na alta parece bom preditor dentre as variáveis que compõem o modelo da internação neonatal. Já nos três períodos do seguimento ambulatorial, variações de escore \ do perímetro cefálico apresentam melhor explicabilidade (tabela 3).
Especificidade, sensibilidade e explicabilidade das variáveis do período de internação e dos períodos de seguimento
| Especificidade | Sensibilidade | Explicabilidade | |
|---|---|---|---|
| Modelos do período de internação | |||
| Peso Alta Z | 100% | 0,00% | 79,71% |
| Peso Z I | 58,82% | 65,71% | 62,32% |
| Peso Z II | 29,63% | 85,71% | 63,77% |
| Peso Z III | 21,05% | 94,00% | 73,91% |
| Estatura Z I | 66,67% | 63,64% | 65,22% |
| PC Z I | 12,50% | 98,11% | 78,26% |
| Modelos do Período I de seguimento | |||
| Peso Z I‐I | 52,78% | 91,43% | 71,83% |
| Peso Z II‐I | 32,14% | 90,70% | 78,87% |
| Estatura Z I‐I | 52,63% | 93,94% | 71,83% |
| PC Z I‐I | 50,00% | 90,91% | 81,69% |
| PC Z III‐I | 0,00% | 100% | 80,28% |
| Modelos do Período II de seguimento | |||
| PC Z III‐II | 0,00% | 100% | 85,92% |
| Modelos do Período III de seguimento | |||
| PC Z III‐III | 0,00% | 100% | 85,92% |
Período I, até três meses IC; Período II, quatro a seis meses IC; Período III, sete a 12 meses IC.
A principal variável que influenciou a falha no crescimento de PTMBP no período de internação e ao longo dos 12 meses de IC foi ter nascido pequeno para a idade gestacional (PIG); enquanto que aqueles que nasceram AIG tiveram 10,3 vezes mais chance de escore z para peso na alta hospitalar acima de –2 DP. A presença de DMO e ROP prediz risco para falha no crescimento no primeiro e segundo trimestre de vida de PTMBP. Além disso, re‐hospitalização no segundo e terceiro trimestres de idade corrigida aumentou as chances de falha de crescimento do PC em 7,7 e 6,6 vezes, respectivamente.
O crescimento extrauterino restrito (CEUR) é sempre considerado como situação de risco nas UTIN, com frequências variáveis em pesquisas feitas em diversos países: 63% na Índia,14 57% na Noruega,16 63,5% no Estado do Rio de Janeiro, Brasil7 e 39,1% em estudo feito na mesma cidade, mas aproximadamente uma década depois.17 Dentre os RNPT avaliados, houve 95,6% abaixo do percentil 10, taxa de CEUR muito mais elevada do que nos trabalhos citados. Dos PT que apresentam CEUR, 12,6% apresentam estatura abaixo de –2 DP na infância, mais comum no sexo masculino.18
Embora o escore z do peso ao nascimento tenha sido semelhante,8 no momento da alta hospitalar houve redução importante quando comparado com o escore z na alta no mesmo estudo feito no Sudeste brasileiro (3,05 x –1,79). A pesquisa ora apresentada abrange crianças nascidas antes de 2010, período em que havia diferentes rotinas em relação à nutrição. Práticas e rotinas assistenciais padronizadas de NP agressiva e enteral precoce são necessárias para tentar evitar ou minimizar o CEUR, pode‐se reduzir em até 2,17 vezes o risco de escore z ≤ –2DP7 A suplementação de colina, uridina e ácido docosahexaenoico é investigada com a intenção de melhorar o crescimento no RN de risco.19 Além disso, o fato de ter uma equipe multidisciplinar em nutrição parenteral para manejo nutricional reduz de 62,6% para 44% a incidência de CEUR.20
Nascer PIG e ter um crescimento inadequado no primeiro ano de vida são fatores de risco para alterações no crescimento aos 24 meses de IC.21 Ainda assim, semelhantemente a outros trabalhos, em que ter nascido PIG aumentou em 12,19 vezes o escore z ≤ –2 DP ao termo7 e aumentou em 3,41 vezes o risco de escore z ≤ –2 DP na alta,17 o nascer PIG também representou risco adicional para CEUR.
A falência de crescimento, queda de escore z > 0,67 nos períodos de acompanhamento, ocorreu em 28% dos PTMBP no Período II (entre quatro e oito meses de IC).22 A DBP foi preditor significativo de falência de crescimento para os períodos I (40 semanas a quatro meses de IC) e II de acompanhamento. No presente estudo não foi encontrado resultado significativo para crescimento e presença de DBP, as morbidades ocorridas no período de seguimento ambulatorial que demonstraram influenciar para falha de crescimento foram DMO e a presença de ROP. Resultados semelhantes demonstram que não houve associação com falência de crescimento e doença pulmonar crônica. Contudo, houve forte influência pela ROP severa.23
Em estudo22 com PT de extremo baixo peso, acompanhados até 20 meses de IC, a taxa de internação foi de 40% durante todo o período de acompanhamento, não houve diferença estatística entre os que apresentaram falência de crescimento (n = 62; 40%) e os que não apresentaram (n = 92; 60%). Nossa taxa de reinternação foi maior (52%) e a ocorrência de internação durante os períodos II e III aumentou a chance de falha de crescimento para o PC no Período III. Esse aspecto é particularmente relevante porque nessa fase da vida o crescimento adequado do PC é fundamental para o desenvolvimento normal.24
Diferenças no padrão de crescimento após a alta dos PTMBP devem ser consideradas. Os achados apresentados possibilitam evidenciar aumento progressivo do valor do escore z de peso, estatura e PC durante todo o acompanhamento ambulatorial. Embora aos 12 meses de IC tenhamos obtido taxas desses parâmetros antropométricos menores do que encontrados no sul do Brasil,10 as taxas de crescimento foram superiores a estudo indiano.14 Desse modo, observa‐se que se deve considerar, além das intercorrências neonatais e de seguimento, inerentes ao nascimento prematuro, o ambiente em que a criança está inserida, bem como fatores socioeconômicos, nutrição, educação e culturas regionais.2
Grande parte dos modelos das variáveis antropométricas consideradas significativas, definidos no período neonatal e Períodos I, II e III do seguimento apresentaram elevadas sensibilidades e especificidades intermediárias, ou seja, definem elevada probabilidade de detectar os casos de sucesso de crescimento e medianamente a probabilidade de detectar os casos de falha de crescimento. O PC apresentou elevada sensibilidade, mas especificidade nula, com exceção do período neonatal. A definição de três períodos para avaliação crítica do crescimento do prematuro permite um olhar mais atento do profissional para detectar falhas precoces e promover o crescimento nos padrões adequados durante esses momentos.
A partir desses achados pode‐se concluir que a principal variável que influenciou o PTMBP, ao longo do período de internação, foi ter nascido PIG, o que durante a alta hospitalar e também ao longo dos 12 meses de IC aumentou a falha de crescimento. Presença de DMO e ROP influencia significativamente no crescimento no primeiro trimestre dos primeiros 12 meses de vida de PTMBP.
Apesar de o crescimento ser também influenciado por fatores socioeconômicos maternos e familiares,25 no presente estudo não se pôde verificar essa influência, visto ser um trabalho retrospectivo. Essa informação não constava nos prontuários revisados, determinou limitação importante dos achados. Assim como o número de PT que foram excluídos da análise por não apresentar o número mínimo de três consultas durante o primeiro ano de vida constituiu‐se um limitador para ampliar os resultados deste estudo. A dificuldade de se fazer seguimento em longo prazo também é encontrada em outras realidades.26,27
O crescimento dos PTMBP, durante os primeiros 12 meses de vida, é influenciado por diversos fatores, desde a condição nutricional in utero até práticas nutricionais na UTI neonatal e no seguimento e aspectos regionais, culturais e ambientais, os quais ainda precisam ser esclarecidos em estudos futuros desenhados para essa finalidade.
Conflitos de interesseOs autores declaram não haver conflitos de interesse.
Como citar este artigo: Rover MM, Viera CS, Silveira RC, Guimarães AT, Grassiolli S. Risk factors associated with growth failure in the follow‐up of very low birth weight newborns. J Pediatr (Rio J). 2016;92:307–13.