To compare the efficacy of intravenous ibuprofen at high doses (20, 10, and 10mg/kg/dose) and at low doses (10, 5, and 5mg/kg/dose) in closure of the ductus arteriosus in preterm neonates.
MethodsA cohort study with historic control of neonates who received high‐dose and low‐dose intravenous ibuprofen, from 2010 to 2013 in the neonatal inpatient unit, for closure of the ductus arteriosus, as documented by echocardiography. Secondary outcomes included number of ibuprofen cycles, incidence of bronchopulmonary dysplasia, necrotizing enterocolitis, change in renal function, and death.
ResultsSeventy‐seven patients received 3 doses of ibuprofen for the treatment of patent ductus arteriosus, 33 received high‐dose and 44 low‐dose therapy. The ductus closed after the first cycle in 25 (56.8%) low‐dose patients and in 17 (51.5%) high‐dose patients (p>0.99). Sixteen patients received a second cycle of ibuprofen, and the ductus closed in 50% after low‐dose and in 60% after high‐dose therapy (p>0.99). Seven patients required surgery for ductus closure, 13.6% in the low‐dose group and 3% in the high‐dose group (p=0.22). Thirty‐nine patients developed bronchopulmonary dysplasia, 50% in the low‐dose group and 51.5% in the high‐dose group (p>0.99). Twenty‐two (50%) low‐dose patients died vs 15 (45.5%) high‐dose patients (p=0.86).
ConclusionsThere was no difference in closure of the ductus arteriosus or occurrence of adverse effects between the two dosing regimens.
Comparar a eficácia do ibuprofeno endovenoso em doses altas (20, 10 e 10mg/kg/dose) e em doses baixas (10, 5 e 5mg/kg/dose) para o fechamento do canal arterial em recém‐nascidos pré‐termo.
MétodosEstudo de coorte com controle histórico que pesquisou recém‐nascidos que receberam ibuprofeno endovenoso, de 2010 a 2013, na unidade de internação neonatal, em doses altas e baixas para o fechamento do canal arterial, documentado por ecocardiograma. Como desfechos secundários foram avaliados o número de ciclos de ibuprofeno feitos, a incidência de displasia broncopulmonar, enterocolite necrosante, alteração de função renal e óbito.
ResultadosReceberam três doses de ibuprofeno para tratamento do canal arterial 77 pacientes, 33 dose alta e 44 dose baixa; 25 (56,8%) dos que receberam dose baixa fecharam o canal após o 1° ciclo e 17 (51,5%) fecharam após receberem dose alta (p>0,99); 16 pacientes receberam o 2° ciclo e 50% fecharam o canal após uso de dose baixa e 60% após o uso de dose alta (p>0.99); sete pacientes foram à cirurgia para fechamento do canal, 13,6% do grupo que recebeu dose baixa e 3% dose alta (p=0,22); 39 pacientes desenvolveram displasia broncopulmonar, 50% do grupo de dose baixa e 51,5% do grupo de dose alta (p>0,99); 22 (50%) dos pacientes do grupo dose baixa evoluíram a óbito versus 15 (45,5%) dos pacientes do grupo de dose alta (p=0,86).
Conclusão: Não encontramos diferença em relação ao fechamento do canal arterial, assim como ocorrência de efeitos adversos, quando comparamos os dois esquemas posológicos.
A persistência do canal arterial (PCA) é a alteração cardíaca mais comum em recém‐nascidos pré‐termo, principalmente naqueles menores de 28 semanas de idade gestacional.1 Essa alteração causa um shunt esquerda‐direita pelo canal arterial e pode tornar‐se clinicamente evidente. Quando sintomática, aumenta a necessidade de suporte ventilatório, o risco de hemorragia intracraniana,2 de displasia broncopulmonar (DBP)3,4 e de enterocolite necosante,5 além de reduzir as taxas de sobrevida.6 Porém, não existem evidências claras sobre os resultados em longo prazo do tratamento da PCA.7 Vários ensaios clínicos randomizados falharam em demonstrar algum benefício do tratamento na sobrevida e nos desfechos em longo prazo.1,8,9
Cada vez mais tem se sugerido uma conduta mais conservadora, principalmente naqueles pacientes com boa evolução clínica. Isso se deve à alta chance de fechamento espontâneo, mais comum em recém‐nascidos com peso superior a 800 g, sem necessidade de ventilação mecânica e sem sinais de insuficiência cardíaca ou de congestão pulmonar.10,11
Naqueles pacientes nos quais o CA torna‐se clinicamente relevante e sintomático, a constrição do CA pode ser induzida com inibidores da cicloxigenase, como a indometacina e o ibuprofeno, com taxas de fechamento permanente em torno de 60‐80%.12–14 Ambos têm efeitos colaterais, mas o ibuprofeno parece ter menos efeitos negativos sobre o fluxo sanguíneo cerebral e renal e também possivelmente menos efeitos colaterais gastrointestinais.15–17
A dose padrão recomendada de ibuprofeno endovenoso para fechamento do canal arterial é de 10mg/kg no primeiro dia e 5mg/kg no segundo e terceiro dias.18,19 Entretanto, Dani et al. demonstraram que o uso de ibuprofeno em altas doses (20,10,10mg/kg/dia) é mais eficaz do que o regime padrão no fechamento do canal arterial (CA) em recém‐nascidos pré‐termo com idade gestacional menor de 29 semanas, sem aumentar a taxa de efeitos adversos.16
A partir de 2012, com o objetivo de alcançar maiores taxas de fechamento do canal arterial em recém‐nascidos pré‐termo, foi modificado o regime de doses de ibuprofeno para o tratamento farmacológico da PCA na Unidade de Internação Neonatal do Hospital de Clínicas de Porto Alegre. Passou‐se a usar doses mais altas de ibuprofeno, em vez da dose padrão anteriormente usada. Assim, passou‐se a administrar a dose de 20mg/kg de ibuprofeno para a primeira infusão intravenosa, no dia 1, seguido por 10mg/kg nos dias 2 e 3, quando os recém‐nascidos apresentavam CA hemodinamicamente significativo confirmado pelo ecocardiograma.
Neste estudo, temos como objetivo comparar a eficácia terapêutica e o impacto das duas posologias de ibuprofeno sobre as taxas de fechamento do canal arterial em recém‐nascidos pré‐termo, além de outras morbidades, como DBP, alteração renal, necessidade de cirurgia para ligadura do canal e óbito.
MétodosFoi feito um estudo de coorte com controle histórico. Foram incluídos todos os RNs pré‐termo que receberam ibuprofeno endovenoso de janeiro de 2010 até dezembro de 2013 para o tratamento do canal arterial no Serviço de Neonatologia do Hospital de Clínicas de Porto Alegre (HCPA). O HCPA é um hospital universitário de nível terciário, com capacidade para admitir até 50 recém‐nascidos. Tem 20 leitos de UTI, que comportam desde casos de menor complexidade até pré‐termos extremos e com patologias raras. O estudo foi aprovado pelo comitê de ética da instituição.
A população foi dividida em dois grupos, aqueles que receberam dose de ibuprofeno baixa (10, 5, 5mg/kg/dia – em dose única diária), tratados antes da mudança do regime de doses, e aqueles que receberam dose alta (20, 10, 10mg/kg/dia – em dose única diária) durante três dias, tratados após a mudança no protocolo assistencial.
Todos os pacientes fizeram ecocardiograma para o diagnóstico de PCA. O tratamento foi indicado naqueles que apresentavam sinais clínicos significativos com presença de sintomas respiratórios e ecocardiograma que demonstrava um shunt esquerda‐direita através do canal arterial com razão átrio‐esquerdo/raiz da aorta igual a ou maior do que 1,5mm.
Foram excluídos recém‐nascidos com malformação cardíaca congênita, aqueles sem ecocardiograma para confirmação do diagnóstico e aqueles que não completaram o tratamento devido à instabilidade clínica ou a óbito.
Os dados demográficos coletados incluíram idade gestacional, peso de nascimento, dias de vida no início do tratamento, necessidade de outros cursos de ibuprofeno, necessidade de ligadura cirúrgica, óbito e morbidades neonatais como displasia broncopulmonar (definida como necessidade de oxigênio suplementar ou de suporte ventilatório aos 28 dias de vida), enterocolite necrosante (presença de pneumatose ou perfuração intestinal), necessidade de suporte ventilatório (CPAP, ventilação mecânica não invasiva [VMNI], ventilação mecânica [VM] e ventilação de alta frequência [VAF]), presença de corioamnionite, sepse com hemocultura positiva, hemorragia peri‐intraventricular graus III e IV. Os níveis de creatinina e ureia séricos 48h antes e depois da conclusão de cada curso também foram anotados.
O fechamento do canal arterial, desfecho primário, foi definido como fechamento completo observado ao ecocardiograma.
Neste estudo, comparamos o desfecho clínico dos pacientes que receberam doses mais baixas de ibuprofeno com aqueles tratados previamente com doses mais baixas.
Análise estatísticaCálculo do tamanho da amostraPara detectar uma diferença de 30 pontos percentuais (de 40% para 10% de falha no fechamento do canal arterial), considerando um poder de 80% e um α de 0,05, foram necessários 32 pacientes em cada grupo.
Testes estatísticosOs dados foram armazenados em um banco de dados elaborado no Statistical Package for Social Sciences® versão 18.0 (SPSS Inc. Released 2009. PASW Statistics para Windows, versão 18.0, IL, EUA) e as análises estatísticas foram feitas no mesmo programa. As variáveis categóricas foram descritas através de frequência absoluta e relativa, as variáveis contínuas com distribuição simétrica pela média e desvio padrão e as assimétricas pela mediana e intervalo interquartil. As variáveis categóricas foram comparadas pelo teste exato de Fisher, as quantitativas com distribuição simétrica pelo teste t de Student e as com distribuição assimétrica pelo teste de Mann‐Whitney. O nível de significância considerado foi de 0,05.
O estudo foi aprovado pelo comitê de pesquisa da instituição e todos os pesquisadores assinaram o termo de uso de dados de prontuário’, em que se comprometeram a manter total sigilo sobre as informações acessadas.
ResultadosReceberam ibuprofeno para o fechamento do canal arterial no período citado acima 84 pacientes, sete foram excluídos, três deles por terem recebido cinco doses de ibuprofeno e não um ou dois ciclos de três doses e quatro por tratamento incompleto devido a óbito ou instabilidade clínica importante. Não houve perda devido a malformações cardíacas ou à ausência de diagnóstico por ecocardiograma. O percentual de perdas foi de 8,3%. A população estudada foi de 77 pacientes, 33 (42,8%) fizeram uso de dosa alta e 44 (57,1%) de dose baixa.
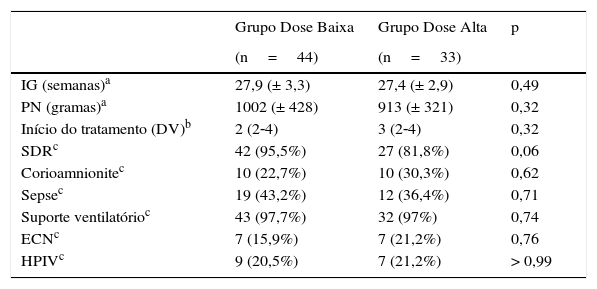
Não houve diferença significativa entre os dois grupos em relação a peso de nascimento (p=0,32), idade gestacional (p=0,49), dias de vida em que iniciaram o tratamento com ibuprofeno (p=0,32), corioamnionite (p=0,62), necessidade de suporte ventilatório (p=0,74), enterocolite necrosante (p=0,76), hemorragia per‐intraventricular (p>0,99), doença da membrana hialina (p=0,06) e infecção com cultural positivo (p=0,71) (tabela 1).
Características dos pacientes estudados
| Grupo Dose Baixa | Grupo Dose Alta | p | |
|---|---|---|---|
| (n=44) | (n=33) | ||
| IG (semanas)a | 27,9 (± 3,3) | 27,4 (± 2,9) | 0,49 |
| PN (gramas)a | 1002 (± 428) | 913 (± 321) | 0,32 |
| Início do tratamento (DV)b | 2 (2‐4) | 3 (2‐4) | 0,32 |
| SDRc | 42 (95,5%) | 27 (81,8%) | 0,06 |
| Corioamnionitec | 10 (22,7%) | 10 (30,3%) | 0,62 |
| Sepsec | 19 (43,2%) | 12 (36,4%) | 0,71 |
| Suporte ventilatórioc | 43 (97,7%) | 32 (97%) | 0,74 |
| ECNc | 7 (15,9%) | 7 (21,2%) | 0,76 |
| HPIVc | 9 (20,5%) | 7 (21,2%) | > 0,99 |
IG, idade gestacional; PN, peso de nascimento; DV, dias de vida; SDR, síndrome do desconforto respiratório; Sepse, presença de hemocultura positiva; ECN, enterocolite necrosante; HPIV, hemorragia peri‐intraventricular
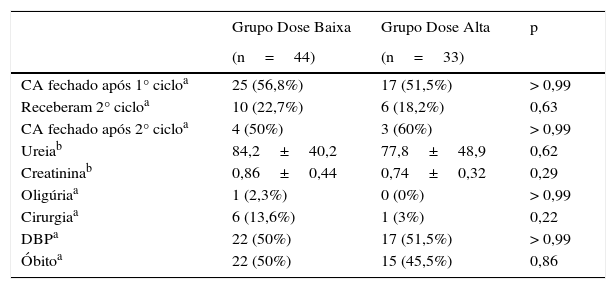
Dentre os que receberam dose baixa, 25 (56,8%) fecharam o canal após o 1° ciclo de ibuprofeno e 17 (51,5%) fecharam após receberem dose alta (p > 0,99).
Do grupo de baixa dose 22,7% dos pacientes receberam 2° ciclo versus 18,2% dos do grupo de alta dose (p=0,63).
Receberam um segundo ciclo de ibuprofeno 16 pacientes, porém apenas 13 tiveram ecocardiograma feito no fim do tratamento, oito do grupo dose baixa e cinco do grupo dose alta; quatro (50%) fecharam o canal após uso de dose baixa e três (60%) após o uso de dose alta (p>0,99).
Em relação aos desfechos secundários, sete pacientes foram a cirurgia para fechamento do canal, 13,6% do grupo que recebeu dose baixa e 3% dose alta (p=0,22); 53 pacientes (68,8%) foram avaliados no 28° dia de vida para displasia broncopulmonar, 30 do grupo dose baixa e 23 do grupo dose alta; 22 pacientes do grupo dose baixa e 17 do grupo dose alta desenvolveram DBP (p>0.99); 22 (50%) pacientes do grupo dose baixa evoluíram a óbito versus 15 (45,5%) do grupo de dose alta (p=0,86). A dosagem de ureia e creatinina após o 1° ciclo não apresentou diferença estatisticamente significativa entre os grupos (p=0,62 para ureia e p=0,29) para creatinina) e apenas um paciente, do grupo de dose baixa, apresentou oligúria (tabela 2).
Resultados do tratamento
| Grupo Dose Baixa | Grupo Dose Alta | p | |
|---|---|---|---|
| (n=44) | (n=33) | ||
| CA fechado após 1° cicloa | 25 (56,8%) | 17 (51,5%) | > 0,99 |
| Receberam 2° cicloa | 10 (22,7%) | 6 (18,2%) | 0,63 |
| CA fechado após 2° cicloa | 4 (50%) | 3 (60%) | > 0,99 |
| Ureiab | 84,2±40,2 | 77,8±48,9 | 0,62 |
| Creatininab | 0,86±0,44 | 0,74±0,32 | 0,29 |
| Oligúriaa | 1 (2,3%) | 0 (0%) | > 0,99 |
| Cirurgiaa | 6 (13,6%) | 1 (3%) | 0,22 |
| DBPa | 22 (50%) | 17 (51,5%) | > 0,99 |
| Óbitoa | 22 (50%) | 15 (45,5%) | 0,86 |
CA, canal arterial; DBP, displasia broncopulmonar.
Neste estudo não encontramos maior eficácia de doses dobradas de ibuprofeno endovenoso em relação à dose padrão para o fechamento do PCA em recém‐nascidos prematuros. Também não encontramos diferença na ocorrência de efeitos adversos em curto prazo ou morbidades neonatais quando comparados os dois regimes.
A dose ideal de ibuprofeno para o tratamento do canal arterial permanece controversa. O regime padrão é baseado em dados de farmacocinética limitados e esparsos.19–21 Desfrere et al. sugeriram que um esquema de doses mais elevadas de 20‐10‐10mg/kg/dia por três dias poderia alcançar maiores taxas de fechamento do PCA em recém‐nascidos menores de 27 semanas de idade gestacional. Entretanto, tolerabilidade e segurança deveriam ser cuidadosamente avaliadas em novos estudos antes de ser rotineiramente recomendadas.22
Meiβner et al. encontraram uma clara tendência de maior fechamento do PCA com doses mais altas sem aumento dos efeitos adversos, porém sem significância estatística.10
Hirt et al. demonstraram que com o aumento da idade pós‐natal o clearence plasmático de ibuprofeno também aumenta, resulta em uma redução da meia vida (42,2h aos três dias versus 17,7h aos cinco dias),19 provavelmente devido à maturação do citocromo P450 que metaboliza o ibuprofeno.23 Esses autores concluíram que o regime de dose de ibuprofeno deveria ser testado prospectivamente.
Com a hipótese de que o aumento da dose de ibuprofeno para o fechamento do PCA seria mais eficaz do que a dose padrão, sem aumento dos eventos adversos, Dani et al. desenharam um estudo randomizado e controlado, no qual foram estudados 70 recém‐nascidos, 35 receberam a dose padrão e 35, a dose dobrada. Os autores observaram que o regime de doses mais altas foi mais eficaz para o fechamento do PCA em recém‐nascidos prematuros menores de 27 semanas de idade gestacional sem aumento das taxas de efeitos adversos.16
Em discordância com o estudo de Dani et al.,16 o uso de altas doses de ibuprofeno em nossa análise não mostrou significância no aumento da taxa de fechamento do canal arterial. Também não encontramos diferença em relação à eficácia do segundo ciclo de tratamento entre os dois grupos. Embora não estatisticamente significativa, a necessidade de cirurgia para fechamento do canal foi maior no grupo que recebeu dose baixa de ibuprofeno. Entretanto, o número de pacientes que foram estudados não é suficiente para analisar esse desfecho de forma segura.
Em nosso estudo não houve diferença estatisticamente significativa em relação às morbimortalidades neonatais, como displasia broncopulmonar, hemorragia peri‐intraventricular, enterocolite necrosante e óbito, entre os grupos que receberam diferentes doses de ibuprofeno.
Falência renal ou oligúria é relatada em 5% a 7% dos casos tratados com ibuprofeno para o fechamento do canal arterial, porém é reversível.1 Dentre os pacientes do nosso estudo, apenas um apresentou oligúria, pertencia ao grupo dose baixa. A administração de doses mais altas foi bem tolerada e os pacientes não apresentaram efeitos adversos. Não houve diferença significativa em relação aos valores séricos de ureia e creatinina pós‐tratamento com ibuprofeno entre os dois grupos. Esses achados coincidem com os dados já publicados na literatura, nos quais somente leves efeitos adversos foram relatados.22
Para afirmar a segurança e a eficácia dos diferentes esquemas de doses de ibuprofeno, apontamos para o pequeno número de pacientes estudados como limitação de nosso estudo, além de ser um estudo retrospectivo. Porém, nos parece razoável considerar doses mais altas quando o tratamento for iniciado após o 5° dia de vida devido à farmacocinética da droga. Não foi possível analisar esse dado no nosso estudo devido ao número de pacientes estudados. Estudos prospectivos randomizados poderiam melhor elucidar essa questão.
Neste estudo não demonstramos benefício na mudança do esquema terapêutico de ibuprofeno para doses dobradas no tratamento do PCA sintomático em recém‐nascidos prematuros. Não houve diferença significativa na comparação dos dois esquemas terapêuticos.
Conflitos de interesseOs autores declaram não haver conflitos de interesse.
Como citar este artigo: Dornelles LV, Corso AL, Silveira RC, Procianoy RS. Comparison of two dose regimens of ibuprofen for the closure of patent ductus arteriosus in preterm newborns. J Pediatr (Rio J). 2016;92:314–8.
O trabalho está vinculado ao Serviço de Neonatologia, Hospital de Clínicas de Porto Alegre (HCPA), Porto Alegre, RS, Brasil.