The stable microbubble test on gastric aspirate and on amniotic fluid has been used for the diagnosis of respiratory distress syndrome in the newborn. However, no study has performed this test on oral aspirates from premature infants. The objective of this study was to evaluate the performance of the stable microbubble test on oral aspirates from preterm newborns to predict respiratory distress syndrome.
MethodThis study included infants with gestational age <34 weeks. Oral fluids were obtained immediately after birth and gastric fluids were collected within the first 30minutes of life. The samples were frozen and tested within 72hours.
ResultsThe sample was composed of paired aspirates from 64 newborns, who were divided into two groups: respiratory distress syndrome group (n=21) and control group (n=43). The median (interquartile range) of the stable microbubble count in the oral samples of infants with respiratory distress syndrome was significantly lower than that of infants who did not develop respiratory symptoms: respiratory distress syndrome group=12 (8‐22) stable microbubbles/mm2; control group=100 (48‐230) microbubbles/mm2 (p <0.001). The correlation between microbubble count in gastric and oral aspirates was 0.90 (95% confidence interval=0.85‐0.95; p <0.001). Considering a cut‐off point of 25 microbubbles/mm2, the sensitivity and the specificity of the stable microbubble test were 81.4% and 85.7%, respectively.
ConclusionThe study suggests that the stable microbubble test performed on oral aspirate is a reliable alternative to that performed on gastric fluid for the prediction of respiratory distress syndrome in the newborn.
O teste das microbolhas estáveis no aspirado gástrico e no líquido amniótico foi usado no diagnóstico da síndrome do desconforto respiratório do recém‐nascido. Contudo, nenhum estudo fez esse teste nos aspirados bucais de neonatos prematuros. O objetivo deste estudo foi avaliar o desempenho do teste das microbolhas estáveis em aspirados bucais de recém‐nascidos prematuros para prever síndrome do desconforto respiratório.
MétodoEste estudo incluiu neonatos com idade gestacional <34 semanas. Os fluidos orais foram obtidos imediatamente após o nascimento e os fluidos gástricos foram coletados nos primeiros 30 minutos de vida. As amostras foram congeladas e testadas em 72 horas.
ResultadosA amostra foi composta de aspirados pareados de 64 recém‐nascidos, divididos em dois grupos: grupo de síndrome do desconforto respiratório (n=21) e grupo de controle (n=43). A mediana (intervalo interquartil) da contagem das microbolhas estáveis nas amostras de fluido oral dos neonatos com síndrome do desconforto respiratório foi significativamente menor que a dos neonatos que não desenvolveram sintomas respiratórios: grupo de síndrome do desconforto respiratório=12 (8‐22) microbolhas estáveis/mm2; grupo de controle=100 (48‐230) microbolhas/mm2 (p <0,001). A correlação entre a contagem das microbolhas nos aspirados gástricos e bucais foi 0,90 (intervalo de confiança de 95%=0,85‐0,95; p <0,001). Considerando um ponto de corte de 25 microbolhas/mm2, a sensibilidade e a especificidade do teste das microbolhas estáveis foram 81,4% e 85,7%, respectivamente.
ConclusãoO estudo sugere que o teste das microbolhas estáveis feito no aspirado bucal é uma opção confiável ao fluido gástrico para a predição da síndrome do desconforto respiratório do recém‐nascido.
Atualmente, tem havido um interesse renovado nos testes de diagnóstico rápido para avaliar a função do sistema surfactante, como o teste das microbolhas estáveis (TME), que pode ser explicado pela busca de indicações opcionais para a terapia com surfactante exógeno precoce.1–3 O TME foi desenvolvido por Pattle et al. em 1979 e foi posteriormente avaliado por Chida et al. em 1993. Desde então, ele tem sido usado para analisar vários fluidos corporais, mostrou excelente sensibilidade e especificidade no diagnóstico da síndrome do desconforto respiratório (SDR) no líquido amniótico, aspirado gástrico e aspirado traqueal.3–9
Em um estudo feito antes da recomendação de uso de rotina da pressão positiva contínua nas vias aéreas (CPAP) na sala de parto, sugere‐se que a contagem das microbolhas estáveis (MBE) nos aspirados gástricos coletados na sala de parto imediatamente após o nascimento foi útil para prever a necessidade do uso do surfactante pulmonar exógeno em recém‐nascidos prematuros que não precisam de ventilação mecânica.7 Recentemente, Bhatia et al. mostraram que bebês extremamente prematuros que sofrem de SDR e tratados com CPAP que apresentaram alta contagem das microbolhas em seu aspirado gástrico (> 8 SMB/mm2) evoluíram bem e não precisaram de ventilação mecânica.10
O TME nos aspirados bucais obtidos no nascimento foi recentemente usado para detectar disfunção do surfactante em recém‐nascidos a termo com taquipneia transitória,11 porém nunca foi usado no diagnóstico da SDR em neonatos prematuros. As amostras de fluidos orais estão pronta e facilmente disponíveis e podem ser coletadas sem uso de um tubo gástrico, que pode colocar em risco o tratamento inicial de recém‐nascidos prematuros. Assim, o objetivo deste estudo foi avaliar o desempenho do TME em aspirados bucais de recém‐nascidos prematuros para prever SDR.
MétodosEste estudo foi feito no Departamento de Neonatologia do Hospital São Lucas na Pontifícia Universidade Católica do Rio Grande do Sul (PUC‐RS), Porto Alegre, Brasil, de janeiro de 2014 a setembro de 2015. Usamos uma amostra de conveniência que consistiu em pacientes com idade gestacional <34 semanas, cujo nascimento ocorreu durante os períodos em que um dos pesquisadores esteve presente na sala de parto e dos quais foi possível coletar aspirados buscais e gástricos. A idade gestacional foi determinada por ultrassonografia obstétrica feita antes das 20 semanas de gestação ou, se indisponível, pela data da última menstruação e posteriormente confirmada pelo New Ballard Score.12 Os recém‐nascidos com as seguintes doenças, que podem comprometer a função respiratória, foram excluídos do estudo: malformações congênitas incompatíveis com a vida, síndromes genéticas, cardiopatias congênitas graves, hérnia diafragmática congênita e presença de líquido amniótico com mecônio. Este estudo foi aprovado pelo Comitê de Ética em Pesquisa da PUC‐RS, relatório da decisão n° 372.742, de 23 de agosto de 2013. Esse comitê dispensou a necessidade do consentimento por escrito, pois o estudo usou material biológico obtido de procedimentos de rotina geralmente descartados, porém que ainda pode ser usado para pesquisa.13
Os fluidos orais foram coletados pelo obstetra durante a liberação das vias aéreas de rotina imediatamente após o nascimento, com uma pera de sucção de borracha. Após cada aspiração oral, o material coletado foi imediatamente armazenado em um recipiente de coleta estéril feito de poliestireno cristal com uma tampa firme e de fácil abertura. Qualquer volume acima de 0,2 mL foi considerado uma amostra adequada. Os aspirados gástricos foram obtidos e avaliados pelo neonatologista em até 30 minutos após os nascimentos de todos os prematuros <34 semanas de gestação como parte da avaliação de rotina. Os aspirados gástricos restantes do teste inicial e os aspirados bucais foram armazenados a ‐20°C por até 96 horas.
As amostras gástricas e bucais foram analisadas simultaneamente pelo TME em até 48 e 96 horas do congelamento, de acordo com o método descrito por Pattle et al.4 com pequenas modificações.2,8,14 Primeiramente, as amostras foram descongeladas no ar ambiente até visualmente derreter e foram homogeneizadas com cuidado. Depois, quase 40μL dos fluidos a serem testados foram aspirados para uma pipeta de Pasteur (Marca GmbH & Co., Wertheimer, Alemanha) com um comprimento de 11cm e 1mm de diâmetro e uma tampa de borracha manual. Com a pipeta mantida verticalmente e posicionada com a ponta quase tocando a câmara de contagem (Neubauer Improve Bright‐Line, Loptik Labor, Alemanha), a alíquota foi rapidamente aspirada e expelida por quase seis segundos (20 vezes) na pipeta, para promover aeração das amostras. Imediatamente após isso, a câmara foi invertida e posicionada embaixo de um microscópio binocular, formou uma gota suspensa. Após quatro minutos, a área de contagem foi examinada com uma ampliação de 100x e foi contado o número de MBEs (bolhas <15μm de diâmetro) por mm2. As bolhas não esféricas e pretas não foram incluídas na contagem. Os resultados da contagem foram expressos em microbolhas estáveis por mm2 (BEM/mm2). Todos os testes foram feitos por um dos autores (MASR), cego para a procedência da amostra.
Os recém‐nascidos foram divididos em dois grupos: 1. Grupo de SDR: neonatos diagnosticados com SDR com base nos critérios clínicos (grunhido expiratório, taquipneia, retrações costais e externas, necessidade de FiO2> 0,40) associados ao padrão radiológico compatível, como padrão reticulogranular difuso e presença de broncogramas aéreos; 2. Grupo de controle: recém‐nascidos que não desenvolveram sintomas respiratórios.
A decisão de usar a terapia com surfactantes e implantar apoio ventilatório foi tomada exclusivamente pela equipe de neonatologia durante o atendimento aos recém‐nascidos, sem interferência dos autores deste estudo. Foram registrados os dados sobre as características maternas, variáveis perinatais, características demográficas dos pacientes, FiO2 máxima, duração da suplementação de oxigênio, apoio ventilatório, uso de surfactante exógeno e resultado.
As variáveis contínuas foram expressas como frequências absolutas e relativas. As variáveis contínuas foram expressas como médias e desvios‐padrão e como medianas e intervalos interquartis quando não distribuídas normalmente. As médias foram comparadas com o teste t de Student quando as variáveis foram simetricamente distribuídas e com o teste de Mann Whitney quando elas foram assimetricamente distribuídas. Foi estabelecido um valor de referência de 15 MBE/mm2 para determinar a deficiência de surfactante pulmonar, com base em um estudo anterior com aspirados gástricos.3 A correlação de Pearson e a análise de regressão linear entre as contagens de microbolhas nos fluidos orais e gástricos foram feitas com a transformação logarítmica. O desempenho do TME nas amostras de fluidos orais e gástricos para prever o desenvolvimento de SDR foi determinado com o cálculo da área abaixo da curva da característica de operação do receptor (ROC) e avaliação da sensibilidade e da especificidade do TME nas duas amostras para o diagnóstico de SDR em recém‐nascidos. O nível de significância foi estabelecido em 5% (p <0,05). A análise estatística teve como base os dados processados e analisados com o software Excel 2010 e a versão 19 do IBM‐SPSS Statistics para Windows.
ResultadosA amostra inicial abrangeu 72 pacientes, oito dos quais foram excluídos: o fluido oral não foi coletado de três recém‐nascidos e as amostras de cinco recém‐nascidos foram insuficientes ou inadequadas para teste. Assim, 21 pacientes com SDR e 43 neonatos prematuros sem sintomas respiratórios foram incluídos no estudo. O peso ao nascer foi 1.465±517g, a idade gestacional média foi de 31 semanas (intervalo interquartil [IIQ]=29‐32 semanas) e houve uma distribuição igual entre os sexos. Na amostra geral, a contagem média foi de 55 MBE/mm2 (IIQ=20‐162 MBE/mm2) nos aspirados gástricos e 60 MBE/mm2 (IIQ=16‐150 MBE/mm2) (p=0,54) nos aspirados bucais.
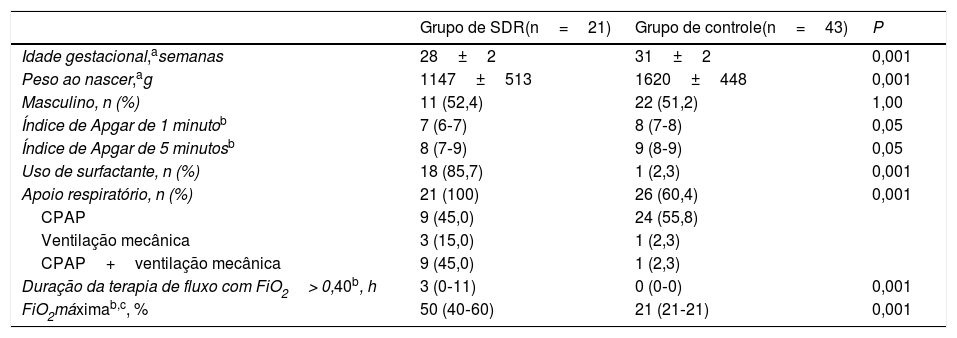
As características demográficas da amostra são apresentadas na tabela 1. Receberam duas doses de corticosteroides antenatais 42 (65,6%) mulheres, ao passo que 15 (24,5%) receberam uma dose. As doenças maternas incluíram 25 (39,1%) casos de hipertensão relacionada à gravidez, cinco (7,8%) casos de diabetes mellitus e dois (3,1%) casos de corioamnionite. Nasceram de parto cesáreo 49 (76,6%) crianças. Surfactante foi administrado a 18 (85,7%) recém‐nascidos no grupo de SDR e um (2,3%) no grupo de controle (p <0,001) e a idade média de administração foi de 60 minutos (IIQ=50‐180min.). Houve cinco (7,1%) casos de displasia broncopulmonar e quatro (6,3%) óbitos, todos os quais no grupo de SDR, três de imaturidade extrema e um de septicemia por bacilos gram‐negativos. Todos os recém‐nascidos no grupo de SDR precisaram de apoio respiratório com CPAP e/ou ventilação mecânica após internação na unidade intensiva neonatal, ao passo que 26 (60,4%) no grupo de controle foram inicialmente tratados com CPAP como tratamento de rotina (p <0,001). Dois pacientes precisaram de ventilação mecânica no grupo de controle, um por septicemia por bacilos gram‐negativos e um por sífilis congênita sintomática com raios X de tórax normal.
Dados sobre as características demográficas, oxigenoterapia e suporte ventilatório para comparação entre os grupos de estudo
| Grupo de SDR(n=21) | Grupo de controle(n=43) | P | |
|---|---|---|---|
| Idade gestacional,asemanas | 28±2 | 31±2 | 0,001 |
| Peso ao nascer,ag | 1147±513 | 1620±448 | 0,001 |
| Masculino, n (%) | 11 (52,4) | 22 (51,2) | 1,00 |
| Índice de Apgar de 1 minutob | 7 (6‐7) | 8 (7‐8) | 0,05 |
| Índice de Apgar de 5 minutosb | 8 (7‐9) | 9 (8‐9) | 0,05 |
| Uso de surfactante, n (%) | 18 (85,7) | 1 (2,3) | 0,001 |
| Apoio respiratório, n (%) | 21 (100) | 26 (60,4) | 0,001 |
| CPAP | 9 (45,0) | 24 (55,8) | |
| Ventilação mecânica | 3 (15,0) | 1 (2,3) | |
| CPAP+ventilação mecânica | 9 (45,0) | 1 (2,3) | |
| Duração da terapia de fluxo com FiO2> 0,40b, h | 3 (0‐11) | 0 (0‐0) | 0,001 |
| FiO2máximab,c, % | 50 (40‐60) | 21 (21‐21) | 0,001 |
h, horas; SDR, Síndrome do desconforto respiratório.
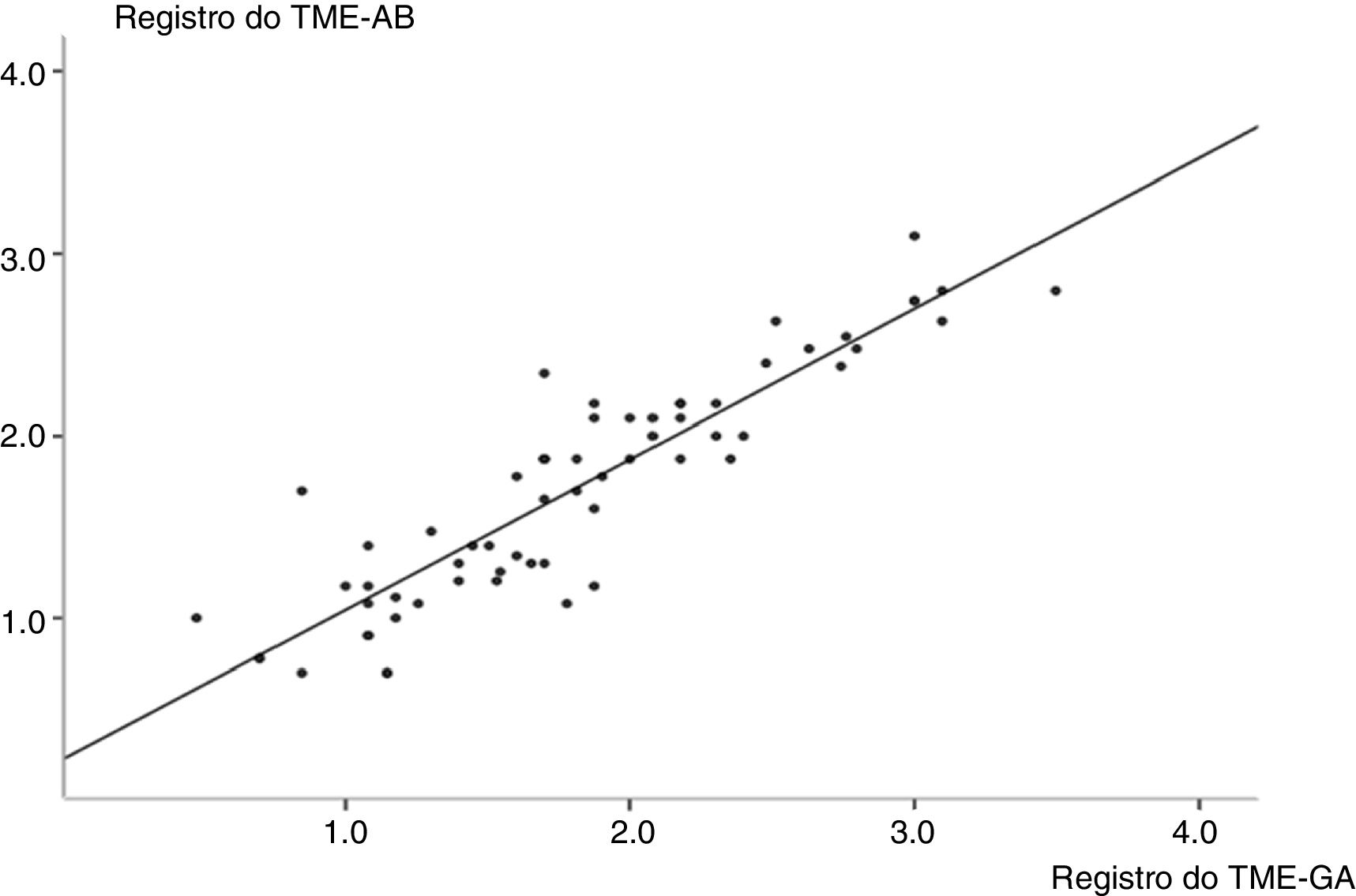
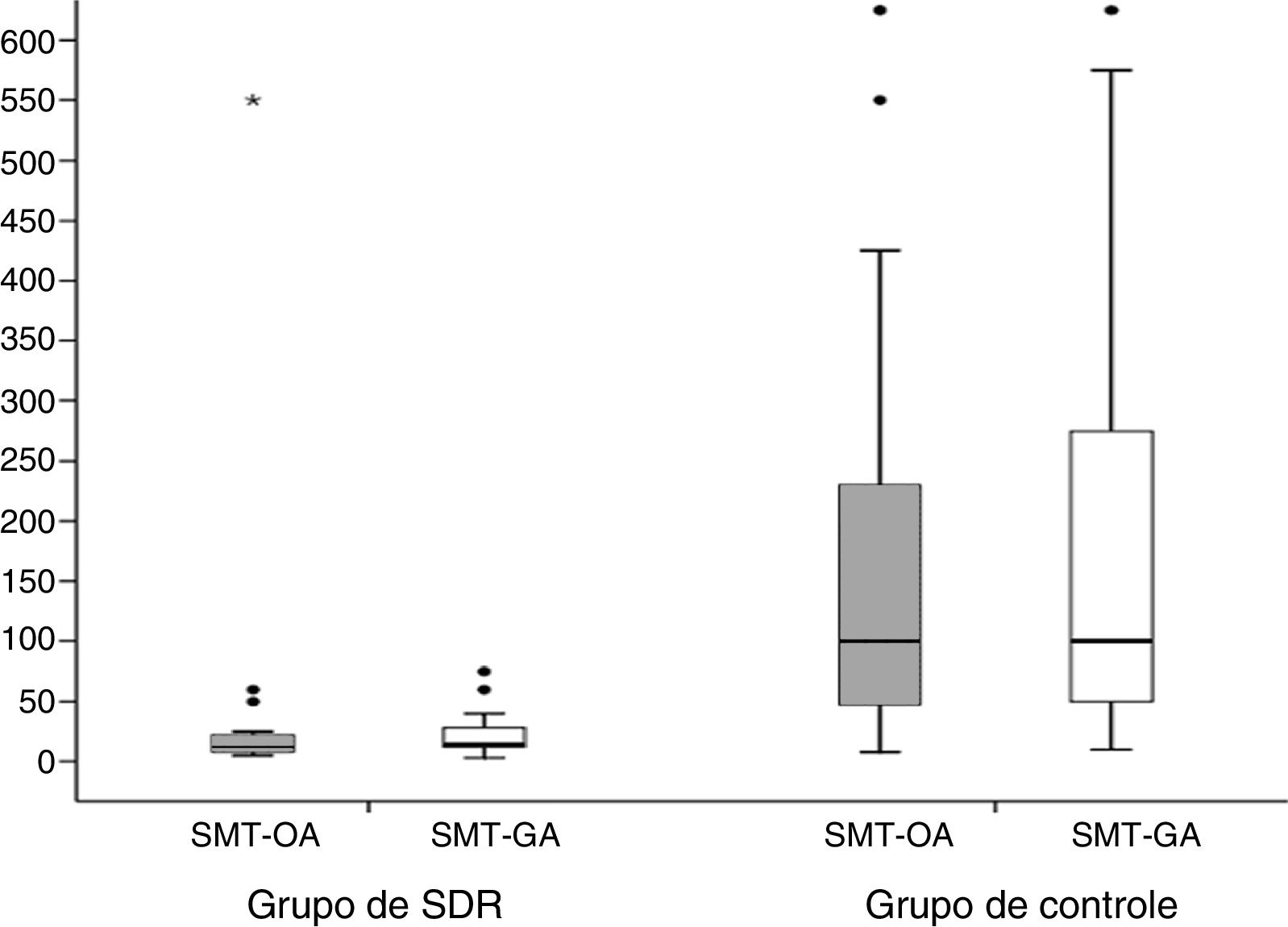
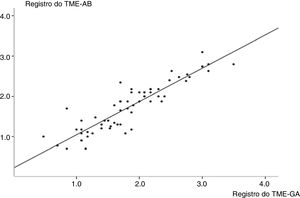
Como mostra a figura 1, foi encontrada forte correlação positiva entre as MBEs nas amostras de fluidos orais e gástricos. A figura 2 mostra o número de MBE por mm2 nos aspirados bucais e gástricos dos dois grupos. Somente um neonato no grupo de SDR apresentou contagem acima de 50 MBE/mm2.
Gráfico de correlação linear que mostra a transformação logarítmica das contagens de microbolhas nos fluidos orais e gástricos (R=0,90; intervalo de confiança de 95%=0,85‐0,95; p <0,001). A análise de regressão encontrou y=0,90x+0,22 (R2=0,81), onde y é a contagem das microbolhas nos aspirados bucais e x é a contagem das microbolhas nos aspirados gástricos. TME‐AB, teste das microbolhas estáveis nos aspirados bucais; TME‐AG, teste das microbolhas estáveis nos aspirados gástricos.
Diagrama de caixa que compara a contagem de microbolhas estáveis (MBE)/mm2 no fluido oral e gástrico de cada grupo. TME‐AB: Grupo de SDR: mediana=12 MBE/mm2 (intervalo interquartil [IIQ]=8‐22 MBE/mm2), Grupo de controle: mediana=100 MBE/mm2 (IIQ=48‐230 MBE/mm2) (p <0,001). TME‐AG=Grupo de SDR=14 MBE/mm2 (IIQ=12‐28 MBE/mm2), Grupo de controle=100 MBE/mm2 (IIQ=50‐275 MBE/mm2) (p <0,001). SDR, síndrome do desconforto respiratório; TME‐AB, teste das microbolhas estáveis nos aspirados bucais; TME‐AG, teste das microbolhas estáveis nos aspirados gástricos.
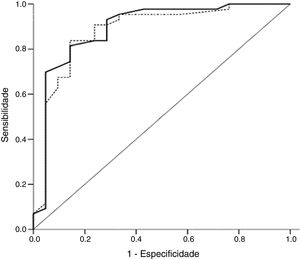
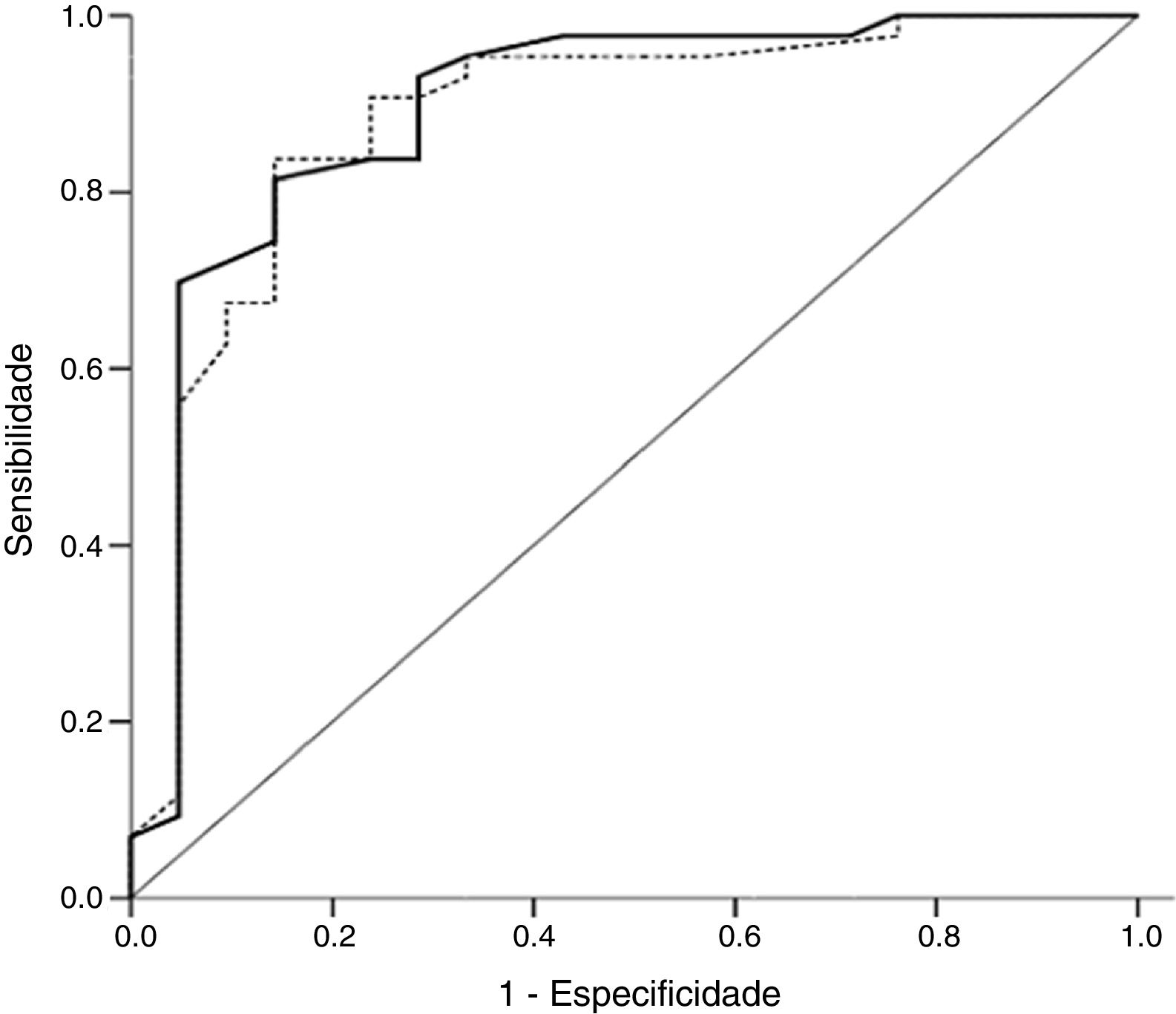
Foi criada uma curva ROC para determinar o melhor ponto de corte da contagem de MBE para prever a função adequada do surfactante em nossas amostras. A área abaixo da curva foi de 0,89 (IC de 95%: 0,81‐0,97; p <0,001) nos aspirados bucais e 0,88 (IC de 95%: 0,80‐0,96; p <0,001) nos aspirados gástricos (fig. 3). Considerando um ponto de corte no qual a sensibilidade e a especificidade são semelhante (25 MBE/mm2) nos aspirados bucais para prever o diagnóstico de deficiência do surfactante em recém‐nascidos, a sensibilidade foi de 81,4% (IC de 95%=67,4‐90,3) e a especificidade de 85,7% (IC de 95%=65,4‐95,0). Nos aspirados gástricos, uma contagem de <15 MBE/mm2, conforme usado em estudos anteriores, mostrou uma sensibilidade de 95,4% (IC de 95%=84,5‐98,7%) e a especificidade de 61,9% (IC de 95%=41,9‐79,3%). Por sua vez, uma contagem de <25 MBE/mm2 mostrou uma sensibilidade de 90,7% (IC de 95%=78,4‐96,3%) e uma especificidade de 71,4% (IC de 95%=50,0‐86,2%). O uso combinado dos dois testes não levou a mudanças significativas na sensibilidade e na especificidade e não mudaria a decisão sobre o número de neonatos que precisam de terapia com surfactante exógeno.
Curva da característica de operação do receptor da contagem das microbolhas nas amostras de fluido oral (linha contínua) e amostras de fluido gástrico (linha pontilhada) para diagnóstico da síndrome do desconforto respiratório. Área abaixo da curva: TME‐AB=0,89 (IC de 95%=0,81‐0,97; p <0,001); TME‐AG=0,88 (IC de 95%=0,80‐0,96; 0,001). TME‐AB, teste das microbolhas estáveis no aspirado bucal; TME‐AG, teste das microbolhas estáveis no aspirado gástrico.
O presente estudo mostrou que a contagem das microbolhas nos aspirados bucais é semelhante à encontrada nos aspirados gástricos e que o TME pode ser feito rotineiramente em amostras buscais para o diagnóstico de SDR. O uso do TME para o diagnóstico da SDR já foi demonstrado na literatura com vários tipos de materiais biológicos, inclusive fluido gástrico.3,8,9 As vantagens desse teste são sua fácil execução, pois pode ser feito à beira do leito, seus rápidos resultados (cerca de cinco minutos) e seu baixo custo.1 O TME nos aspirados gástricos foi introduzido em nosso serviço como parte do cuidado de rotina e como um método para auxiliar na indicação precoce de surfactante para neonatos com muito baixo peso ao nascer sintomáticos tratado com CPAP.1 Estorgato et al. publicaram recentemente um estudo que visa a avaliar o desempenho do TME nos aspirados bucais para detectar deficiências na função do surfactante entre neonatos com taquipneia transitória, porém o uso de amostras de fluído bucal no diagnóstico da SDR em neonatos prematuros ainda não foi avaliado.11
O diagnóstico da SDR teve como base parâmetros clínicos e radiológicos. Ocasionalmente, a SDR pode ser confundida com outras doenças pulmonares. Contudo, nenhum teste de laboratório tem sensibilidade e especificidade suficientes para ser usado como o teste de diagnóstico padrão de base. Nosso estudo constatou que os neonatos prematuros que desenvolveram SDR apresentaram uma contagem das microbolhas significativamente menor em comparação com os neonatos sem sinais de insuficiência respiratória, nos aspirados bucais e gástricos. Esses achados corroboram os observados em estudos anteriores que envolvem fluidos gástricos e traqueais.3,8,15–17
O presente estudo também constatou forte correlação positiva entre a contagem das microbolhas nos aspirados gástricos e bucais, indicou que o TME bucal pode ser uma opção para avaliar a maturidade pulmonar em recém‐nascidos prematuros no nascimento. Esse achado era esperado, pois os fluidos orais seriam semelhantes ao conteúdo gástrico no nascimento.
Constatou‐se que a contagem das microbolhas estáveis no aspirado bucal foi muito precisa para o diagnóstico da SDR, com sensibilidade de 81,4% e especificidade de 85,7% para o ponto de corte de 25 MBE/mm2. Esses valores de desempenho foram semelhantes aos encontrados no fluido gástrico para o ponto de corte de 15 MBE/mm2 (95,4% e 61,9%, respectivamente) e em outros estudos que avaliam os aspirados gástricos (97% e 83%, respectivamente).3 Por sua vez, os valores encontrados aqui foram ligeiramente menores do que os encontrados nos aspirados traqueais (sensibilidade de 89‐96% e especificidade de 97‐100%).8,9 Assim, nossos achados sugerem que o TME nos aspirados bucais pode ser um teste útil para diagnosticar SDR.
O presente estudo tem algumas limitações. O TME não pode ser feito em 10% das amostras de fluido oral, devido à falta de materiais (ou materiais insuficientes), mostrou uma das possíveis dificuldades de uso desse teste como uma ferramenta de diagnóstico. Nesses casos, o TME pode ser feito nos aspirados gástricos.
A grande vantagem do TME nas amostras de fluido oral é a rápida disponibilidade do material para teste, pois os aspirados bucais geralmente são coletados imediatamente após o nascimento do neonato pelo obstetra, representa, assim, a ferramenta mais fácil e mais universal de avaliação precoce da maturidade fetal. Da mesma forma, a coleta de amostras de fluido oral tem algumas vantagens sobre a dos fluidos gástricos e traqueais, no sentido de que ela não exige procedimentos invasivos desconfortáveis que possam colocar em risco os cuidados iniciais dos neonatos prematuros, como colocação de um tubo gástrico e/ou intubação traqueal.
Nosso estudo mostrou que o TME pode indicar a terapia com surfactante precoce em alguns neonatos que desenvolveram RDS, mesmo nos tratados com CPAP como cuidado de rotina, pois os sinais clínicos iniciais da deficiência de surfactante ainda são sutis ou duvidosos e nenhum sinal radiológico é específico para o diagnóstico dessa doença. O TME pode ser usado em combinação com outros critérios clínicos para tomada de decisão de tratamento. Em nosso serviço, a terapia com surfactante exógeno precoce é indicada para neonatos prematuros tratados com CPAP, caso eles tenham uma contagem das microbolhas <15 MBE/mm2 nos aspirados gástricos e sinais clínicos de insuficiência respiratória. Do contrário, o uso de surfactantes é postergado até o início dos sintomas de insuficiência respiratória em associação à necessidade de FiO2 ≥ 0,40).
Os resultados deste estudo sugerem que o TME nos aspirados bucais com um ponto de corte de aproximadamente 25 MBE/mm2 tem alta sensibilidade para diagnosticar disfunção do surfactante em recém‐nascidos prematuros, representa uma opção confiável ao aspirado gástrico. Além disso, esse método opcional possibilita que o material seja coletado em qualquer centro obstétrico e contribui para a identificação precoce (ou seja, na primeira hora de vida) de neonatos prematuros com deficiência do surfactante e risco de desenvolvimento da SDR, possivelmente melhora as indicações de tratamento com surfactante exógeno.
Conflitos de interesseOs autores declaram não haver conflitos de interesse.
Como citar este artigo: Ribeiro MA, Fiori HH, Luz JH, Garcia PC, Fiori RM. Rapid diagnosis of respiratory distress syndrome by oral aspirate in premature newborns. J Pediatr (Rio J). 2019;95:489–94.
Estudo vinculado à Faculdade de Medicina, Pontifícia Universidade Católica do Rio Grande do Sul, Porto Alegre, RS, Brasil.



![Diagrama de caixa que compara a contagem de microbolhas estáveis (MBE)/mm2 no fluido oral e gástrico de cada grupo. TME‐AB: Grupo de SDR: mediana=12 MBE/mm2 (intervalo interquartil [IIQ]=8‐22 MBE/mm2), Grupo de controle: mediana=100 MBE/mm2 (IIQ=48‐230 MBE/mm2) (p <0,001). TME‐AG=Grupo de SDR=14 MBE/mm2 (IIQ=12‐28 MBE/mm2), Grupo de controle=100 MBE/mm2 (IIQ=50‐275 MBE/mm2) (p <0,001). SDR, síndrome do desconforto respiratório; TME‐AB, teste das microbolhas estáveis nos aspirados bucais; TME‐AG, teste das microbolhas estáveis nos aspirados gástricos. Diagrama de caixa que compara a contagem de microbolhas estáveis (MBE)/mm2 no fluido oral e gástrico de cada grupo. TME‐AB: Grupo de SDR: mediana=12 MBE/mm2 (intervalo interquartil [IIQ]=8‐22 MBE/mm2), Grupo de controle: mediana=100 MBE/mm2 (IIQ=48‐230 MBE/mm2) (p <0,001). TME‐AG=Grupo de SDR=14 MBE/mm2 (IIQ=12‐28 MBE/mm2), Grupo de controle=100 MBE/mm2 (IIQ=50‐275 MBE/mm2) (p <0,001). SDR, síndrome do desconforto respiratório; TME‐AB, teste das microbolhas estáveis nos aspirados bucais; TME‐AG, teste das microbolhas estáveis nos aspirados gástricos.](https://static.elsevier.es/multimedia/22555536/0000009500000004/v4_201909060648/S2255553618301149/v4_201909060648/pt/main.assets/thumbnail/gr2.jpeg?xkr=ue/ImdikoIMrsJoerZ+w90K3EErzaXq47TPDDaeTjoE=)