To identify risk factors for chronic kidney disease progression in Brazilian children and to evaluate the interactions between factors.
MethodsThis was a multicenter prospective cohort in São Paulo, involving 209 children with CKD stages 3–4. The study outcome included: (a) death, (b) start of kidney replacement therapy, (c) eGFR decrease >50% during the followup. Thirteen risk factors were tested using univariate regression models, followed by multivariable Cox regression models. The terms of interaction between the variables showing significant association with the outcome were then introduced to the model.
ResultsAfter a median follow‐up of 2.5 years (IQR=1.4–3.0), the outcome occurred in 44 cases (21%): 22 started dialysis, 12 had >50% eGFR decrease, seven underwent transplantation, and three died. Advanced CKD stage at onset (HR=2.16, CI=1.14–4.09), nephrotic proteinuria (HR=2.89, CI=1.49–5.62), age (HR=1.10, CI=1.01–1.17), systolic blood pressure Z score (HR=1.36, CI=1.08–1.70), and anemia (HR=2.60, CI=1.41–4.77) were associated with the outcome. An interaction between anemia and nephrotic proteinuria at V1 (HR=0.25, CI=0.06–1.00) was detected.
ConclusionsAs the first CKD cohort in the southern hemisphere, this study supports the main factors reported in developed countries with regards to CKD progression, affirming the potential role of treatments to slow CKD evolution. The detected interaction suggests that anemia may be more deleterious for CKD progression in patients without proteinuria and should be further studied.
Identificar os fatores de risco para progressão da DRC em crianças do Brasil e avaliar as interações entre os fatores.
MétodosCoorte prospectiva multicêntrica em São Paulo, envolvendo 209 crianças com DRC em estágios 3‐4. O desfecho do estudo incluiu: a) óbito, b) início da terapia de substituição renal, c) redução de > 50% na taxa estimada de filtração glomerular (eGFR) durante o acompanhamento. Foram testados 13 fatores de risco com o modelo de regressão univariada seguido do modelo de regressão multivariado de Cox. Os termos de interação entre as variáveis mostraram associação significativa e foram introduzidos ao modelo.
ResultadosApós média de acompanhamento de 2,5 anos (IIQ=1,4 a 3,0), 44 casos (21%) apresentaram desfecho: 22 iniciaram diálise, 12 apresentaram redução de > 50% na eGFR, sete foram submetidos a transplante e três morreram. Estágio avançado de DRC no acometimento (RR=2,16, IC=1,14‐4,09), proteinúria nefrótica (RR = 2,89, IC=1,49‐5,62), idade (RR = 1,10, IC=1,01‐1,17), escore Z da pressão arterial sistólica (RR=1,36, IC=1,08‐1,70) e anemia (RR=2,60, IC – 1,41‐4,77) foram associados ao resultado. Foi detectada interação entre anemia e proteinúria nefrótica na primeira visita (V1) (RR=0,25, IC=0,06‐1,00).
ConclusõesCom a primeira coorte de DRC no hemisfério sul, este estudo é concordante com os principais fatores relatados em países desenvolvidos com relação à progressão da DRC, afirmando o possível papel dos tratamentos para mostrar a evolução da DRC. A interação detectada sugere que a anemia pode ser mais nociva na progressão da DRC em pacientes sem proteinúria e deve ser ainda mais estudada.
A doença renal crônica (DRC) tem consequências devastadoras em crianças e adolescentes. É uma doença progressiva que varia desde alterações anatômicas e doenças funcionais leves do trato urinário a perda total das funções renais. A DRC é definida como taxa de filtração glomerular (GFR) abaixo de 90mL/min/1,73 m2 por mais de três meses e é classificada em cinco estágios com base na gravidade da redução na GFR.1
Vários tipos de tratamento podem ser usados para mostrar a progressão da doença ou minimizar as comorbidades associadas.2 O tratamento é diferente para cada estágio da DRC e a taxa de evolução da doença não é uniforme. Assim, conhecer os fatores de risco para progressão da DRC tem importantes implicações práticas, pois possibilita preparação e aprimoramento da terapia.
Estudos anteriores sugeriram que um estágio mais avançado da DRC está associado a maior probabilidade de avanço da doença.3 Adicionalmente, proteinúria nefrótica, hipoalbuminemia, pressão arterial (PA) alta, dislipidemia, sexo masculino e anemia podem acelerar a redução na GFR.4,5 A puberdade também pode aumentar a taxa de progressão da DRC e acredita‐se que os hormônios sexuais podem promover deterioração mais rápida da função renal.6
Os estudos mencionados foram feitos em países economicamente desenvolvidos no hemisfério norte. Contudo, os fatores associados à progressão mais rápida da DRC encontrados nesses estudos podem não ser totalmente aplicáveis a outras regiões geográficas ou a países economicamente menos desenvolvidos, o que limita a generalidade dos resultados. Portanto, é importante determinar os fatores envolvidos na progressão da DRC em outras regiões geográficas devido às diferenças em fatores genéticos, sociais e culturais. Ademais, as diferenças na infraestrutura dos serviços de saúde entre os continentes podem resultar em diferentes padrões de progressão da doença, pois o tratamento da DRC é caro e envolve uma organização elaborada de serviços de saúde especializados. Assim, existe a possibilidade de os fatores macroeconômicos interferirem no fornecimento da terapia, o que pode afetar a progressão da DRC em crianças.
Além disso, os fatores de risco para progressão da DRC podem interagir de forma que um fator de risco específico possa mudar o efeito de outro fator de risco no desenvolvimento da DRC e essas possíveis interações foram raramente exploradas em crianças.
O objetivo deste estudo foi identificar os principais fatores de risco para progressão da DRC em uma amostra de crianças e adolescentes no Brasil e avaliar as possíveis interações entre esses fatores.
Material e métodosEste estudo avaliou os dados de um estudo de coorte prospectivo multicêntrico que envolveu crianças e adolescentes submetidos a acompanhamento médico para DRC em estágios 3 ou 4 em sete centros no Estado de São Paulo, Brasil (SP‐CKDkid). Estimulamos antecipadamente que seria viável recrutar uma amostra de conveniência que incluísse aproximadamente 200 pacientes, com sua primeira visita no início do estudo e um período de acompanhamento de aproximadamente dois anos com visitas a cada seis meses.
Os critérios de inclusão foram a) idade de um a 17 anos no início do estudo, b) eGFR abaixo de 60mL/min/1,73 m2 e acima de 15mL/min/1,73 m2 por pelo menos três meses, c) assinatura do consentimento informado pelos pais ou responsáveis legais e do termo de consentimento pelas crianças com mais de 12 anos e d) acompanhamento anterior com adesão adequada ao acompanhamento por pelo menos três meses.
Os pacientes que receberam qualquer transplante, com malignidades tratadas nos últimos 24 meses, com HIV e com planos de se mudar para outra cidade posteriormente ao dia de convite para participar da coorte foram excluídos do estudo.
O resultado combinado do estudo incluiu a ocorrência de pelo menos um dos seguintes eventos durante o acompanhamento: a) óbito, b) início de terapia de substituição renal (diálise ou transplante) ou c) redução de mais de 50% da eGFR.
A GFR foi estimada das medições de estatura e níveis de creatinina sérica feitas em cada centro médico e em cada visita com a fórmula de Schwartz.7
Os possíveis fatores de risco foram: a) idade do paciente na primeira visita (V1), b) sexo, c) etiologia da DRC como uma variável binária definida como anomalias congênitas do rim e do trato urinário (Cakut) ou outras causas combinadas, d) etnia, com base na autodefinição pelo paciente e/ou responsável legal e classificada como variável binária de branco ou não branco (para essa variável, havia disponíveis os dados de 179 pacientes), e) situação socioeconômica do paciente, conforme estabelecida pelos critérios da Associação Brasileira de Empresas de Pesquisa (Abep) em 2011, implicava A como a classe mais rica, f) ocorrência de puberdade durante o acompanhamento, definida como Tanner ≥ 2 para qualquer característica, g) estágio da DRC na V1 como variável binária identificada por GFR ≥ 30 e < 60 ou GFR < 30, h) proteinúria nefrótica na V1, definida como variável binária pela presença de uma razão de proteína/creatinina acima de 2 gramas/grama de creatinina nas amostras de urina isolada, i) PA na V1 definida como escore de Z da média de três medições de PA consecutivas,8 j) anemia na V1, definida como nível de hemoglobina inferior ao quinto percentil para sexo e idade,9 k) colesterol sérico na V1, definida como variável quantitativa contínua em mg/dL, l) bicarbonato sérico na V1, definido como variável contínua em mEq/L e m) hormônio da paratireoide no soro (PTH) na V1, definida como variável quantitativa contínua em pg/mL.
Todas as variáveis clínicas e análises laboratoriais foram coletadas e processadas nos centros médicos participantes e um laboratório central não foi usado neste estudo.
Usamos a mediana e o intervalo interquartil (IIQ) para descrever as variáveis quantitativas e as variáveis qualitativas foram descritas com tabelas de frequência. O efeito de cada possível fator de risco sobre o resultado combinado foi avaliado por uma análise de regressão de Cox em cada variável (análise univariada). As variáveis com valores de p abaixo de 0,2 na análise univariada foram então incluídas em um modelo multivariado de Cox. Nesse modelo, começamos por incluir todas as variáveis pré‐selecionadas e então removemos individualmente as variáveis que não alcançaram uma associação estatisticamente significativa com o resultado (seleção backward). Além disso, os termos de interação entre as variáveis que mostraram uma associação estatisticamente significativa com o resultado combinado foram introduzidos ao modelo de Cox para avaliar a ocorrência de interações entre as variáveis e o resultado combinado do estudo.
Um nível de relevância de 5% (α < 0,05) foi adotado em todos os testes para refutar a hipótese nula e foi usado o software Stata (Stata Statistical Software: Release 14. College Station, TX, EUA), para todos os cálculos estatísticos.
Os Comitês de Ética de Pesquisa dos sete centros participantes aprovaram o protocolo do estudo e todos os procedimentos do estudo foram feitos após obter a assinatura do formulário de consentimento informado por um pai/mãe ou responsável legal e dos termos de aprovação por pacientes com mais de 12 anos.
ResultadosDe agosto de 2013 a agosto de 2016, 245 pacientes foram pré‐selecionados para o estudo, porém 36 casos (15%) foram excluídos da análise pelos seguintes motivos: a) indivíduos com DRC em estágio 5 (15 casos) ou estágio 2 (quatro casos) na V1 ou b) dados ausentes (17 casos). Em comparação com as crianças incluídas no estudo, os participantes excluídos pelos motivos descritos acima não mostraram diferenças significativas em idade (9,3 [IIQ = 5,4 a 13,2] anos em comparação com 9,9 [IIQ = 5,3 a 13,5] anos, respectivamente, p = 0,752), distribuição por sexo (masculino = 59% e 69%, respectivamente, p = 0,251) e percentual de Cakut de acordo com a etiologia da DRC (73% em comparação com 86%, respectivamente, p = 0,088).
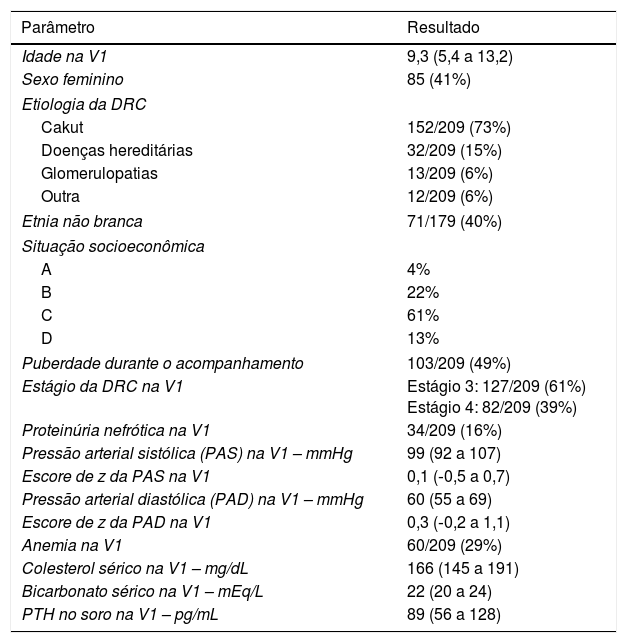
Após exclusão, a análise teve como base uma amostra de 209 crianças com DRC. O período médio de acompanhamento foi de 2,5 anos (IIQ = 1,4 a 3) e 88% dos pacientes foram mantidos para uma segunda visita, 70% para uma terceira e 67% para uma quarta. Os dados demográficos da amostra e os possíveis fatores de riscos são mostrados na tabela 1.
Dados demográficos e os possíveis fatores de riscos na amostra
| Parâmetro | Resultado |
|---|---|
| Idade na V1 | 9,3 (5,4 a 13,2) |
| Sexo feminino | 85 (41%) |
| Etiologia da DRC | |
| Cakut | 152/209 (73%) |
| Doenças hereditárias | 32/209 (15%) |
| Glomerulopatias | 13/209 (6%) |
| Outra | 12/209 (6%) |
| Etnia não branca | 71/179 (40%) |
| Situação socioeconômica | |
| A | 4% |
| B | 22% |
| C | 61% |
| D | 13% |
| Puberdade durante o acompanhamento | 103/209 (49%) |
| Estágio da DRC na V1 | Estágio 3: 127/209 (61%) Estágio 4: 82/209 (39%) |
| Proteinúria nefrótica na V1 | 34/209 (16%) |
| Pressão arterial sistólica (PAS) na V1 – mmHg | 99 (92 a 107) |
| Escore de z da PAS na V1 | 0,1 (‐0,5 a 0,7) |
| Pressão arterial diastólica (PAD) na V1 – mmHg | 60 (55 a 69) |
| Escore de z da PAD na V1 | 0,3 (‐0,2 a 1,1) |
| Anemia na V1 | 60/209 (29%) |
| Colesterol sérico na V1 – mg/dL | 166 (145 a 191) |
| Bicarbonato sérico na V1 – mEq/L | 22 (20 a 24) |
| PTH no soro na V1 – pg/mL | 89 (56 a 128) |
As variáveis quantitativas são expressas como mediana (intervalo interquartil).
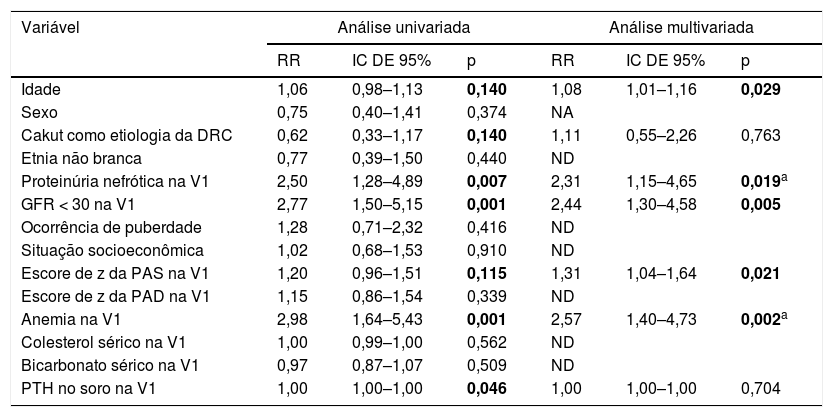
A GFR de base foi 33,1mL/min/1,73 m2 (IIQ = 24,7 a 40,9) e durante o acompanhamento essa taxa apresentou redução de 1,6mL/min/1,73 m2 (IIQ = ‐6,3 a 1,6). No término do acompanhamento, verificamos resultado combinado em 44 casos (21%). Desses pacientes, 22 iniciaram diálise, 12 perderam > 50% da GFR, sete receberam transplantes de rim e três morreram. Os resultados da análise de regressão de Cox são apresentados na tabela 2.
Análise de possíveis fatores de risco na progressão da DRC
| Variável | Análise univariada | Análise multivariada | ||||
|---|---|---|---|---|---|---|
| RR | IC DE 95% | p | RR | IC DE 95% | p | |
| Idade | 1,06 | 0,98–1,13 | 0,140 | 1,08 | 1,01–1,16 | 0,029 |
| Sexo | 0,75 | 0,40–1,41 | 0,374 | NA | ||
| Cakut como etiologia da DRC | 0,62 | 0,33–1,17 | 0,140 | 1,11 | 0,55–2,26 | 0,763 |
| Etnia não branca | 0,77 | 0,39–1,50 | 0,440 | ND | ||
| Proteinúria nefrótica na V1 | 2,50 | 1,28–4,89 | 0,007 | 2,31 | 1,15–4,65 | 0,019a |
| GFR < 30 na V1 | 2,77 | 1,50–5,15 | 0,001 | 2,44 | 1,30–4,58 | 0,005 |
| Ocorrência de puberdade | 1,28 | 0,71–2,32 | 0,416 | ND | ||
| Situação socioeconômica | 1,02 | 0,68–1,53 | 0,910 | ND | ||
| Escore de z da PAS na V1 | 1,20 | 0,96–1,51 | 0,115 | 1,31 | 1,04–1,64 | 0,021 |
| Escore de z da PAD na V1 | 1,15 | 0,86–1,54 | 0,339 | ND | ||
| Anemia na V1 | 2,98 | 1,64–5,43 | 0,001 | 2,57 | 1,40–4,73 | 0,002a |
| Colesterol sérico na V1 | 1,00 | 0,99–1,00 | 0,562 | ND | ||
| Bicarbonato sérico na V1 | 0,97 | 0,87–1,07 | 0,509 | ND | ||
| PTH no soro na V1 | 1,00 | 1,00–1,00 | 0,046 | 1,00 | 1,00–1,00 | 0,704 |
PAD, pressão arterial diastólica; PAS, pressão arterial sistólica.
A análise das interações entre os fatores de risco revelou uma interação entre anemia na V1 e proteinúria nefrótica (razão de risco (RR) para interação = 0,25; IC de 95% = 0,06‐1,00; p = 0,05), indicou que os níveis de hemoglobina acima do percentil 5 foram associados a um menor ritmo de progressão da DRC apenas em crianças que não apresentaram proteinúria nefrótica e cujo efeito não foi evidente em casos que envolvem proteinúria nefrótica (figura 1).
DiscussãoO principal achado deste estudo foi a corroboração dos fatores anteriormente conhecidos como associados à progressão da DRC, inclusive estágio avançado da DRC, proteinúria nefrótica, maior idade, PA alta e anemia. Adicionalmente, demonstramos a presença de interações entre os fatores de risco para desenvolvimento de DRC, em que o efeito de um fator específico pode ser modificado por outro fator, sugeriu uma possível modulação dos efeitos de dois ou mais fatores na determinação da taxa de perda da função renal. No caso desta amostra, os efeitos nocivos da anemia parecem ser mais importantes em crianças sem proteinúria e isso pode ter implicações na prática clínica.
O estágio da DRC é um fator bem conhecido associado à progressão da doença e uma explicação plausível é o comprometimento mais rápido da função renal conforme a progressão da doença.3,5,10
A proteinúria, outro marcador reconhecido de prognóstico ruim de DRC, também foi associada ao resultado de nosso estudo. Em nossa série, resultado combinado foi observado em 40% das crianças com proteinúria nefrótica, em comparação com 16% das crianças sem proteinúria nefrótica. Esses achados corroboram a associação entre proteinúria nefrótica e progressão mais rápida da DRC.10,11 Essa associação é tão clara que, recentemente, a proteinúria foi postulada não somente como um biomarcador de progressão, mas também como um fator causal de doença renal. Os dados experimentais indicam que a albuminuria tem efeitos tóxicos sobre o tecido renal e leva a uma perda progressiva da função renal. Os mecanismos pelos quais a albuminuria acelera a lesão renal incluem o estímulo de fatores pró‐inflamatórios e indutores de fibrose, culmina em dano aos túbulos intersticiais.12 O fato de a proteinúria ser um indicador ou agente de lesão renal na DRC ainda é desconhecido.13–15O aumento na PA em nosso modelo foi associado à pior progressão da DRC e esse resultado é compatível com estudos anteriores feitos em várias regiões do hemisfério norte, no oeste5,16 e leste.17 No estudo americano, as crianças com PA elevada apresentaram tempo resumido de 38% para atingir o resultado composto, que está de acordo com o aumento de 31% no risco de atingir o resultado composto de nossa amostra.5 A associação parece ser alta, pois o estudo europeu também mostrou que o perigo de progressão para o ponto final foi 0,65 (IC de 95%, 0,44 a 0,94) e o controle intensificado da PA implica que o controle ideal da PA pode desacelerar a progressão da DRC.18
Em nossa coorte, optamos por expressar a PA como escore de z em vez de usar os valores da PA em mmHg, pois nossa amostra envolveu diferentes faixas etárias, inclusive crianças entre um e 17 anos. De acordo com o modelo obtido nesta análise, um aumento de uma unidade no escore de z da PA sistólico na V1 foi associado a uma maior probabilidade de 1,31 vez de atingir o resultado combinado do estudo. Uma possível explicação para a associação entre a PA e o aumento do risco de progressão da DRC pode ser um viés de seleção devido à possibilidade de PA mais alta em crianças com pior função renal. Nesse caso, o efeito seria explicado pela baixa função renal, e não pela PA. Esse resultado não foi observado neste estudo e a diferença no escore de z da PA sistólica entre crianças nos estágios 3 e 4 na V1 foi apenas DP de 0,002. Isso sugere que a PA tem um efeito independente sobre a progressão da DRC. O mecanismo subjacente ao efeito da PA sobre a progressão da DRC é semelhante ao suposto mecanismo para explicar o efeito da PA sobre o sistema cardiovascular, com um papel proeminente de PA alta devido a rigidez muscular, que afeta de forma secundária a microcirculação renal.19,20
Independentemente da explicação para o efeito da PA sobre a progressão da DRC, ela parece ser muito generalizada, pois resultados semelhantes são relatados em estudos que envolvem diferentes origens étnicas e genéticas.
O efeito da idade sobre a progressão da DRC pode ser explicado por três hipóteses: a) um aumento na perda da função renal associado ao desenvolvimento da puberdade, b) uma maior proporção de crianças em estágios mais avançados da DRC e c) maior taxa de doenças glomerulares que evoluem mais rapidamente em crianças mais velhas. Em nossa amostra, o efeito da idade pode ser possivelmente explicado pela primeira hipótese, pois o perfil de diagnóstico predominante de nossa amostra foi Cakut, com pouca representação de doenças glomerulares em todas as faixas etárias. Essa menor frequência de doenças glomerulares pode decorrer do atraso no diagnóstico e no encaminhamento de pacientes com essas doenças no Brasil. Contudo, nossos resultados não possibilitam confirmar essa hipótese. Por fim, não podemos aceitar a segunda hipótese para nossa amostra, pois o percentual de crianças nos estágios 3 e 4 foi semelhante entre as diferentes faixas etárias.
A presença de anemia no início do estudo também foi associada a prognóstico ruim da DRC. Esse resultado é corroborado por um relato de estudo de coorte de sete centros sobre a progressão da DRC em 108 adolescentes dos EUA, mostrou‐se que a queda anualizada na GFR foi maior entre pacientes com anemia com uma queda acelerada de 8,2mL/min por 1,73 m2; IC de 95%: 4,1 a 12,21 e também por um estudo colaborativo NAPRTCS, que avaliou 4.166 crianças e revelou que os pacientes com anemia no início do acompanhamento apresentaram aumento de 52% no risco de progressão da doença, em comparação com os pacientes sem anemia.22 O mecanismo proposto para explicar o efeito da anemia sobre a progressão da DRC é que a hipóxia no tecido renal estimula a produção de citocinas que induzem fibrose e ensaios clínicos em adultos sugeriram que a correção da anemia com eritropoietina pode reduzir o risco de progressão da DRC.9,23
Juntos, os resultados discutidos acima estão de acordo com os resultados de estudos anteriores. Contudo, alguns fatores considerados importantes em outros estudos, como o diagnóstico de base, sexo masculino, puberdade e dislipidemia, não foram associados a um baixo resultado da DRC em nosso estudo. Considerando o diagnóstico de base, supomos que esse fator provavelmente não foi identificado devido à predominância evidente dos casos de Cakut em nossa coorte, que limitaram nossa capacidade de estabelecer diferenças com outros diagnósticos de base. Ademais, apesar de não ter havido associação significativa entre a ocorrência de puberdade e progressão da DRC, a idade foi associada aos piores resultados e pode ser uma indicação indireta do efeito da puberdade. Por outros fatores (sexo masculino e dislipidemia), pode haver diferenças reais entre as populações. Contudo, não podemos excluir a possibilidade de o poder de nosso estudo ter sido insuficiente para demonstrar a presença dessas associações devido ao número de participantes em nossa coorte e ao acompanhamento relativamente curto.
O estudo mais semelhante ao nosso foi feito no Brasil para identificar um modelo para prever a progressão da DRC e envolveu 147 crianças, avaliadas retroativamente por aproximadamente 4,5 anos.24 O modelo mais preciso incluiu eGFR e proteinúria na internação e doença renal primária e a glomerulopatia representa um fator de risco para progressão mais rápida da doença. Exceto o diagnóstico etiológico da DRC, os achados desse estudo foram semelhantes ao nosso.
Uma limitação de nosso estudo foi que as análises bioquímicas foram feitas em laboratórios individuais em cada centro, o que reduziu a uniformidade metodológica das medições laboratoriais. As eGFR tiveram como base as medições de creatinina feitas em cada centro e essa fonte de variação é uma possível limitação de nossos achados, pois o resultado combinado do estudo incluiu uma redução de mais de 50% na eGFR em qualquer momento do acompanhamento. Contudo, esse viés de risco potencial deve ser baixo, pois repetimos nosso modelo estatístico considerando apenas os resultados clínicos observados entre os membros da coorte: a) óbito ou b) início da terapia de substituição renal (diálise ou transplante). Nessa análise post‐hoc, as variáveis associadas ao resultado foram semelhantes às descritas na análise primária: início do acompanhamento da DRC em estágio 4, proteinúria nefrótica e anemia na V1. Contudo, os efeitos da idade e da PA na V1 não foram confirmados.
Outro fator que deve ser considerado uma possível fonte de viés em nosso estudo foi que a GFR foi definida com a fórmula de Schwartz e que a proteinúria foi definida como razão de proteína/creatinina na urina, que pode não representar as medições mais precisas dessas variáveis.
Apesar de suas possíveis limitações, esta coorte teve como base a prática clínica diária de sete centros de nefrologia pediátrica em uma região populosa de um país em desenvolvimento localizado no hemisfério Sul, com predominância de pacientes em uma situação econômica desfavorecida. A maior parte das crianças e adolescentes em todo o mundo vive em uma situação análoga e acreditamos que este estudo possivelmente contribui para o entendimento de fatores de risco para progressão da DRC em crianças em regiões geográficas com condições semelhantes.
Este estudo demonstra a importância do estágio da DRC na linha de base, idade mais avançada, proteinúria em grande escala, anemia e PA sistólica como fatores associados à progressão mais rápida da DRC. Desses fatores, pelo menos três (hipertensão, proteinúria e anemia) podem ser abordados por terapias específicas, que têm implicações práticas significativas. Infelizmente, o diagnóstico da DRC no Brasil é frequentemente estabelecido de forma tardia no curso da doença, quando são indicadas as terapias de substituição renal.25 Esse fato limita a possível utilidade das terapias para postergar a progressão da DRC, o que reforça a necessidade de um diagnóstico precoce da doença. Por fim, observamos uma interação entre a hemoglobina sérica e a proteinúria durante a progressão da DRC, isso sugere que o efeito da hemoglobina pode ser mais importante em crianças sem proteinúria e essa hipótese deve ser testada ainda mais devido às possíveis implicações práticas.
FinanciamentoMinistério da Saúde do Brasil, Programa de Apoio ao Desenvolvimento Institucional do Sistema Único de Saúde – Proadi‐SUS, n° de protocolo 25000.180613/2011‐11.
Conflitos de interesseOs autores declaram não haver conflitos de interesse.
Aos pesquisadores abaixo que contribuíram para o estudo: Débora Helena Silveira Dias, Marta Liliane Maia, Anelise Del Vechio Gessullo, Luciana de Santis Feltran, Anna Cristina Gervásio Lutaif, Sumara Zuanazzi Pinto Rigatto, Helen Sasaki Takagi, Erika Arai Furusawa, Maria Cristina Andrade, Maria Luiza Dautro Moreira do Val, Enzo Ricardo Russo, Elaine Mara Lourenço.
Como citar este artigo: Belangero VM, Prates LC, Watanabe A, Schvartsman BS, Nussenzveig P, Cruz NA, et al. Prospective cohort analyzing risk factors for chronic kidney disease progression in children. J Pediatr (Rio J). 2018;94:525–31.
Estudo feito no Hospital Samaritano de São Paulo, São Paulo, SP, Brasil.