The aim of this study was to identify the causes of congenital microcephaly in Rio Grande do Sul, a state in southern Brazil, where no ZIKV outbreak was detected, from December 2015 to December 2016, which was the period when ZIKV infection was at its peak in northeast Brazil.
MethodsThis was a cross‐sectional study where all notifications of congenital microcephaly in the state of Rio Grande do Sul were included for analysis. Evaluation of cases followed the guidelines of the Brazilian Ministry of Health. Dysmorphological and neurological evaluations were performed by a specialized team, and genetic tests and neuroimaging were performed when clinically indicated. STORCH infections were diagnosed using standard tests. ZIKV infection was diagnosed through maternal serum RT‐PCR and/or neuroimaging associated with clinical/epidemiological criteria.
ResultsFrom 153744 registered live births in the study period, 148 cases were notified, but 90 (60.8%) of those were later excluded as “non‐confirmed” microcephaly. In the 58 confirmed cases of microcephaly (prevalence = 3.8/10000 live births), congenital infections (syphilis, toxoplasmosis, cytomegalovirus, and ZIKV) constituted the predominant etiology (50.0%), followed by isolated CNS (15.5%), and genetic syndromes (10.3%). Congenital ZIKV syndrome (CZS) with typical phenotype was diagnosed in three cases (5.2% of all confirmed microcephaly cases or 10.4% of all congenital infections).
ConclusionIn Rio Grande do Sul, where no outbreak of ZIKV infection was recorded, congenital infections were the leading cause of congenital microcephaly, and the attributable risk for CZS in the etiology of microcephaly was 5.2%.
Identificar as causas da microcefalia congênita no Rio Grande do Sul, Região Sul do Brasil, onde não foi detectado surto de ZIKV, de dezembro de 2015 a dezembro de 2016. Esse foi o período em que a infecção por ZIKV estava em seu auge no Nordeste do Brasil.
MétodosEste é um estudo transversal no qual todas as notificações de microcefalia congênita no estado do Rio Grande do Sul foram incluídas para análise. A avaliação dos casos seguiu as orientações do Ministério da Saúde. A avaliação dismorfológica e neurológica foi feita por uma equipe especializada e os testes genéticos e as neuroimagens foram feitos quando indicado clinicamente. As infecções STORCH (Sífilis, Toxoplasmose, Rubéola, Citomegalovírus e Herpes simples) foram diagnosticadas utilizando testes padrão. A infecção por ZIKV foi diagnosticada por meio da transcriptase reversa seguida de reação em cadeia da polimerase (RT‐PCR) no soro materno e/ou neuroimagem associada a critérios clínicos/epidemiológicos.
ResultadosDe 153.744 nascidos vivos registrados no período do estudo, 148 bebês foram casos notificados, porém 90 (60,8%) casos foram excluídos posteriormente como microcefalia “não confirmada”. Nos 58 casos confirmados de microcefalia (prevalência = 3,8/10.000 nascidos vivos), as infecções congênitas (sífilis, toxoplasmose, citomegalovírus e ZIKV) constituíram a etiologia predominante (50,0%), seguidas de doenças ligadas ao SNC isolado (15,5%) e síndromes genéticas (10,3%). A síndrome congênita do ZIKV (SCZ) com fenótipo típico foi diagnosticada em três casos (5,2% de todos os casos confirmados de microcefalia ou 10,4% de todas as infecções congênitas).
ConclusãoNo Rio Grande do Sul, Brasil, onde não foi registrado surto de infecção por ZIKV, a principal causa de microcefalia congênita foram infecções congênitas e o risco atribuível para SCZ na etiologia de microcefalia foi de 5,2%.
Em fevereiro de 2016, a Organização Mundial de Saúde (OMS) declarou uma Emergência de Saúde Pública de Interesse Internacional (ESPII) com relação à infecção por vírus Zika (ZIKV) na América Latina e sua possível associação com aglomerados de microcefalia. Antes disso, em novembro de 2016, o Ministério da Saúde (MS) havia implantado uma notificação obrigatória de microcefalia neonatal e/ou outras anomalias no sistema nervoso central (SNC).1 A associação entre as anomalias no SNC, inclusive microcefalia e infecção pré‐natal por ZIKV, foi comprovada em 20162,3 e foi definida uma síndrome congênita do ZIKV.4
Contudo, a microcefalia congênita é uma doença heterogênea, com base em uma medida do perímetro cefálico, com grande número de causas genéticas e ambientais descritas até hoje, inclusive infecções congênitas, síndromes genéticas e malformações no SNC.1,5,6 A maior parte das orientações atuais define a microcefalia como uma circunferência occipitofrontal (COF), ou perímetro cefálico (PC), mais de dois desvios‐padrão (DPs) abaixo da média populacional, e microcefalia grave como PC < 3 DP abaixo da média. O PC é uma medida indireta do tamanho do cérebro e pode ser uma variável preditora de desenvolvimento cerebral anormal.1,7
As causas da microcefalia geralmente permanecem desconhecidas. Em estudos retrospectivos, nenhuma etiologia é identificada em até 40‐70% dos casos.5,6 A notificação obrigatória da microcefalia possibilita uma avaliação mais detalhada desses casos. Contudo, há uma associação bem estabelecida entre a microcefalia e as infecções maternas, principalmente nas que ocorrem nas primeiras 12 semanas de gravidez, que podem causar formas características de dano cerebral. Além da microcefalia, essas manifestações incluem hidrocefalia, calcificações cerebrais, ventriculomegalia, distúrbios da migração cortical, anomalias na matéria branca e hipoplasia cerebelar.8
Antes de 2015, a prevalência estimada de microcefalia grave no nascimento foi 0,5 por 10.000 nascidos vivos. Após identificação da possível associação entre a infecção por ZIKV e microcefalia na Região Nordeste do Brasil, essa prevalência aumentou para cerca de 20 casos por 10.000 nascidos vivos. Os estados nordestinos do Brasil apresentaram a maior incidência da doença do ZIKV na população geral (34/10.000 no Estado da Bahia em 2016). Por outro lado, no Rio Grande do Sul (RS), o estado mais meridional do Brasil, apesar de terem sido identificados casos autóctones no início de 2016, não houve surto e o pico de incidência foi de somente 1,7 caso por 100.000 habitantes.9
MétodosModelo do estudoFizemos um estudo transversal, no qual foram incluídas todas as notificações de microcefalia congênita no Rio Grande do Sul, de dezembro de 2015 a 31 de dezembro de 2016 (56 semanas epidemiológicas).
Definição dos casos e protocolo do estudoDurante os primeiros três meses do estudo, a notificação foi obrigatória pelo MS para todos os bebês nascidos com PC igual ou inferior a 32cm. Foi feita uma análise da notificação dos casos feita pelo MS em fevereiro de 2016, quando foi definida microcefalia para escore z do PC < 2 abaixo da média para o sexo e a idade gestacional (IG), de acordo com as curvas do Intergrowth.10 A avaliação dos casos seguiu as diretrizes do Protocolo de Vigilância e Resposta publicado pelo MS.1
Relato de casosOs neonatos foram relatados para o Registro de Eventos de Saúde Pública (RESP) pelo primeiro médico a identificar microcefalia. Os médicos tiveram de informar os dados de nascimento e parto (inclusive PC, peso, IG), os achados clínicos e de imagem anormais, as doenças maternas e gestacionais e as possíveis infecções e exposições durante a gravidez, inclusive viagem para áreas endêmicas do ZIKV. Os casos foram classificados posteriormente por nós como (1) casos “não confirmados” de microcefalia: bebês prematuros proporcionais sem outras anomalias (foram excluídos como microcefalia ao ajustar o sexo e a idade gestacional com a aplicação dos gráficos do Integrowth); PC pequeno em bebês proporcionais pequenos para a idade gestacional, com desenvolvimento normal e sem anomalia associada; PC de 32cm no nascimento (critérios de inclusão somente nos primeiros três meses da notificação obrigatória) sem outras anomalias e desenvolvimento normal no acompanhamento; (2) casos “confirmados” ou reais de microcefalia: todos os casos relatados restantes. Os casos confirmados foram classificados posteriormente por etiologia, como segue. As infecções congênitas foram diagnosticadas com os seguintes critérios: 1) ZIKV: confirmada por histórico materno de viagem para áreas endêmicas, erupções cutâneas e dor nas articulações; e histórico neonatal de achados de imagem no SNC, achados no exame físico ou resultado na reação em cadeia da polimerase (PCR) do ZIKV compatível com doença do vírus Zika. 2) CMV: confirmado por PCR positiva na urina. 3) Toxoplasmose e rubéola: confirmadas por sorologia positiva para imunoglobulina (IgM) no sangue. 4) Sífilis: confirmada por exame do Laboratório de Pesquisa de Doenças Venéreas (VDRL) em uma amostra de sangue do neonato ou amostra do fluido cerebrospinal (LCR) ou teste positivo para anticorpo treponêmico fluorescente (FTAAbs).
Os testes de sorologia para toxoplasmose e rubéola e PCR do ZIKV nas amostras de sangue das mães e dos neonatos foram feitos no Laboratório Central do Estado (Laceno). O exame de sífilis por VDRL, PCR do CMV e a neuroimagem (ultrassom, TC ou RMI) foram feitos nos municípios de origem dos pacientes. A tabela 1 descreve a distribuição dos testes de diagnóstico feitos na amostra.
Investigação laboratorial e de imagem de 148 casos notificados de microcefalia no Rio Grande do Sul, Brasil, de 1° dezembro de 2015 a 31 de dezembro de 2016
| N | % | |
|---|---|---|
| Neuroimagema | 90 | 60,8 |
| Sorologia para toxoplasmose | 107 | 72,3 |
| Sorologia para rubéola | 101 | 68,2 |
| Reação em cadeia da polimerase do vírus Zika, sangue | 105 | 71 |
| Exame de sífilis (VDRL) | 108 | 73 |
| Reação em cadeia da polimerase do citomegalovírus, urina | 30 | 20,3 |
Os dados maternos e neonatais foram analisados pelo Centro Estadual de Vigilância em Saúde (CEVS). Os prontuários foram revisados conjuntamente pela equipe do CEVS e pelo Sistema Nacional de Informação sobre Agentes Teratogênicos (SIAT). O SIAT conta com uma equipe multidisciplinar de geneticistas médicos, pediatras e enfermeiros especialmente treinados – que incluem alguns dos autores deste relatório – e é afiliado ao Serviço de Genética Médica do Hospital de Clínicas de Porto Alegre (HCPA), um centro de cuidado terciário e importante hospital de referência do Rio Grande do Sul.
Atendimento ao pacienteTodos os pacientes inicialmente receberam atendimento em seus municípios de origem. Todos os casos confirmados de microcefalia foram encaminhados para nosso hospital de referência (HCPA) para avaliação clínica e, caso necessário, investigação adicional.
Investigação das causas genéticas ou malformações isoladas no SNCOs neonatos com histórico familiar de anomalias genéticas, consanguinidade, achados anormais no diagnóstico por imagem ou manifestações clínicas (alterações morfológicas) sugestivas de doenças genéticas foram submetidos a teste genético específico (inclusive cariotipagem e rastreio de erros inatos do metabolismo) e um exame físico detalhado, feito por um geneticista médico, juntamente com a investigação das possíveis causas infecciosas.
Os percentis do PC foram calculados com os gráficos do Intergrowth, corrigidos para sexo e IG. A análise da amostra foi feita na versão 20.0 do software SPSS. A prevalência da microcefalia foi calculada com o número de nascidos vivos entre dezembro de 2015 e dezembro de 2016. Este estudo foi aprovado pelo Comitê de Ética em Pesquisa do HCPA (protocolo n° 16‐0577).
ResultadosEm geral, 148 neonatos foram notificados no Rio Grande do Sul durante as 56 semanas epidemiológicas de interesse, em 153.744 nascidos vivos registrados (prevalência 9,6/10.000). O exame de neuroimagem foi feito em 60,8% dos casos e os testes das infecções congênitas foram feitos em 20% a 73% dos neonatos (tabela 1).
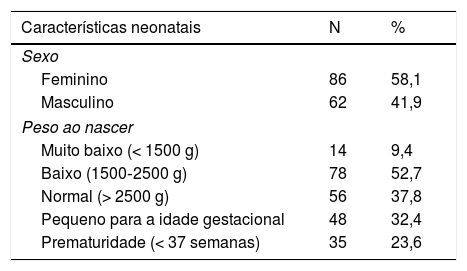
As características demográficas das mães e antropométricas dos recém‐nascidos são apresentadas na tabela 2. De modo geral, 18 mães (18,3%) relataram ter consumido bebidas alcóolicas durante a gravidez (dessas, cinco neonatos apresentaram anomalias no SNC de etiologia não definida) e 30 relataram tabagismo; 14 relataram uso de drogas ilícitas; 27 (62,1%) apresentaram baixo peso ao nascer; 35 (23,6%) nasceram prematuros e 48 (32,4%) eram pequenos para a idade gestacional. Os achados de neuroimagem foram anormais em 48,9% dos casos (n = 44/90), quando disponível.
Características maternas e neonatais de 148 casos notificados de microcefalia no Rio Grande do Sul, Brasil, de 1° de dezembro de 2015 a 31 de dezembro de 2016
| Características neonatais | N | % |
|---|---|---|
| Sexo | ||
| Feminino | 86 | 58,1 |
| Masculino | 62 | 41,9 |
| Peso ao nascer | ||
| Muito baixo (< 1500 g) | 14 | 9,4 |
| Baixo (1500‐2500 g) | 78 | 52,7 |
| Normal (> 2500 g) | 56 | 37,8 |
| Pequeno para a idade gestacional | 48 | 32,4 |
| Prematuridade (< 37 semanas) | 35 | 23,6 |
| Características maternas | N | % |
|---|---|---|
| Idade | ||
| Até 20 | 34 | 22,9 |
| 20‐35 | 86 | 58,1 |
| Mais de 35 | 28 | 18,9 |
| Etnia | ||
| Branca | 99 | 66,9 |
| Mista | 21 | 14,2 |
| Negra | 28 | 18,9 |
| Exposições na gestaçãoa | ||
| Bebidas alcoólicas | 18 | 18,3 |
| Tabagismo | 30 | 30,6 |
| Drogas ilícitas | 14 | 14,3 |
Uma análise detalhada dos 148 bebês notificados levou a 90 (60,8%) casos considerados microcefalia “não confirmada”: 20 com PC de 32 no nascimento e desenvolvimento normal no acompanhamento; e 70 nasceram com PC inferior a 32cm, porém foram excluídos após se aplicarem os gráficos do Intergrowth (ajustados para idade gestacional e sexo); ou proporcionalmente pequenos para a idade gestacional e sem detecção de qualquer anomalia cerebral ou neurológica. Nesse grupo, foram detectados alguns fatores de risco conhecidos para prematuridade/pequeno para a idade gestacional, como infecção por HIV (dois casos), consumo de bebidas alcóolicas (cinco casos), crack (dois casos), fumaça de cigarro, hipertensão materna. Contudo, uma causa definida não pôde ser estabelecida.
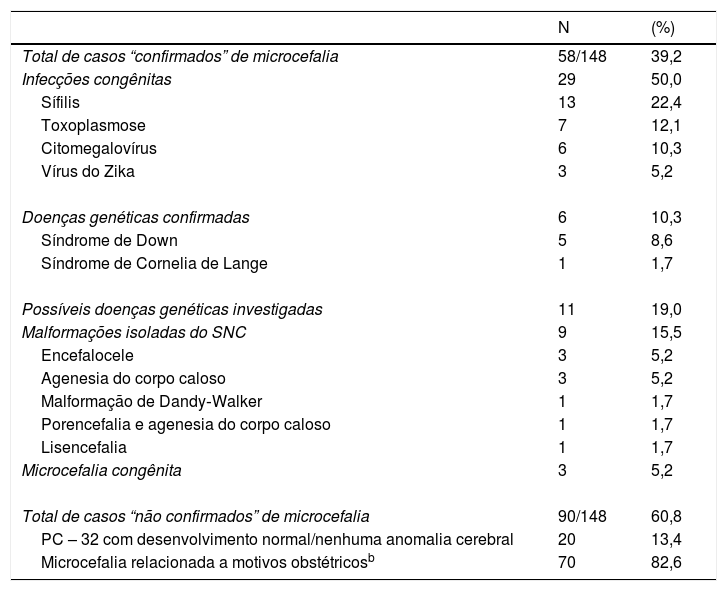
Nos 58 casos confirmados de microcefalia (prevalência = 3,8/10.000 nascidos vivos), as infecções congênitas foram o principal fator causal identificado (n = 29; 50,0%): sífilis (n = 13; 22,4%), toxoplasmose (n = 7; 12,1%), CMV (n = 6; 10,3%) e ZIKV (n = 3; 5,2%). Nove casos (15,5%) foram classificados como malformações isoladas no SNC (tabela 3) e consistiram em encefalocele (5,2%), agenesia do corpo caloso (5,2%), entre outras. Seis pacientes (10,3%) foram diagnosticados com síndromes genéticas, porém, em outros 11 casos, houve suspeita de uma doença genética, porém sem confirmação de síndrome específica.
Descrição das causas de 148 casos notificados de microcefalia no Rio Grande do Sul, Brasil, de 1° de dezembro de 2015 a 31 de dezembro de 2016
| N | (%) | |
|---|---|---|
| Total de casos “confirmados” de microcefalia | 58/148 | 39,2 |
| Infecções congênitas | 29 | 50,0 |
| Sífilis | 13 | 22,4 |
| Toxoplasmose | 7 | 12,1 |
| Citomegalovírus | 6 | 10,3 |
| Vírus do Zika | 3 | 5,2 |
| Doenças genéticas confirmadas | 6 | 10,3 |
| Síndrome de Down | 5 | 8,6 |
| Síndrome de Cornelia de Lange | 1 | 1,7 |
| Possíveis doenças genéticas investigadas | 11 | 19,0 |
| Malformações isoladas do SNC | 9 | 15,5 |
| Encefalocele | 3 | 5,2 |
| Agenesia do corpo caloso | 3 | 5,2 |
| Malformação de Dandy‐Walker | 1 | 1,7 |
| Porencefalia e agenesia do corpo caloso | 1 | 1,7 |
| Lisencefalia | 1 | 1,7 |
| Microcefalia congênita | 3 | 5,2 |
| Total de casos “não confirmados” de microcefalia | 90/148 | 60,8 |
| PC – 32 com desenvolvimento normal/nenhuma anomalia cerebral | 20 | 13,4 |
| Microcefalia relacionada a motivos obstétricosb | 70 | 82,6 |
a Critérios para notificação de dezembro de 2015 a fevereiro de 2016, somente.
Caso 1: sexo feminino, nascida em 2015, de um casal jovem e saudável não consanguíneo, histórico familiar negativo para anomalias congênitas, idade gestacional (IG) de 38 semanas, peso 2,436g; comprimento 44cm; PC 27cm (escore z < 3). A mãe viajou para o Nordeste do Brasil (Recife, Pernambuco) durante seu segundo mês de gravidez, quando apresentou erupções cutâneas, conjuntivite e artralgia. Não fez exame, pois, na época, estava com uma infecção e o ZIKV não foi considerado uma infecção de preocupação. O exame clínico no bebê foi feito por nossa equipe aos três meses de idade, quando observamos uma desproporção craniofacial significativa com perímetro cefálico pequeno e osso occipital proeminente, colapso dos ossos cranianos, pele redundante no couro cabeludo e na região da nuca, espasticidade, hiperatividade, dificuldades de deglutição e choro inconsolável. O fundo dos olhos não foi avaliado, pois a paciente interrompeu o acompanhamento. A RT‐PCR foi negativa no LCR e soro do bebê. Ressonância magnética neurológica: microcalcificações, aumento ventricular, paquigiria, atrofia cortical. Storch foi negativo. O caso foi concluído como SCZ com base nos critérios clínicos e epidemiológicos.
Caso 2: sexo masculino, nascido em 2015, de um casal jovem e saudável não consanguíneo, histórico familiar negativo para anomalias congênitas, idade gestacional (IG) de 37 semanas, peso 2,740g; comprimento 43cm; PC 31cm (escore z < 2). A mãe viajou para Campinas, São Paulo, e logo após seu retorno apresentou erupções cutâneas pruriginosas e artralgia, porém não fez o teste de PCR. O exame clínico por nossa equipe foi feito aos 20 meses de idade. Naquela época, o PC era 39,5cm (escore z < 3). Observamos desproporção craniofacial acentuada, testa estreita com depressão bifrontal, suturas sobrepostas, dobras epicânticas, estrabismo, pés tortos e artrogripose nos joelhos. No exame neurológico, observamos hipertonia acentuada, irritabilidade e atraso neuromotor. Ressonância magnética neurológica: calcificações, aumento ventricular, polimicrogiria. Storch foi negativo. O caso foi concluído como SCZ com base nos critérios clínicos e epidemiológicos.
Caso 3: sexo feminino, nascida em 2016, de um casal jovem e saudável não consanguíneo, histórico familiar negativo para anomalias congênitas, idade gestacional (IG) de 37 semanas, peso 2,100g; comprimento 43cm; PC 26,5cm (escore z < 3). A mãe mencionou ter tido febre leve, erupções cutâneas pruriginosas e artralgia no segundo mês de gestação. Ela não viajou, porém estava em uma cidade onde a dengue é endêmica. Ela não fez exame durante a gravidez. O exame clínico por nossa equipe foi feito aos 11 meses de idade: PC 33cm (escore z < 3), desproporção craniofacial, testa estreita com depressão bifrontal, osso occipital proeminente, colapso dos ossos cranianos, dobras cutâneas, mãos com contraturas, artrogripose. Exame neurológico: espasticidade, irritabilidade, dificuldade de deglutição e choro inconsolável. Atraso no neurodesenvolvimento. Fundo de olho normal. A RT‐PCR foi negativa no LCR e soro do bebê. Exame de TC: calcificações bilaterais no cérebro, aumento ventricular, padrão giral simplificado. Storch foi negativo. O caso foi concluído como SCZ com base nos critérios clínicos e epidemiológicos.
DiscussãoNo Rio Grande do Sul, o estado mais meridional do Brasil, a circulação autóctone do ZIKV foi restrita a algumas regiões geográficas e ao verão, pois o inverno nessa parte do Brasil tem temperaturas médias abaixo de 20°C, inibe a atividade do Aedes egyptii. Contudo, a prevalência de microcefalia no presente estudo foi 3,8/10.000, que ultrapassa bastante a estimativa brasileira antes de 2015 de 0,5 caso por 10.000 nascidos vivos.9 Para fins de comparação, em um estudo que avaliou os nascidos vivos de janeiro de 2015 a janeiro de 2016, as taxas de prevalência mais elevadas foram observadas nos estados do Nordeste do Brasil: Pernambuco (16,6/10.000 IC =12,3‐17,2) e Paraíba (10,8/10.000; IC = 8,86‐13,04), em comparação com 0,60/10.000 (IC 0,22‐1,31).11 Portanto, essas observações mostram que, no Rio Grande do Sul, há um aumento nos relatos de microcefalia em comparação com os anos anteriores, apesar de não tão alto quando nos estados nordestinos, onde há uma real epidemia do ZIKV. Esse aumento no Rio Grande do Sul está mais provavelmente relacionado à definição mais ampla de microcefalia (escores z do PC < 2 abaixo da média), bem como à pesquisa ativa e relato de recém‐nascidos com perímetro cefálico pequeno, independentemente de sua etiologia. Essa hipótese é compatível com as observações nos hospitais que participam do Estudo Colaborativo Latino Americano de Malformações Congênitas (Eclamc) de 2005 a 2014, no qual foi estimada uma prevalência de base populacional para microcefalia de 3,0/10.000 (IC de 95%: 2,7‐3,4/10.000).12
No presente estudo, 50,0% dos casos de microcefalia estavam relacionados à infecção, porém apenas 10,4% eram secundários ao ZIKV. Um estudo nacional investigou a prevalência de infecção relacionada à microcefalia no Brasil em 2015‐2016 com o uso das informações secundárias dos Sistemas de Vigilância do Ministério da Saúde. Eles concluíram que, em 5.968 casos de microcefalia relatados no Brasil, 1.950 (32,7%) estavam relacionados à infecção (30,3% ainda estavam sob investigação). A infecção por ZIKV foi a etiologia em 15,6% dos casos, predominantemente no Nordeste do Brasil. As infecções Storch somente puderam ser confirmadas em 5,4% e esse pequeno percentual deve‐se provavelmente à falta de disponibilidade de testes laboratoriais.11 No Piauí, um estado nordestino no Brasil, foi observado prevalência de 13,6/10.000 casos de microcefalia, durante a epidemia do vírus Zika em 2015‐2016, e 45,3% (34/75) deles possivelmente relacionados ao Zika, pois o Storch foi negativo nesses 34.13
As doenças genéticas sindrômicas totalizaram 10% dos casos no presente estudo; 19% ainda eram investigados devido a uma possível doença genética; 15% estavam associados a malformações do sistema nervoso central. Uma taxa semelhante foi relatada nos EUA em uma amostra de recém‐nascidos com microcefalia e 13% dos casos foram atribuíveis a doenças genéticas confirmadas.14 Nos hospitais sul‐americanos, no estudo Eclamc,12 23% dos bebês com microcefalia foram diagnosticados com uma síndrome genética e 12% associados a malformações neurológicas, não muito diferente de nosso estudo.
Em nosso estudo, 61% foram descartados por motivos clínicos. Em seu trabalho que analisou os primeiros 1.501 nascidos vivos com investigação completa no Brasil, Franca et al.15 também descartaram 59% das notificações, mais frequentemente devido ao fato de eles não terem apresentado anomalias óbvias como sintomas neurológicos ou de serem recém‐nascidos proporcionalmente pequenos (por exemplo, com baixo peso ao nascer). Um dos motivos desse alto percentual de exclusão por motivos clínicos é a adoção dos escores z < 2 como limite para notificação, que é menos específico para detectar anomalias congênitas e incluir muitos bebês “normais” com PC na distribuição mais baixa da curva normal. Antes do surgimento do ZIKV, a definição clínica de microcefalia foi, em geral, restrita a escores z < 3.12
Este estudo tem várias limitações. Primeira, devido à natureza da emergência de saúde com relação ao ZIKV, a indisponibilidade ocasional de algumas modalidades de diagnóstico e a impossibilidade de alguns pacientes viajarem para o HCPA, nem todas as avaliações clínicas foram feitas pela mesma equipe. Segunda, a medição do PC pode não ter sido feita de forma sistematicamente correta e a neuroimagem somente esteve disponível a aproximadamente 60% dos recém‐nascidos. Terceiro, o viés de memória retrospectivo aplica‐se a algumas doenças das mães, inclusive tratamentos e exposições durante a gravidez (principalmente com relação ao consumo de bebidas alcóolicas). Quarto, o exame de sorologia do CMV estava disponível para somente 29% dos casos e o exame de herpes não foi incluído em todos.
Por fim, a indisponibilidade de testes de diagnóstico de fato confiáveis para detecção do ZIKV é outra limitação deste estudo. Conforme observado em outros estudos, a PCR do ZIKV no soro das mães ou dos neonatos normalmente é negativa até sete dias após a infecção. Os testes imunológicos para triagem populacional são suscetíveis à reatividade cruzada com outras infecções flavivírus e não foram feitos sistematicamente em nossa amostra. Nesse contexto, um exame clínico abrangente e direcionado, com base na descrição de casos na literatura da síndrome congênita do Zika, desempenha um papel decisivo no diagnóstico.8,16,17 Assim, casos menos severos de infecção por ZIKV podem não ter sido relatados.
Apesar dessas limitações, este estudo fornece uma importante estimativa da etiologia da microcefalia em uma região adjacente, porém não diretamente afetada pelo surto do ZIKV.
Em conclusão, as infecções congênitas têm o maior impacto sobre a etiologia da microcefalia no Rio Grande do Sul, apesar de a contribuição do ZIKV ter sido relativamente baixa em relação à observada no Nordeste do Brasil. Portanto, apesar dos esforços do Ministério da Saúde do Brasil para melhorar o tratamento e a prevenção de doenças na gestação, ainda há muito trabalho a ser feito em termos de educação e saúde pública para melhorar a eficácia das medidas preventivas e garantir que elas atinjam a maior parte da população.
FinanciamentoPrograma de Apoio Fundo de Incentivo a Pesquisa de Eventos do Hospital de Clínicas de Porto Alegre (Fipe‐HCPA) e Conselho Nacional de Desenvolvimento Científico e Tecnológico (CNPq).
Conflitos de interesseOs autores declaram não haver conflitos de interesse.
Ao CEVS por seu apoio na avaliação dos casos; ao SIAT por seu trabalho na investigação dos dados; à administração do HCPA, que atuou como hospital de referência para esses casos; e ao Programa de Pós‐Graduação em Medicina em Ciências Médicas, Universidade Federal do Rio Grande do Sul.
Como citar este artigo: Herber S, Silva AA, Sanseverino MT, Friedrich L, Ranieri TM, Favreto C, et al. Prevalence and causes of congenital microcephaly in the absence of a Zika virus outbreak in southern Brazil. J Pediatr (Rio J). 2019;95:600–6.