Evaluate the association between perinatal factors and amplitude‐integrated electroencephalogram abnormalities in preterm infants on the first day of life.
MethodsThis was a cross‐sectional study of 60 infants with gestational age between 23 and 32 weeks, without malformations. Infants were continuously monitored by amplitude‐integrated electroencephalogram on the first day of life, for at least 3h. The tracings were recorded and analyzed in each column for the following: burst‐suppression pattern, sleep‐wake cycle, and amplitude of the lower margin (<3μV or <5μV). The association of maternal complications, mode of delivery, birth weight, gestational age, neonatal sex, resuscitation procedures, hypothermia on admission, and the Score for Neonatal Acute Physiology, Perinatal Extension, Version II [SNAPPE‐II]) with amplitude‐integrated electroencephalogram alterations was assessed by multiple logistic regression.
ResultsA discontinuous pattern occurred in 65% of infants, and a continuous pattern occurred in 23%. The burst‐suppression pattern was associated with vaginal delivery (OR: 7.6; 95% CI: 1.1–53.1) and SNAPPE‐II≥40 (OR: 13.1; 95% CI: 1.8–95.1). A lower margin of the amplitude‐integrated electroencephalogram of <3μV was also associated with SNAPPE‐II≥40 (OR: 10.6, 95% CI: 2.3–49.2), while a value <5μV was associated with lower GA (OR: 0.51, 95% CI: 0.34–0.76). There were no associations between the perinatal variables and the absence of a sleep‐wake cycle in amplitude‐integrated electroencephalogram recordings on the first day of life.
ConclusionBiological variables and clinical severity are associated with electroencephalographic characteristics of preterm infants on the first day of life and should be considered in clinical practice when amplitude‐integrated electroencephalogram is performed.
Avaliar a associação entre fatores perinatais e anormalidades no eletroencefalograma de amplitude integrada em recém‐nascidos prematuros no primeiro dia de vida.
MétodosEste é um estudo transversal de 60 bebês com idade gestacional entre 23-32 semanas, sem malformações. Os recém-nascidos foram continuamente monitorados por eletroencefalograma de amplitude integrada no primeiro dia de vida por pelo menos 3 horas. Os traçados foram registrados e analisados em cada coluna para: padrão de surto-supressão, ciclo de sono-vigília e amplitude da margem inferior (< 3 μV ou < 5 μV). A associação de complicações maternas, tipo de parto, peso ao nascer, idade gestacional, sexo do neonato, procedimentos de reanimação, hipotermia na admissão e Escore para Fisiologia Neonatal Aguda, Extensão Perinatal, versão II (SNAPPE-II) com alterações no eletroencefalograma de amplitude integrada foi avaliada por regressão logística múltipla.
ResultadosUm padrão descontínuo ocorreu em 65% dos recém‐nascidos e o padrão contínuo ocorreu em 23%. O padrão de surto‐supressão foi associado ao parto vaginal (OR 7,6; IC95% 1,1‐53,1) e SNAPPE‐II≥40 (OR 13,1; IC95% 1,8‐95,1). Uma margem inferior do eletroencefalograma de amplitude integrada < 3μV também foi associada com escore SNAPPE‐II≥40 (OR 10,6, IC95% 2,3‐49,2), enquanto um valor <5μV foi associado com menor IG (OR 0,51, IC 95% 0,34‐0,76). Não houve associações entre as variáveis perinatais e a ausência de ciclo sono‐vigília nas gravações de eletroencefalograma de amplitude integrada no primeiro dia de vida.
ConclusãoAs variáveis biológicas e a gravidade clínica estão associadas às características eletroencefalográficas dos recém‐nascidos prematuros no primeiro dia de vida e devem ser consideradas na prática clínica quando o eletroencefalograma de amplitude integrada é realizado.
A monitoração da função cerebral de prematuros tem ganhado importância devido aos fatores que podem prejudicar seu sistema nervoso central, especialmente nos primeiros dias de vida.1–5 Um método cada vez mais usado é a avaliação da atividade elétrica cerebral por meio de eletroencefalograma de amplitude integrada (aEEG).6 Isso se deve à facilidade de uso do monitor, à possibilidade de interpretação por neonatologistas à beira do leito, à boa correlação com o EEG convencional7,8 e ao fato de o método levar em consideração a maturação cerebral.9 Entretanto, considerando os múltiplos fatores perinatais que podem afetar a atividade elétrica do cérebro, a interpretação dos resultados do aEEG nesses pacientes ainda é limitada.
Nos últimos anos, dois estudos investigaram o efeito dos fatores perinatais no aEEG.10,11 Natalucci et al. analisaram os traçados de aEEG nas primeiras 96 horas de vida de neonatos com idade gestacional (IG) < 32 semanas, estabilidade hemodinâmica e sem malformações e observaram aumento da maturação com aumentos na IG corrigida.10 Reynolds et al. avaliaram 136 bebês com IG < 30 semanas por 72 horas nas primeiras duas semanas de vida e por quatro horas na idade corrigida de 30, 34 e 40 semanas. Um padrão periódico imaturo no aEEG inicial foi associado a um alto escore de gravidade clínica, parto vaginal, sexo masculino e progressão para óbito.11 No entanto, nenhum dos estudos acima avaliou se as alterações de aEEG observadas nos primeiros dias de vida foram associadas a fatores perinatais relacionados às variáveis ??maternas periparto e neonatais.
Nesse contexto, o objetivo do presente estudo foi avaliar a associação entre fatores perinatais e alterações no traçado de aEEG no primeiro dia de vida em prematuros com IG entre 23 e 32 semanas.
MétodosEste estudo transversal foi feito na unidade de terapia intensiva neonatal (UTIN) do Hospital Universitário da Escola Paulista de Medicina da Universidade Federal de São Paulo (EPM‐Unifesp) e aprovado pelo Comitê de Ética em Pesquisa da instituição (Protocolo n° 10309512.7.0000.5505). Os pais ou responsáveis ??pelos bebês participantes autorizaram o estudo e assinaram o termo de consentimento livre e esclarecido.
Os participantes do estudo eram recém‐nascidos prematuros com IG entre 230/7 e 326/7semanas pela estimativa obstétrica, nas primeiras 24 horas de vida, sem anormalidades congênitas maiores. Foram excluídos os pacientes que necessitaram de ressuscitação avançada na sala de parto, aqueles cujas mães usaram drogas ilícitas ou álcool antes do nascimento ou receberam anestesia geral durante o parto. Os recém‐nascidos para os quais o dispositivo de aEEG não estava disponível e aqueles monitorados por um período menor do que três horas também foram excluídos. O cálculo do tamanho da amostra considerou a necessidade de avaliar pelo menos cinco fatores independentes para cada variável resposta e a necessidade de incluir de 10 a 15 pacientes para cada variável independente analisada no modelo de regressão logística,12 para 60 pacientes.
O monitoramento do aEEG teve início nas primeiras 24 horas de vida, após admissão e estabilização do paciente na UTIN, caracterizada por normotermia, início de infusão endovenosa e uso de surfactante, quando necessário. O aEEG foi monitorado com um monitor Olympic CFM 6000 (Natus Medical Incorporated, Califórnia, EUA). A pele do couro cabeludo foi preparada para a aplicação do eletrodo.13 Dois eletrodos de hidrogel foram colocados nas regiões parietais P3‐P4, conforme recomendado no sistema internacional 10‐20,14 com uma distância aproximada de 7,5cm entre eles. Um eletrodo neutro foi colocado na linha média da área frontal. Os pacientes foram monitorados continuamente no primeiro dia de vida por pelo menos três horas após a colocação do eletrodo. O manuseio dos recém‐nascidos foi registrado nos traçados com os marcadores do dispositivo.
Os traçados foram registrados e revisados pelos pesquisadores principais com um monitor Olympic CFM 6000 Viewer (Natus Medical Incorporated, Califórnia, EUA). As margens superiores e inferiores de cada coluna registrada, que corresponderam a um traçado de 10 minutos do aEEG, foram analisadas. A gravação do traçado do aEEG incluiu o registro de EEGs brutos. O EEG bruto foi analisado para detectar artefatos com base no padrão detalhado por Hellström‐Westas et al.6 Se um artefato fosse detectado, o intervalo correspondente de 10 minutos do aEEG era removido da análise. Os períodos de monitoramento com impedância maior do que 20 kΩ, que indicava adesão deficiente dos eletrodos, também foram descartados.
As variáveis analisadas no aEEG, como detalhado por Hellström‐Westas et al.,6 foram: 1) padrão de fundo eletrocortical predominante (se presente em mais de 50% do intervalo registrado analisado), foi classificado como supressão contínua, descontínua e de surto; 2) presença do ciclo de sono‐vigília (a partir da variação sinusoidal de margem inferior para o ciclo maduro); 3) média das margens inferior e superior demonstrada em μV; 4) amplitude da banda EEG; 5) presença de convulsões (confirmada pelo EEG bruto).
Dados demográficos e clínicos da mãe foram coletados, assim como dados demográficos e procedimentos neonatais feitos na sala de parto. Após admissão na UTIN, foram registrados: adequação do peso para IG,15 hipotermia à admissão,16 Escore para Fisiologia Neonatal Aguda, Extensão Perinatal, escore SNAPPE‐II,17 administração de opioide (fentanil) e tratamento com cafeína no primeiro dia após o nascimento.
As seguintes anormalidades no aEEG no primeiro dia de vida, conforme definido por Hellström‐Westas et al.6 e Burdjalov et al.,9 foram adotadas como variáveis de resposta no estudo: 1) Padrão de surto‐supressão predominante no aEEG; 2) Ausência do ciclo de sono‐vigília; 3) Margem inferior média do traçado de aEEG < 5μV; 4) Margem inferior média do traçado de aEEG < 3μV. Para cada variável, os recém‐nascidos com e sem a alteração foram comparados em relação às características maternas e neonatais, com o teste do qui‐quadrado ou exato de Fisher para variáveis categóricas e teste t ou de Mann‐Whitney para variáveis numéricas. Para construir os modelos de regressão logística e identificar os fatores associados a cada uma das quatro anormalidades no traçado do aEEG, foram escolhidas as variáveis independentes com p < 0,20 na análise univariada. As variáveis com p > 0,05 foram removidas uma a uma e o ajuste do modelo foi avaliado em cada estágio. Os resultados foram descritos como odds ratio (OR) e intervalo de confiança de 95% (IC95%). Todos os modelos logísticos foram ajustados para a duração dos traçados registrados, as horas de vida no início do monitoramento e a idade gestacional, uma vez que a distribuição de 10 semanas da idade gestacional dos bebês incluídos poderia ser o determinante mais importante dos diferentes padrões do aEEG. Como a administração de fentanil apresentou uma forte correlação com o parto vaginal e o escore SNAPPE II ≥ 40 (correlação de Spearman; p = 0,016 e p < 0,001, respectivamente), o uso de opioide não foi incluído nos modelos logísticos. A qualidade do ajuste de todos os modelos logísticos foi avaliada pelo teste de Hosmer‐Lemeshow. Usou‐se o software SPSS (IBM SPSS Statistics for Windows, versão 19.0, Armonk, NY, EUA).
ResultadosDe junho de 2013 a novembro de 2015, ocorreram 2.097 nascimentos em nosso hospital. Desses, 145 recém‐nascidos preencheram os critérios de inclusão para o estudo; no entanto, 80 foram excluídos por razões técnicas. Dos 65 pacientes restantes, quatro não foram autorizados pelos pais a serem monitorados como parte do estudo e um recém‐nascido foi excluído após o diagnóstico de uma síndrome genética. Portanto, o estudo incluiu 60 prematuros.
Entre a população estudada, 51 (85%) eram de gestação única, 15 (25%) nasceram por parto vaginal, 48 (80%) mães receberam pelo menos uma dose de corticoide antenatal, 33 (55%) mães receberam sulfato de magnésio para neuroproteção e 10 (17%) mães apresentaram infecção periparto. Dos 60 neonatos, três (5%) tinham idade gestacional de 24 semanas, 10 (17%) 25‐26 semanas, 17 (28%) 27‐28 semanas, 16 (27%) 29‐30 semanas e 14 (23%) 31‐32 semanas. A IG média foi de 28,5 ± 2,4 semanas (intervalo: 24‐32 semanas) e o peso médio ao nascer foi de 1.045 ± 369g (intervalo: 380‐2.050). Dezenove (32%) recém‐nascidos eram pequenos para a idade gestacional e 33 (55%) eram do sexo masculino. Na sala de parto, 42 (70%) crianças necessitaram de ventilação com pressão positiva e 15 (25%) necessitaram de intubação. Na admissão na UTIN, 23 (38%) pacientes apresentaram temperatura axilar < 36°C. O escore SNAPPE médio foi de 26 ± 24 e esse valor foi maior ou igual a 40 em 16 (27%) neonatos.
Os registros de aEEG foram iniciados em 12 ± 6 horas de vida e a duração média do monitoramento foi de 1.281 ± 314 minutos (mediana e moda de 1.440 minutos). O traçado do aEEG permitiu a análise da atividade cerebral em 85% desses registros. A margem inferior média foi de 4,2 ± 1,3μV e a margem superior média foi de 24,6 ± 6,0μV. A presença de aEEG contínuo, aEEG descontínuo e surto‐supressão foi observada em 14 (23%), 39 (65%) e sete (12%) recém‐nascidos, respectivamente. Um ciclo de sono‐vigília foi observado em 42 (70%) neonatos e convulsões eletroencefalográficas em dois (3%) pacientes.
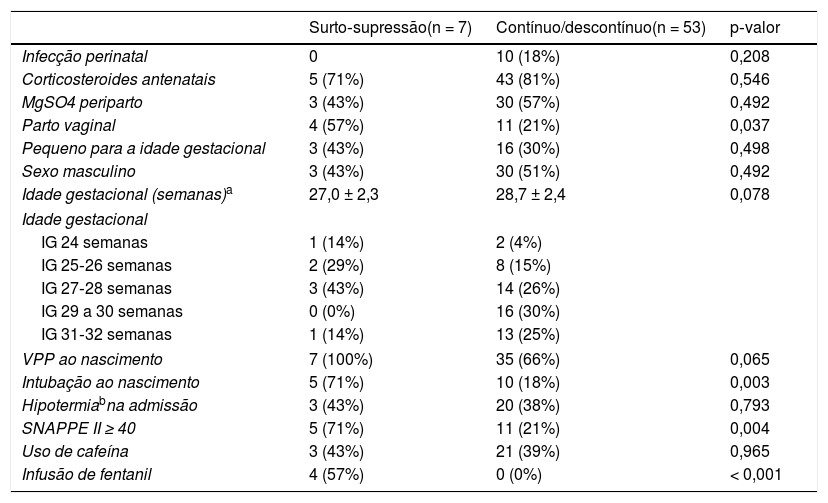
A análise univariada dos fatores associados ao surto‐supressão na população estudada é apresentada na tabela 1. Na análise multivariada para o desfecho surto‐supressão, dois modelos logísticos foram construídos, considerou‐se a colinearidade das variáveis “ventilação com pressão positiva ao nascimento” e “intubação ao nascimento”. Ambos os modelos indicaram que o parto vaginal (OR = 7,6, IC95% = 1,1‐53,1; p = 0,041) e o escore SNAPPE II ≥ 40 (OR = 13,1; IC95% = 1,8‐95,1; p = 0,011) aumentaram a chance da presença de um padrão surto‐supressão no primeiro dia de vida (teste de Hosmer‐Lemeshow: p = 0,736 para ambos os modelos).
Fatores associados ao padrão surto‐supressão no padrão de fundo do traçado do aEEG em recém‐nascidos prematuros (RNP) no primeiro dia de vida
| Surto‐supressão(n = 7) | Contínuo/descontínuo(n = 53) | p‐valor | |
|---|---|---|---|
| Infecção perinatal | 0 | 10 (18%) | 0,208 |
| Corticosteroides antenatais | 5 (71%) | 43 (81%) | 0,546 |
| MgSO4 periparto | 3 (43%) | 30 (57%) | 0,492 |
| Parto vaginal | 4 (57%) | 11 (21%) | 0,037 |
| Pequeno para a idade gestacional | 3 (43%) | 16 (30%) | 0,498 |
| Sexo masculino | 3 (43%) | 30 (51%) | 0,492 |
| Idade gestacional (semanas)a | 27,0 ± 2,3 | 28,7 ± 2,4 | 0,078 |
| Idade gestacional | |||
| IG 24 semanas | 1 (14%) | 2 (4%) | |
| IG 25‐26 semanas | 2 (29%) | 8 (15%) | |
| IG 27‐28 semanas | 3 (43%) | 14 (26%) | |
| IG 29 a 30 semanas | 0 (0%) | 16 (30%) | |
| IG 31‐32 semanas | 1 (14%) | 13 (25%) | |
| VPP ao nascimento | 7 (100%) | 35 (66%) | 0,065 |
| Intubação ao nascimento | 5 (71%) | 10 (18%) | 0,003 |
| Hipotermiabna admissão | 3 (43%) | 20 (38%) | 0,793 |
| SNAPPE II ≥ 40 | 5 (71%) | 11 (21%) | 0,004 |
| Uso de cafeína | 3 (43%) | 21 (39%) | 0,965 |
| Infusão de fentanil | 4 (57%) | 0 (0%) | < 0,001 |
SNAPPE II, Score for Neonatal Acute Physiology, Perinatal Extension, Version II; VPP, ventilação com pressão positiva.
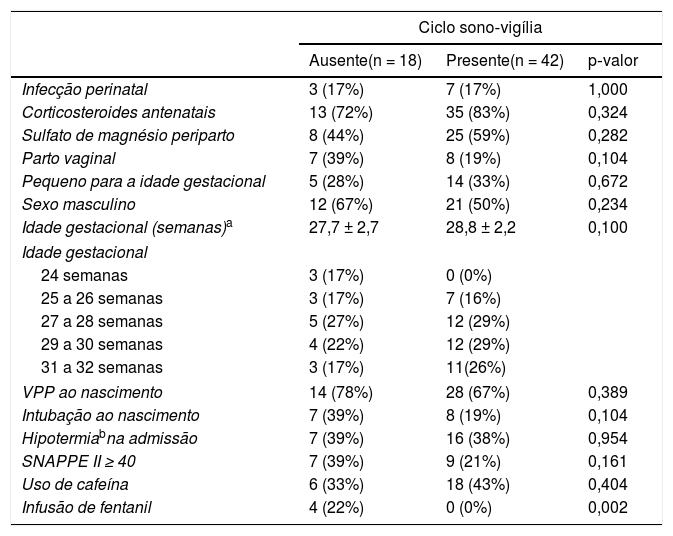
As diferenças entre os pacientes que apresentaram ou não o ciclo de sono‐vigília no traçado do aEEG no primeiro dia de vida são mostradas na tabela 2. Nenhuma variável alterou a chance da ausência do ciclo de sono‐vigília no aEEG no primeiro dia de vida na população estudada.
Fatores associados à ausência do ciclo de sono‐vigília no traçado do aEEG em RNP no primeiro dia de vida
| Ciclo sono‐vigília | |||
|---|---|---|---|
| Ausente(n = 18) | Presente(n = 42) | p‐valor | |
| Infecção perinatal | 3 (17%) | 7 (17%) | 1,000 |
| Corticosteroides antenatais | 13 (72%) | 35 (83%) | 0,324 |
| Sulfato de magnésio periparto | 8 (44%) | 25 (59%) | 0,282 |
| Parto vaginal | 7 (39%) | 8 (19%) | 0,104 |
| Pequeno para a idade gestacional | 5 (28%) | 14 (33%) | 0,672 |
| Sexo masculino | 12 (67%) | 21 (50%) | 0,234 |
| Idade gestacional (semanas)a | 27,7 ± 2,7 | 28,8 ± 2,2 | 0,100 |
| Idade gestacional | |||
| 24 semanas | 3 (17%) | 0 (0%) | |
| 25 a 26 semanas | 3 (17%) | 7 (16%) | |
| 27 a 28 semanas | 5 (27%) | 12 (29%) | |
| 29 a 30 semanas | 4 (22%) | 12 (29%) | |
| 31 a 32 semanas | 3 (17%) | 11(26%) | |
| VPP ao nascimento | 14 (78%) | 28 (67%) | 0,389 |
| Intubação ao nascimento | 7 (39%) | 8 (19%) | 0,104 |
| Hipotermiabna admissão | 7 (39%) | 16 (38%) | 0,954 |
| SNAPPE II ≥ 40 | 7 (39%) | 9 (21%) | 0,161 |
| Uso de cafeína | 6 (33%) | 18 (43%) | 0,404 |
| Infusão de fentanil | 4 (22%) | 0 (0%) | 0,002 |
SNAPPE II, Score for Neonatal Acute Physiology, Perinatal Extension, Version II; VPP, ventilação com pressão positiva.
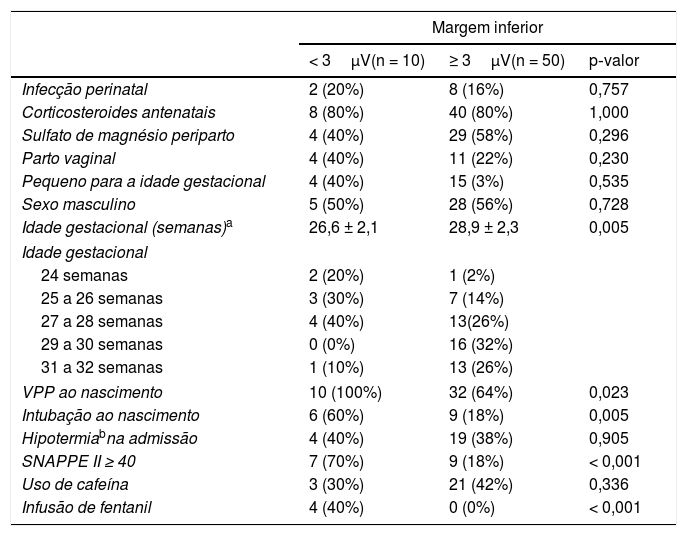
A análise univariada dos fatores associados com uma margem inferior < 3μV, no aEEG de recém‐nascidos prematuros no primeiro dia de vida, é mostrada na tabela 3. Na análise multivariada, a presença de um escore SNAPPE II ≥ 40 aumentou a probabilidade de uma margem inferior < 3μV (OR = 10,6; IC95% = 2,3‐49,2; p = 0,003; teste de Hosmer‐Lemeshow: p = 0,128). A variável “ventilação com pressão positiva ao nascimento” foi substituída por “intubação ao nascimento” no modelo logístico devido à colinearidade entre elas com resultados idênticos: o escore SNAPPE II ≥ 40 foi associado a uma maior chance de detectar uma margem inferior <3 μV no aEEG de prematuros no primeiro dia de vida (OR = 10,6; IC95% = 2,3‐49,2; p = 0,003; teste de Hosmer‐Lemeshow: p = 0,128).
Fatores associados a uma margem inferior < 3μV, no traçado do aEEG de RNP no primeiro dia de vida
| Margem inferior | |||
|---|---|---|---|
| < 3μV(n = 10) | ≥ 3μV(n = 50) | p‐valor | |
| Infecção perinatal | 2 (20%) | 8 (16%) | 0,757 |
| Corticosteroides antenatais | 8 (80%) | 40 (80%) | 1,000 |
| Sulfato de magnésio periparto | 4 (40%) | 29 (58%) | 0,296 |
| Parto vaginal | 4 (40%) | 11 (22%) | 0,230 |
| Pequeno para a idade gestacional | 4 (40%) | 15 (3%) | 0,535 |
| Sexo masculino | 5 (50%) | 28 (56%) | 0,728 |
| Idade gestacional (semanas)a | 26,6 ± 2,1 | 28,9 ± 2,3 | 0,005 |
| Idade gestacional | |||
| 24 semanas | 2 (20%) | 1 (2%) | |
| 25 a 26 semanas | 3 (30%) | 7 (14%) | |
| 27 a 28 semanas | 4 (40%) | 13(26%) | |
| 29 a 30 semanas | 0 (0%) | 16 (32%) | |
| 31 a 32 semanas | 1 (10%) | 13 (26%) | |
| VPP ao nascimento | 10 (100%) | 32 (64%) | 0,023 |
| Intubação ao nascimento | 6 (60%) | 9 (18%) | 0,005 |
| Hipotermiabna admissão | 4 (40%) | 19 (38%) | 0,905 |
| SNAPPE II ≥ 40 | 7 (70%) | 9 (18%) | < 0,001 |
| Uso de cafeína | 3 (30%) | 21 (42%) | 0,336 |
| Infusão de fentanil | 4 (40%) | 0 (0%) | < 0,001 |
SNAPPE II, Score for Neonatal Acute Physiology, Perinatal Extension, Version II; VPP, ventilação com pressão positiva.
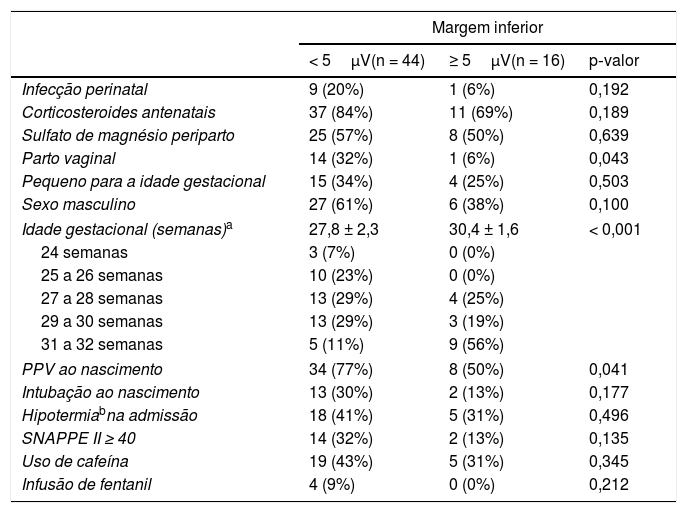
A análise univariada dos fatores associados a uma margem inferior < 5μV na população estudada é mostrada na tabela 4. No modelo logístico, cada semana gestacional adicional diminuiu a probabilidade de uma margem inferior < 5μV em quase 50% (OR = 0,51 IC95% = 0,34‐0,761; p = 0,001). A variável sexo resultou em melhor ajuste do modelo, embora não tenha sido significativo (OR = 4,03; IC95% = 0,96‐16,04; p = 0,057). O ajuste do modelo logístico com as variáveis IG e sexo demonstrou um valor de p = 0,210 no teste de Hosmer‐Lemeshow.
Fatores associados a margens inferiores < 5μV no traçado do aEEG de RNP no primeiro dia de vida
| Margem inferior | |||
|---|---|---|---|
| < 5μV(n = 44) | ≥ 5μV(n = 16) | p‐valor | |
| Infecção perinatal | 9 (20%) | 1 (6%) | 0,192 |
| Corticosteroides antenatais | 37 (84%) | 11 (69%) | 0,189 |
| Sulfato de magnésio periparto | 25 (57%) | 8 (50%) | 0,639 |
| Parto vaginal | 14 (32%) | 1 (6%) | 0,043 |
| Pequeno para a idade gestacional | 15 (34%) | 4 (25%) | 0,503 |
| Sexo masculino | 27 (61%) | 6 (38%) | 0,100 |
| Idade gestacional (semanas)a | 27,8 ± 2,3 | 30,4 ± 1,6 | < 0,001 |
| 24 semanas | 3 (7%) | 0 (0%) | |
| 25 a 26 semanas | 10 (23%) | 0 (0%) | |
| 27 a 28 semanas | 13 (29%) | 4 (25%) | |
| 29 a 30 semanas | 13 (29%) | 3 (19%) | |
| 31 a 32 semanas | 5 (11%) | 9 (56%) | |
| PPV ao nascimento | 34 (77%) | 8 (50%) | 0,041 |
| Intubação ao nascimento | 13 (30%) | 2 (13%) | 0,177 |
| Hipotermiabna admissão | 18 (41%) | 5 (31%) | 0,496 |
| SNAPPE II ≥ 40 | 14 (32%) | 2 (13%) | 0,135 |
| Uso de cafeína | 19 (43%) | 5 (31%) | 0,345 |
| Infusão de fentanil | 4 (9%) | 0 (0%) | 0,212 |
SNAPPE II, Score for Neonatal Acute Physiology, Perinatal Extension, Version II; VPP, ventilação com pressão positiva.
Este estudo mostrou que os traçados eletroencefalográficos predominante nos recém‐nascidos prematuros avaliados foram os traçados descontínuos e que as variáveis biológicas dos pacientes e sua gravidade clínica estavam associadas às características eletroencefalográficas no primeiro dia de vida.
O padrão de surto‐supressão ocorreu em 12% dos recém‐nascidos prematuros incluídos neste estudo e essa taxa foi semelhante à encontrada por Chalak et al.18 (16%) em recém‐nascidos com IG < 28 semanas monitorados no primeiro dia de vida. Wikström et al.19 analisaram traçados de aEEG durante as primeiras 72 horas de vida e observaram o padrão de surto‐supressão em 25% dos pacientes com IG entre 28 e 30 semanas e 5% a 8% naqueles com IG < 28 semanas. Em comparação com o nosso estudo, esses autores monitoraram pacientes por um período mais longo, possivelmente aumentou‐se o efeito das complicações associadas à prematuridade e ao cuidado neonatal na atividade elétrica cerebral. Nossos resultados sugerem uma associação do padrão surto‐supressão com o parto vaginal e com a gravidade clínica dos recém‐nascidos, como demonstrado pela presença do escore SNAPPE II ≥ 40. O parto vaginal pode aumentar a pressão venosa central e alterar o fluxo sanguíneo cerebral, que também é afetado pela gravidade clínica, uma vez que a deficiência da autorregulação do fluxo sanguíneo cerebral é comum em bebês extremamente prematuros e gravemente doentes.1,20 Alterações no fluxo sanguíneo cerebral podem levar a mudanças na atividade elétrica cerebral e ao desenvolvimento do padrão de surto‐supressão. A flutuação do fluxo sanguíneo cerebral é um dos mecanismos envolvidos na fisiopatologia da hemorragia peri‐intraventricular em prematuros e o padrão de surto‐supressão está associado à ocorrência de hemorragias cerebrais nesses pacientes.18,21
Um ciclo de sono‐vigília foi observado em 70% dos pacientes monitorados, semelhante ao observado por Wikström et al.19 em recém‐nascidos com IG < 30 semanas nas primeiras 72 horas de vida. Nosso resultado também é consistente com os achados de Soubasi et al.,22 que estudaram neonatos com IG < 32 semanas durante as primeiras 12 a 72 horas de vida. Reynolds et al.11 analisaram os fatores perinatais associados à ausência do ciclo de sono‐vigília nas primeiras duas semanas de vida em neonatos com IG < 30 semanas, mostraram associação com escore de gravidade elevado, parto vaginal, sexo masculino e progressão para óbito. Em nosso estudo, nenhum dos fatores perinatais avaliados foi associado à ausência do ciclo de sono‐vigília no aEEG de recém‐nascidos prematuros durante o primeiro dia de vida. Os diferentes resultados podem ter ocorrido porque Reynolds et al.11 iniciaram o monitoramento mais tarde (média: 59h) do que em nosso estudo (média: 12h), possivelmente refletiram os efeitos das complicações da prematuridade e do cuidado neonatal no não desenvolvimento do ciclo de sono‐vigília.
No presente estudo, uma margem inferior, < 3μV, foi observada em 20% dos pacientes, semelhante à taxa de 22% encontrada por Soubasi et al. em recém‐nascidos com IG < 32 semanas nas primeiras 72 horas de vida.22 Para Griesmaier et al.,23 a idade pós‐natal estava fortemente associada à presença de uma margem inferior < 3μV. Nossos achados indicaram que um escore SNAPPE II ≥ 40 estava associado à presença de uma margem inferior no traçado do aEEG < 3μV. Da mesma forma, Horst et al. observaram uma correlação negativa entre a margem inferior média e o escore clínico de gravidade do SNAP II; essa correlação foi mais forte no primeiro dia de vida e desapareceu no quarto dia de vida em recém‐nascidos com IG entre 26 e 32 semanas.24 Esses resultados sugerem que a instabilidade hemodinâmica de prematuros imediatamente após o nascimento3 modifica a atividade cerebral e diminui a margem inferior do traçado do aEEG; esse efeito é mais forte nas primeiras horas de vida.
Uma margem inferior < 5μV foi observada em 73% dos pacientes no primeiro dia de vida, resultado semelhante ao observado por Soubasi et al.22 em prematuros acompanhados nas primeiras 72 horas de vida. Uma margem inferior < 5μV, em nosso estudo, foi associada à IG, mas o sexo masculino promoveu um melhor ajuste do modelo para a análise multivariada. Vários estudos indicam que a amplitude da margem inferior está associada à IG e à idade pós‐natal e que a margem inferior aumenta à medida que a IG aumenta.10,23–26 Em relação ao sexo, Olishar et al.27 verificaram que o sexo masculino e uma IG menor aumentaram a probabilidade de anormalidades no escore composto do aEEG, definido pelo traçado da linha basal, ciclo de sono‐vigília e convulsões.
Observamos a diferença nos fatores associados a margens inferiores < 3μV e < 5μV em nosso estudo (SNAPPE II ≥ 40 vs. IG, respectivamente). Isso pode ocorrer, em parte, devido à depressão mais intensa da atividade elétrica cerebral na presença de alterações estruturais ou bioquímicas no sistema nervoso central, comuns em pacientes críticos, como indicado pelo escore SNAPPE II ≥ 40.22,24 Portanto, a margem inferior < 3μV no primeiro dia de vida pode indicar anormalidades da função cerebral em recém‐nascidos prematuros, enquanto a margem inferior entre 3‐5μV está mais fortemente associada à maturidade dos recém‐nascidos. De fato, uma margem inferior entre 3‐5μV em recém‐nascidos com IG < 26 semanas foi considerada normal por Burdjalov et al.9
A incidência de convulsões em nosso estudo (3%) foi semelhante à observada por Lloyd et al. (5%),28 que usaram um EEG multicanal. No entanto, Shah et al.,29 que usaram um aEEG de dois canais, encontraram convulsões eletrográficas em 13,7% dos recém‐nascidos monitorados. Em nosso estudo e no de Lloyd et al., o monitoramento foi iniciado o mais rapidamente possível após o nascimento, enquanto Shah et al. começaram a monitorar, em média, no fim do primeiro dia de vida (22h), com diferentes janelas para incidência e diagnóstico de convulsões.
Nosso estudo tem limitações, particularmente em relação ao seu desenho observacional transversal. A duração do monitoramento da atividade elétrica cerebral variou entre 180 e 1.650 minutos; assim, o traçado da linha basal pode não estar totalmente estabelecido em pacientes monitorados por um período mais curto. Houve uma perda de recém‐nascidos elegíveis para o estudo devido à falta de equipamentos e outros problemas técnicos. Observa‐se que esses problemas ocorreram de forma aleatória, o que provavelmente diminuiu a possibilidade de viés. Os traçados do aEEG foram analisados visualmente, e não com um software, o que teria aumentado a acurácia dos valores obtidos das margens inferiores e superiores. No entanto, como as margens inferiores foram comparadas categoricamente (com pontos de corte de 3μV e 5μV), a classificação visual dessa variável não afetou os resultados. Finalmente, os traçados foram analisados por um único pesquisador. Para superar essa limitação e aumentar a acurácia da leitura, cada coluna de registro foi analisada individualmente, com atenção para a ocorrência de artefatos e exclusão do período em que os artefatos foram observados.
Em conclusão, fatores como IG, tipo de parto e gravidade clínica dos recém‐nascidos prematuros estão associados às características do traçado eletroencefalográfico no primeiro dia de vida e devem ser considerados e discutidos quando se busca um padrão de normalidade e na caracterização de anormalidades nesse grupo de pacientes durante a monitoração clínica por aEEG.
FinanciamentoJCS recebeu uma bolsa do Ministério da Educação do Brasil (Capes – Coordenação de Aperfeiçoamento de Pessoal de Nível Superior).
Conflitos de interesseOs autores declaram não haver conflitos de interesse.
Como citar este artigo: Castro JS, Leslie AT, Guinsburg R. Perinatal factors associated with amplitude‐integrated electroencephalography abnormalities in preterm infants on the first day of life. J Pediatr (Rio J). 2020;96:622–9.
Estudo vinculado a Universidade Federal de São Paulo, Escola Paulista de Medicina, São Paulo, SP, Brasil.