To describe the success rate and the complications after procedures to diagnose abdominal non‐Hodgkin's lymphoma in children and adolescents.
MethodsA retrospective cross‐sectional study was conducted with a population consisting of children and adolescents with abdominal non‐Hodgkin's lymphoma diagnosed between September 1994 and December 2012. The sample comprised of 100 patients who underwent 113 diagnostic procedures, including urgent surgery (n=21), elective surgery (n=36), and non‐surgical diagnosis (n=56).
ResultsThe most frequent procedures were laparotomy (46.9%) and ultrasound‐guided core biopsy (25.6%). The rate of diagnostic success was 95.2% for urgent surgeries; 100% for elective surgeries and 82.1% for non‐surgical procedures (p<0.05). The rates of complication during the three diagnosis procedures considered were significant (p<0.001; 95.2% of the urgent surgeries, 83.8% of the elective surgeries, and 10.7% of the non‐surgical procedures). The length of time before resuming a full diet and starting chemotherapy was significantly reduced for patients who underwent non‐surgical procedures when compared with the other procedures (p<0.001).
ConclusionNon‐surgical procedures for the diagnosis of pediatric abdominal non‐Hodgkin's lymphoma are an effective option with low morbidity rate, allowing an earlier resumption of a full diet and chemotherapy initiation. Furthermore, non‐surgical procedures should also be considered for obtaining tumor samples from patients with extensive disease.
Descrever a taxa de sucesso e as complicações dos procedimentos para o diagnóstico de linfoma não Hodgkin abdominal em crianças e adolescentes.
MétodosEstudo retrospectivo transversal em uma população de crianças e adolescentes com linfoma não Hodgkin abdominal diagnosticada entre setembro de 1994 e dezembro de 2012. A amostra foi composta por 100 pacientes submetidos a 113 procedimentos diagnósticos, inclusive cirurgia de urgência (n = 21), cirurgia eletiva (n = 36) e diagnóstico não cirúrgico (n = 56).
ResultadosOs procedimentos mais frequentes foram laparotomia (46,9%) e biópsia guiada por ultrassonografia (25,6%). A taxa de sucesso diagnóstico foi de 95,2% para cirurgias de urgência; 100% para cirurgias eletivas e 82,1% para procedimentos não cirúrgicos (p < 0,05). Houve diferença significativa entre as taxas de complicação associadas aos três grupos (p < 0,001; 95,2% das cirurgias urgentes, 83,8% das cirurgias eletivas e 10,7% dos procedimentos não cirúrgicos). O tempo decorrido até o reinício da dieta plena e o início a quimioterapia foi significativamente reduzido para os pacientes submetidos a procedimentos não cirúrgicos quando comparados com os outros procedimentos (p < 0,001).
ConclusãoOs procedimentos não cirúrgicos para o diagnóstico do linfoma não Hodgkin abdominal pediátrico são uma opção efetiva com baixa taxa de morbidade, permitem uma retomada mais precoce de uma dieta plena e início de quimioterapia. Em pacientes com doença extensa, os procedimentos não cirúrgicos também devem ser considerados para a obtenção de amostras tumorais.
Os linfomas pediátricos são a terceira neoplasia maligna mais comum de crianças e adolescentes em países desenvolvidos e o segundo mais comum em países em desenvolvimento, após a leucemia.1,2
Não há um consenso com relação à melhor forma de obter material para um estudo histopatológico sobre linfoma não Hodgkin (LNH) quando diferentes variáveis, como precisão de diagnóstico e morbidez‐mortalidade após o procedimento, são consideradas.3–5 A biópsia cirúrgica de nódulos linfáticos e tecido extranodal é considerada um padrão de base para diagnóstico de linfoma. Contudo, recentemente, a biópsia guiada por imagem tem sido considerada uma opção adequada à cirurgia, pois é menos cara, menos invasiva e tem poucas complicações relacionadas, principalmente quando se trata de massas não superficiais.4,6–8 Apesar de haver comprovação dos benefícios de procedimentos não cirúrgicos no diagnóstico de LNH em adultos, não há literatura exclusivamente com relação a crianças e adolescentes.
Este estudo visa a descrever a taxa de sucesso e as complicações para cada tipo de procedimento usado no diagnóstico histológico e citológico de crianças e adolescentes com LNH abdominal.
MétodosModelo do estudoEstudo retrospectivo, observacional e transversal. O estudo foi aprovado pelo Comitê de Ética em Pesquisa Humana (CAAE 11825013.1.0000.5201). A população estudada abrangeu crianças e adolescentes com LNH abdominal diagnosticados entre setembro de 1994 e dezembro de 2012. Durante esse período, 262 pacientes com LNH foram internados no serviço de oncologia pediátrica. Desses, 177 até 18 anos e diagnosticados com LNH abdominal foram incluídos neste estudo, apesar de sete pacientes diagnosticados por meio de material biológico extra‐abdominal e 70 com prontuários médicos incompletos ou ausentes (definido por resultados patológico e complicações do procedimento diagnóstico) terem sido excluídos deste estudo.
Coleta de dados e análiseAs variáveis clínicas e epidemiológicas coletadas foram: idade no momento do diagnóstico (anos), tamanho do tumor (maior eixo da massa em centímetros), tipo histológico de acordo com a Organização Mundial de Saúde,9 estágio de acordo com o Estadiamento de Murphy do Tumor,10 método de diagnóstico, local do tumor e número de procedimentos necessários para diagnóstico. Os dados foram agrupados de acordo com o método de diagnóstico: métodos cirúrgicos, inclusive laparotomia e biópsia laparoscópica, que foram divididos em grupo de cirurgia de urgência (na presença de abdômen agudo cirúrgico) ou grupo de cirurgia eletiva (com indicação puramente de diagnóstico, na ausência de abdômen agudo); e métodos não cirúrgicos, inclusive ultrassom e biópsia guiada por tomografia, biópsia, paracentese e biópsia endoscópica. Nesses grupos, as variáveis coletadas foram: sucesso no diagnóstico (definido por confirmação do diagnóstico por patologia/citologia), complicações relacionadas ao método de diagnóstico (classificado em níveis de gravidade de I a V,11 número de amostras coletadas na biópsia, indicação e achado cirúrgico em cirurgias urgentes, tempo antes de reiniciar uma dieta completa (dias) e tempo antes de iniciar quimioterapia (dias).
As amostras enviadas para o departamento de patologia foram processadas da seguinte forma: para amostras de tecido de métodos cirúrgicos e não cirúrgicos, foi feita análise citológica por decalque (imprint), seguida de exame de histopatologia de cortes corados de hematoxilina e eosina e análise de imuno‐histoquímica (IHC); foi avaliado o fluido peritoneal por análise citológica após citocentrifugação e, desde 2003, por citometria de fluxo e imunofenotipagem.
A classificação de complicação processual modificada por Dindo et al. consistiu em cinco níveis de gravidade. O nível I incluiu qualquer desvio do pós‐operatório normal. Os regimes terapêuticos permitidos foram: medicamentos como antieméticos, antipiréticos, analgésicos, diuréticos, eletrólitos e fisioterapia. Esse nível também inclui infecções de feridas abertas no leito. O nível II abrangeu complicações que exigem tratamento farmacológico com medicamentos, exceto os permitidos para as complicações de nível I (também são incluídas transfusões sanguíneas e nutrição parenteral total). As complicações de nível III foram definidas como as que exigem intervenção cirúrgica, endoscópica ou radiológica. As complicações de nível IV fatais exigem tratamento intensivo. O nível V significa morte de um paciente.11
Análise estatísticaA análise de dados foi feita com o software Stata 12.1 (StataCorp, College Station, TX, EUA). O teste Z foi usado para análise do sucesso no diagnóstico e das complicações. O qui‐quadrado (χ2) foi usado para comparar a proporção de complicações de cada nível de gravidade entre os diferentes procedimentos de diagnóstico. O teste exato de Fisher foi usado para comparação entre os grupos, quando o número esperado de indivíduos em uma categoria foi suficientemente pequeno. Essa análise foi seguida do uso do procedimento de Marascuilo para comparação entre os grupos. O teste de Kruskal‐Wallis com pós‐teste de Bonferroni foi usado para testar a relevância das diferenças encontradas entre os diferentes grupos com relação ao tempo antes de reiniciar uma dieta completa e o tempo antes de iniciar quimioterapia. Os índices de prevalência foram calculados por meio dos ajustes dos modelos de regressão de Poisson com a opção de desvio‐padrão robusto. A relação entre o número de fragmentos na biópsia e o diagnóstico positivo foi analisada com o teste qui‐quadrado para tendências lineares. Um valor de p < 0,05 foi considerado significativo.
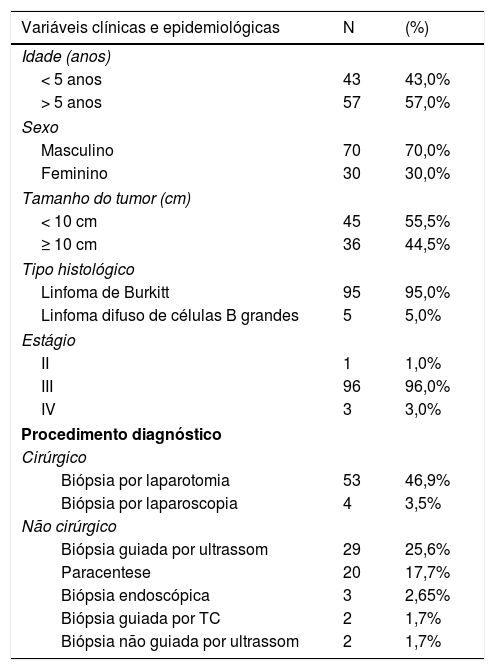
ResultadosA amostra consistiu em 100 pacientes, submetidos a 113 procedimentos de diagnóstico, inclusive 57 cirurgias e 56 procedimentos não cirúrgicos. Houve uma predominância de pacientes do sexo masculino (2.3:1). As idades variaram entre 1‐16, com média de 6,3 (± 3,5) anos. No momento do diagnóstico, 43% dos pacientes estavam com cinco anos. O linfoma de Burkitt (LB) foi o tipo histológico predominante de LNH (95%). Os casos de linfoma linfoblástico não foram relatados. Câncer estágio III foi predominante em 96% dos casos (tabela 1). Os locais de tumor mais comuns foram: intestino delgado (64%), mesentério (59%), retroperitônio (26%), cólon (21%), pélvis (20%), fígado (17%) e rim (10%). Outros locais (28 pacientes) incluíram outros órgãos abdominais e não abdominais.
Frequência de distribuição de variáveis clínicas e epidemiológicas em pacientes com linfoma não Hodgkin abdominal
| Variáveis clínicas e epidemiológicas | N | (%) |
|---|---|---|
| Idade (anos) | ||
| < 5 anos | 43 | 43,0% |
| > 5 anos | 57 | 57,0% |
| Sexo | ||
| Masculino | 70 | 70,0% |
| Feminino | 30 | 30,0% |
| Tamanho do tumor (cm) | ||
| < 10 cm | 45 | 55,5% |
| ≥ 10 cm | 36 | 44,5% |
| Tipo histológico | ||
| Linfoma de Burkitt | 95 | 95,0% |
| Linfoma difuso de células B grandes | 5 | 5,0% |
| Estágio | ||
| II | 1 | 1,0% |
| III | 96 | 96,0% |
| IV | 3 | 3,0% |
| Procedimento diagnóstico | ||
| Cirúrgico | ||
| Biópsia por laparotomia | 53 | 46,9% |
| Biópsia por laparoscopia | 4 | 3,5% |
| Não cirúrgico | ||
| Biópsia guiada por ultrassom | 29 | 25,6% |
| Paracentese | 20 | 17,7% |
| Biópsia endoscópica | 3 | 2,65% |
| Biópsia guiada por TC | 2 | 1,7% |
| Biópsia não guiada por ultrassom | 2 | 1,7% |
Cm, centímetros; TC, tomografia computadorizada.
Entre os pacientes, 12 foram submetidos a dois procedimentos de diagnóstico e um deles foi submetido a três procedimentos de diagnóstico. Os métodos de diagnóstico mais amplamente usados foram laparotomia, biópsia guiada por ultrassom e paracentesis (tabela 1). Cirurgias de urgência foram feitas em 21 casos (36,8%), ao passo que 36 pacientes foram submetidos a cirurgia eletiva (63,1). Intussuscepção foi a principal indicação e achado cirúrgico (50%) em cirurgias de urgência. Entre esses pacientes, três já haviam sido submetidos a perfuração intestinal. Tumor perfurado foi o segundo achado isolado mais frequente (31,8%); 18 pacientes (85,7%) foram submetidos a enterectomia que envolveu o tumor e 12 deles com anastomose primária. Dois pacientes com intussuscepção foram submetidos a redução e biópsia incisional das lesões.
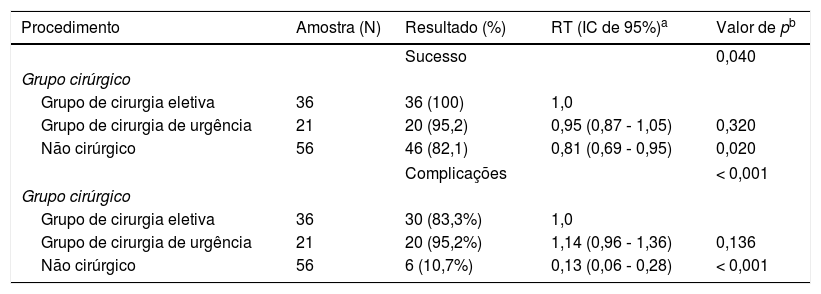
A taxa de sucesso do diagnóstico para laparotomia foi 98,1%, ao passo que biópsia ficou em 82,8%. Ao comparar os métodos usados (cirurgia de urgência, eletiva e não cirurgia), encontramos uma diferença significativa em favor da biópsia cirúrgica para confirmação do diagnóstico (p < 0,05; tabela 2).
Sucesso no diagnóstico e taxas de complicações nos procedimentos de diagnóstico em pacientes com linfoma não Hodgkin abdominal
| Procedimento | Amostra (N) | Resultado (%) | RT (IC de 95%)a | Valor de pb |
|---|---|---|---|---|
| Sucesso | 0,040 | |||
| Grupo cirúrgico | ||||
| Grupo de cirurgia eletiva | 36 | 36 (100) | 1,0 | |
| Grupo de cirurgia de urgência | 21 | 20 (95,2) | 0,95 (0,87 ‐ 1,05) | 0,320 |
| Não cirúrgico | 56 | 46 (82,1) | 0,81 (0,69 ‐ 0,95) | 0,020 |
| Complicações | < 0,001 | |||
| Grupo cirúrgico | ||||
| Grupo de cirurgia eletiva | 36 | 30 (83,3%) | 1,0 | |
| Grupo de cirurgia de urgência | 21 | 20 (95,2%) | 1,14 (0,96 ‐ 1,36) | 0,136 |
| Não cirúrgico | 56 | 6 (10,7%) | 0,13 (0,06 ‐ 0,28) | < 0,001 |
Entre os pacientes sujeitos a biópsia (n = 32), foram feitos 33 procedimentos. O número de fragmentos obtidos variou de um a sete, com média de 2,87 (± 1,49). Os dados foram divididos em quatro classes de acordo com o número de fragmentos extraídos (1, 2, 3, ≥ 4), respectivamente em quatro, 13, sete e nove procedimentos. Um aumento progressivo na taxa de sucesso do método foi atingido conforme mais fragmentos eram extraídos (75%, 76,9%, 85,7% e 100%). Avaliamos a associação entre a taxa de sucesso do diagnóstico e o número de fragmentos extraídos em paciente submetidos a biópsia e encontramos uma tendência linear significativa (p = 0,04).
Não foi possível confirmação do diagnóstico na biópsia em 11 (9,7%) dos procedimentos, que envolveram 10 pacientes. Eles foram paracentese (n = 5), biópsia guiada por ultrassom (n = 5) e laparotomia (n = 1), inclusive um processo não específico de reação histiocítica, dois casos em que o fluido da paracentese não pôde ser recuperado e oito resultados inconclusivos pela patologista/citologia. O método de diagnóstico usado após a primeira falha foi laparotomia em sete casos, paracentese em um caso e biópsia por ultrassom em dois casos. Um paciente foi submetido a laparoscopia após dois procedimentos inconclusivos de biópsias guiadas por ultrassom.
Entre as biópsias guiadas por ultrassom, quatro foram analisadas por imuno‐histoquímica. Elas foram consideradas insuficientes para fins de diagnóstico, pois continham alterações celulares inflamatórias ou degenerativas associadas a padrões imuno‐histoquímicos nucleares. Citometria de fluxo e análise imunofenotípica não foram possíveis em três amostras. O tecido extraído por laparotomia não foi submetido a análise imuno‐histoquímica.
Algum tipo de complicação foi relatado em 56 procedimentos. Uma diferença significativa foi observada entre os grupos de cirurgia urgente, eletiva e procedimentos não cirúrgicos (p < 0,01, tabela 2). A complicação mais frequentemente relatada foi dor (49 pacientes, 43,3%). Seis pacientes desenvolveram obstrução parcial e dois deles precisam ser submetidos a cirurgia. Três pacientes apresentaram complicações relacionadas a deiscência intestinal (dois deles foram tratados com ostomia e o terceiro com fístula enterocutânea). Duas laparoscopias foram convertidas em laparotomias, uma devido a problemas técnicos e outra devido ao fato de o paciente ter apresentado parada cardiorrespiratória. O número e a gravidade das complicações associadas ao procedimento foram maiores entre os procedimentos cirúrgicos (eletivos e de urgência). As complicações de níveis II, III e IV não foram associadas a procedimentos não cirúrgicos. A análise por meio do teste de Marascuilo da gravidade das complicações não diferiu entre os dois grupos de cirúrgica nos níveis I, II e III. Porém, houve diferença significativa entre eles e o grupo não cirúrgico nesses níveis (p < 0,001) para o nível I e II e para o nível III (p = 0,006). Devido ao pequeno número de complicações do nível IV (n = 3), não conseguimos demonstrar diferença estatística entre os grupos. Não foi descrito nível V (tabela 3).
Complicações devido a procedimentos de diagnóstico em pacientes com linfoma não Hodgkin abdominal
| Nível de complicaçãoa | Procedimentos de cirurgia eletiva (n = 36) | Procedimentos de cirurgia de urgência (n = 21) | Procedimentos não cirúrgicos (n = 56) | Total |
|---|---|---|---|---|
| Nível Ib | 27 (75,0%)f1 | 20 (95,2%)g1 | 6 (10,7%)h1 | 53 (46,9%) |
| Nível IIc | 15 (41,6%)f2 | 9 (42,8%)g2 | 0h2 | 24 (21,2%) |
| Nível IIId | 8 (22,2%)f3 | 6 (28,5%)g3 | 0h3 | 14 (12,3%) |
| Nível IVe | 1 (2,7%) | 2 (9,5%) | 0 | 3 (2,6%) |
Teste qui‐quadrado: p < 0,001; Teste de Marascuilo para f1xg1: p = 0,060; f1xh1: p < 0,001; g1xh1: p < 0,001.
Teste de Fisher: p < 0,001; Teste de Marascuilo para f2xg2: p = 0,985; f2xh2: p < 0,001; g2xh2: p < 0,001.
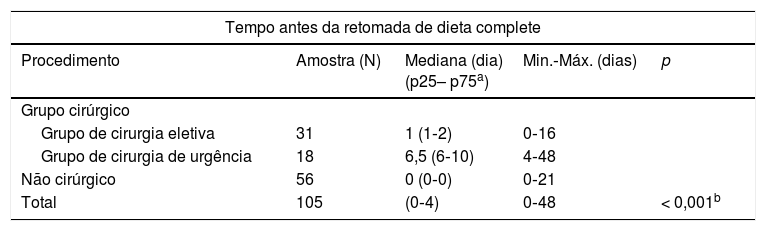
Em 105 procedimentos, não foi possível determinar o intervalo entre o procedimento e a retomada de uma dieta completa (0‐48 dias). Observamos uma associação significativa entre o procedimento de diagnóstico e o tempo necessário para retomada de uma dieta completa (p < 0,001). As comparações entre os grupos revelaram que o tempo necessário para retomar uma dieta completa foi, em geral, menor em pacientes submetidos a um procedimento não cirúrgico, em comparação com o grupo de cirurgia eletiva (p < 0,001), bem como ao grupo de cirurgia urgente (p < 0,001). Além disso, os pacientes submetidos a cirurgia eletiva apresentaram tempo significativamente menor necessário para retomar uma dieta completa, em comparação com pacientes submetidos a cirurgia urgente (p < 0,005) (tabela 4).
Tempo antes da retomada de uma dieta completa e início da quimioterapia
| Tempo antes da retomada de dieta complete | ||||
|---|---|---|---|---|
| Procedimento | Amostra (N) | Mediana (dia) (p25– p75a) | Min.‐Máx. (dias) | p |
| Grupo cirúrgico | ||||
| Grupo de cirurgia eletiva | 31 | 1 (1‐2) | 0‐16 | |
| Grupo de cirurgia de urgência | 18 | 6,5 (6‐10) | 4‐48 | |
| Não cirúrgico | 56 | 0 (0‐0) | 0‐21 | |
| Total | 105 | (0‐4) | 0‐48 | < 0,001b |
| Tempo antes do início da quimioterapia | ||||
|---|---|---|---|---|
| Grupo cirúrgico | ||||
| Grupo de cirurgia eletiva | 35 | 5 (3‐6) | 1‐26 | |
| Grupo de cirurgia de urgência | 20 | 8 (7‐12) | 5‐24 | |
| Não cirúrgico | 43 | 2 (0‐5) | 0‐18 | |
| Total | 98 | 5 (1‐7) | 0‐26 | < 0,001c |
O intervalo de tempo entre a confirmação do diagnóstico e o início de quimioterapia foi registrado para 98 pacientes, variou de zero a 26 dias. Observamos uma associação significativa entre o procedimento de diagnóstico e o início de quimioterapia (p < 0,001). O teste de Kruskal‐Wallis com pós‐teste de Bonferroni mostrou que o tempo necessário para início da quimioterapia foi, em geral, menor para pacientes submetidos a procedimentos não cirúrgicos, em comparação com o grupo de cirurgia eletiva (p < 0,005), bem como ao grupo de cirurgia de urgência (p < 0,001). A mesma conclusão é aplicada a pacientes do grupo de cirurgia eletiva em comparação com o grupo de cirurgia de urgência (p < 0,001) (tabela 4).
DiscussãoHá estudos semelhantes a este; contudo, nenhum deles exclusivamente com pacientes com menos de 18 anos em um único centro,4–7,12,13 com uma amostra tão grande.3,14,15 Além disso, tivemos acesso, também, a alguns aspectos nem sempre enfatizados por outros estudos, como a estratificação de complicações, complicações de menor nível e tempo antes do início da quimioterapia em associação com o método de diagnóstico.
No presente estudo, apenas um paciente apresentou doença localizada (estágio II) e mais de 40% dos pacientes apresentaram lesões com mais de 10cm. O tamanho da massa abdominal foi anteriormente correlacionado a um mau prognóstico, bem como o número de locais extranodais.16 Observamos que, além do envolvimento do intestino delgado, frequentemente outros locais extranodais no abdômen e fora do abdômen foram simultaneamente envolvidos. Esse envolvimento extranodal é típico de linfoma pediátrico em comparação com o de adultos, que basicamente envolve estruturas nodais.14,17,18
Anteriormente, sugeriu‐se que a ressecção do tumor primário aumentaria a expectativa de vida entre crianças com LNH, principalmente no caso de LB.19 Atualmente, há um entendimento comum de que o LNH é uma doença sistêmica; portanto, cirurgias amplas não são mais recomendadas devido a complicações e atraso no início da quimioterapia.14,20
O principal achado intracirúrgico em nossos procedimentos de urgência foi intussuscepção, similarmente ao descrito por Vural et al.14 (30,4%) e por Attarbaschi et al.20 (47%). Outras complicações comumente mencionadas por outros autores incluem obstrução, perfuração e hemorragia.14,20 Devido à indicação de urgência para abdômen agudo, que representa uma situação médica mais complexa, constatamos nesse grupo a maior taxa de complicações associadas ao método de diagnóstico, bem como atraso no início da quimioterapia.
A biópsia aberta é geralmente necessária para o diagnóstico bem‐sucedido de LNH e outras técnicas podem ser usadas quando a condição do paciente não é indicativa de procedimento cirúrgico. Contudo, o procedimento mais rápido e menos invasivo deve ser usado no diagnóstico da condição de LNH como tumores mortais e de rápido crescimento, apesar de vários estudos terem mostrado o uso bem‐sucedido da biópsia no diagnóstico de linfomas.4,6,8,14
Em nosso estudo, as amostras de tumores dos grupos cirúrgicos foram melhores no fornecimento de material patológico suficiente para o diagnóstico de LNH pediátrico em comparação com técnicas não cirúrgicas. A laparotomia foi a opção preferencial quando o primeiro procedimento não invasivo mostrou falha. Contudo, eles também levaram em consideração o maior número e as complicações mais graves decorrentes dos procedimentos de diagnóstico. Nenhum óbito esteve diretamente associado aos procedimentos, não obstante o fato de que a cirurgia levou a um aumento na morbidez e atraso na retomada da dieta e início da quimioterapia. Vários casos descreveram um aumento nas complicações14 e insuficiência renal associada a mortalidade3,21 e atrasos no início da quimioterapia.14
A laparoscopia mostrou uma boa taxa de sucesso no diagnóstico, porém todos os pacientes apresentaram complicações, inclusive um paciente com sequela neurológica grave. As complicações em nossa amostra foram mais frequentes e mais graves do que as descritas em outros estudos.12 Lamentamos a falta de estudos sobre LNH pediátrico e laparoscopia, que contribuiriam para um melhor entendimento do papel desses procedimentos nessa população específica. Contudo, pode‐se pressupor que, devido ao fato de nossos pacientes estarem em um estágio avançado da doença, a formação de pneumoperitônio contribuiria para um resultado desfavorável; porém apenas investigações adicionais conseguirão esclarecer esse problema.
A biópsia, independentemente de guiada por ultrassom, apresentou uma boa taxa de sucesso no diagnóstico e baixas taxas de complicações com relação aos outros métodos. Além disso, as complicações foram tratadas clinicamente. Nossos achados são semelhantes aos descritos em outros estudos,4,5,8 que podem, até, não causar complicações14 e levar a uma taxa de sucesso no diagnóstico de até 97%.6 Sobre esse assunto, há também falta de literatura a respeito exclusivamente de pacientes pediátricos.
Nossa análise mostrou ainda que não houve melhoria no diagnóstico na extração de mais de quatro fragmentos. Os estudos geralmente mencionam a remoção de um a cinco fragmentos.4,5,8 Kerviler et al. recomendam, para um paciente com suspeita de linfoma, que sejam feitas três biópsias e que o material seja mantido em formol e duas biópsias adicionais imediatamente congeladas em nitrogênio líquido para extração de DNA e RNA. Adicionalmente, para linfomas agressivos ou linfoma de Burkitt, é possível fazer decalques de um núcleo para rápido diagnóstico citológico.8
Alguns aspectos favoráveis estão associados a biópsia, inclusive redução da morbidez, menor tempo de narcose,7,15 menor tempo de internação e início antecipado das terapias.4 Essa é uma técnica menos invasiva com melhores resultados que surgem de melhorias técnicas e os especialistas envolvidos, bem como boa quantidade de material patológico necessário para as análises morfológica e imuno‐histoquímica.4,5,14 Contudo, poucos aspectos precisam ser mais bem esclarecidos, como calibre da agulha6,8 e o uso conjunto de punção aspirativa com agulha fina (PAAF).13,22,23
Entre os métodos com imagem, o ultrassom é o método mais amplamente usado devido à sua qualidade dinâmica, que ajuda a evitar áreas de necrose durante a punção.4,6,8 As biópsias guiadas por tomografia computadorizada também podem ser feitas e podem ajudar nos casos em que os tumores são difíceis de ser encontrados por ultrassom,5 porém suas desvantagens são maior custo e exposição a radiação ionizante.24
A obtenção de materiais por meio de paracentese produziu resultados positivos e apenas uma complicação associada (5%) com relação à queixa de dor do paciente. De acordo com Mann et al.,15 o diagnóstico por meio de citologia (inclusive análise de líquido ascítico, pleural e punção aspirativa por agulha fina [PAAF]) pode ser feito na maior parte dos casos. Contudo, o procedimento exige um citopatologista experiente para interpretação citológica e estudo de imunofenótipos. Duas amostras de fluido de paracentese não puderam ser recuperadas, resultaram em falha do método. Esse evento adverso pode ser reduzido com o uso de métodos de imagem para guiar o procedimento de punção.25
A complicação mais frequente no estudo dos dados apresentados aqui foi dor. Dor pós‐operatória, apesar de não geralmente descrita como uma complicação em estudos de procedimentos de diagnóstico em LNH, ainda é uma das principais complicações. Ela tem sido associada a desconforto considerável e sofrimento, principalmente entre crianças, e contribui para um aumento da morbidez pós‐operatória, bem como baixa aceitação da dieta, distúrbios do sono, alterações comportamentais e vômito.26,27
Os LNHs pediátricos geralmente são tumores agressivos com altas taxas de proliferação celular. Portanto, a quantidade ideal e a qualidade dos materiais patológicos é essencial para garantir que todos os testes necessários sejam feitos imediatamente de forma a possibilitar um diagnóstico oportuno. Tradicionalmente, a biópsia excisional ou incisional tem sido considerada a técnica padrão de referência,22 contudo há um aumento reconhecido nas complicações e nos custos do processo, bem como maior potencial de atraso no tratamento.3,6,14 Indubitavelmente, em casos urgentes complexos, como intussuscepções ou perfuração, a cirurgia é imperativa não somente para diagnóstico, mas também terapia. Assim, os procedimentos não cirúrgicos são uma opção eficaz que possibilita rápido diagnóstico, mesmo com pouca quantidade de material, e o ajuda em estudos auxiliares (inclusive citofluorometria e técnicas moleculares), apresenta baixa morbidez no diagnóstico de LNH pediátrico com envolvimento abdominal, que possibilita retomada antecipada da dieta e início de quimioterapia.
Contudo, ainda são necessários estudos mais abrangentes que envolvam crianças e adolescentes para corroborar nossos achados, para que possamos recomendar o uso de procedimentos menos invasivos como a primeira linha de consulta no diagnóstico de LNH abdominal, bem como esclarecer alguns aspectos que nosso estudo não conseguiu responder devido às limitações de modelo e ao tamanho da amostra.
Conflitos de interesseOs autores declaram não haver conflitos de interesse.
Ao Professor José Natal Figueiroa e a Severino Ibánhez por suas contribuições sobre os estágios iniciais do manuscrito.
Como citar este artigo: Aguiar AA, Lima LC, Araújo CC, Gallindo RM. Pediatric abdominal non‐Hodgkin's lymphoma: diagnosis through surgical and non‐surgical procedures. J Pediatr (Rio J). 2019;95:54–60.