This study aims to describe real world palivizumab use and effectiveness in high‐risk Latin American infants and young children.
MethodProspective, multicenter observational study with infants at risk for severe RSV infection who received palivizumab according to routine clinical practice. Subjects were followed for one year with monthly visits after the first dose of palivizumab. An infant was considered adherent if receiving all the expected injections or five or fewer injections within appropriate inter‐dose intervals. Annual incidence rates and risk factors of lower respiratory tract infection (LRTI) hospitalization were determined through Poisson regression models (α=0.05).
ResultsThe study enrolled 458 children from seven countries in Latin America, from February 2011 to September 2012. The majority (98%) were born <36 weeks gestation. Overall, patients received 83.7% of their expected injections and 86.7% completed one year of follow‐up. Of the 61 LRTI hospitalizations, 12 episodes were due to RSV infection. The RSV‐associated hospitalization rate was 2.9 per 100 patient‐years. Bronchopulmonary dysplasia was identified as an independent risk factor for LRTI hospitalization. A total of 1165 adverse events were recorded during one year of follow‐up. One hundred and two patients (22.3%) had a total of 135 serious adverse events, but no events were considered to be related to palivizumab.
ConclusionsThe rate of RSV hospitalization in high‐risk infants in Latin America was low and aligned with those observed in randomized control trials and observational studies. Palivizumab prophylaxis appeared effective and had a good safety profile in this population.
Descrever o uso e a eficácia do palivizumabe no mundo real em neonatos e jovens crianças de alto risco latino‐americanas.
MétodoEstudo observacional prospectivo multicêntrico com neonatos em risco devido a infecção grave por VSR que receberam palivizumabe de acordo com a prática clínica de rotina. Os indivíduos foram acompanhados por um ano, com visitas mensais após a primeira dose de palivizumabe. Um neonato foi considerado adepto se recebeu todas as injeções esperadas ou ≤ 5 injeções nos intervalos entre doses adequados. As taxas de incidência anuais e os fatores de risco de internação por infecção do trato respiratório inferior (ITRI) foram determinados por meio dos modelos de regressão de Poisson (α=0,05).
ResultadosO estudo inscreveu 458 crianças de sete países da América Latina, de fevereiro de 2011 a setembro de 2012. A maioria (98%) nasceu com < 36 semanas. Em geral, os pacientes receberam 83,7% de suas injeções esperadas e 86,7% completaram um ano de acompanhamento. Das 61 internações por ITRI, 12 episódios foram devidos a infecção por VSR. A taxa de internação associada ao VSR foi de 2,9 em cada 100 pacientes‐ano. A displasia broncopulmonar foi identificada como um fator de risco independente da internação por ITRI. Foram registrados 1.165 eventos adversos durante um ano de acompanhamento; 122 (22,3%) apresentaram 135 eventos adversos graves, porém nenhum deles foi considerado relacionado ao palivizumabe.
ConclusõesA taxa de internação por VSR em neonatos de alto risco na América Latina foi baixa e em linha com as observadas em ensaios clínicos controlados randomizados e estudos observacionais. A profilaxia com palivizumabe pareceu eficaz e com bom perfil de segurança nessa população.
As infecções do trato respiratório inferior (ITRI) são a principal causa de doenças agudas e mortalidade em neonatos e crianças<5 anos, representam aproximadamente 1,4 milhão de óbitos em todo o mundo em 2010.1 O vírus sincicial respiratório (VSR) é a etiologia mais frequente de doenças respiratórias graves, como a bronquiolite e/ou pneumonia.2,3 Uma metanálise estimou que pelo menos 33,8 milhões de episódios de ITRI e 66.000 a 199.000 óbitos em crianças<5 anos foram causados por uma infecção por VSR em 2005.2 Praticamente 99% dos óbitos por VSR ocorreram em países em desenvolvimento, nos quais a incidência de ITRI associada ao VSR parece ser mais do que o dobro daquela observada em países industrializados.2
Na América Latina, uma metanálise recente estimou prevalência de 41,5% (IC de 95%, 32,0‐41,4) de VSR em neonatos de 0‐11 meses com ITRI e estimou que o VSR foi responsável por 36,5% (IC de 95%, 28,5‐44,9) das internações em hospitais devido a ITRI entre neonatos de 0 a 11 meses.4 Ademais, uma possível coorte epidemiológica de pacientes com<18 anos internados devido a ITRIs de 2000 a 2013 em Buenos Aires registrou uma taxa de fatalidade associada ao VSR de 1,9% (74 óbitos/3.888 casos).5 Apesar de essas estimativas indicarem uma urgência das intervenções relacionadas à saúde, são necessários mais estudos para quantificar a carga de doença devido ao VSR e os fatores de risco associados às internações por ITRI em países da América Latina.2,4
Vários fatores sociais e relacionados ao paciente foram associados ao aumento do risco de infecção por VSR, a saber, idade<6 meses no início da estação de incidência do VSR, sexo masculino, nascimento múltiplo, aglomeração em casa, baixa situação socioeconômica e escolaridade dos pais, frequência em creche, exposição à fumaça de cigarro em ambientes fechados e amamentação reduzida.6,7 Além disso, alguns quadros clínicos estão associados a doenças graves e à internação por VSR, inclusive prematuridade (neonatos nascidos com ≤ 35 semanas de idade gestacional), displasia broncopulmonar (DBP) e cardiopatia congênita hemodinamicamente significativa (CCHS).3,8–10 Contudo, a importância relativa desses fatores de risco poderá ser diferente na América Latina.
O palivizumabe (Synagis®; AbbVie Inc, IL, EUA) é um anticorpo monoclonal humanizado aprovado para a prevenção de doenças graves por VSR em bebês prematuros e jovens crianças com DBP ou CCHS.11 Sua segurança e eficácia foram avaliadas em estudos controlados randomizados, testes abertos não comparativos e diversos estudos observacionais.12 Taxas mais baixas de internações por VSR e complicações clínicas foram relatadas em crianças que receberam a profilaxia com palivizumabe.8,12,13 Entretanto, existe uma escassez de dados sobre o uso e a eficácia do palivizumabe em países em desenvolvimento, nos quais as taxas de infecção por VSR são mais elevadas, especificamente em países da América Latina.12,14–17
Este estudo visa a descrever o uso do palivizumabe em neonatos de alto risco e estimar a frequência de internação por VSR entre neonatos e jovens crianças tratadas com palivizumabe em países da América Latina no período de um ano de acompanhamento após a primeira dose.
MétodosModelo do estudoEste foi um estudo multicêntrico prospectivo e observacional em uma coorte de neonatos em risco devido a infecção grave por VSR que receberam palivizumabe durante a circulação local de VSR e nos termos da autorização de venda a respeito de dosagem, população e indicação. O estudo foi feito em 24 locais de sete países da América Latina (Argentina, Chile, Colômbia, Equador, México, Peru e Uruguai). O recrutamento de indivíduos começou em 19 de fevereiro de 2011 e foi concluído em 6 de setembro de 2012; cada indivíduo foi monitorado por 12 meses, com visitas mensais no período de administração de palivizumabe e, depois, com ligações mensais.
Critérios de elegibilidadeEm cada local do estudo, bebês prematuros (nascidos com ≤ 35 semanas de idade gestacional) ou jovens crianças com histórico de DBP ou CCHS que receberam a primeira dose de palivizumabe nas semanas anteriores à avaliação dos critérios de inclusão eram elegíveis para participar. Crianças excluídas da administração de palivizumabe segundo a prática local não participaram. Os pais ou responsáveis legais dos neonatos e jovens crianças incluídos forneceram um consentimento informado por escrito.
Acompanhamento e coleta de dadosOs indivíduos inscritos foram acompanhados por um ano após sua primeira dose de palivizumabe. Dados epidemiológicos e clínicos, informações sobre a adesão de pacientes, internações e dados de segurança foram coletados mensalmente de acordo com a prática clínica de rotina, por meio de avaliações no consultório durante os quatro primeiros meses. Após os quatro primeiros meses, ocorreram visitas de monitoramento de seis e 12 meses e ligações de acompanhamento nos meses 5, 7, 8, 9, 10 e 11 após a inclusão do indivíduo no estudo.
O histórico de saúde de cada paciente e a exposição a fatores de risco ambiental foram coletados e foi feito um exame físico em cada visita ao consultório para o estudo. Eventos adversos e internações ocorridas desde a visita anterior também foram registrados. A ITRI foi definida como pneumonia, bronquiolite ou pieira de acordo com o diagnóstico clínico. Foram coletadas amostras nasais e faringianas para o teste de VSR apenas quando recomendado pelas diretrizes clínicas locais e/ou mediante decisão do médico.
As crianças podiam receber até cinco doses de palivizumabe, de acordo com a prescrição do médico. A adesão dos pacientes ao tratamento foi calculada como o número de doses de palivizumabe recebidas em comparação com o número esperado de doses. O número esperado de doses para cada paciente foi estimado com base na sazonalidade e nas diretrizes atuais de cada país. Foi feita uma análise do intervalo entre doses (nos casos em que a data de cada dose estava disponível) e os intervalos de 30 (± 5) dias foram considerados em conformidade.
Análise de segurançaOs eventos adversos foram classificados com base na classificação do sistema da versão 16.0 do Dicionário Médico para Atividades Regulatórias. Eventos adversos graves foram definidos como qualquer evento adverso que tenha resultado em óbito, situação de risco de vida, internação do paciente, deficiência ou incapacidade persistente ou significativa ou em outros eventos clinicamente relevantes.
Análise estatísticaFoi estimado um tamanho mínimo de amostra de 400 pacientes com base no possível número de pacientes que recebiam palivizumabe em cada país para permitir a estimativa da proporção de ITRIs com intervalo de confiança (IC) de 95%, com precisão estimada de 3%. Toda a análise de dados foi feita com o Stata (StataCorp. 2007. Stata Software estatístico: versão 10. TX, EUA). As frequências e percentuais de variáveis categóricas e as medidas da posição central e da dispersão de variáveis quantitativas foram usadas para descrever as características dos indivíduos da amostra, o uso de palivizumabe e os eventos adversos mais comuns. Foi estimado um IC de 95% para as proporções ou taxas de incidência dos resultados relevantes. Foram usados modelos lineares generalizados para estimar as taxas anuais de internação por ITRI. Os modelos de regressão de Poisson foram aplicados para identificar os fatores de risco das internações por ITRI e as características básicas como idade, sexo, peso ao nascer e comorbidades foram incluídas como covariáveis.
Este estudo foi feito de acordo com a Declaração de Helsinque. O protocolo foi aprovado por comitês éticos institucionais independentes antes do início e segundo a legislação nacional. Foi obtido o consentimento informado por escrito de no mínimo um pai ou responsável legal de todos os pacientes.
ResultadosCaracterísticas da amostraForam inscritos 464 neonatos e jovens crianças de 24 locais de sete países da América Latina, dos quais seis foram excluídas devido à ausência de visitas de acompanhamento adicionais (n=4), consentimento informado inválido (n=1) e administração de palivizumabe na estação anterior (n=1). Assim, 458 neonatos e jovens crianças foram incluídos e 397 (86,7%) completaram um ano de acompanhamento. Entre os 61 neonatos e jovens crianças que não concluíram o acompanhamento, 43 (70,5%) deixaram de ser acompanhados, seis (9,8%) retiraram o consentimento do estudo, três (4,9%) faleceram por motivos não relacionados a doenças respiratórias e nove (29,4%) não concluíram o estudo por outros motivos.
Os dados demográficos dos neonatos e das jovens crianças incluídos são apresentados na tabela 1; 52% dos pacientes eram do sexo masculino. O peso médio ao nascer era de 1.345g (desvio padrão [DP] 460) e a idade gestacional mediana era de 31 semanas (variação de 23‐39 semanas). Quase todos os pacientes do estudo (98,2%) foram prematuros; 29,2% dos pacientes apresentavam DBP e 10,1%, CCHS. Além disso, a prematuridade com DBP e/ou CCHS foi observada em 33,4% dos pacientes.
Características demográficas, clínicas e de tratamento da população estudada (n=458)
| País de inscrição, n (%) | |
| Argentina | 149 (32,5%) |
| Colômbia | 147 (32,1%) |
| México | 100 (21,8%) |
| Chile | 32 (7,0%) |
| Peru | 13 (2,8%) |
| Uruguai | 10 (2,2%) |
| Equador | 7 (1,5%) |
| Masculino, n (%) | 239 (52,2%) |
| Idade (dias) na primeira dose, mediana (IIQ) | 55 (31‐99) |
| Peso ao nascer (g), média±DPb | 1344,6±460,5 |
| Idade gestacional (semanas), mediana (IIQ) | 31 (28‐32) |
| Idade gestacional (semanas), n (%) | |
| < 32 semanas | 287 (62,7%) |
| < 29 semanas | 118 (25,8%) |
| 29‐32 semanas | 169 (36,9%) |
| 32‐35 semanas | 163 (35,6%) |
| > 35 semanas | 8 (1,7%) |
| Prematuridade, n (%) | 449 (98,0%) |
| Somente prematuridade | 296 (64,6%) |
| Prematuridade+DBP | 112 (24,5%) |
| Prematuridade+CC | 24 (5,2%) |
| Prematuridade+DBP+CC | 17 (3,7%) |
| Prematuridade+DBP e/ou CC | 153 (33,4%) |
| DBP, n (%) | 134 (29,2%) |
| CC, n (%) | 46 (10,0%) |
| Mãe com primeiro grau completo, n (%) | 443 (96,7%) |
| Tabagismo durante a gravidez, n (%) | 9 (19,7%) |
| Mãe asmática/atópica, n (%) | 55 (12,0%) |
| Nascimento múltiplo, n (%) | 141 (30,8%) |
| Amamentação aos 3 meses de idade,an (%) | 222 (49,4%) |
| Outras crianças na casa ≤ 6 anos, n (5) | 160 (34,9%) |
| Exposição à fumaça de cigarro em casa, n (%) | 78 (17,0%) |
| Frequência em creche, n (%) | 5 (1,1%) |
| Assistência médica pré‐natal,bn (%) | 386 (84,2%) |
| Internação na unidade de terapia intensiva neonatal, n (%) | 447 (97,5%) |
| Ventilação mecânica neonatal, n (%) | 257 (56,1%) |
| Adesão ao tratamento com palivizumabe, n (%) | 383 (83,7%) |
| Doses administradas por paciente, n (%) | |
| 5 doses | 200 (43,7%) |
| 4 doses | 66 (14,4%) |
| 3 doses | 130 (28,4%) |
| 2 doses | 28 (6,1%) |
| 1 dose | 34 (7,4%) |
| Pacientes recebendo as doses esperadas, n (%) | |
| Acima do esperado | 29 (6,3%) |
| Como esperado | 240 (52,4%) |
| Abaixo do esperado | 189 (41,2%) |
| Fornecedor do palivizumabe (n=1.707 doses) | |
| Plano de saúde privado | 814 (47,7%) |
| Sistema público de saúde | 669 (39,2%) |
| Previdência social/Sociedade de Apoio Mútuo | 207 (12,1%) |
| Desembolsado pelo paciente | 17 (1,0%) |
CC: cardiopatia congênita; DBP, displasia broncopulmonar; DP: desvio padrão; IIQ: intervalo interquartil.
O motivo mais frequente da indicação de palivizumabe foi a prematuridade (por si mesma ou em conjunto com outras indicações) (98,0%). O número total de doses administradas foi de 1.744 em 458 pacientes, corresponde a 3,8±1,3 doses por paciente em média. De maneira geral, os pacientes receberam 83,7% (IC de 95%, 80,8‐86,5) de suas doses esperadas, com base na sazonalidade e nas atuais diretrizes de cada país, e 78,4% dos 1.249 intervalos entre doses foram classificados como aderentes (tabela 1). O tempo médio entre o início da profilaxia com palivizumabe e o desenvolvimento de ITRI devido ao VSR foi de 75,7 dias, com mediana de 44 dias.
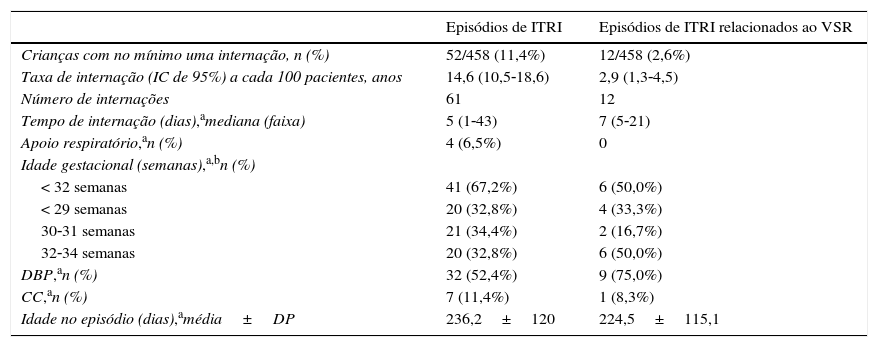
Internações devido à ITRIOcorreram 61 episódios de ITRI que exigiram internação em 52 crianças (tabela 2). A taxa de internação devida a ITRI foi de 14,6 em cada 100 pacientes‐anos (IC de 95%, 10,5‐18,6). A infecção por VSR foi confirmada em 12 episódios em 12 neonatos e a taxa de internação associada ao VSR foi de 2,9 em cada 100 pacientes‐ano (IC de 95%, 1,3‐4,5). Nenhuma das internações por VSR exigiu apoio respiratório. Dos 12 casos de internação associada ao VSR, todos eram bebês prematuros e dez apresentaram outro fator de risco: nove eram pacientes com DBP e um apresentava CCHS.
Caracterização dos episódios de internação devido a ITRI
| Episódios de ITRI | Episódios de ITRI relacionados ao VSR | |
|---|---|---|
| Crianças com no mínimo uma internação, n (%) | 52/458 (11,4%) | 12/458 (2,6%) |
| Taxa de internação (IC de 95%) a cada 100 pacientes, anos | 14,6 (10,5‐18,6) | 2,9 (1,3‐4,5) |
| Número de internações | 61 | 12 |
| Tempo de internação (dias),amediana (faixa) | 5 (1‐43) | 7 (5‐21) |
| Apoio respiratório,an (%) | 4 (6,5%) | 0 |
| Idade gestacional (semanas),a,bn (%) | ||
| < 32 semanas | 41 (67,2%) | 6 (50,0%) |
| < 29 semanas | 20 (32,8%) | 4 (33,3%) |
| 30‐31 semanas | 21 (34,4%) | 2 (16,7%) |
| 32‐34 semanas | 20 (32,8%) | 6 (50,0%) |
| DBP,an (%) | 32 (52,4%) | 9 (75,0%) |
| CC,an (%) | 7 (11,4%) | 1 (8,3%) |
| Idade no episódio (dias),amédia±DP | 236,2±120 | 224,5±115,1 |
CC: cardiopatia congênita; DBP: displasia broncopulmonar; DP: desvio padrão; IC: intervalo de confiança; ITRI: infecção do trato respiratório inferior; VSR: vírus sincicial respiratório.
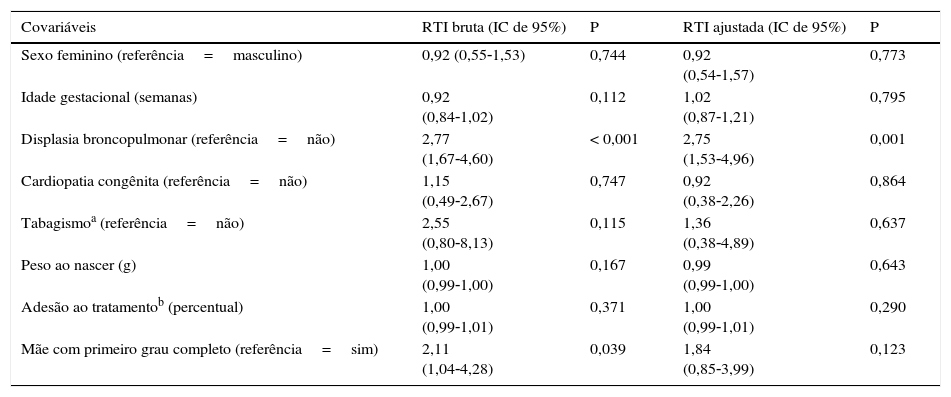
Foram feitas análises univariadas e multivariadas para identificar os fatores de risco da internação por LRTI (tabela 3). Na análise univariada, um nível mais baixo de escolaridade materna e a DBP provaram aumentar o risco de internação por ITRI em uma população que recebeu a profilaxia com palivizumabe. Na análise do modelo multivariado, apenas a DBP foi confirmada como fator de risco independente (razão de taxas de incidência (RTI) ajustada, 2,77).
Fatores de risco de internações por ITRI
| Covariáveis | RTI bruta (IC de 95%) | P | RTI ajustada (IC de 95%) | P |
|---|---|---|---|---|
| Sexo feminino (referência=masculino) | 0,92 (0,55‐1,53) | 0,744 | 0,92 (0,54‐1,57) | 0,773 |
| Idade gestacional (semanas) | 0,92 (0,84‐1,02) | 0,112 | 1,02 (0,87‐1,21) | 0,795 |
| Displasia broncopulmonar (referência=não) | 2,77 (1,67‐4,60) | < 0,001 | 2,75 (1,53‐4,96) | 0,001 |
| Cardiopatia congênita (referência=não) | 1,15 (0,49‐2,67) | 0,747 | 0,92 (0,38‐2,26) | 0,864 |
| Tabagismoa (referência=não) | 2,55 (0,80‐8,13) | 0,115 | 1,36 (0,38‐4,89) | 0,637 |
| Peso ao nascer (g) | 1,00 (0,99‐1,00) | 0,167 | 0,99 (0,99‐1,00) | 0,643 |
| Adesão ao tratamentob (percentual) | 1,00 (0,99‐1,01) | 0,371 | 1,00 (0,99‐1,01) | 0,290 |
| Mãe com primeiro grau completo (referência=sim) | 2,11 (1,04‐4,28) | 0,039 | 1,84 (0,85‐3,99) | 0,123 |
IC, intervalo de confiança; ITRI: infecção do trato respiratório inferior; RTI: razão de taxa de incidência.
O texto em negrito é considerado significativo; p<0,05.
Análises adicionais foram feitas no subgrupo de 134 pacientes com DBP; 28 pacientes com DBP apresentaram 32 episódios de internação relacionada a ITRI e nove episódios foram confirmados como relacionados à infecção por VSR. A taxa de internação devida a ITRI foi de 26,4 em cada 100 pacientes‐ano (IC de 95%, 17,1‐35,8) e a taxa de internação devida ao VSR foi de 7,4 em cada 100 pacientes‐ano (IC de 95%, 2,7‐12,1).
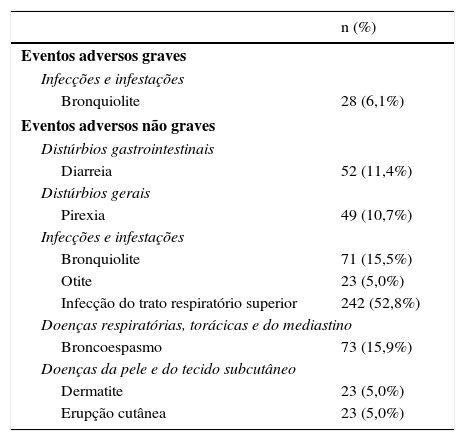
Eventos adversos durante o tratamento com palivizumabeForam registrados 1.165 eventos adversos durante um ano de acompanhamento; 102 pacientes (22,3%) apresentaram 135 eventos adversos graves. A tabela 4 apresenta os eventos adversos não graves (≥ 5% dos pacientes) relatados no estudo (n=299). Dos eventos adversos graves relatados, o mais comum (≥ 5% dos pacientes) foi a bronquiolite (n=28; 6,1%). Adicionalmente, 92 eventos adversos graves (68,1%) resultaram em ou prolongaram o tempo de internação, 29 (21,4%) foram classificados pelo investigador como clinicamente relevantes e 11 (8,1%) foram possivelmente fatais. Três óbitos (2,2%) foram registrados durante o acompanhamento e não foram considerados relacionados ao tratamento com palivizumabe ou à infecção por VSR. Foram relatados seis eventos de dor no local da injeção após a administração de palivizumabe em três pacientes. Não ocorreram eventos adversos graves considerados relacionados ao palivizumabe.
Eventos adversos graves e não graves mais comuns (≥ 5% dos indivíduos)a
| n (%) | |
|---|---|
| Eventos adversos graves | |
| Infecções e infestações | |
| Bronquiolite | 28 (6,1%) |
| Eventos adversos não graves | |
| Distúrbios gastrointestinais | |
| Diarreia | 52 (11,4%) |
| Distúrbios gerais | |
| Pirexia | 49 (10,7%) |
| Infecções e infestações | |
| Bronquiolite | 71 (15,5%) |
| Otite | 23 (5,0%) |
| Infecção do trato respiratório superior | 242 (52,8%) |
| Doenças respiratórias, torácicas e do mediastino | |
| Broncoespasmo | 73 (15,9%) |
| Doenças da pele e do tecido subcutâneo | |
| Dermatite | 23 (5,0%) |
| Erupção cutânea | 23 (5,0%) |
MedDRA, Dicionário Médico para Atividades Regulatórias.
O palivizumabe é aprovado para a profilaxia de doença grave por VSR, com eficácia comprovada na redução de internações de neonatos de alto risco.8,13 Contudo, uma profilaxia consistente pode ser desafiadora devido a diversos fatores médicos e socioeconômicos da criança.18,19 Este estudo apresentou uma descrição prospectiva do uso e da eficácia do palivizumabe nos países da América Latina.
A taxa de internações por VSR observada no estudo (2,9 em cada 100 pacientes‐ano) é baixa e está no intervalo relatado com relação ao palivizumabe em diferentes ensaios clínicos (0,0‐5,3%).8,13,20 Adicionalmente, os resultados deste estudo também são compatíveis com os de outros estudos observacionais (1,3‐2,9 episódios em cada 100 pacientes‐ano).12,21,22 Por outro lado, existem poucos dados sobre as taxas de internação por VSR em neonatos sem a profilaxia com palivizumabe na América Latina. Um estudo de um hospital público da Argentina mostrou que neonatos sem a profilaxia com palivizumabe apresentaram taxas de internação por VSR‐ITRI de 26% e 29% em duas coortes históricas.23
Foi mostrado que as taxas de internação por VSR em pacientes com profilaxia com palivizumabe podem chegar a 7,6% em algumas circunstâncias, principalmente em pacientes com DBP.13,18,23 De fato, neste estudo, uma taxa de internação por VSR de 7,4 em cada 100 pacientes‐ano foi observada em crianças com DBP, achado em linha com resultados relatados anteriormente.18 A mediana do tempo de internação devido a doenças causadas pelo VSR foi de sete dias, resultado semelhante àquele observado em estudos de outros países22,24 e a achados do estudo de Bauer et al. em um único centro na Argentina.23
A incidência e a gravidade da infecção por VSR em neonatos prematuros foram associadas a diversos fatores, como a presença de irmãos em casa e frequência em creche, entre outros.6,25 Um estudo de coorte prospectivo com 152 neonatos internados por ITRI mostrou que o baixo peso ao nascer, o baixo nível de escolaridade da mãe e as baixas condições socioeconômicas eram fatores de risco associados às internações por VSR em neonatos prematuros e nascidos a termo sem instabilidade hemodinâmica, doenças cardíacas ou doença pulmonar crônica no Brasil.26 Na Argentina, Bauer et al. também observaram que crianças com menos de 10 anos em casa e mães que não concluíram o ensino fundamental estavam associadas ao aumento do risco de internação por VSR entre neonatos prematuros com e sem DBP.27 Ademais, alguns estudos mostraram aumento no risco de ITRI devido à exposição à fumaça de cigarro em casa, embora seja necessária uma pesquisa adicional para determinar seu impacto sobre a gravidade da ITRI por VSR.6 No presente estudo, apenas a DBP foi identificada como fator de risco independente da internação por ITRI, ao passo que outros fatores não estavam associados ao aumento do risco.
No que diz respeito à segurança, nenhum evento adverso grave relacionado ao palivizumabe foi relatado em nosso estudo. O padrão e o tipo de eventos adversos foram compatíveis com o perfil de segurança conhecido do palivizumabe, que normalmente reflete os problemas médicos subjacentes desses pacientes.8,12,18,28 De maneira semelhante a outros estudos, as infecções respiratórias do trato superior foram os eventos adversos mais frequentes, com proporção comparável àquela relatada em um estudo brasileiro (59,4% em comparação com 52,8% em nosso estudo).29
Este estudo teve algumas limitações, como ocorre em estudos observacionais. Como não teve controle, não fornece uma estimativa tão clara do impacto da profilaxia com palivizumabe como os resultados obtidos por meio de ensaios clínicos comparativos randomizados.24 Além disso, nem todas as internações passaram por um exame diagnóstico para confirmar se o episódio foi causado por uma infecção por VSR. Contudo, como o teste de VSR depende das diretrizes locais e não era sempre feito, esses resultados devem ser interpretados com cautela. Isso ocorre devido principalmente à variabilidade entre os locais participantes no que diz respeito às diretrizes locais sobre testes de diagnóstico, limitação que também estava presente em estudos semelhantes do mundo real.21,24,30 A falta de informações também pode ser um fator em alguns casos em que a internação ocorreu em um hospital não envolvido no estudo. Contudo, foram envidados esforços para coletar dados a respeito da presença de VSR nesses casos. Por fim, outra limitação foi que eventos adversos não graves não foram classificados pelos investigadores como relacionados ou não ao palivizumabe.
Embora os locais participantes não representem totalmente a população geral de pacientes que recebem a profilaxia em países da América Latina, eles foram selecionados com base em sua capacidade de inscrições e experiência com o palivizumabe e o tratamento de crianças de alto risco. Por outro lado, como os pais das crianças precisavam ter acesso ao sistema de saúde, um viés de seleção pode afetar algumas variáveis, como a adesão ao tratamento e o nível de escolaridade, que de outra forma poderiam estar associadas às internações por ITRI. Por fim, embora a incidência e a gravidade da infecção por VSR sejam afetadas pela sazonalidade,25 isso não deve comprometer os principais achados. Este estudo foi feito durante dois anos consecutivos (incluindo mais de uma estação de VSR) em diferentes cidades e países, fornece, assim, uma visão geral da região da América Latina, ao mesmo tempo em que abrange a maioria de seus padrões de sazonalidade de VSR. Na verdade, até onde sabemos, este é o primeiro estudo multicêntrico que incluiu neonatos que receberam profilaxia na região da América Latina, com a vantagem da coleta de dados demográficos e clínicos completos de praticamente todas as crianças inscritas, embora outros estudos em um único centro e com um acompanhamento mais curto tenham sido feitos nessa região.
A taxa de internação devida a infecção por VSR foi baixa nessa população e em linha com as observadas em vários ensaios clínicos controlados randomizados e estudos observacionais. Com base em nosso estudo, a profilaxia com palivizumabe é eficaz e tem um bom perfil de segurança em neonatos da América Latina com alto risco de infecção grave por VSR.
FinanciamentoEste estudo foi financiado por AbbVie, Inc.
Conflitos de interesseN Vain recebeu uma bolsa/apoio à pesquisa e honorários de palestrante e consultoria da AbbVie. M E Serra é funcionária da Fundasamin, contratada pela AbbVie para Gestão de Dados do Estudo. A AbbVie Inc. esteve envolvida no modelo do estudo; na coleta, análise e interpretação de dados; e na preparação e aprovação deste manuscrito. L. Castillo e G. Bugarin são funcionários da AbbVie e podem deter ações ou opções.
Ao Dr. Guillermo de Jesus Ruelas Orozco, à Dra. Margarita Morales Marquez, Dra. Carolina Salazar e Dra. Adriana Castro e à Sra. Mariana Jacqueline Martínez Muñoz por sua colaboração neste estudo. E à Sra. Milene Fernandes (Eurotrials, Scientific Consultants), que ajudou a redigir este trabalho.
Como citar este artigo: Castillo LM, Bugarin G, Arias JC, Rangel JI, Serra ME, Vain N. One‐year observational study of palivizumab prophylaxis on infants at risk for respiratory syncytial virus infection in Latin America. J Pediatr (Rio J). 2017;93:467–74.