To review the principles of neonatal‐pediatric extracorporeal membrane oxygenation therapy, prognosis, and its establishment in limited resource‐limited countries in Latino America.
SourcesThe PubMed database was explored from 1985 up to the present, selecting from highly‐indexed and leading Latin American journals, and Extracorporeal Life Support Organization reports.
Summary of the findingsExtracorporeal membrane oxygenation provides “time” for pulmonary and cardiac rest and for recovery. It is used in the neonatal‐pediatric field as a rescue therapy for more than 1300 patients with respiratory failure and around 1000 patients with cardiac diseases per year. The best results in short‐ and long‐term survival are among patients with isolated respiratory diseases, currently established as a standard therapy in referral centers for high‐risk patients. The first neonatal/pediatric extracorporeal membrane oxygenation Program in Latin America was established in Chile in 2003, which was also the first program in Latin America to affiliate with the Extracorporeal Life Support Organization. New extracorporeal membrane oxygenation programs have been developed in recent years in referral centers in Argentina, Colombia, Brazil, Mexico, Perú, Costa Rica, and Chile, which are currently funding the Latin American Extracorporeal Life Support Organization chapter.
ConclusionsThe best results in short‐ and long‐term survival are in patients with isolated respiratory diseases. Today extracorporeal membrane oxygenation therapy is a standard therapy in some Latin American referral centers. It is hoped that these new extracorporeal membrane oxygenation centers will have a positive impact on the survival of newborns and children with respiratory or cardiac failure, and that they will be available for an increasing number of patients from this region in the near future.
Analisar os fundamentos, o prognóstico e o estabelecimento da terapia de oxigenação por membrana extracorpórea ECMO neonatal‐pediátrica em países da América Latina com recursos limitados.
FontesA base de dados PubMed foi explorada de 1985 até hoje, selecionamos os principais periódicos da América Latina e relatos da Organização de Suporte de Vida Extracorpóreo.
Resumo dos achadosA oxigenação por membrana extracorpórea proporciona “tempo” para descanso pulmonar e cardíaco e para recuperação. Ela é usada no campo neonatal‐pediátrico como terapia de resgate, com mais de 1.300 pacientes com insuficiência respiratória e cerca de 1.000 pacientes com cardiopatias por ano. Os melhores resultados de sobrevida de curto e longo prazo são de pacientes com doenças respiratórias isoladas, o que estabelece uma terapia padrão em centros de encaminhamento para pacientes de alto risco. O primeiro programa de oxigenação por membrana extracorpórea neonatal/pediátrico na América Latina foi estabelecido no Chile em 2003, que também foi o primeiro programa na América Latina a se afiliar à Organização de Suporte de Vida Extracorpóreo. Novos programas de oxigenação por membrana extracorpórea foram desenvolvidos nos últimos anos em centros de encaminhamento em Argentina, Colômbia, Brasil, México, Peru, Costa Rica e Chile, que atualmente fundam a seção da América Latina da Organização de Suporte de Vida Extracorpóreo.
ConclusõesOs melhores resultados de sobrevida de curto e longo prazo são de pacientes com doenças respiratórias isoladas. Atualmente, a terapia de oxigenação por membrana extracorpórea é uma terapia padrão em alguns centros de encaminhamento da América Latina. Esperamos que esses novos centros de oxigenação por membrana extracorpórea tenham um impacto positivo sobre a sobrevida de neonatos e crianças com insuficiência respiratória ou cardíaca e que estejam disponíveis para um número cada vez maior de pacientes de nossa região no futuro próximo.
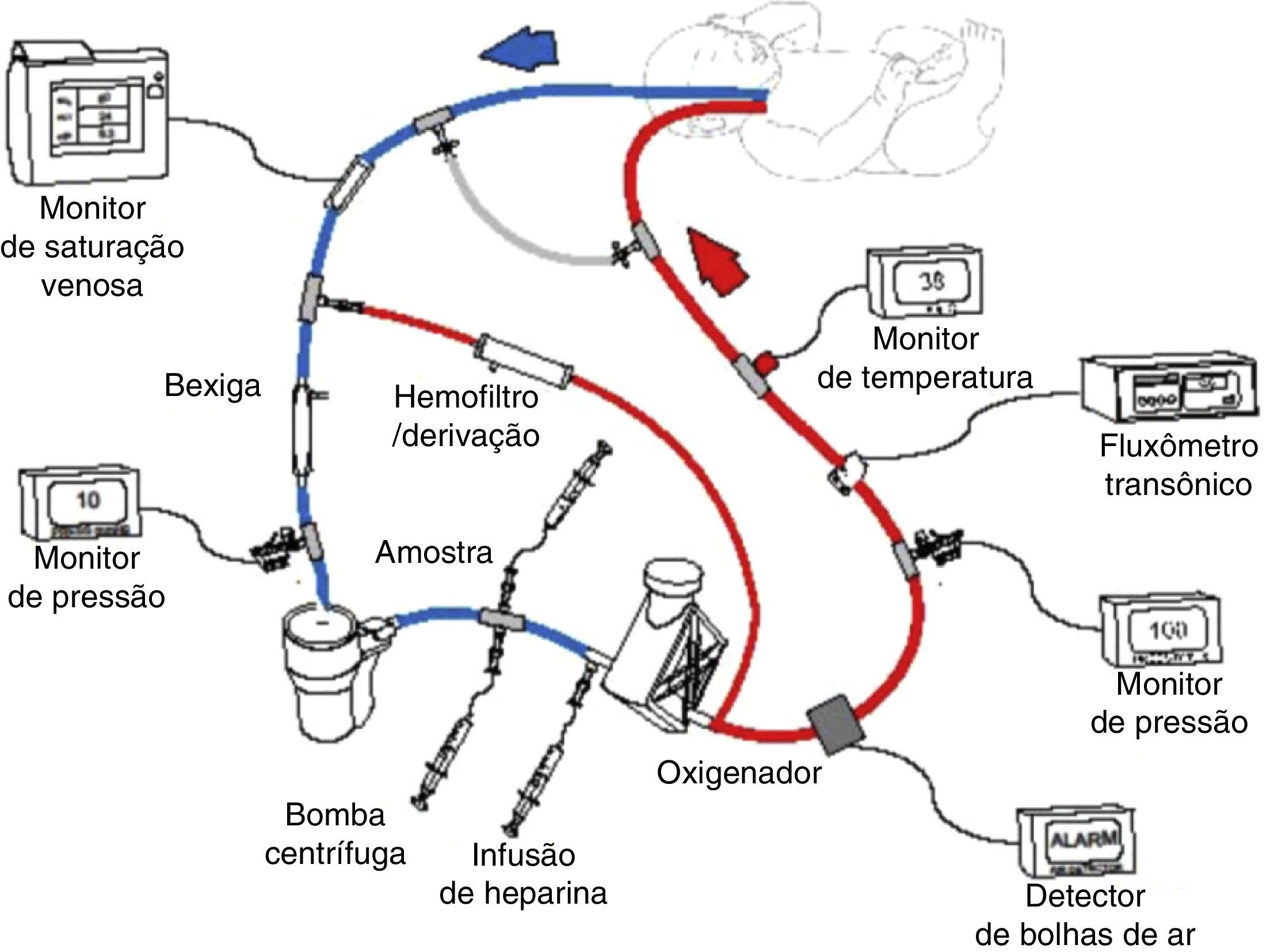
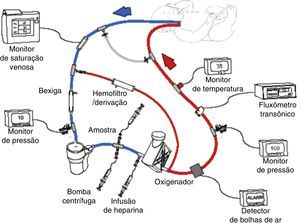
A oxigenação por membrana extracorpórea (ECMO) ou suporte de vida extracorpóreo (ECLS) é uma terapia que usa uma circulação extracorpórea parcial modificada para prestar apoio pulmonar e/ou cardíaco por um longo período, geralmente de uma a quatro semanas (fig. 1). Ela é usada em pacientes com insuficiência cardiopulmonar reversível devido a doenças pulmonares, cardíacas ou de outro tipo. A ECMO proporciona tempo para descanso pulmonar e/ou cardíaco e para recuperação. Se considerarmos que a ECMO é invasiva, ela envolve riscos potenciais, motivo pelo qual foram estabelecidos critérios para selecionar pacientes com previsão de mortalidade de 50% a 100%. O candidato ideal à ECMO tem alta previsão de mortalidade, porém com uma lesão pulmonar ou cardiovascular possivelmente reversível.1,2
Esquema do circuito venoarterial da ECMO com bomba centrífuga e oxigenador de polimetilpentano. O sangue venoso é obtido do átrio direito por meio da veia jugular interna direita, bombeado, oxigenado, aquecido e devolvido para a aorta por meio da artéria carótida direita. Reprodução autorizada de ECMO Manual of the Children's National Medical Center, George Washington University, Washington D.C., 2010.
O primeiro sobrevivente adulto da terapia de ECMO foi tratado em 1971 por J. Donald Hill, que usou um oxigenador Bramson com um paciente politraumatizado.1 Contudo, no fim dos anos 1970, o uso da terapia em adultos foi abandonado devido aos resultados ruins em estudos controlados. Anos depois, a ECMO apresentou um ressurgimento em pacientes neonatais e pediátricos graças ao cirurgião Robert Bartlett.1 Em 1975, no Orange County Medical Center, Bartlett usou a ECMO com sucesso em um recém‐nascido latino abandonado que sofria de síndrome do desconforto respiratório.1 O uso da ECMO em recém‐nascidos aumentou no fim dos anos 1980, com sobrevida de 80% entre pacientes com previsão de mortalidade de 60‐80%. Devido ao aumento do uso de ECMO em pacientes neonatais, uma aliança de voluntários, a Organização de Apoio Extracorpóreo à Vida (ELSO) foi formada entre centros de ECMO em 1989.1
Neonatos são a principal faixa etária para a qual a terapia de ECMO é muito superior à terapia máxima convencional, conforme mostrado em um estudo multicêntrico controlado e randomizado com 185 recém‐nascidos com insuficiência respiratória grave em 55 hospitais no Reno Unido.3–5 O estudo mostrou que a mortalidade e a deficiência grave avaliadas no 1°, 4° e 7° anos de vida reduziram significativamente com o uso da ECMO (59% para o grupo de terapia convencional em comparação com 37% para o grupo de ECMO).4–6 No acompanhamento de sete anos, 76% das crianças apresentaram desenvolvimento cognitivo normal.5
Análises sistemáticas mostram que o uso de ECMO em neonatos próximos ao termo com insuficiência respiratória grave, porém possivelmente reversível, melhora significativamente a sobrevida sem aumentar deficiências graves, tem a melhor relação custo‐benefício em comparação com outras terapias de tratamento intensivo.7,8
A respeito do uso da ECMO como terapia de resgate para neonatos com hérnia diafragmática congênita (HDC) e insuficiência respiratória grave, estudos prospectivos controlados indicam reduções apenas na mortalidade precoce.3,9 Contudo, uma metanálise de estudos retrospectivos e nossa própria experiência indicam uma taxa maior de sobrevida de curto e longo prazo com HDC em unidades de saúde que incluem ECMO.9–11
Novas terapias surgiram nos anos 1990 para combater patologias cardiorrespiratórias, como ventilação oscilatória de alta frequência (VOAF), tensoativos e inalação de óxido nítrico (iNO).12 Com essas terapias associadas a centros de ECMO, a morbimortalidade dessas patologias foi significativamente reduzida em países mais desenvolvidos.5
De acordo com a ELSO, na última década, a ECMO foi usada anualmente como terapia de resgate em cerca de 800 neonatos que não respondiam ao tratamento intensivo com ventilação oscilatória de alta frequência (VOAF) e/ou inalação de óxido nítrico (iNO).2,13 Atualmente, a taxa de uso de ECMO nos EUA é de aproximadamente um neonato a cada 5.000 nascidos vivos.2 Essa terapia apresenta claramente uma taxa maior de sobrevida global (74% com alta hospitalar) entre neonatos com insuficiência respiratória grave, melhor qualidade de vida futura e índice favorável de custo‐benefício.2,6
As indicações que levam ao uso de ECMO em pacientes pediátricos são mais diversas e difíceis de ser definidas do que para pacientes neonatais.14,15 Contudo, nos últimos anos, o número de casos respiratórios relatados à ELSO aumentou para cerca de 500 crianças por ano, com taxa de sobrevida global de 58% com alta hospitalar ou transferência.2,13,14 A insuficiência respiratória hipóxica aguda é a doença respiratória mais comum na aceitação de pacientes para ECMO.16 Nesse grupo, a pneumonia viral é a causa mais comum e uma das doenças com as melhores taxas de sobrevida, juntamente com pneumonia por aspiração e desconforto respiratório pós‐traumático agudo.15 Atualmente, os pacientes são aceitos com imunossupressão e suspeita de sepse, essa normalmente com falência múltipla dos órgãos.16 Os grupos de pacientes pediátricos com os piores prognósticos são aqueles que passaram por transplantes de medula óssea ou por pneumonia associada à Bordetella pertussis e à hipertensão pulmonar e pacientes com falência múltipla dos órgãos, em contrapartida ao bom prognóstico de pacientes com comprometimento pulmonar isolado.16
Nos anos 1970, a ECMO foi usada para administrar a insuficiência respiratória e a hipertensão pulmonar e, de certa forma, posteriormente para assistência cardíaca ventricular. Em 1972, o Dr. Bartlett prestou com sucesso a assistência com ECMO a um menino de dois anos após um procedimento de Mustard de correção de transposição dos grandes vasos e posterior insuficiência cardíaca.1 Metade dos pacientes que precisam de ECMO cardíaca apresenta cardiopatia congênita cianótica complexa.2 Os maiores grupos que precisam de ECMO são pacientes que passaram por uma cardiotomia devido à comunicação atrioventricular (AV) completa (20%), pacientes com ventrículo único (17%) ou tetralogia de Fallot (14%).17 Entre as principais causas que levam à aplicação de ECMO cardíaca pré‐operatória estão hipóxia (36%), parada cardíaca (24%) e não desmame da circulação extracorpórea (14%). Consequentemente, o uso de iNO e VOAF pode reduzir a necessidade de ECMO ao diminuir o grau de hipóxia.17
A ECMO é superior a dispositivos de assistência ventricular em casos em que os mecanismos predominantes de fisiopatologia são hipóxia, hipertensão pulmonar ou insuficiência biventricular.17
As indicações cardíacas neonatais e pediátricas aumentaram de forma constante ao longo do tempo, chegaram a mais de 1.000 casos relatados à ELSO anualmente, constituem uma terapia de apoio valiosa em centros de cirurgia cardíaca de alta complexidade.2,18
Até 2009, quase 80% dos mais de 50.000 pacientes tratados com ECMO relatados à ELSO eram recém‐nascidos ou crianças. Os neonatos tratados por problemas respiratórios representavam cerca de metade de todos os pacientes relatados.2 Nos últimos anos, a ECMO cardiorrespiratória adulta tem aumentado progressivamente 1.500% e a ECMO respiratória pediátrica, 100%, parcialmente devido à epidemia de gripe H1N1 e a novas evidências de ensaios randomizados com adultos.19,20
Se considerarmos as evidências de benefícios claros de sobrevida, qualidade de vida e relação custo‐benefício dessa terapia e a ausência de um programa formal de ECMO no Chile, foi decidido, em 1998, estabelecer um programa neonatal‐pediátrico de ECMO na Unidade de Terapia Intensiva Neonatal do Hospital Universitário Católico (Programa ECMO‐UC) de acordo com as normas da ELSO para pacientes com insuficiência cardiovascular ou respiratória grave, porém reversível, refratária ao tratamento máximo convencional.21,22 O trabalho começou em 1999 com o desenvolvimento de uma equipe multidisciplinar (neonatologista, pediatras de cuidados intensivos, cirurgiões cardíacos e pediátricos, enfermeiros, perfusionistas, terapeutas respiratórios, psicólogos) com treinamento em centros de ECMO nos EUA afiliados à ELSO.21 O treinamento foi consolidado no Chile com um curso experimental que usou ovelhas.21
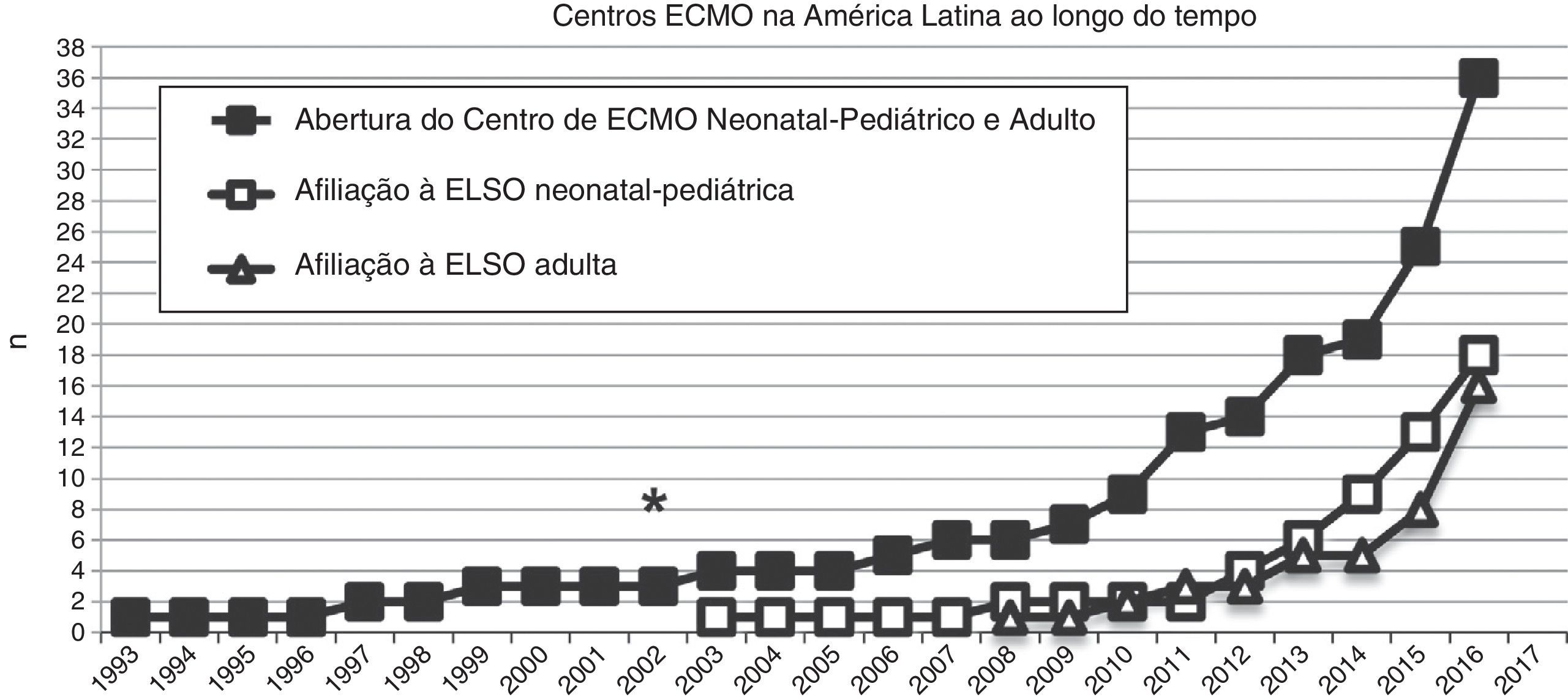
Em 2003, o primeiro programa neonatal‐pediátrico de ECMO foi consolidado no Chile e se tornou o primeiro membro latino‐americano da ELSO (fig. 2). De maio de 2003 a junho de 2016, o centro tratou 181 pacientes (155 neonatos e 26 crianças) com patologias respiratórias e cardíacas graves.
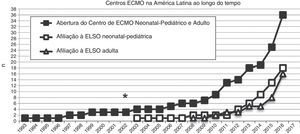
Número de centros de ECMO criados na América Latina desde 1993 (quadrados pretos) e número desses centros de ECMO na América Latina afiliados à ELSO e à ELSO América Latina desde 2003, divididos em centros neonatais‐pediátricos e centros adultos (quadrados e triângulos brancos, respectivamente). O asterisco (*) marca o ano de 2003, quando o primeiro centro de ECMO neonatal‐pediátrico foi aberto.
Para determinar o impacto do estabelecimento de um Programa Neonatal de ECMO sobre o resultado de recém‐nascidos com insuficiência respiratória hipóxica (HRF) grave em um país emergente como o Chile, estudamos dados de neonatos (peso ao nascer (PN)>2.000g e idade gestacional (IG) ≥ 35 semanas) com HRF e índice de oxigenação (IO)>25, comparados antes e após a ECMO.11 A ECMO foi iniciada em neonatos com HRF refratária que não respondiam à iNO/VOAF. Foram analisados dados de 259 neonatos; 100 nascidos no período anterior à ECMO e 159 nascidos após o estabelecimento do programa de ECMO. A sobrevida aumentou significativamente de 72% antes da ECMO para 89% durante o período de ECMO. Durante o período de ECMO, 98/159 (62%) pacientes com HRF foram resgatados com iNO/VOAF, ao passo que 61 (38%) não apresentaram melhoria; desses, 52 receberam ECMO.11 A razão sobrevida/alta hospitalar na ECMO foi de 85%. Após o ajuste de possíveis variáveis de confusão, a gravidade do IO antes do tratamento, a chegada tardia ao centro de encaminhamento, a presença de pneumotórax e o diagnóstico de uma hérnia diafragmática foram significativamente associados à necessidade de ECMO ou ao óbito. A conclusão desse estudo foi que o estabelecimento de um programa de ECMO estava associado a um aumento significativo na sobrevida de neonatos ≥ 35 semanas com HRF grave em um país emergente.11
Em 2013, em um editorial no periódico Pediatric Critical Care Medicine, Steinhorn e Keller comentam que a experiência chilena é notável por diversos motivos.23 “O Chile é um país com recursos limitados, a ECMO é notoriamente cara e demanda muitos recursos, devido à necessidade de equipamentos sofisticados e enfermeiros e técnicos bem treinados para acompanhamento constante”.23 Eles notam: “Após o início do programa de ECMO, quase um a cada 10.000 neonatos nascidos no Chile foi transferido para a Pontifícia Universidad Católica de Chile para receber cuidados respiratórios avançados. Estabelecer o programa e facilitar o transporte complexo de neonatos gravemente doentes por um país grande é de fato uma conquista notável. Em uma época em que o gasto de recursos econômicos com a saúde pediátrica é escrutinado, é encorajador ver o compromisso do Chile com o aumento da sobrevida de neonatos em sua comunidade, sabe‐se que a sobrevida de boa qualidade de neonatos com a ECMO provavelmente apresentará retornos maiores ao longo dos anos do que o gasto inicial de recursos”.23 Steinhorn e Keller concluem que as lições da experiência chilena também serão valiosas para outros países com recursos limitados que planejam aumentar seu nível de cuidados disponíveis e destacam as vantagens da regionalização de terapias médicas especializadas como a ECMO, que acelera o acúmulo de experiência de cirurgiões, neonatologistas e outros profissionais mais bem colocados para tratar esses neonatos.11,23
Em Bucaramanga, Colômbia, um relatório da Fundación Cardiovascular de Colombia de 2013 mostrou que, apesar da disponibilidade reduzida de recursos técnicos e econômicos, a terapia de ECMO pode ser implantada com sucesso em um país em desenvolvimento. Seu modelo de tratamento tem como base enfermeiros especialistas em ECMO assistidos por uma equipe multidisciplinar. Seu protocolo de circuito e monitoramento laboratorial reduzido e um circuito simples e mais barato são importantes para obter bons resultados com uma equipe reduzida.24 Recentemente, Miana, do Instituto do Coração, Universidade de São Paulo, Brasil, demonstrou que o investimento no treinamento de uma equipe de ECMO combinado com o investimento com bom custo‐benefício em tecnologia pode trazer benefícios significativos a pacientes pós‐cardiotomia.25
Após os exemplos das ELSO da Europa e da Região Ásia‐Pacífico, em 2012, a América Latina criou a seção local da ELSO (ELSO América Latina), com a missão de contribuir para a disseminação da terapia de ECMO segundo as recomendações da ELSO, educar prática e teoricamente por meio de cursos e oficinas e incentivar o trabalho colaborativo entre os centros da América Latina. A fundação ELSO América Latina foi organizada em Santiago/Chile durante o Simpósio de ECMO da América Latina de 2012. Cerca de 250 médicos de ECMO da América Latina participaram do evento, que também teve a participação de representantes da ELSO (Dr. Steve Conrad, Dr. Michael Hines, Peter Rycus e Dr. William Lynch).
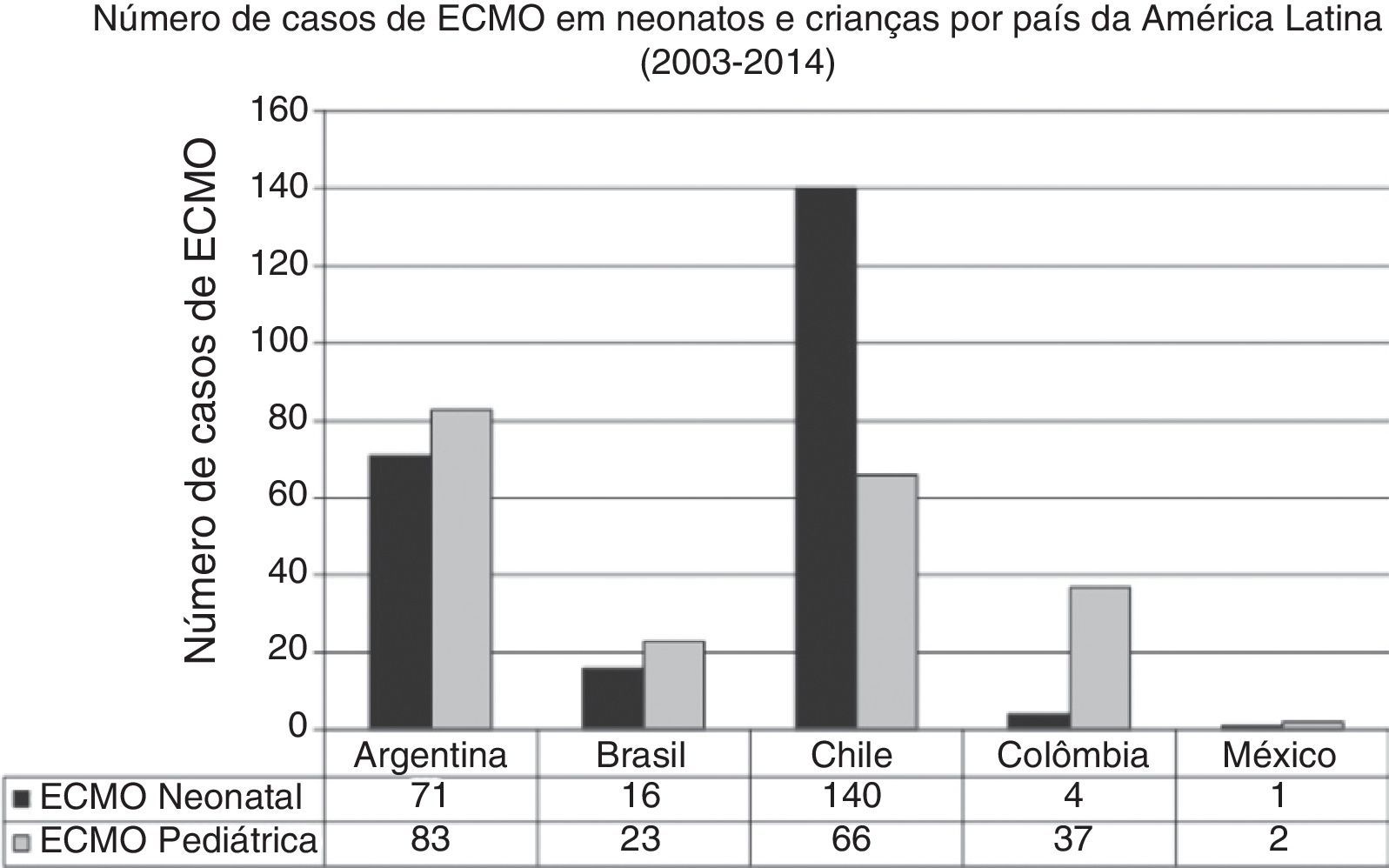
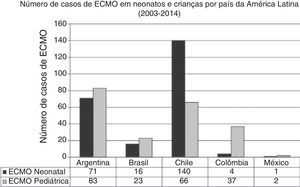
Na última década, novos programas neonatais‐pediátricos de ECMO foram estabelecidos em centros de alta complexidade e volume em diversos países da América Latina, como Argentina, Colômbia, Brasil, México, Peru e Costa Rica.21,26–28 A maioria desses centros entrou na seção da ELSO e da ELSO América Latina. Após a criação da seção da ELSO América Latina, um notório aumento de centros de ECMO foi observado na região (fig. 2). Atualmente, existem 33 centros da ELSO em sete países, 16 deles são centros neonatais e/ou pediátricos, com mais de 270 recém‐nascidos e 220 crianças relatados à ELSO até julho de 2016 (fig. 2).2 Como visto na figura 3, a proporção de pacientes de ECMO neonatais ou pediátricos difere em cada país, com mais casos neonatais no Chile em comparação com casos pediátricos, porém mais casos pediátricos em Colômbia, Argentina e Brasil em comparação com casos neonatais (fig. 3).
Como Caneo, de São Paulo, Brasil, comentou recentemente: “A boa notícia é que, com o apoio de especialistas dos EUA, Europa e Canadá, os resultados nos centros da ELSO América Latina apresentam melhoria ao seguir suas diretrizes de treinamento e ao seguir um processo educacional padrão”.29
Fisiologia da ECMODurante o apoio extracorpóreo, o sangue é drenado do paciente para uma bomba externa (rotativa ou centrífuga), que bombeia o sangue por meio de uma membrana de troca (oxigenador de silicone ou polimetilpentano) para oxigenação e remoção do CO2 e de um aquecedor para devolver o sangue à circulação do paciente (fig. 1). Essa terapia exige a anticoagulação do circuito e do paciente com heparina administrada ao circuito da ECMO, a fim de evitar a ativação da cascata de coagulação. Além disso, diversos monitores de pressão, fluxo, bolhas e temperatura são usados. O monitoramento contínuo da coagulação é fundamental, com o uso do tempo de coagulação ativada (TCA), nível de antifator Xa, contagem de plaquetas, medição dos níveis de fibrinogênio e, em alguns pacientes, nível de antitrombina III e tromboelastografia.30
Existem basicamente duas formas de ECMO:
- a)
Venoarterial (VA): o sangue é drenado do átrio direito com uma cânula inserida na veia jugular interna direita, veia femoral ou diretamente no átrio direito e devolvido à aorta torácica por meio de uma cânula na carótida direita, femoral ou aórtica (fig. 1). A VA‐ECMO presta apoio cardíaco e pulmonar. As cânulas transtorácicas (cânula auricular direita e aórtica) normalmente são usadas em pacientes cardíacos no pós‐operatório.30
- b)
Venovenosa (VV): o sangue é drenado do átrio direito pelos orifícios posterior e inferior de uma cânula de duplo lúmen inserida na jugular direita e devolvido ao mesmo átrio direito por meio do orifício anterior da mesma cânula, direcionada à válvula tricúspide. Um dos limites desse método é a recirculação do sangue já oxigenado por meio da cânula de duplo lúmen, corrigida com os novos desenhos da cânula para VV‐ECMO. A VV‐ECMO também é feita em crianças mais velhas com o uso de duas cânulas, remove o sangue da veia jugular e o devolve pela veia femoral. A VV‐ECMO exige um coração em bom funcionamento. Essa modalidade de ECMO evita a canulação da carótida ou da artéria femoral, diminui, assim, as complicações decorrentes da canulação ou da ligadura dessas artérias e da entrada de ar no circuito de ECMO. O uso desse modo aumentou no último ano e atualmente é usado em 40% e 50% dos casos respiratórios neonatais e pediátricos, respectivamente.30
Com ambas as formas de ECMO, os parâmetros ventilador e fração inspirada de oxigênio (FiO2) são mantidos baixos para permitir que os pulmões se recuperem, porém, de maneira geral, a pressão expiratória final positiva (PEEP) permanece alta (6 a 8cm H2O) para evitar a atelectasia.
O oxigênio é entregue durante a ECMO pela combinação da oxigenação sanguínea por meio de membranas, fluxo de sangue pelo circuito extracorpóreo, oxigenação pelo pulmão nativo e saída do coração nativo.30 Por sua vez, a oxigenação na membrana da ECMO é uma função da geometria, da composição do material e da espessura da membrana, da espessura laminar do sangue e da FiO2, do momento em que as hemácias permanecem na área de troca, da concentração de hemoglobina e da saturação de O2.30
A remoção de CO2 por ECMO ocorre em função da geometria, do material e da área de superfície da membrana, da pressão de CO2 no sangue e, em menor grau, dos fluxos de sangue e gás pela membrana.30
A circulação na VA‐ECMO gera um fluxo sanguíneo basicamente não pulsátil. Conforme o fluxo sanguíneo ao circuito extracorpóreo aumenta, a onda do pulso diminui e, com 100%, a circulação para completamente, exceto ondas ocasionais. Contudo, normalmente a VA‐ECMO envolve uma circulação de 80%, deixa 20% ou mais de sangue circulado pelo coração e pelos pulmões, resulta em um pulso altamente reduzido, porém visível.30 O rim é indubitavelmente o órgão mais afetado pela ausência de pulsatilidade, resulta em um efeito antidiurético devido à estimulação justaglomerular. O fluxo não pulsátil também estava relacionado à estimulação dos receptores de pressão do seio carotídeo, provoca uma grande liberação de catecolamina, com efeitos deletérios sobre a microcirculação.30
Critérios de seleção para aplicação da ECMOOs critérios diferem para pacientes neonatais ou pediátricos e dependem de a possibilidade da causa ser principalmente cardíaca ou respiratória. Os critérios são gerais e devem ser individualizados para cada paciente, avaliam‐se os riscos e benefícios da aplicação da ECMO.16
- •
Idade gestacional ≥ 34 semanas
- •
Peso ao nascer ≥ 2kg
- •
Não responsivo ao tratamento médico máximo (VOAF, iNO, tensoativo)
- •
Doença cardiopulmonar reversível
- •
Ventilação mecânica ≤ 10‐14 dias
- •
Alta mortalidade pulmonar (50‐100%). Um dos itens a seguir:
- ‐
Índice de oxigenação (IO)>40 por 4 horas (iNO, VOAF)
- ‐
PaO2<40‐50mmHg por 4 horas (100% O2)
- ‐
Gradiente A/aDO2>600mmHg por 4 horas
- ‐
IO 3 25 após 72 horas com VOAF‐iNO31
- ‐
- •
Acidose metabólica não tratável (pH<7,15 por 2 horas)
- •
Débito cardíaco reduzido com etiologia reversível
- •
Impossibilidade de desmame da circulação extracorpórea
- •
Ponte para transplante cardíaco32
- •
Inexistência de lesões pós‐cirurgia cardíaca
- •
Inexistência de grande hemorragia intracraniana
- •
Inexistência de hemorragia incontrolável
- •
Inexistência de evidências de dano cerebral maciço
- •
Inexistência de malformações ou síndromes com prognóstico fatal
Os critérios fundamentais são semelhantes para pacientes pediátricos com insuficiência respiratória, com ênfase especial na possibilidade de o paciente enfrentar um sério risco pulmonar com risco elevado de óbito, porém com uma possível reversibilidade da doença por meio do repouso respiratório, gasométrico e hemodinâmico. Entre os critérios pediátricos, temos:14
- •
IO>40 por 6 horas em ventilação mecânica invasiva (VMI) e/ou VOAF
- •
IO>35 por>12 horas
- •
Efeitos adversos da ventilação mecânica
- •
Ventilação mecânica ≤ 10‐14 dias
- •
Hipercapnia com pH<7,1 por 4 horas
- •
Deterioração aguda com terapia ideal
As contraindicações específicas da ECMO para pacientes cardíacos são a presença de lesões pós‐cirúrgicas residuais e as contraindicações do transplante cardíaco. Contudo, cada caso deve ser analisado individualmente se considerarmos que as contraindicações podem estar relacionadas ou mudar ao longo do tempo.17,33 As indicações cardíacas ou hemodinâmicas para pacientes pediátricos são:
- •
Insuficiência cardiovascular severa, porém possivelmente reversível, que não responde a medicamentos vasoativos, de vasodilatação ou antiarrítmicos
- •
Persistência de SVO2<60%; pH<7,15
- •
Não desmame da circulação extracorpórea após a cirurgia
- •
Arritmia grave com má perfusão
- •
Deterioração ventricular rápida ou disfunção grave
Os parâmetros iniciais apontam para o atingimento de uma circulação de 50% ou mais de débito cardíaco (estimado em 200mL/kg/min) e são ajustados para manter a pressão adequada e um estado ácido‐básico. Quando a função cardíaca é conservada e a principal patologia é pulmonar, a VV‐ECMO pode ser usada para auxiliar na oxigenação e na ventilação. A atenção meticulosa a todos os aspectos do paciente é essencial. São necessárias verificações frequentes de gases sanguíneos, do circuito da ECMO, da coagulação e da função renal, bem como uma avaliação de ultrassom cerebral em busca de hemorragia intracraniana e infarto cerebral. Os pacientes estão sedados, porém normalmente não paralisados, o que facilita a avaliação neurológica. À medida que o paciente melhora, o suporte da ECMO é gradualmente reduzido. Os pacientes são decanulados quando não podem tolerar o suporte mínimo da ECMO (10% das circulações da VA‐ECMO) com parâmetros baixos a moderados de ventilação mecânica. O tratamento com a ECMO normalmente dura entre cinco e dez dias para pacientes neonatais com doenças respiratórias e mais tempo em casos de hérnia diafragmática congênita (10 a 12 dias em média).2
ComplicaçõesO procedimento da ECMO apresenta vários riscos de complicação devido ao uso de anticoagulantes e mudanças nos fluxos sanguíneos, como consequência da gravidade da doença do paciente após a introdução da ECMO. Entre as complicações mais comuns estão hemorragia (sítio cirúrgico 6%, pulmonar 4%, gastrointestinal 2%), infarto ou hemorragia cerebral (9% e 5%, respectivamente), convulsões (11%), disfunção cardíaca (atrofia do miocárdio 6%, arritmia 4%), insuficiência renal (4%), sepse (6%), hiperbilirrubinemia (9%), hipertensão arterial (12%) e hemólise (13%).2 A complicação mais comum da ECMO é de longe a necessidade de drogas vasoativas durante o apoio extracorpóreo, seguido da hemorragia do sítio cirúrgico.34
A hemorragia intracraniana é a principal causa de óbito durante a ECMO e o aparecimento de convulsões é um sinal de mau prognóstico. Também existem complicações decorrentes de falhas do circuito do oxigenador ou de outros equipamentos da ECMO.2
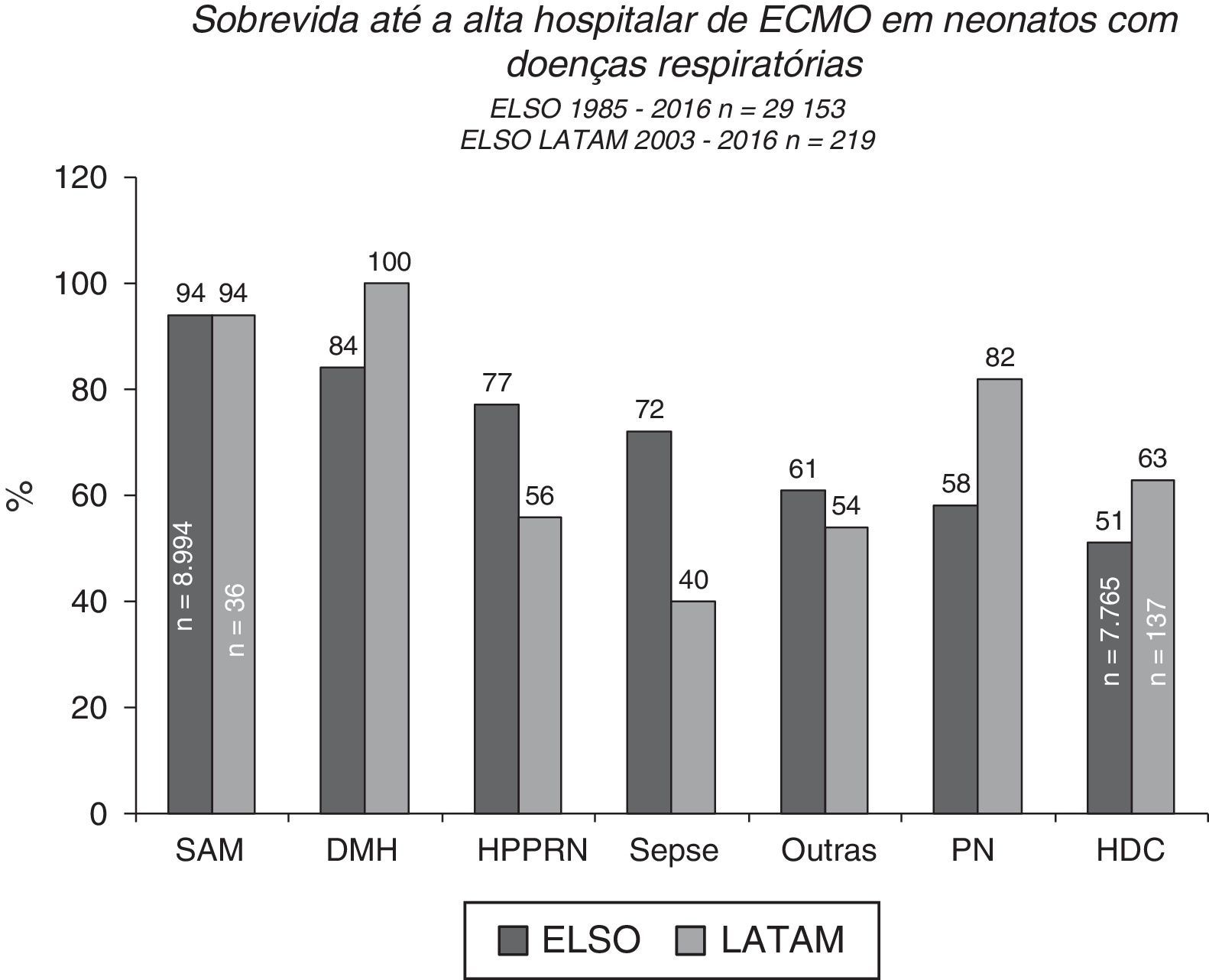
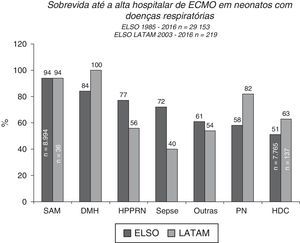
Prognóstico e acompanhamento da ECMOA sobrevida pós‐ECMO entre pacientes neonatais varia de acordo com a doença de base, as causas respiratórias são os melhores resultados de sobrevida até a alta hospitalar de cerca de 70%, de acordo com relatórios da ELSO e da ELSO América Latina (figs. 4 e 5).2 Entre todas as causas respiratórias, os neonatos com síndrome de aspiração meconial (SAM) apresentam a mais alta taxa de sobrevida até a alta hospitalar, de 94% (figs. 4 e 5).2,3 A ECMO venovenosa normalmente é usada para a SAM, que está associada a uma taxa mais baixa de riscos e complicações, como infartos cerebrais e convulsões e variações mínimas nos padrões de fluxo sanguíneo.
Sobrevida até a alta hospitalar de 29.153 e 219 neonatos tratados com ECMO, relatados à ELSO internacional e à ELSO América Latina, respectivamente, de acordo com a causa respiratória. SAM, síndrome de aspiração meconial; DMH, doença da membrana hialina; HPPRN, hipertensão pulmonar persistente do recém‐nascido; PN, pneumonia; HDC, hérnia diafragmática congênita.
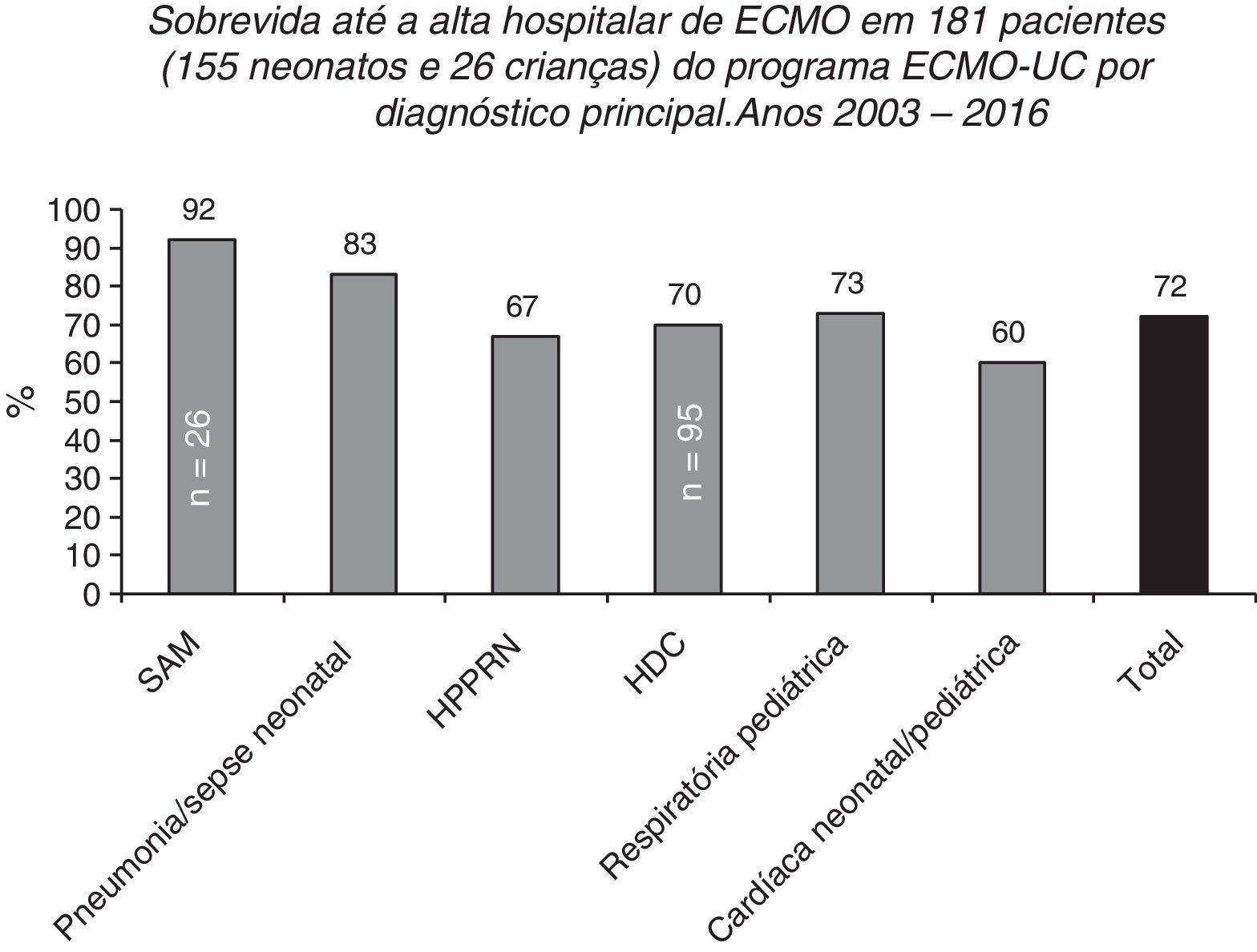
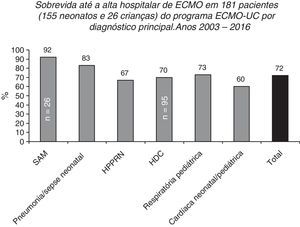
Sobrevida até a alta hospitalar de 155 e 26 pacientes pediátricos tratados no Programa de ECMO Neonatal‐Pediátrica do Hospital Universitário Católico em Santiago, Chile (Programa ECMO‐UC) de 2003 a 2016 relatados à ELSO de acordo com o principal diagnóstico. SAM, síndrome de aspiração meconial; HDC, hérnia diafragmática congênita; HPPRN, hipertensão pulmonar persistente do recém‐nascido.
Por outro lado, os pacientes tratados com ECMO por causas cardíacas apresentam taxa de sobrevida mais baixa, de cerca de 45%.2,13,33 Contudo, para pacientes bem selecionados, a ECMO é uma ferramenta útil que deve estar disponível em centros de cardiologia altamente complexos.17 Entre os pacientes tratados com a ECMO por causas cardíacas estão principalmente aqueles com cardiomiopatia e miocardite, com taxas de sobrevida até a alta hospitalar de 61% e 51%, respectivamente.2,13,33 Nos últimos anos, a ECMO foi usada como ferramenta de ressuscitação pós‐cardiopulmonar com resultados variáveis, com taxas de sobrevida próximas de 40%.2,13
A sobrevida e o prognóstico neurológico em cinco anos entre pacientes que estiveram na ECMO por causas não cardíacas são, em geral, muito bons, porém pioram com baixa idade gestacional, baixo peso ao nascer e alto índice de oxigenação (IO) pré‐ECMO.35 Os piores resultados de sobrevida e evolução neurológica são de pacientes com diagnósticos de choque séptico e HDC. Contudo, os fatores pré‐existentes e a gravidade dos recém‐nascidos após a introdução da ECMO parecem ser os principais determinantes do prognóstico de longo prazo.10,35,36
O prognóstico respiratório de longo prazo depende da etiologia básica, do grau de barotrauma e da duração da exposição ao oxigênio. Entre 10% e 30% dos pacientes com HDC apresentam episódios de pieira até os 10 anos e cerca de 50% apresentam hiperinsuflação e episódios de obstrução das vias aéreas.37,38
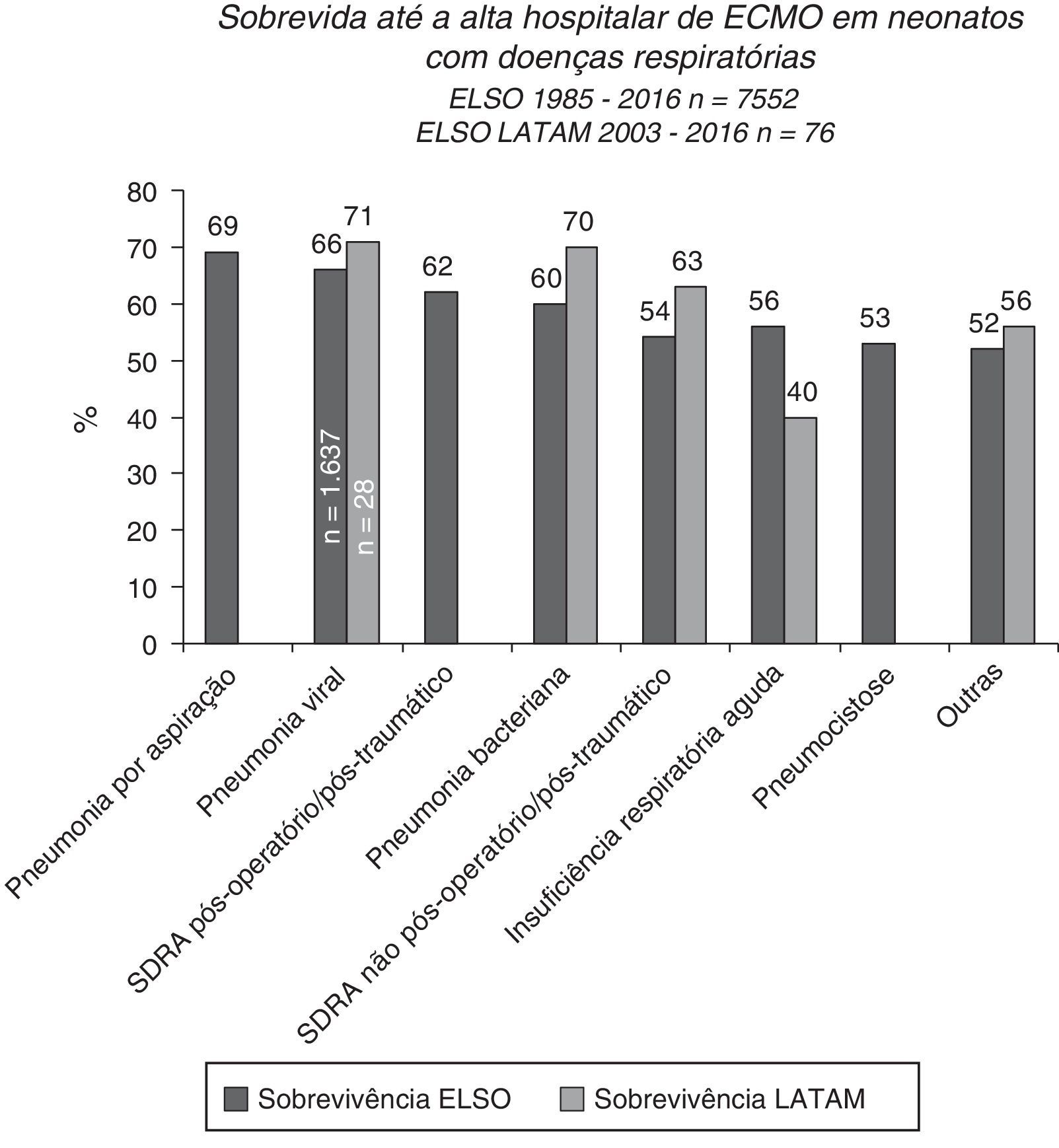
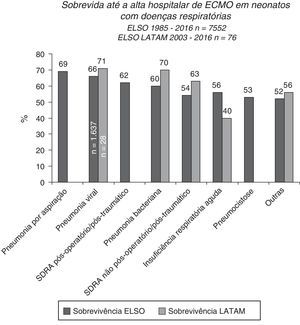
A sobrevida pós‐ECMO é mais baixa para pacientes pediátricos do que neonatais, embora exista um prognóstico melhor no grupo com insuficiência respiratória, principalmente pacientes com pneumonia por aspiração, pneumonia viral e síndrome do desconforto respiratório aguda pós‐operatória ou pós‐traumática (fig. 6).15,39 A pneumonia viral é a doença mais comum que leva à ECMO pediátrica e entre essas etiologias o vírus sincicial respiratório tem a mais alta taxa de sobrevida pós‐ECMO, de 70%.15 Os pacientes com pneumonia causada por outros vírus e pela Bordetella pertussis apresentam taxas de sobrevida menores, de 56% e 39%, respectivamente.15,39
Os pacientes pediátricos que recebem a ECMO devido a causas cardíacas apresentam taxa de sobrevida ligeiramente maior do que suas contrapartes neonatais2,13 (sobrevida até a alta hospitalar de 55%), destacam‐se as taxas de sobrevida até a alta hospitalar de 72% e 61% para miocardite e cardiomiopatia, respectivamente.2,13
Após 13 anos, de maio de 2003 a julho de 2016, o centro do ECMO‐UC tratou 181 pacientes (155 recém‐nascidos e 26 crianças, até 11 anos) com patologias respiratórias e cardíacas graves (fig. 6); 72% desses recém‐nascidos e crianças sobreviveram até alta hospitalar. Os 51 pacientes que faleceram apresentaram como doenças de base: HDC (n=29), cardiopatia congênita operada com não desmame da circulação extracorpórea ou arritmias (n=11), hipertensão pulmonar persistente secundária a sepse, pneumonia, síndrome de aspiração meconial, deficiência de SP‐B ou ABCA3 ou inexistência de uma causa definida (n=10) e pneumonia devido à Bordetella pertussis (n=1).2 Entre pacientes tratados com ECMO, existem principalmente recém‐nascidos com HDC, com taxa de sobrevida até a alta hospitalar de 70% (66/95).2
Todos os sobreviventes em nosso programa do ECMO‐UC no Chile estão em um programa especial de acompanhamento da ECMO.38 Entre o acompanhamento neurológico, os testes Bayley II em 12‐18 meses mostram que mais de 90% das crianças apresentaram índices de desenvolvimento mental (IDM) normais ou ligeiramente alterados e mais de 70% apresentaram índices de desenvolvimento psicomotor (IDP) normais ou ligeiramente alterados.38 Nenhum paciente apresentou alterações incapacitantes na visão ou na audição. No acompanhamento dos pacientes com HDC, mais de 80% apresentaram IDM normal segundo os testes Bayley II em 12‐18 meses e, de forma semelhante em todo o grupo, mais de 70% apresentaram IDP normal ou ligeiramente alterado.
A respeito do acompanhamento respiratório, 83% dos pacientes apresentaram hiper‐reatividade broncopulmonar clínica normal ou ligeiramente alterada e 27% apresentaram hiper‐reatividade bronquial na avaliação aos 3 anos.38
O estabelecimento de um programa de ECMO no Chile foi associado ao aumento significativo na sobrevida de recém‐nascidos próximos ao termo com insuficiência respiratória grave. A terapia de ECMO foi bem‐sucedida e não provocou sequelas incapacitantes na maioria dos pacientes.
Conclusões e futuras consideraçõesA terapia de ECMO, atualmente denominada de forma mais abrangente apoio de vida extracorpóreo (ECLS), é uma terapia padrão na neonatologia e pediatria, com benefícios de curto e longo prazo demonstrados. Ela pode ser incorporada à terapia intensiva com bons resultados em países em desenvolvimento, porém exige centros neonatais e pediátricos altamente complexos com uma equipe treinada e comprometida.
Os futuros pacientes tratados com ECLS serão progressivamente mais complicados e, devido a isso, serão necessárias modalidades automatizadas mais novas e simples de ECLS, com menor necessidade de anticoagulantes, para minimizar os riscos relacionados e possibilitar seu uso estendido. Assim, os recém‐nascidos e as crianças com doenças graves podem receber ECLS em transplantes de coração e pulmão ou usá‐lo como ponte para dispositivos de assistência ventricular.18,32,33 Mesmo os recém‐nascidos prematuros com insuficiência cardiopulmonar grave podem futuramente aproveitar o ECLS umbilical ou a baixa circulação com o uso de dispositivos de assistência pulmonar (LAD).40 Novos oxigenadores microporosos de baixa resistência tornam as bombas desnecessárias, com o uso da artéria ou veia umbilical como derivação arteriovenosa.41,42 Recém‐nascidos com HDC também podem ser admitidos para tratamento precoce com ECLS para minimizar os danos pulmonares e favorecer o crescimento pulmonar com o uso de fatores de crescimento e/ou ventilação líquida com perfluorocarbono associada ao ECLS. Alguns centros, como o Hospital Infantil de Boston, têm usado o tratamento intraparto extraútero (EXIT para ECMO) em pacientes com HDC e marcadores pré‐natais de mau prognóstico ou para garantir a ventilação efetiva em recém‐nascidos sem vias aéreas seguras ou que devem passar por uma insuficiência respiratória grave após o nascimento (HDC, teratoma cervical, patologias das vias aéreas, grandes massas pulmonares, cistos bronquiais etc.).43
Esperamos que o ECLS permita que continuemos a auxiliar no funcionamento pulmonar e cardíaco de forma mais racional por meio do reparo de processos cardiopulmonares graves, porém reversíveis.
Esperamos que os novos programas de ECMO na América Latina, como centros de referência, tenham um impacto positivo sobre a sobrevida de recém‐nascidos e crianças com insuficiência respiratória ou cardíaca e que esse tratamento esteja disponível a um maior número de pacientes em nossa região no futuro próximo.
Conflitos de interesseOs autores declaram não haver conflitos de interesse.
Às seguintes instituições por sua contribuição para nosso programa de ECMO: Organização de Apoio Extracorpóreo à Vida (ELSO), Seção da América Latina da ELSO (ELSO América Latina), Centro Médico Infantil Nacional, Universidade George Washington, Washington D.C.; UTIN W. H. Tooley Universidade da Califórnia, São Francisco; Fundação de Saúde Infantil, Universidade do Alabama, Birmingham; Hospital Infantil Egleston, Universidade Emory, Atlanta; Universidade de Washington, St. Louis; Ministério da Saúde Pública do Chile e Divisão Neonatal, Departamento de Pediatria e Departamento de Doenças Cardiovasculares e Anestesia da Pontifícia Universidade Católica de Chile. Ficamos muito gratos a muitos centros de ECMO na América Latina que contribuíram com dados de seus pacientes: Argentina: Hospital Prof. Dr. Juan Pedro Garrahan, Buenos Aires; Hospital Universidad Austral, Pilar, Buenos Aires; Hospital Sor María Ludovica, La Plata, Buenos Aires; Hospital Italiano, Buenos Aires; Clínica Bazterrica, Buenos Aires; Hospital Universitario Fundación Favaloro, Buenos Aires. Brasil: Instituto do Coração (InCor), São Paulo; Hospital de Clínicas, Universidade de São Paulo, Campinas, São Paulo; Hospital da Bahia, Salvador. Chile: Clínica Las Condes, Santiago; Clínica Alemana, Santiago; Clínica Santa María, Santiago; Hospital Roberto del Rio, Santiago. Colômbia: Fundación Cardiovascular de Colombia, Bucaramanga; Fundación Clínica Shaio, Bogotá; Clínica CardioVID, Medellín. México: Hospital Christus Muguerza, Monterrey. Paraguai: Hospital Pediátrico Niños de Acosta Ñu, San Lorenzo. Peru: Hospital Nacional Edgardo Rebagliati Martins, Lima.
Como citar este artigo: Kattan J, González Á, Castillo A, Caneo LF. Neonatal and pediatric extracorporeal membrane oxygenation in developing Latin American countries. J Pediatr (Rio J). 2017;93:120–9.