To compare different neonatal outcomes according to the different types of treatments used in the management of gestational diabetes mellitus.
MethodsThis was a retrospective cohort study. The study population comprised pregnant women with gestational diabetes treated at a public maternity hospital from July 2010 to August 2014. The study included women aged at least 18 years, with a singleton pregnancy, who met the criteria for gestational diabetes mellitus. Blood glucose levels, fetal abdominal circumference, body mass index and gestational age were considered for treatment decision‐making. The evaluated neonatal outcomes were: type of delivery, prematurity, weight in relation to gestational age, Apgar at 1 and 5min, and need for intensive care unit admission.
ResultsThe sample consisted of 705 pregnant women. The neonatal outcomes were analyzed based on the treatment received. Women treated with metformin were less likely to have children who were small for gestational age (95% CI: 0.09–0.66) and more likely to have a newborn adequate for gestational age (95% CI: 1.12–3.94). Those women treated with insulin had a lower chance of having a preterm child (95% CI: 0.02–0.78). The combined treatment with insulin and metformin resulted in higher chance for a neonate to be born large for gestational age (95% CI: 1.14–11.15) and lower chance to be born preterm (95% CI: 0.01–0.71). The type of treatment did not affect the mode of delivery, Apgar score, and intensive care unit admission.
ConclusionsThe pediatrician in the delivery room can expect different outcomes for diabetic mothers based on the treatment received.
Comparar diferentes desfechos neonatais de acordo com as diferentes modalidades de tratamento do diabetes mellitus gestacional.
MétodosTrata‐se de uma coorte retrospectiva. A população do estudo foi composta por gestantes com diabetes gestacional atendidas em uma maternidade pública de julho de 2010 a agosto de 2014. Foram incluídas mulheres com idade mínima de 18 anos, gestação única e com critérios para diabetes mellitus gestacional. Para decisão terapêutica foram considerados glicemias, circunferência abdominal fetal, índice de massa corporal e idade gestacional. Os desfechos neonatais avaliados foram: via de parto, prematuridade, relação do peso com idade gestacional, Apgar no 1° e 5° minuto e necessidade de internação em unidade de terapia intensiva.
ResultadosA amostra foi composta por 705 gestantes. Os desfechos neonatais foram analisados com base na terapêutica recebida. Mulheres tratadas com metformina tiveram menor chance de ter filhos pequenos para a idade gestacional (IC 95%: 0,09‐0,66) e maior chance de ter um filho adequado para a idade gestacional (IC 95%: 1,12‐3,94). A gestante tratada com insulina teve menor chance de ter um filho prematuro (IC 95%: 0,02‐0,78). O tratamento feito com a associação de insulina e metformina resultou em maior chance de um recém‐nascido grande para a idade gestacional (IC 95%: 1,14‐11,15) e menor chance de prematuridade (IC 95%: 0,01‐0,71). A modalidade de tratamento não interferiu na via de parto, Apgar e internação em terapia intensiva.
ConclusõesO pediatra na sala de parto pode esperar diferentes desfechos para o filho de mãe diabética, com base no tratamento recebido.
Segundo um estudo multicêntrico latino‐americano, o diabetes mellitus gestacional (DMG) consiste no mais prevalente problema metabólico presente na gestação.1 Ocorre em mulheres cuja função pancreática é insuficiente para superar a resistência à insulina devido à secreção de hormônios diabetogênicos pela placenta.2 No Brasil, estima‐se que a prevalência de DMG varie de 2,4% a 7,2%.3
Tanto a mãe como o bebê são afetados pelo DMG, uma vez que ambos têm risco de desenvolver desfechos indesejáveis.4 O DMG afeta o recém‐nascido (RN) na medida em que aumenta as chances de macrossomia, sofrimento fetal, desordens metabólicas, hiperbilirrubinemia, desequilíbrio do crescimento e outras complicações.5 Como forma de minimizar as consequências, é necessário que a doença seja diagnosticada e tratada precocemente, pois os desfechos também estão relacionados ao início e à duração da intolerância à glicose, bem como à severidade do diabetes materno.5
Por muito tempo, a insulina foi usada como tratamento padrão para o DMG. Entretanto, pesquisadores têm demonstrado a segurança de hipoglicemiantes orais como a metformina, usada no tratamento inicial quando somente a dieta não é suficiente para atingir níveis glicêmicos desejados.6,7
Estudos que compararam o uso de metformina e insulina no manejo do DMG demonstraram benefícios com o uso do hipoglicemiante oral, como menor número de nascimento de bebês prematuros e partos cesáreos, redução do ganho de peso materno e desfechos neonatais desfavoráveis6,8 como macrossomia, hipoglicemia, icterícia e admissão em serviços de cuidados neonatais especiais.9
Dessa forma, o objetivo do estudo foi comparar diferentes desfechos neonatais de acordo com as diferentes modalidades de tratamentos empregados no manejo do DMG.
MetodologiaTrata‐se de uma coorte retrospectiva, com base em análise de prontuário, feita de julho de 2010 a agosto de 2014. A amostra do estudo foi de conveniência e a população caracteriza‐se por gestantes portadoras de DMG atendidas no ambulatório de gestação de alto risco de uma maternidade pública. O projeto foi aprovado pelo Comitê de Ética em Pesquisa do Hospital Regional Hans Dieter Schmidt, Joinville (SC).
Foram incluídas todas as mulheres com idade igual ou superior a 18 anos, com gestação única e que preencheram os critérios para DMG.10 O diagnóstico de DMG foi feito com base no teste de tolerância oral à glicose. A presença de pelo menos um dos três critérios a seguir confirmava o diagnóstico: glicemia de jejum ≥ 92mg/dL, glicemia na 1a hora ≥ 180mg/dL e glicemia na 2a hora ≥ 153mg/dL.11 Além disso, foram incluídas mulheres com bebês sem malformações, que mantiveram acompanhamento no ambulatório e que tiveram o parto feito na maternidade.
Foram excluídas as pacientes que tiveram óbito intrauterino (n = 3). Dessas, duas faziam parte do grupo tratado com a associação metformina e insulina e uma havia sido tratada com dieta.
A primeira consulta de acompanhamento das diabéticas costuma envolver ultrassom obstétrico e a rotina de triagem para diabetes gestacional. Além disso, as gestantes participaram de uma palestra de recepção, com nutricionista e fisioterapeuta, a fim de receber informações para mudança de estilo de vida (dieta e exercício físico). Então, a glicemia capilar é monitorada duas vezes no dia da consulta (jejum e uma hora após‐café) e uma vez ao mês em quatro horários (em jejum e uma hora após o início de cada refeição). As consultas têm intervalo entre 15 e 21 dias.
Foram considerados as glicemias (jejum e pós‐prandial), a circunferência abdominal fetal, o índice de massa corporal (IMC) e a idade gestacional para decisão terapêutica. A dietoterapia foi indicada para todas as gestantes. Nos casos leves de DMG a escolha era a metformina. Em caso de não controle glicêmico com dose máxima de metformina (2,5 gramas) foi associada insulinoterapia e nos casos com critério de gravidade maior foi iniciada insulinoterapia diretamente, sem a tentativa com metformina. Para ser considerado um caso grave de DMG era necessário ter circunferência abdominal fetal acima do percentil 90 e glicemia materna de jejum > 100 e pós‐prandial (uma hora) > 140.
Os dados coletados referentes às gestantes foram nome completo, data da última menstruação, data provável do parto, idade gestacional e número de partos normais, cesáreas e abortos, peso e altura pré‐gestacionais, resultado do teste de tolerância oral à glicose, tratamento usado e valores glicêmicos.
Após o nascimento, foram analisados os prontuários dos bebês dessas mães diabéticas, a fim de coletar informações sobre via de parto, idade gestacional do nascimento, peso, altura, escore de Apgar no 1° e 5° minuto, morfologia e admissão em UTI neonatal.
Os dados coletados foram armazenados no software Microsoft Excel 2013 (Microsoft®, EUA). Todas as informações obtidas foram analisadas com o software Statistical Package for the Social Science (SPSS) (IBM Corp. Released 2012. IBM SPSS Statistics para Windows, versão 21.0, EUA). Para as variáveis quantitativas foram calculados médias e desvios‐padrão e para as qualitativas, frequências absolutas e relativas. Foram construídos modelos de regressão logística binominal, de modo a examinar a influência das diferentes modalidades terapêuticas nos desfechos neonatais e ajustar o efeito das variáveis de confusão. Foram estabelecidos intervalos de confiança (IC) de 95% e consideramos significativos valores p < 0,05.
ResultadosA amostra do estudo foi composta por 705 gestantes com diagnóstico de diabetes mellitus gestacional (DMG) e seus respectivos bebês. No fim da análise dos prontuários as participantes foram agrupadas em quatro grupos terapêuticos: (1) dieta, (2) metformina, (3) insulina e (4) metformina + insulina.
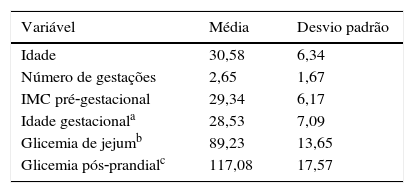
A tabela 1 lista as características gerais das gestantes participantes do estudo. De modo sintético, as gestantes tinham idade média de 30,6 anos (DP ± 6,34) e média de número de gestações de 2,65 (DP ± 1,67). A cesárea foi a via de parto de 52,1%. Em relação ao tratamento do DMG, a maioria das gestantes teve a dieta como terapêutica de escolha (41,6%), 35,5% foram tratadas com metformina, 15% com insulina e o restante com a associação de metformina e insulina (7,9%).
A doença hipertensiva da gestação esteve presente em 72 pacientes. Houve 26 casos nas mães tratadas com metformina, 16 no tratamento dieta e 15 tanto no tratamento insulina como na associação metformina mais insulina. As mães que receberam tratamento com a associação metformina e insulina tiveram uma chance maior para doença hipertensiva da gestação (AOR 2,38 [1,07‐5,28]), quando comparado com o tratamento dieta. Os demais tratamentos do DMG não tiveram diferença em relação a esse desfecho materno.
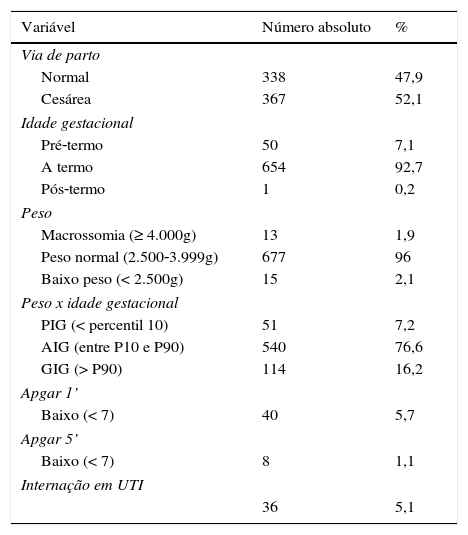
Sobre as características dos recém‐nascidos (tabela 2), a média da IG no momento do parto foi de 38,6 semanas (DP ± 1,38). Nasceram prematuros 34 bebês (4,8%); 40 (5,6%) tiveram o Apgar baixo no primeiro minuto e oito (1,1%) no quinto minuto; 114 (16,1%) neonatos foram grandes para a idade gestacional e 51 (7,2%) nasceram pequenos para a idade gestacional; 36 (5,1%) precisaram de internação em UTI.
Características gerais dos recém‐nascidos (n = 705)
| Variável | Número absoluto | % |
|---|---|---|
| Via de parto | ||
| Normal | 338 | 47,9 |
| Cesárea | 367 | 52,1 |
| Idade gestacional | ||
| Pré‐termo | 50 | 7,1 |
| A termo | 654 | 92,7 |
| Pós‐termo | 1 | 0,2 |
| Peso | ||
| Macrossomia (≥ 4.000g) | 13 | 1,9 |
| Peso normal (2.500‐3.999g) | 677 | 96 |
| Baixo peso (< 2.500g) | 15 | 2,1 |
| Peso x idade gestacional | ||
| PIG (< percentil 10) | 51 | 7,2 |
| AIG (entre P10 e P90) | 540 | 76,6 |
| GIG (> P90) | 114 | 16,2 |
| Apgar 1’ | ||
| Baixo (< 7) | 40 | 5,7 |
| Apgar 5’ | ||
| Baixo (< 7) | 8 | 1,1 |
| Internação em UTI | ||
| 36 | 5,1 | |
AIG, adequado para a idade gestacional; GIG, grande para a idade gestacional; PIG, pequeno para a idade gestacional; UTI, unidade de terapia intensiva.
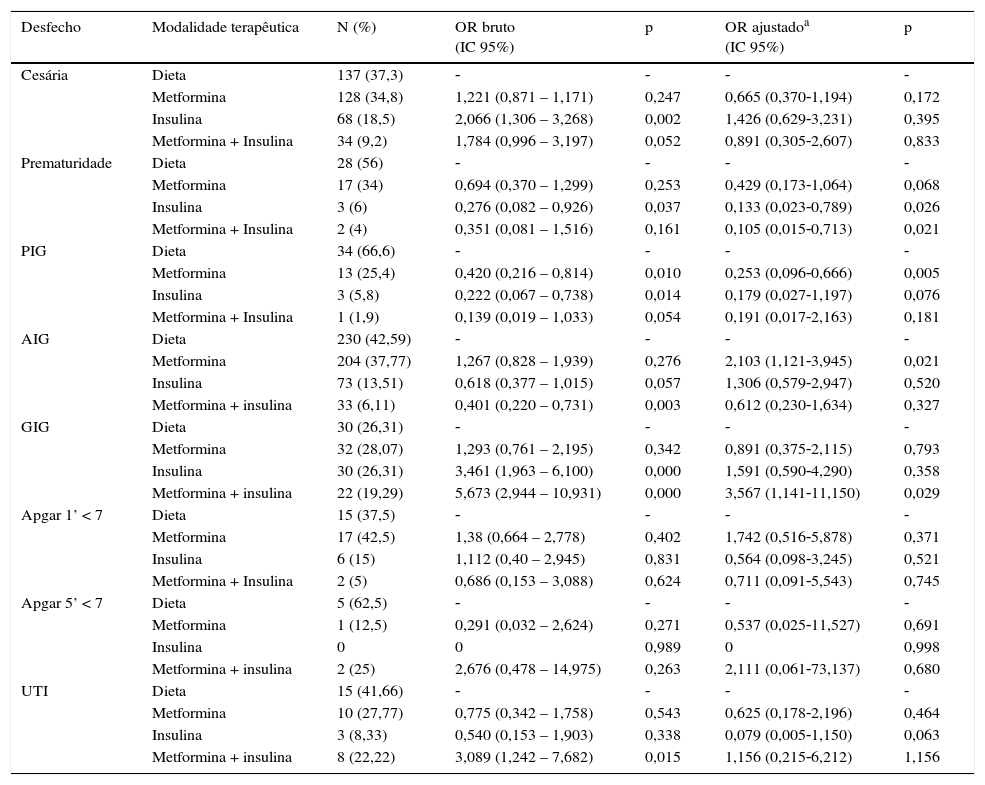
Os desfechos neonatais foram analisados com base na terapêutica do DMG (tabela 3). Levou‐se em conta que os tratamentos foram comparados com a dieta. A modalidade de tratamento não interferiu nos desfechos via de parto, valores de Apgar do primeiro e quinto minuto e necessidade de internação em UTI.
Análise multivariada dos desfechos neonatais de acordo com a modalidade de tratamento do DMG (n = 705)
| Desfecho | Modalidade terapêutica | N (%) | OR bruto (IC 95%) | p | OR ajustadoa (IC 95%) | p |
|---|---|---|---|---|---|---|
| Cesária | Dieta | 137 (37,3) | ‐ | ‐ | ‐ | ‐ |
| Metformina | 128 (34,8) | 1,221 (0,871 – 1,171) | 0,247 | 0,665 (0,370‐1,194) | 0,172 | |
| Insulina | 68 (18,5) | 2,066 (1,306 – 3,268) | 0,002 | 1,426 (0,629‐3,231) | 0,395 | |
| Metformina + Insulina | 34 (9,2) | 1,784 (0,996 – 3,197) | 0,052 | 0,891 (0,305‐2,607) | 0,833 | |
| Prematuridade | Dieta | 28 (56) | ‐ | ‐ | ‐ | ‐ |
| Metformina | 17 (34) | 0,694 (0,370 – 1,299) | 0,253 | 0,429 (0,173‐1,064) | 0,068 | |
| Insulina | 3 (6) | 0,276 (0,082 – 0,926) | 0,037 | 0,133 (0,023‐0,789) | 0,026 | |
| Metformina + Insulina | 2 (4) | 0,351 (0,081 – 1,516) | 0,161 | 0,105 (0,015‐0,713) | 0,021 | |
| PIG | Dieta | 34 (66,6) | ‐ | ‐ | ‐ | ‐ |
| Metformina | 13 (25,4) | 0,420 (0,216 – 0,814) | 0,010 | 0,253 (0,096‐0,666) | 0,005 | |
| Insulina | 3 (5,8) | 0,222 (0,067 – 0,738) | 0,014 | 0,179 (0,027‐1,197) | 0,076 | |
| Metformina + Insulina | 1 (1,9) | 0,139 (0,019 – 1,033) | 0,054 | 0,191 (0,017‐2,163) | 0,181 | |
| AIG | Dieta | 230 (42,59) | ‐ | ‐ | ‐ | ‐ |
| Metformina | 204 (37,77) | 1,267 (0,828 – 1,939) | 0,276 | 2,103 (1,121‐3,945) | 0,021 | |
| Insulina | 73 (13,51) | 0,618 (0,377 – 1,015) | 0,057 | 1,306 (0,579‐2,947) | 0,520 | |
| Metformina + insulina | 33 (6,11) | 0,401 (0,220 – 0,731) | 0,003 | 0,612 (0,230‐1,634) | 0,327 | |
| GIG | Dieta | 30 (26,31) | ‐ | ‐ | ‐ | ‐ |
| Metformina | 32 (28,07) | 1,293 (0,761 – 2,195) | 0,342 | 0,891 (0,375‐2,115) | 0,793 | |
| Insulina | 30 (26,31) | 3,461 (1,963 – 6,100) | 0,000 | 1,591 (0,590‐4,290) | 0,358 | |
| Metformina + insulina | 22 (19,29) | 5,673 (2,944 – 10,931) | 0,000 | 3,567 (1,141‐11,150) | 0,029 | |
| Apgar 1’ < 7 | Dieta | 15 (37,5) | ‐ | ‐ | ‐ | ‐ |
| Metformina | 17 (42,5) | 1,38 (0,664 – 2,778) | 0,402 | 1,742 (0,516‐5,878) | 0,371 | |
| Insulina | 6 (15) | 1,112 (0,40 – 2,945) | 0,831 | 0,564 (0,098‐3,245) | 0,521 | |
| Metformina + Insulina | 2 (5) | 0,686 (0,153 – 3,088) | 0,624 | 0,711 (0,091‐5,543) | 0,745 | |
| Apgar 5’ < 7 | Dieta | 5 (62,5) | ‐ | ‐ | ‐ | ‐ |
| Metformina | 1 (12,5) | 0,291 (0,032 – 2,624) | 0,271 | 0,537 (0,025‐11,527) | 0,691 | |
| Insulina | 0 | 0 | 0,989 | 0 | 0,998 | |
| Metformina + insulina | 2 (25) | 2,676 (0,478 – 14,975) | 0,263 | 2,111 (0,061‐73,137) | 0,680 | |
| UTI | Dieta | 15 (41,66) | ‐ | ‐ | ‐ | ‐ |
| Metformina | 10 (27,77) | 0,775 (0,342 – 1,758) | 0,543 | 0,625 (0,178‐2,196) | 0,464 | |
| Insulina | 3 (8,33) | 0,540 (0,153 – 1,903) | 0,338 | 0,079 (0,005‐1,150) | 0,063 | |
| Metformina + insulina | 8 (22,22) | 3,089 (1,242 – 7,682) | 0,015 | 1,156 (0,215‐6,212) | 1,156 |
AIG, adequado para a idade gestacional; GIG, grande para a idade gestacional; IC, intervalo de confiança; OR, odds ratio; PIG, pequeno para a idade gestacional; UTI, unidade de terapia intensiva.
OR ajustado para as seguintes variáveis: idade materna, índice de massa corporal maternal, número de gestações, tipo de parto, idade gestacional da primeira consulta, glicemia média de jejum, glicemia média pós‐prandial e circunferência abdominal fetal (considerada entre a 28ª a 32ª semana de gestação).
As gestantes que receberam tratamento com metformina tiveram uma chance menor de gerar filho pequeno para a idade gestacional (PIG) e também tiveram uma chance de um pouco mais de duas vezes de gerar um bebê com peso adequado para a idade gestacional (AIG). As mães que receberam tratamento com insulina tiveram chance menor de que seus filhos nascessem prematuros. Da mesma forma, as mães tratadas com a associação de metformina mais insulina também apresentaram menor chance de gerar bebês prematuros. Ademais, as mulheres tratadas com essa associação terapêutica tiveram uma chance maior do que três vezes de gerar filho grande para a idade gestacional (GIG).
DiscussãoO atual estudo avalia diferentes desfechos neonatais de acordo com a modalidade de tratamento escolhida para o DMG. Em nossa população, 16,2% dos recém‐nascidos foram classificados como GIGs. O tratamento com a associação de metformina com insulina foi responsável por uma chance 3,5 vezes maior de nascimento de bebê GIG (AOR 3,56 [1,14‐11,15]). A taxa de recém‐nascidos PIG foi de 7,2%, a chance foi menor no grupo de mulheres tratadas com metformina (AOR 0,25 [0,09‐0,66]). Já a porcentagem dos AIGs foi de 76,6%, a metformina demonstrou uma chance duas vezes maior de favorecer o nascimento de RN AIG (AOR 2,10 [1,12‐3,94]).
A percentagem de prematuros foi de 7,1%. O tratamento com insulina demonstrou uma menor chance para esse desfecho (AOR 0,13 [0,023‐0,78]), assim como a associação de metformina com insulina (AOR 0,10 [0,01‐0,71]). A taxa de internação em UTI foi de 5,1% e as modalidades de tratamentos não interferiram na necessidade de cuidados intensivos. O percentual de partos cesáreos foi de 52,1% e as modalidades de tratamento do DMG não interferiram na via de parto. Não houve aumento da chance de Apgar baixo, tanto no primeiro quanto no quinto minuto, conforme a terapêutica usada.
O estudo é válido porque, embora a insulina seja considerada o tratamento clássico padrão para a doença, a metformina já demonstra ter bons resultados no controle do diabetes mellitus gestacional e parece amenizar os possíveis desfechos neonatais.6,7
O médico responsável pela gestante com DMG precisa estar ciente dos riscos maternos e neonatais relacionados a esse distúrbio metabólico.12 Uma das complicações mais comuns do diabetes gestacional é o nascimento de bebê GIG.12 Quando o recém‐nascido é classificado dessa forma, além de o parto estar associado a maior risco de tocotraumatismos e distócia de ombro, repercussões imediatas como hipoglicemia e disfunção respiratória também podem ocorrer.12
Em nossa população, 16,2% dos recém‐nascidos foram classificados como grandes para a idade gestacional. Na literatura essa taxa oscilou de 13,4 a 30%.13–16 Nas pacientes que fizeram associação de metformina com insulina houve um risco 3,5 vezes maior de nascimento de um bebê GIG. Não houve diferença para os demais tratamentos. Na literatura houve maiores taxas de GIG com o tratamento insulina quando comparado com o tratamento metformina ou dieta.6
Entre as complicações perinatais de um recém‐nascido GIG, pode‐se citar o maior risco de aspiração meconial, fratura de clavícula, hipóxia perinatal, hipoglicemia, hiperbilirrubinemia, taquipneia transitória, lesão do plexo braquial, distócia de ombro e até a morte neonatal.17 Também são bebês de maior risco na escolha da terapêutica, pois o tratamento da gestante já foi mais incisivo em razão das características fetais observadas durante o pré‐natal.
Por outro lado, a terapêutica intensiva do DMG pode ter como repercussão a redução do peso fetal, o que evita GIGs. Porém, uma das consequências é o aumento dos recém‐nascidos PIGs.18 Tais distúrbios também têm relação com complicações neonatais precoces e doenças na vida adulta.18,19
Em nossa população a incidência de recém‐nascidos PIG foi de 7,2%. Na literatura oscilou de 3% a 10,5%.19,20 A chance de nascimento de neonatos PIGs foi menor no grupo de mulheres tratadas com metformina. Já no estudo de Goh et al. não houve diferença para o desfecho PIG nos diferentes tratamentos.6
Tão desfavorável quanto o nascimento de RN GIG é o RN PIG, visto que ambos estão associados a maior morbimortalidade em curto e longo prazo. Por isso, prevenir recém‐nascidos PIG é uma meta tão importante quanto a prevenção dos GIG.20 Assim, em um grupo seleto de gestantes, quando houver evidências indiretas de hiperinsulinização fetal à ultrassonografia (USG) poderia ser diminuída a dose do medicamento.
Para isso, talvez tenha que se valorizar mais o peso do bebê estimado pelo US na opção terapêutica das pacientes tratadas com metformina, visto que houve um risco maior de RNs PIG. Assim, um enfoque baseado nos parâmetros ultrassonográficos pode proporcionar a criação de um modelo terapêutico mais tolerante naquelas pacientes em que o peso do RN esteja diminuído à USG e a dose poderá ser diminuída.20
A qualidade de tratamento oferecido à gestante diabética reflete diretamente na classificação de peso do recém‐nascido. Sendo os RNs AIGs o objetivo da terapêutica, o sucesso do tratamento pode também ser avaliado por meio desses. No atual estudo, a incidência dos AIGs foi de 76,6%. A literatura relata que os AIGs oscilam em torno de 86,6%.20 A metformina mostrou‐se muito satisfatória nesse quesito, pois demonstrou uma chance duas vezes maior de favorecer o nascimento de RN AIG.
Parto prematuro espontâneo e clinicamente indicado ocorre mais frequentemente em gestantes diabéticas do que em não diabéticas.5 Recém‐nascido prematuro tem maior taxa de mortalidade infantil e morbidade em comparação com crianças nascidas a termo. As complicações da prematuridade em curto prazo estão relacionadas com o aparelho cardiovascular e respiratório.21 Como complicação de longo prazo podem ocorrer desordens no desenvolvimento neurológico, como paralisia cerebral.22 A criança que nasce prematura tem chances maiores de desenvolver hipertensão, obesidade e doenças cardiovasculares na vida adulta.23
A percentagem de recém‐nascidos prematuros no presente estudo foi de 7,1%. Em outros estudos a taxa de bebês pré termos variou de 4% a 16%.5,6 O atual estudo mostra que bebês pré‐termos são mais comuns nos filhos de mães tratadas com insulina ou associação de metformina com insulina, quando comparada com a terapêutica dieta. Esses dados corroboram os resultados de um estudo semelhante.6 Além disso, a comparação do desfecho prematuridade entre tratamento dieta e metformina não demonstrou diferença significativa,6 assim como o presente estudo.
Devido às diversas complicações que o filho de mãe com diabetes gestacional está sujeito, em certas ocasiões se faz necessário um cuidado mais intensivo. Os motivos de internação em UTI neonatal podem ser por anomalias congênitas – como malformações cardiovasculares – prematuridade, asfixia perinatal, angústia respiratória, complicações metabólicas (hipoglicemia, hipocalcemia, policitemia, hiperbilirrubinemia), entre outros.5 Em nosso estudo a taxa de internação em UTI foi de 5,1%. Esse valor corrobora outros valores encontrados na literatura (2% a 6%),1,20 mas também discorda de outros, nos quais a necessidade de internação em UTI variou de 15%6 a 23,5%.5
No presente estudo a modalidade de tratamento não interferiu na necessidade de cuidados intensivos especiais, enquanto que outros autores encontraram como resultado que os bebês de mulheres tratadas com insulina tiveram maiores taxas de admissões neonatais em UTI quando comparados com os de gestantes que fizeram tratamento com metformina ou dieta.6
Uma vez que a gestante diabética tem maior risco de gerar um filho GIG, a indicação de partos cesáreos pode aumentar. O objetivo dessa via de parto é impedir o trauma durante o nascimento de bebês com peso estimado maior ou igual a 4.500 gramas.17
O percentual de partos cesáreos no estudo foi de 52,1%. Esse dado é semelhante à porcentagem de cesáreas nos estudos brasileiros,24,25 mas no cenário internacional as taxas são menores.6,26 Essa diferença talvez seja devido à disseminação da prática de cesariana no Brasil, diferentemente de outros países. As modalidades de tratamento do DMG não interferiram na via de parto. Em contrapartida, outro estudo demonstrou que a cesárea foi mais prevalente nas mulheres tratadas com insulina.6
O boletim de Apgar é usado como metodologia de avaliação da qualidade do nascimento do RN entre o primeiro e o quinto minuto de vida.27 Serve para avaliar o ajuste imediato do RN à vida extrauterina e analisar as condições de vitalidade. Consiste na avaliação de cinco itens do exame físico do recém‐nascido: frequência cardíaca, esforço respiratório, tônus muscular, irritabilidade reflexa e cor da pele.27
O boletim Apgar do primeiro minuto é considerado um diagnóstico da situação presente, índice que pode traduzir sinal de asfixia e da necessidade de ventilação mecânica.27 Já o Apgar do quinto minuto é considerado mais acurado, leva ao prognóstico da saúde neurológica e a desfechos como sequela neurológica ou morte.27
Em nossa população, da mesma forma que em outros estudos,5,26 não houve aumento de risco de Apgar baixo, tanto no primeiro quanto no quinto minuto, conforme a terapêutica usada. Isso pode demonstrar o sucesso no atendimento oferecido aos RNs das gestantes diabéticas.28
Os desfechos via de parto cesariana e índices de Apgar no primeiro e quinto minutos e necessidade de internação em UTI não foram diferentes entre os tratamentos usados.
Devido à metodologia usada no estudo, há certa limitação na comparação dos resultados, uma vez que poucos estudos usaram o mesmo método. Outro ponto a ser destacado é a heterogeneidade das participantes de cada grupo de modalidade terapêutica, isso porque cada tratamento visa a um perfil de gestante distinto.
O estudo conclui que o pediatra presente na sala de parto pode esperar diferentes desfechos para o filho de mãe diabética com base no tratamento que ela recebeu durante a gestação. Mulheres tratadas com metformina têm menores chances de ter filhos PIGs e, ainda, uma chance maior de ter um filho AIG. A gestante que foi tratada com insulina tem menor chance de ter um filho prematuro. Já se o tratamento do DMG foi feito com a associação de insulina com metformina, é esperado que o filho dessa gestante tenha maior chance de nascer GIG e menor chance de nascer prematuro.
Para os demais desfechos avaliados (via de parto, boletim de Apgar e necessidade de internação em UTI) não houve diferença entre as modalidades de tratamento.
Conflitos de interesseOs autores declaram não haver conflitos de interesse.
À Maternidade Darcy Vargas.
Como citar este artigo: Silva AL, Amaral AR, Oliveira DS, Martins L, Silva MR, Silva JC. Neonatal outcomes according to different therapies for gestational diabetes mellitus. J Pediatr (Rio J). 2017;93:87–93.
Estudo vinculado à Maternidade Darcy Vargas, Joinville, SC, Brasil.