This study aimed to identify markers of metabolic syndrome (MS) in patients with phenylketonuria (PKU).
MethodsThis was a cross‐sectional study consisting of 58 PKU patients (ages of 4‐15 years): 29 patients with excess weight, and 29 with normal weight. The biochemical variables assessed were phenylalanine (phe), total cholesterol, HDL‐c, triglycerides, glucose, and basal insulin. The patients had Homeostasis Model Assessment (HOMA) and waist circumference assessed.
ResultsNo inter‐group difference was found for phe. Overweight patients had higher levels of triglycerides, basal insulin, and HOMA, but lower concentrations of HDL‐cholesterol, when compared to the eutrophic patients. Total cholesterol/HDL‐c was significantly higher in the overweight group. A positive correlation between basal insulin level and HOMA with waist circumference was found only in the overweight group.
ConclusionThe results of this study suggest that patients with PKU and excess weight are potentially vulnerable to the development of metabolic syndrome. Therefore, it is necessary to conduct clinical and laboratory monitoring, aiming to prevent metabolic changes, as well as excessive weight gain and its consequences, particularly cardiovascular risk.
Determinar marcadores bioquímicos da síndrome metabólica em pacientes com PKU.
MétodosForam avaliados dois grupos de pacientes com PKU, de quatro a 15 anos, com excesso de peso (29) e eutróficos (29). As variáveis bioquímicas avaliadas foram fenilalanina (phe), colesterol total, HDL‐c, triglicérides, glicose e insulina basal. Foi determinado o Homa e mensurada a circunferência da cintura.
ResultadosAs concentrações de phe, de colesterol total e de glicose foram equivalentes entre os grupos. Os pacientes com excesso de peso apresentaram maiores concentrações de triglicérides, de insulina basal, maiores valores da determinação do Homa, menores concentrações de HDL colesterol e valores mais elevados da relação do colesterol total/HDL‐c. Houve correlação positiva entre a dosagem de insulina basal e do Homa com a circunferência da cintura nos pacientes do grupo com excesso de peso.
ConclusõesOs resultados deste estudo sugerem que pacientes com PKU e excesso de peso são potencialmente vulneráveis ao desenvolvimento da síndrome metabólica. Há, portanto, necessidade de acompanhamento clínico‐laboratorial que previna as alterações metabólicas, o ganho excessivo de peso e as suas consequências, em especial o risco cardiovascular.
A fenilcetonúria (PKU), erro inato do metabolismo de aminoácidos caracterizado pela perda ou diminuição da atividade da enzima fenilalanina hidroxilase, tem como consequência a elevação das concentrações sanguíneas de fenilalanina e de seus metabólitos. Daí resultam lesões neurológicas que culminam em retardo mental irreversível.1,2 O controle da doença é feito pela prescrição de dieta isenta em proteínas de origem animal e restrita em proteínas vegetais. Em razão da qualidade da alimentação, alguns estudiosos têm relacionado a fenilcetonúria à tendência de ganho excessivo de peso e à síndrome metabólica (SM).3–6 Por outro lado, o excesso de peso e as alterações metabólicas a ele associadas têm sido relacionados a risco cardiovascular elevado, o que tem alertado pesquisadores em todo o mundo para a importância da identificação precoce e da prevenção de danos entre as populações de risco.7–11
Pelas particularidades da alimentação, os fenilcetonúricos podem ser considerados como grupo vulnerável a alterações metabólicas e ao excesso de peso. A restrição proteica favorece – e até mesmo estimula – o consumo de alimentos ricos em carboidratos (especialmente os simples) e em lipídios, em particular, e aumenta o risco de ganho de peso.
A síndrome metabólica estaria presente nessa população em decorrência tanto da própria doença quanto da alimentação. A detecção de parâmetros que identificam a presença da SM pode prevenir o aparecimento nesses pacientes de outras doenças, como, por exemplo, a diabete e as doenças cardiovasculares. A International Diabetes Federation (IDF) considera que a medida da circunferência da cintura (CC), associada às determinações das concentrações do HDL colesterol (HDLc), dos triglicérides (TG) e da glicose, constitui parâmetro para a identificação da síndrome metabólica. Essa seria definida por medidas da CC acima do percentil 90 associadas a, pelo menos, dois dos seguintes achados: concentrações elevadas de TG, redução do HDLc, aumentos da pressão arterial e da glicemia de jejum.11
O estudo em tela buscou determinar alguns marcadores da SM nos pacientes com fenilcetonúria atendidos no Serviço Especial de Genética do Hospital das Clínicas da Universidade Federal de Minas Gerais (SEG‐HC‐UFMG), com vistas a identificar riscos e a promover melhor controle clínico‐laboratorial e à adoção de protocolos especiais para prevenção de danos cardiovasculares.
MetodologiaFoi desenvolvido um estudo de série de casos que envolveu 58 crianças e adolescentes de quatro a 15 anos com fenilcetonúria. A coleta de dados foi feita entre outubro/2008 e novembro/2009. Os pacientes foram selecionados, agendados e submetidos as avaliações clínicas e laboratoriais.
O estudo foi aprovado pelo Comitê de Ética em Pesquisa da Universidade Federal de Minas Gerais (COEP‐UFMG). O termo de Consentimento Livre e Esclarecido (TCLE) foi assinado por um dos pais, responsável legal e/ou pelos fenilcetonúricos maiores de seis anos, após os devidos esclarecimentos.
Os grupos foram definidos de acordo com o Índice de Massa Corporal (IMC) calculado de acordo com a fórmula: IMC=peso (Kg) / altura2 (m). O valor obtido foi avaliado mediante o uso das curvas de crescimento da Organização Mundial de Saúde (OMS) para crianças até cinco anos (2006) e de cinco a 19 anos (2007), considerando‐se como pontos de corte para sobrepeso e obesidade IMC > 85 e p > 97, respectivamente. Os grupos foram assim constituídos: 29 pacientes eutróficos e 29 com excesso de peso.
As medidas da circunferência da cintura foram analisadas de acordo com o percentil sugerido por MacCarthy et al.7
Para feitura dos exames laboratoriais, os pacientes foram submetidos a 10 horas de jejum que não podia ultrapassar 14 horas. Foram determinadas as concentrações séricas de fenilalanina (phe‐jejum), colesterol total, HDL‐c, triglicérides, glicose e insulina basal. Os lípides e a glicose foram analisados por método enzimático, por meio da técnica de química seca. A resistência à insulina foi calculada pelo modelo matemático de Matthews et al.12 As dosagens dos lipídios foram avaliadas de acordo com a I Diretriz de aterosclerose na infância e adolescência.13 A média de fenilalanina (phe‐controle) foi determinada pela média aritmética das 12 últimas dosagens e foi considerada inadequada quando superior ao valor máximo de referência para a faixa etária.14 As dosagens de fenilalanina foram obtidas por ultramicrofluorimetria, pelo método UMTEST PKU.15
Os resultados obtidos foram armazenados, tabulados em planilha de dados eletrônicos e analisados por meio do programa estatístico SPSS versão 15.0. A distribuição da amostra foi verificada por meio do teste de Shapiro‐Wilk. Para as variáveis com distribuição normal, foi usado o teste t de Student e para aquelas sem distribuição normal foi usado o teste não paramétrico de Mann‐Whitney. A análise de associação foi feita com uso do teste qui‐quadrado de Pearson e a análise de correlação pelo teste de Spearman.
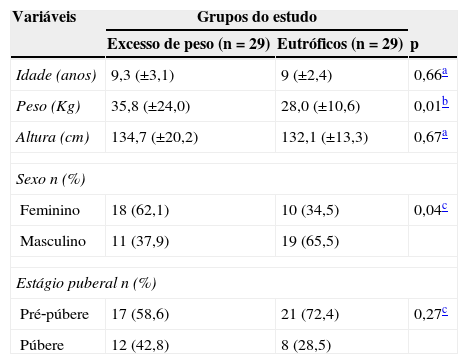
ResultadosAs características antropométricas e a distribuição por sexo e por estágio puberal de cada grupo estão descritos na tabela 1.
Caracterização dos dois grupos de pacientes com fenilcetonúria, entre quatro e 15 anos, participantes do estudo
| Variáveis | Grupos do estudo | ||
|---|---|---|---|
| Excesso de peso (n=29) | Eutróficos (n=29) | p | |
| Idade (anos) | 9,3 (±3,1) | 9 (±2,4) | 0,66a |
| Peso (Kg) | 35,8 (±24,0) | 28,0 (±10,6) | 0,01b |
| Altura (cm) | 134,7 (±20,2) | 132,1 (±13,3) | 0,67a |
| Sexo n (%) | |||
| Feminino | 18 (62,1) | 10 (34,5) | 0,04c |
| Masculino | 11 (37,9) | 19 (65,5) | |
| Estágio puberal n (%) | |||
| Pré‐púbere | 17 (58,6) | 21 (72,4) | 0,27c |
| Púbere | 12 (42,8) | 8 (28,5) | |
Os grupos se comportam da mesma maneira em relação ao controle de phe sanguínea. Não houve diferença significativa (p=1) nas médias de phe do indivíduo, 50% de exames estavam adequados nos dois grupos. E nos níveis de phe coletados em jejum (p=0,14), 58,6% de exames estavam adequados no grupo excesso de peso e 41,4% nos eutróficos.
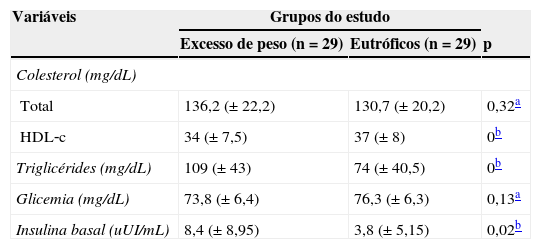
Os pacientes do grupo excesso de peso apresentaram maiores concentrações de triglicérides e de insulina basal, mas menores concentrações de HDL colesterol, quando comparados com os pacientes eutróficos (tabela 2).
Níveis sanguíneos de colesterol total e HDL‐c, triglicérides, glicemia e insulina basal de pacientes com fenilcetonúria com excesso de peso e eutróficos
| Variáveis | Grupos do estudo | ||
|---|---|---|---|
| Excesso de peso (n=29) | Eutróficos (n=29) | p | |
| Colesterol (mg/dL) | |||
| Total | 136,2 (±22,2) | 130,7 (±20,2) | 0,32a |
| HDL‐c | 34 (±7,5) | 37 (±8) | 0b |
| Triglicérides (mg/dL) | 109 (±43) | 74 (±40,5) | 0b |
| Glicemia (mg/dL) | 73,8 (±6,4) | 76,3 (±6,3) | 0,13a |
| Insulina basal (uUI/mL) | 8,4 (±8,95) | 3,8 (±5,15) | 0,02b |
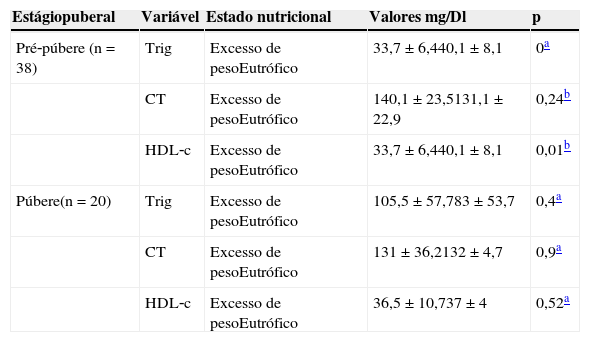
O perfil lipídico dos pacientes, quando analisado de acordo com o estágio puberal, evidenciou dosagens de triglicérides mais elevadas e de HDL‐c mais baixas no grupo de pacientes pré‐púberes e com excesso de peso. Não foram encontradas diferenças, com significância estatística, entre os dois grupos de pacientes na puberdade (tabela 3).
Comparação entre a média ou a mediana dos níveis séricos de triglicérides, colesterol total e HDL‐c em fenilcetonúricos eutróficos e com excesso de peso, de acordo com estágio puberal
| Estágiopuberal | Variável | Estado nutricional | Valores mg/Dl | p |
|---|---|---|---|---|
| Pré‐púbere (n=38) | Trig | Excesso de pesoEutrófico | 33,7±6,440,1±8,1 | 0a |
| CT | Excesso de pesoEutrófico | 140,1±23,5131,1±22,9 | 0,24b | |
| HDL‐c | Excesso de pesoEutrófico | 33,7±6,440,1±8,1 | 0,01b | |
| Púbere(n=20) | Trig | Excesso de pesoEutrófico | 105,5±57,783±53,7 | 0,4a |
| CT | Excesso de pesoEutrófico | 131±36,2132±4,7 | 0,9a | |
| HDL‐c | Excesso de pesoEutrófico | 36,5±10,737±4 | 0,52a |
Trig, triglicérides; CT, colesterol total.
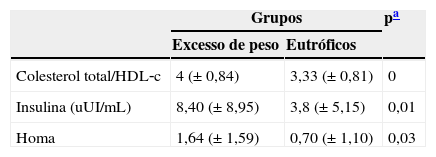
O grupo excesso de peso apresentou valores significativamente mais elevados da relação do colesterol total/HDL‐c, das concentrações sanguíneas de insulina basal e da determinação do Homa (tabela 4).
Comparação entre a relação colesterol total/HDL‐c, os níveis sanguíneos de insulina basal e de Homa em pacientes fenilcetonúricos com excesso de peso e eutróficos
| Grupos | pa | ||
|---|---|---|---|
| Excesso de peso | Eutróficos | ||
| Colesterol total/HDL‐c | 4 (±0,84) | 3,33 (±0,81) | 0 |
| Insulina (uUI/mL) | 8,40 (±8,95) | 3,8 (±5,15) | 0,01 |
| Homa | 1,64 (±1,59) | 0,70 (±1,10) | 0,03 |
Houve correlação positiva entre a dosagem de insulina basal (p=0) e o Homa (p=0,08) com a circunferência da cintura, apenas nos pacientes do grupo com excesso de peso.
DiscussãoO excesso de peso é, na atualidade, problema de saúde pública em grande parte do mundo. No Brasil, a despeito de programas de prevenção empreendidos por gestores e profissionais de saúde, as taxas de prevalência têm aumentado em todas as faixas etárias.16
O interesse pelo tema obesidade em fenilcetonúricos resultou da observação rotineira do atendimento clínico aos pacientes no SEG‐HC/UFMG, confirmada por avaliações feitas em 2007 e 2009. Por meio de investigações transversais, foram identificadas taxas de prevalência de sobrepeso e de obesidade em elevação, que saltaram de 16,8% e 8,8%, respectivamente, em 2007 para 19,8% e 9,6% em 2009.
A ocorrência de excesso de peso em uma população de fenilcetonúricos, cuja dieta é periodicamente acompanhada por nutricionistas, tem uma de suas possíveis justificativas no caráter restritivo e monótono do cardápio, especialmente para crianças maiores e adolescentes, que gozam de autonomia para as escolhas alimentares. As transgressões dietéticas ocasionam, de um lado, variações nos controles laboratoriais da doença a partir dessa faixa etária e, de outro, anormalidades metabólicas que, no médio prazo, podem se traduzir em ganho excessivo de peso e risco cardiovascular aumentado. Estudos diversos confirmam essas dificuldades de controle em pacientes que adquirem autonomia.17–20 Era de se esperar que, também neste estudo, o grupo de pacientes com excesso de peso apresentasse maiores concentrações de phe no sangue – por transgressão dietética – assim como relatado por Mcburnie et al.,3 que poderia justificar o excesso de peso nestes pacientes. Entretanto, verificou‐se que a maioria dos exames médios de phe sanguínea estava elevada nos dois grupos de participantes e na variável phe‐jejum o grupo excesso de peso apresentou maior número de exames adequados. Belanger‐Quintan et al.5 e Rocha et al.20 sugeriram que o excesso de peso dos fenilcetonúricos estava relacionado à gravidade da doença. Como no presente estudo a maioria dos indivíduos participantes nos dois grupos tem a forma grave da doença, não foi possível relacionar o excesso de peso com a gravidade. Portanto, parece que o excesso de peso detectado nesses pacientes não está relacionado necessariamente a transgressão alimentar ou a gravidade da doença.
A não observância ou a inadequação das orientações nutricionais, no tratamento da fenilcetonúria, pode causar anormalidades decorrentes da carência ou do excesso de nutrientes.21‐24 É mais frequente o excesso de peso (e suas consequências). Assim, como demonstrado por Freedman et al.,25 os pacientes com excesso de peso, avaliados nesse estudo, apresentaram correlação positiva entre as medidas da CC e as concentrações de insulina basal e determinações do Homa. As baixas concentrações de colesterol encontradas podem ser explicadas por fatores genéticos, pela inibição da biossíntese de colesterol e ainda pelo uso de dieta vegetariana exclusiva.10,26–29 Os fenilcetonúricos com excesso de peso, além da obesidade central expressa pela CC, apresentaram concentrações sanguíneas elevadas de triglicérides e reduzidas de HDL‐c. Isso sugere a existência da síndrome metabólica.11 Baixas concentrações de HDL‐c e altas concentrações de LDL, mesmo isoladas, têm sido consideradas boas preditoras de risco cardiovascular.29,30
Segundo Burrows et al.,8 crianças e adolescentes têm um risco triplicado de desenvolver SM quando a insulina basal e o Homa são > percentil 75. Nesse estudo, maior percentual de pacientes com valores elevados de insulina basal e Homa foi identificado entre aqueles com excesso de peso e púberes (31% x 14%). As características alimentares dos fenilcetonúricos associadas às mudanças fisiológicas da puberdade podem explicar esses achados, que devem se constituir em fatores de alerta para o diagnóstico de síndrome metabólica. A OMS (Organização Mundial da Saúde)31 e o Egir (Grupo Europeu para o Estudo da Resistência à Insulina)32 consideram a resistência à insulina como um dos marcadores da SM. Nos pacientes com fenilcetonúria e excesso de peso foram encontrados, também, valores elevados de Homa.
Assim como Rocha et al.,20 nossos resultados demonstram que os pacientes com PKU e excesso de peso se comportam da mesma maneira que pessoas obesas sem a doença genética. Entretanto, fenilcetonúricos com excesso de peso podem ser mais suscetíveis à síndrome metabólica (SM) em razão de fatores inerentes a doença. Assim, cabe uma revisão do protocolo de atendimento desses pacientes, caracterizada pela introdução de procedimentos simples, factíveis em qualquer atendimento ambulatorial. Orientações gerais devem enfatizar a necessidade de manutenção da alimentação isenta em fenilalanina, com controle do consumo exagerado de açúcar, e, ainda, a importância da incorporação da atividade física na vida cotidiana, da forma mais adequada a cada indivíduo. O controle clínico deve incluir a medida regular da circunferência da cintura e, quando necessário, o monitoramento das concentrações sanguíneas de colesterol, triglicérides, glicose e insulina basal.
Os pacientes com excesso de peso apresentaram maiores concentrações sanguíneos de triglicérides e insulina basal, maiores valores da relação colesterol total/ HDL‐c e de Homa e menores concentrações de HDL‐c. Os resultados deste estudo sugerem que pacientes com fenilcetonúria e excesso de peso são potencialmente vulneráveis ao desenvolvimento da síndrome metabólica. Há, portanto, necessidade de acompanhamento clínico‐laboratorial que previna as alterações metabólicas, o ganho excessivo de peso e as suas consequências, em especial o risco cardiovascular. Além disso, orientações alimentares específicas devem ser enfatizadas nas consultas de rotina, especialmente para os pacientes que têm excesso de peso, no intuito de prevenir inadequações metabólicas.
FinanciamentoFundação de Amparo à Pesquisa do Estado de Minas Gerais (Fapemig).
Conflitos de interesseOs autores declaram não haver conflitos de interesse.
Como citar este artigo: Kanufre VC, Soares RD, Alves MR, Aguiar MJ, Starling AL, Norton RC. Metabolic syndrome in children and adolescents with phenylketonuria. J Pediatr (Rio J). 2015;91:98–103.
Estudo vinculado ao Núcleo de Ações e Pesquisa em Apoio Diagnóstico (Nupad), Hospital das Clínicas, Universidade Federal de Minas Gerais (UFMG), Belo Horizonte, MG, Brasil.