This systematic review of national or regional guidelines published in English aimed to better understand variance in pre‐hospital and emergency department treatment of status epilepticus.
SourcesSystematic search of national or regional guidelines (January 2000 to February 2017) contained within PubMed and Google Scholar databases, and article reference lists. The search keywords were status epilepticus, prolonged seizure, treatment, and guideline.
Summary of findings356 articles were retrieved and 13 were selected according to the inclusion criteria. In all six pre‐hospital guidelines, the preferred route of medication administration was to use alternatives to the intravenous route: all recommended buccal and intranasal midazolam; three also recommended intramuscular midazolam, and five recommended using rectal diazepam. All 11 emergency department guidelines described three phases in therapy. Intravenous medication, by phase, was indicated as such: initial phase – ten/11 guidelines recommended lorazepam, and eight/11 recommended diazepam; second phase – most (ten/11) guidelines recommended phenytoin, but other options were phenobarbital (nine/11), valproic acid (six/11), and either fosphenytoin or levetiracetam (each four/11); third phase – four/11 guidelines included the choice of repeating second phase therapy, whereas the other guidelines recommended using a variety of intravenous anesthetic agents (thiopental, midazolam, propofol, and pentobarbital).
ConclusionsAll of the guidelines share a similar framework for management of status epilepticus. The choice in route of administration and drug type varied across guidelines. Hence, the adoption of a particular guideline should take account of local practice options in health service delivery.
Esta análise sistemática de diretrizes nacionais ou regionais publicadas em inglês tem como objetivo entender melhor a diferença no tratamento do estado de mal epiléptico pré‐hospitalar e no departamento de emergência.
FontesPesquisa sistemática de diretrizes nacionais ou regionais (janeiro de 2000 a fevereiro de 2017) contidas nas bases de dados do Pubmed e do Google Acadêmico e listas de referência de artigos. As palavras‐chave da busca foram estado de mal epiléptico, convulsão prolongada, tratamento e diretriz.
Resumo dos achadosForam identificados 356 artigos e 13 foram selecionados de acordo com os critérios de inclusão. Em todas as seis diretrizes pré‐hospitalares, o caminho preferencial de administração da medicação foi usar opções à via intravenosa: todas recomendaram midazolam bucal e intranasal; três também recomendaram midazolam intramuscular; e cinco recomendaram usar o diazepam via retal. Todas as 11 diretrizes de departamento de emergência descreveram três fases na terapia. No que diz respeito à medicação intravenosa, por fase, temos: fase inicial – 10/11 diretrizes recomendaram lorazepam e 8/11 recomendaram diazepam; segunda fase – a maioria (10/11) das diretrizes recomendou fenitoína, porém outras opções foram fenobarbital (9/11), ácido valproico (6/11) e fosfenitoína ou levetiracetam (individualmente, 4/11); terceira fase – 4/11 diretrizes incluíram a opção de repetir a terapia da segunda fase, ao passo que as outras diretrizes recomendaram usar diversos agentes anestésicos intravenosos (tiopental, midazolam, propofol e pentobarbital).
ConclusõesTodas as diretrizes compartilham uma estrutura semelhante para manejo do estado de mal epiléptico. A escolha da via de administração e do tipo de medicamento variou em todas as diretrizes. Assim, a adoção de uma diretriz específica deve levar em consideração as opções da prática local na prestação de serviços de saúde.
O estado de mal epiléptico (EME) é definido como “uma condição resultante tanto da falha de mecanismos responsáveis por encerrar convulsões quanto da introdução de mecanismos que levam a convulsões com prolongamento anormal (após o ponto temporal t1) e uma condição que pode ter consequências de longo prazo (após o ponto temporal t2), inclusive morte neuronal, lesão neuronal e alteração de redes neurais, depende do tipo e da duração das convulsões. No caso de EME convulsivo (tônico‐clônico), ambos os pontos temporais (t1 aos 5 minutos e t2 aos 30 minutos) têm como base experimentos animais e pesquisa clínica”.1
Assim, em crianças, há dois subgrupos de pacientes que apresentam convulsão: aqueles com episódios breves com duração < 5 minutos (antes do t1) com alta probabilidade de resolução sem tratamento; e aqueles com episódios com duração > 7 minutos, mais propensos a evoluir para episódios prolongados com necessidade de tratamento agudo para parar a convulsão. O consenso da força‐tarefa da Liga Internacional contra a Epilepsia (ILAE) a respeito da classificação do EME é que o tratamento de crises convulsivas deve, para tanto, ser iniciado aproximadamente aos cinco minutos.1
Este artigo discute algumas das questões relacionadas ao tratamento anticonvulsivo de emergência de convulsões agudas, prolongadas e EME em crianças com ênfase nas diretrizes e protocolos relacionados ao período pré‐hospitalar, aos serviços de emergência médica (SEM) e ao departamento de emergência (DE) usados por sociedades, organizações e autoridades nacionais e regionais. O leitor interessado em outro tipo de manejo, investigações e acompanhamento clínico subsequente no departamento ambulatorial ou pelo médico de atenção primária à saúde deve buscar análises de práticas recentes e as recomendações da Academia Americana de Neurologia.2,3
MétodosFonte de dadosFoi feita uma análise sistemática de artigos disponíveis nos bancos de dados do Pubmed e do Google Acadêmico. Listas de referência de artigos identificados também foram verificadas. A estratégia de busca incluiu a combinação das seguintes palavras‐chave em inglês: estado de mal epiléptico, convulsão prolongada, tratamento e diretriz.
Critérios de seleçãoNesta análise qualitativa, selecionamos artigos para consideração com o uso da declaração de 2009 do grupo de Itens de Relatório Preferidos para Análises Sistemáticas e Metanálise (Prisma).4 Os artigos publicados foram incluídos em nossa análise quando atendiam aos seguintes critérios: 1) Protocolo ou diretriz sobre o uso de tratamento com medicamentos anticonvulsivos para convulsão prolongada ou EME publicados de 1° de janeiro de 2000 a 28 de fevereiro de 2017; 2) Publicação que incluiu uma diretriz nacional ou regional para a população pediátrica no ambiente de SEM ou DE; e 3) nos casos em que mais de um artigo da mesma organização ou sociedade foi identificado, incluímos a publicação mais recente.
Todos os artigos que atenderam aos critérios de inclusão foram submetidos à extração de dados e à avaliação crítica de cada autor. As principais características foram resumidas após a extração de dados, consistiram em: autoria; período de manejo, SEM ou DE; período do tratamento; e medicação recomendada e via de administração.
Síntese/análise de dadosA estratégia de busca dos bancos de dados identificou 356 títulos listados. Cada resumo foi examinado e 344 foram excluídos porque não atendiam aos critérios de inclusão. Doze artigos foram elegíveis para análise completa e suas listas de referência identificaram mais um artigo. Assim, 13 artigos foram incluídos na síntese qualitativa e os achados foram analisados descritivamente5–17
Resultados e discussãoA tabela 1 descreve as características das diretrizes de tratamento. A tabela 2 apresenta o uso de medicamentos anticonvulsivos imediatos (“STAT” ou statim [Latim]) por tipo, dosagem e via de administração abordados nas diretrizes. É evidente que as diretrizes não recomendam exatamente a mesma dosagem para cada medicamento anticonvulsivo. Contudo, essas diferenças poderão ser devidas a preferências regionais, histórico ou experiência. Os desenvolvedores de novas diretrizes devem levar em consideração a dosagem e a dosagem máxima recomendada, bem como quaisquer novos estudos clínicos sobre medicamentos publicados após 2017.
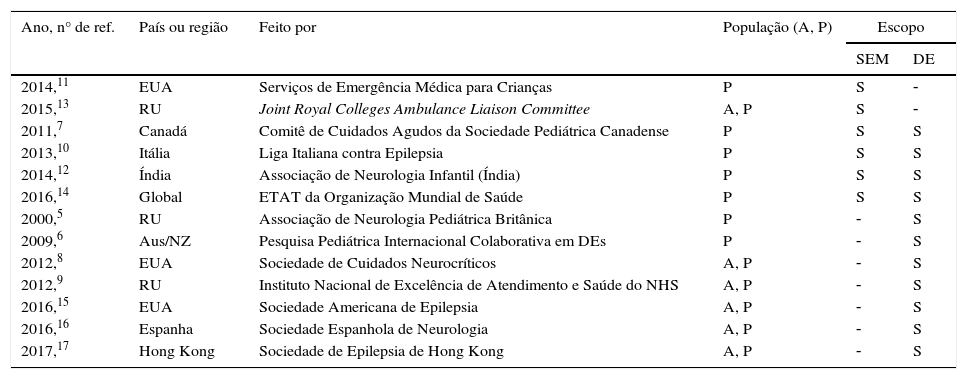
Características da diretriz ou protocolo
| Ano, n° de ref. | País ou região | Feito por | População (A, P) | Escopo | |
|---|---|---|---|---|---|
| SEM | DE | ||||
| 2014,11 | EUA | Serviços de Emergência Médica para Crianças | P | S | ‐ |
| 2015,13 | RU | Joint Royal Colleges Ambulance Liaison Committee | A, P | S | ‐ |
| 2011,7 | Canadá | Comitê de Cuidados Agudos da Sociedade Pediátrica Canadense | P | S | S |
| 2013,10 | Itália | Liga Italiana contra Epilepsia | P | S | S |
| 2014,12 | Índia | Associação de Neurologia Infantil (Índia) | P | S | S |
| 2016,14 | Global | ETAT da Organização Mundial de Saúde | P | S | S |
| 2000,5 | RU | Associação de Neurologia Pediátrica Britânica | P | ‐ | S |
| 2009,6 | Aus/NZ | Pesquisa Pediátrica Internacional Colaborativa em DEs | P | ‐ | S |
| 2012,8 | EUA | Sociedade de Cuidados Neurocríticos | A, P | ‐ | S |
| 2012,9 | RU | Instituto Nacional de Excelência de Atendimento e Saúde do NHS | A, P | ‐ | S |
| 2016,15 | EUA | Sociedade Americana de Epilepsia | A, P | ‐ | S |
| 2016,16 | Espanha | Sociedade Espanhola de Neurologia | A, P | ‐ | S |
| 2017,17 | Hong Kong | Sociedade de Epilepsia de Hong Kong | A, P | ‐ | S |
A, adulto; Aus/NZ, Austrália e Nova Zelândia; DE, Departamento de Emergência; ETAT, avaliação de triagem e tratamento de emergência pediátrica; EUA, Estados Unidos da América; NHS, Serviço Nacional de Saúde; P, pediátrico; RU, Reino Unido; S, sim; SEM, Serviços de Emergência Médica.
Medicamentos anticonvulsivos imediatos normalmente usados, via de administração e dosagem
| Medicamento | Via de administração | |||
|---|---|---|---|---|
| Retal | Bucal (B)/Intranasal (N) | Intraóssea (IA)/Intramuscular (IM) | Intravenosa | |
| Diazepam | Bólus | Bólus | Bólus | |
| 0,2‐0,5 mg/kg/dose15,17 | IO: 0,25 mg/kg x2 doses6 | 0,15‐0,2 mg/kg x2 doses15,17 | ||
| 0,5 mg/kg/dose5,6 | 0,2‐0,3 mg/kg x2 doses12 | |||
| 0,5 mg/kg x 2 doses7 | 0,25 mg/kg x2 doses6 | |||
| 0,3 mg/kg x2 dose7 | ||||
| 0,5 mg/kg10 | ||||
| Dose máxima | Dose máxima | |||
| 10 mg;6 20 mg15,17 | < 5 anos, 5 mg;7 ≥ 5 anos, 10 mg;7 10 mg10,12,15,17 | |||
| Lorazepam | Bólus | Bólus | Bólus | |
| 0,1 mg/kg x2 doses7 | B: 0,1 mg/kg x2 doses7,10 | 0,1 mg/kg x2 doses5,7,10,12,15,17 | ||
| Dose máxima | Dose máxima | Dose máxima | ||
| 4 mg7 | B: 2,5 mg10; 4 mg7 | 4 mg5,7,10,12,15,17 | ||
| Midazolam | Bólus | Bólus | Bólus | |
| B: 5‐10 mg17 | IO: 0,15 mg/kg x2 doses6 | 0,15 mg/kg x2 doses6 | ||
| IN: 0,2 mg/kg7 | IM: 0,15 mg/kg x 2 doses6 | 0,15‐0,2 mg/kg x2 doses12 | ||
| IM: 0,2 mg/kg x 2 doses7,10 | 0,2 mg/kg x2 doses10 | |||
| Dose máxima | ||||
| IN: 5 mg/nostril7 | Dose máxima | |||
| IM: 5 mg;10 13‐40kg, 5 mg;15 > 40kg, 10 mg;15 10 mg17 | ||||
| Fosfenitoína | Bólus | Bólus | ||
| (EF, equivalentes da fenitoína) | IM: 20mg PE/kg7 | 20mg PE/kg7,12,15 | ||
| Dose máxima | Dose máxima | |||
| IM: 1000mg PE7 | 1000mg PE;7 1500mg PE15 | |||
| Fenitoína | Bólus | Bólus | ||
| IO: 20 mg/kg6 | 15‐20 mg/kg16,17 | |||
| 18 mg/kg5 | ||||
| Dose máxima | 18‐20 mg/kg10 | |||
| IO: 1000 mg7 | 20 mg/kg6,7,12 | |||
| Dose máxima | ||||
| 1000 mg11,16 | ||||
| Fenobarbital | Bólus | |||
| 10‐20 mg/kg16 | ||||
| 15 mg/kg/dose15,17 | ||||
| 15‐20 mg/kg10 | ||||
| 20 mg/kg6,12 | ||||
| Dose máxima | ||||
| 1000 mg10 | ||||
| Ácido valproico | Bólus | |||
| 20 mg/kg12 | ||||
| 25‐45 mg/kg16 | ||||
| 30‐45 mg/kg10 | ||||
| 40 mg/kg15,17 | ||||
| Dose máxima | ||||
| 1500 mg;10 3000 mg15,17 | ||||
| Levetiracetam | Bólus | |||
| 20 mg/kg16 | ||||
| 20‐30 mg/kg12 | ||||
| 60 mg/kg15,17 | ||||
| Dose máxima | ||||
| 4500 mg15,17 | ||||
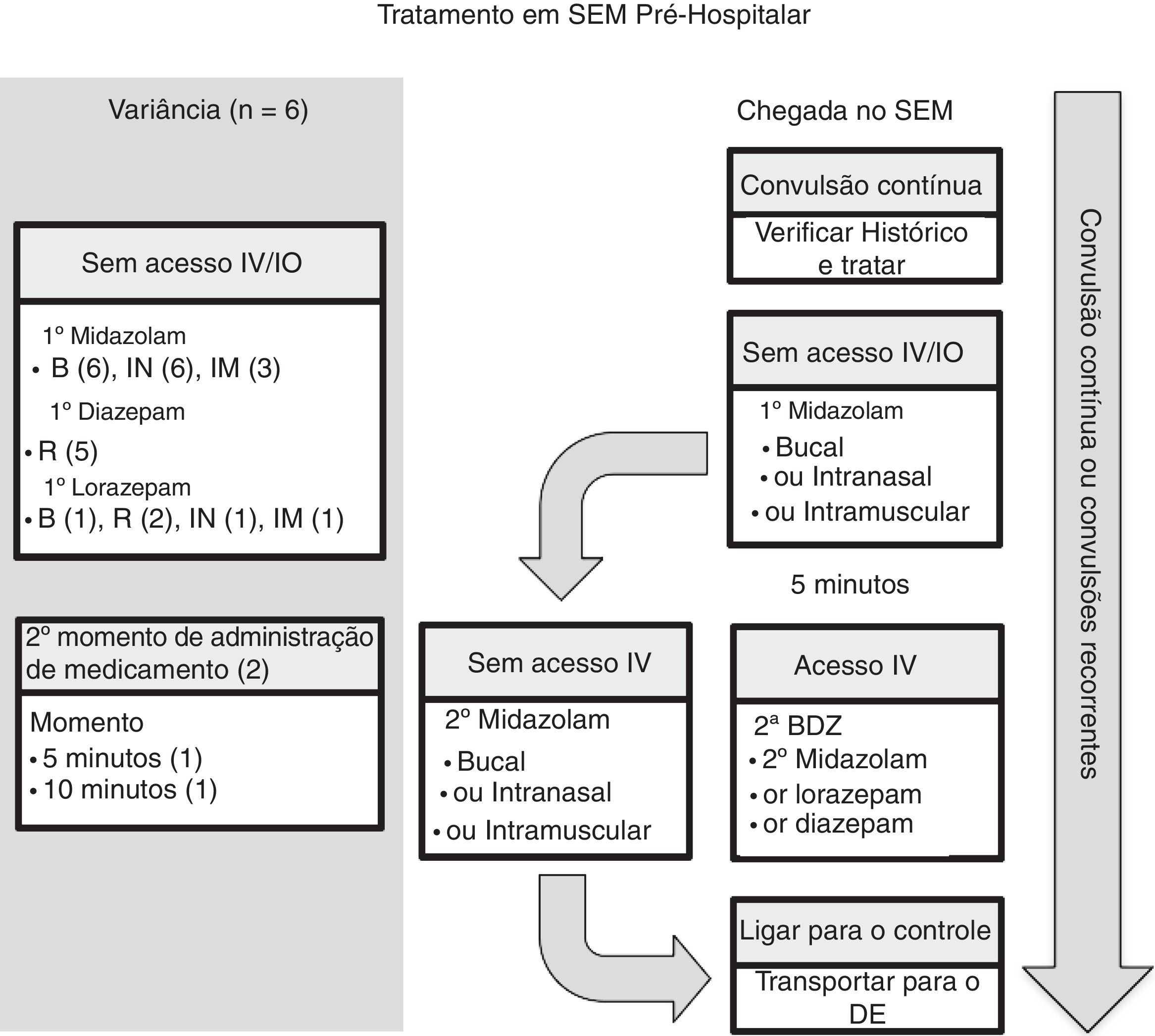
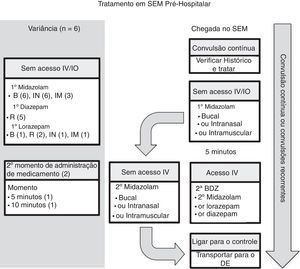
Seis diretrizes tiveram como foco o manejo nos SEM.7,10–14 Na figura 1, selecionamos o algoritmo pelos Serviços de Emergência Médica para Crianças (SEMC) para comparação.11 Essa diretriz foi aplicada a crianças com convulsão testemunhada não relacionada a trauma e que ainda ocorressem no momento da chegada ao SEM.
Tratamento de SEM pré‐hospitalares.
B, bucal; BDZ, benzodiazepina; DE, departamento de emergência; SEM, sistema de emergência médica; IO, intraóssea; IN, intranasal; IM, intramuscular; IV, intravenosa; R, retal.
Nota: O número entre parênteses é o número da diretriz, entre seis diretrizes nessa categoria (veja o texto para obter mais detalhes).
No geral, todas as seis diretrizes recomendaram midazolam bucal ou midazolam intranasal e três recomendaram midazolam intramuscular.10,11,14 Cinco diretrizes recomendaram diazepam retal como opção.7,10,12–14 Uma segunda dose de benzodiazepina foi recomendada em duas das diretrizes, uma aos cinco minutos11 e outra aos 10.13 Todas as diretrizes declararam preferência por vias de administração não intravenosas opcionais em vez de acesso intravenoso na chegada. Duas das diretrizes11,13 recomendaram tentar o acesso intravenoso ou intraósseo em situações específicas. Por fim, apenas uma das diretrizes forneceu critérios para transferência do paciente para o DE.13
Comentário sobre diretrizes de SEM pré‐hospitalaresAo considerar as seis diretrizes pré‐hospitalares, o midazolam via bucal ou intranasal foi recomendado por todas elas. Essa diretriz provavelmente reflete a eficácia do midazolam em comparação com o diazepam e a facilidade de administração por essas vias de acesso. Contudo, o diazepam retal ainda aparecia na maioria das diretrizes pré‐hospitalares. O midazolam bucal é mais efetivo do que o diazepam retal para interromper convulsões e reduzir sua recorrência em até uma hora de acometimento e tão seguro quanto o diazepam retal com relação à incidência de depressão respiratória.18 A eficácia do midazolam intranasal é semelhante ou mais efetiva do que o diazepam retal. O midazolam intranasal também tem um tempo de administração mais curto e uma ação mais rápida para interromper a convulsão do que o diazepam retal. O midazolam intranasal é de fácil administração, porém tem um breve efeito nasal irritante. A análise sistemática mostra que o midazolam, por qualquer via, é melhor para interromper a convulsão do que o diazepam, por qualquer via.19
Além da eficácia e fácil administração, a benzodiazepina não intravenosa depende da disponibilidade, da experiência e da preferência do local. Por exemplo, de acordo com Osborne et al.,13 as ambulâncias no Reino Unido não dispunham de midazolam, então a equipe de SEM administraria o midazolam bucal ou intranasal do próprio paciente, caso disponível, do contrário, o diazepam retal seria usado devido à dificuldade do acesso intravenoso em crianças. Por razões semelhantes, o diazepam retal normalmente estava disponível e foi recomendado na diretriz pré‐hospitalar da Liga Italiana contra Epilepsia.10 A diretriz14 da avaliação de triagem e tratamento de emergência (ETAT) da Organização Mundial de Saúde (OMS) recomenda que quando as preparações oral e intranasal do midazolam e do lorazepam não estiverem prontamente disponíveis, especialmente em ambientes com recursos limitados, as preparações intravenosas disponíveis podem ser administradas pelas vias oral ou intranasal. Por fim, o midazolam intramuscular foi recomendado em três das seis diretrizes.10,11,14 Essa administração exige experiência adicional, é efetiva e segura. Por exemplo, no Teste de Medicação Anticonvulsiva Rápida Antes da Chegada (Rampart), o midazolam intramuscular foi tão efetivo quanto o lorazepam intravenoso no ambiente pré‐hospitalar.20 Houve taxas semelhantes de intubação endotraqueal e recorrência de convulsões nos grupos do midazolam e do lorazepam. No geral, todas as diretrizes recomendaram a via de administração não intravenosa.
Duas das diretrizes recomendaram tentar o acesso intravenoso ou intraósseo apenas em situações específicas.11,13 O algoritmo pelos SEMC11 nos Estados Unidos considera obter acesso intravenoso ou intraósseo quando o tempo de transporte esperado for longo ou quando exigido para outros aspectos do cuidado do paciente, como fluido intravenoso ou outros medicamentos. O algoritmo13 pelo Joint Royal Colleges Ambulance Liaison Committee (JRCALC) do Reino Unido recomenda uma segunda dose de diazepam caso a convulsão continue após o diazepam retal, deve ser administrada por via intravenosa ou intraóssea. Contudo, conseguir acesso intravenoso pode ser difícil em uma criança com convulsão contínua no ambiente pré‐hospitalar. Isso exige prestadores de SEM treinados e equipamentos que poderão não ser encontrados em ambientes com recursos limitados (consulte a diretriz da ETAT14). Além disso, a convulsão poderá parar antes de obter acesso intravenoso, tornar o procedimento desnecessário;11 o tempo necessário para obter acesso intravenoso poderá prolongar o tempo na cena e atrasar a administração de medicamentos.13
Duas das diretrizes recomendaram administrar uma segunda dose de benzodiazepinas no ambiente pré‐hospitalar.11,13 As outras quatro diretrizes não incluíram essa opção. Recomenda‐se manter as vias aéreas, a respiração e a circulação adequadas enquanto o paciente é transferido para o DE,7,10,12,13 bem como entrar em contato com o centro de controle médico para obter orientação.11 Uma diretriz forneceu orientação sobre critérios para transferência para o hospital. A diretriz13 do JRCALC recomenda a transferência para o hospital em casos de crianças com menos de um ano, crianças em sua primeira convulsão ou primeira convulsão febril e casos de convulsões sucessivas ou dificuldade de monitoramento. A diretriz13 do JRCALC também recomenda uma transferência de tempo crítico para o hospital caso quaisquer dos seguintes sinais sejam observados: dificuldade com problemas nas vias aéreas, na respiração, na circulação ou de deficiência; lesão séria na cabeça; EME após falha no tratamento; ou infecção subjacente.
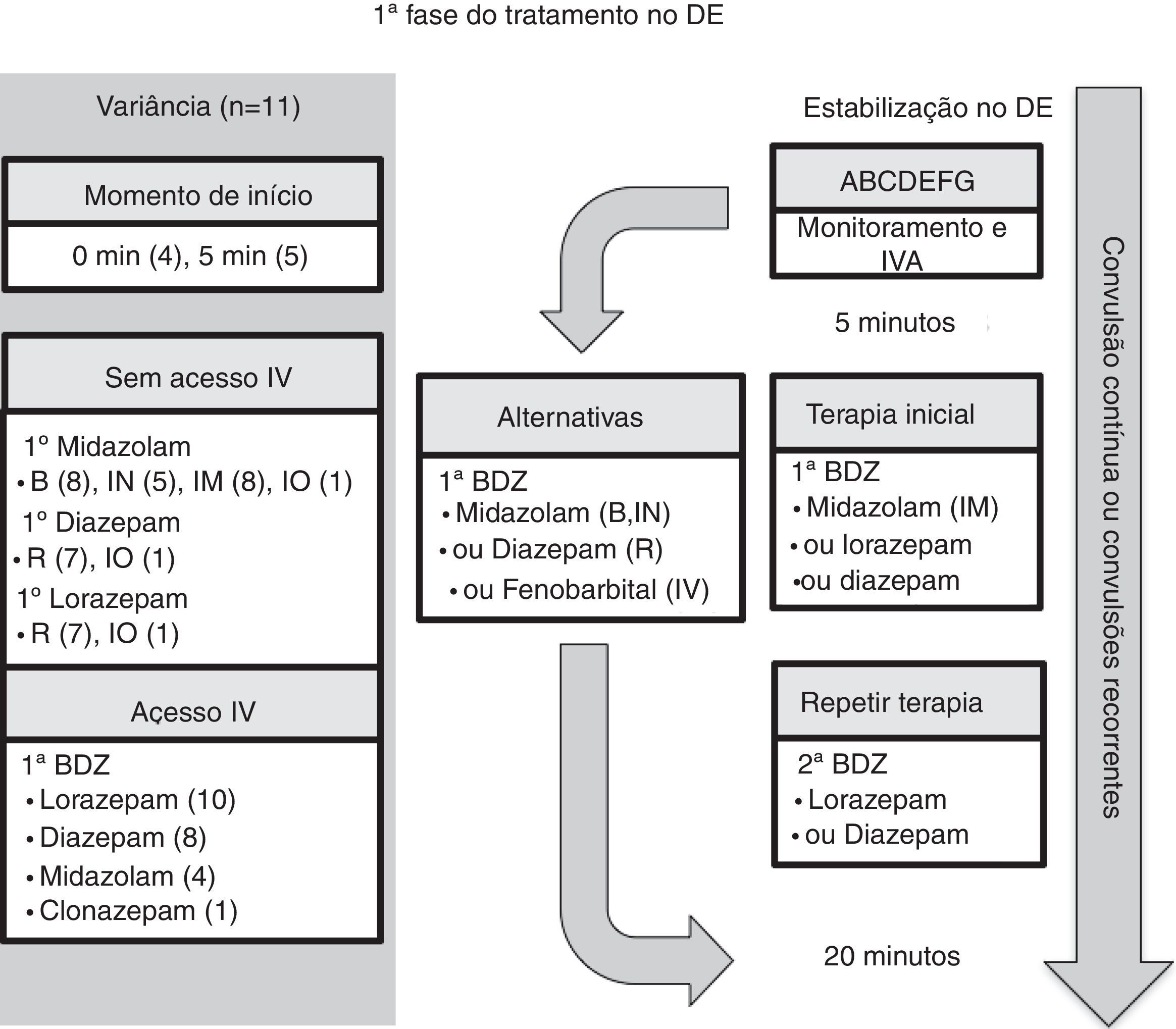
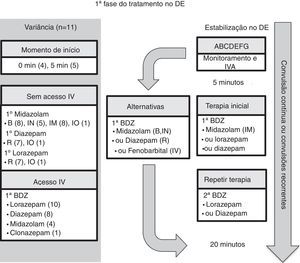
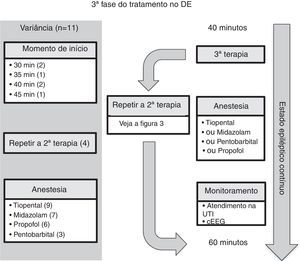
Manejo no departamento de emergênciaOnze diretrizes tiveram como foco o manejo no DE.5–10,12,14–17 Para comparação, selecionamos o algoritmo da Sociedade Americana de Epilepsia (AES) com relação à crise convulsiva com duração de pelo menos cinco minutos.15 A estrutura desse algoritmo segue três fases de terapia (figuras 2–4 e tabela 3). A primeira fase de terapia é a estabilização inicial e a administração de uma benzodiazepina. A segunda fase de terapia é a administração de um segundo medicamento anticonvulsivo que não seja a benzodiazepina em caso de falha das benzodiazepinas. A terceira fase de terapia é a administração de um anestésico geral no apoio de terapia intensiva quando o EME se tornar resistente a pelo menos dois medicamentos anticonvulsivos da primeira e da segunda fases da terapia.
Primeira fase do tratamento no DE.
ABCDEFG, suporte de estabilização com intervenção de vias aéreas, respiração, circulação, dextrose, neurologia essencial, fluidos, quadro geral; BDZ, benzodiazepina; DE, departamento de emergência; SEM, sistema de emergência médica; IO, intraóssea; IN, intranasal; IM, intramuscular; IV, intravenosa; IVA, acesso intravenoso; R, retal.
Nota: O número entre parênteses é o número da diretriz, entre 11 diretrizes nessa categoria (veja o texto para obter mais detalhes).
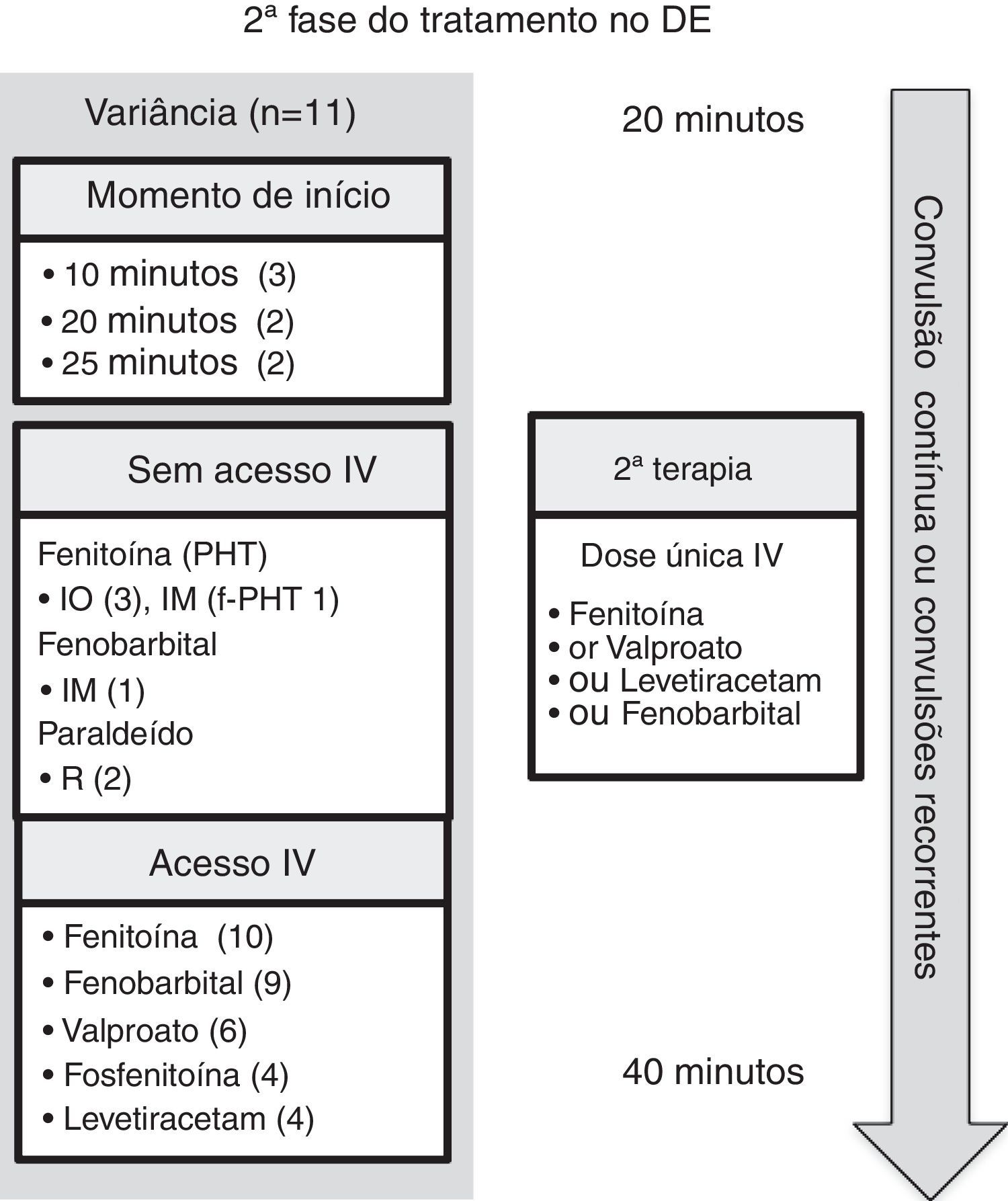
Segunda fase do tratamento no DE.
DE, departamento de emergência; f‐PHT, fosfenitoína; IO, intraóssea; IN, intranasal; IM, intramuscular; IV, intravenosa; R, retal.
Nota: O número entre parênteses é o número da diretriz, entre onze diretrizes nessa categoria (veja o texto para obter mais detalhes).
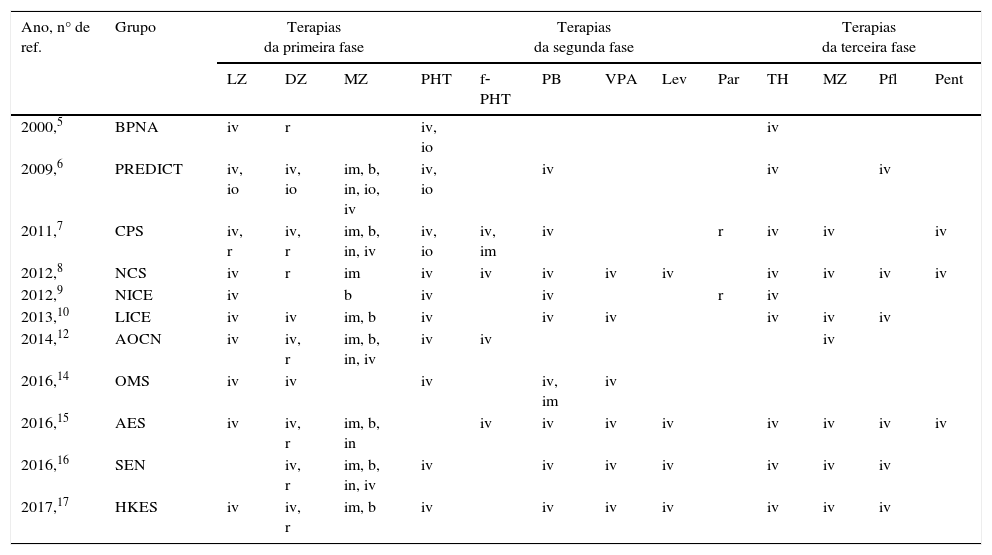
Comparação de medicamentos anticonvulsivos usados em cada uma das três fases de terapia e suas vias de administração (veja também as tabelas 1 e 2)
| Ano, n° de ref. | Grupo | Terapias da primeira fase | Terapias da segunda fase | Terapias da terceira fase | ||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| LZ | DZ | MZ | PHT | f‐PHT | PB | VPA | Lev | Par | TH | MZ | Pfl | Pent | ||
| 2000,5 | BPNA | iv | r | iv, io | iv | |||||||||
| 2009,6 | PREDICT | iv, io | iv, io | im, b, in, io, iv | iv, io | iv | iv | iv | ||||||
| 2011,7 | CPS | iv, r | iv, r | im, b, in, iv | iv, io | iv, im | iv | r | iv | iv | iv | |||
| 2012,8 | NCS | iv | r | im | iv | iv | iv | iv | iv | iv | iv | iv | iv | |
| 2012,9 | NICE | iv | b | iv | iv | r | iv | |||||||
| 2013,10 | LICE | iv | iv | im, b | iv | iv | iv | iv | iv | iv | ||||
| 2014,12 | AOCN | iv | iv, r | im, b, in, iv | iv | iv | iv | |||||||
| 2016,14 | OMS | iv | iv | iv | iv, im | iv | ||||||||
| 2016,15 | AES | iv | iv, r | im, b, in | iv | iv | iv | iv | iv | iv | iv | iv | ||
| 2016,16 | SEN | iv, r | im, b, in, iv | iv | iv | iv | iv | iv | iv | iv | ||||
| 2017,17 | HKES | iv | iv, r | im, b | iv | iv | iv | iv | iv | iv | iv | |||
Grupos: AES, Sociedade Americana de Epilepsia; AOCN, Associação de Neurologia Infantil (Índia); BPNA, Associação de Neurologia Pediátrica Britânica; CPS, Sociedade Pediátrica Canadense; HKES, Sociedade de Epilepsia de Hong Kong; LICE, Liga Italiana contra Epilepsia; NCS, Sociedade de Cuidados Neurocríticos; NICE, Instituto Nacional de Excelência de Atendimento e Saúde do Serviço Nacional de Saúde; OMS, Organização Mundial de Saúde; Predict, Pesquisa Pediátrica Internacional Colaborativa em Departamentos de Emergência; SEN, Sociedade Espanhola de Neurologia.
Terapias: DZ, diazepam; f‐PHT, fosfenitoína; Lev, levetiracetam; LZ, lorazepam; MZ, midazolam; Par, paraldeído; PB, fenobarbital; Pent, pentobarbital; Pfl, propofol; PHT, fenitoína; TH, tiopental; VPA, ácido valproico.
Vias: b, bucal; im, intramuscular; in, intranasal; io, intraóssea; iv, intravenosa; r, retal.
O momento para iniciar cada fase de terapia foi semelhante em todas as diretrizes. Na fase inicial de terapia, nove das diretrizes relataram um momento de início igual ou anterior ao algoritmo da AES.5–7,9,10,12,15–17 O acometimento da segunda e da terceira fase de terapia foi igual ou anterior ao momento de início relatado pela AES em cinco das diretrizes que determinaram o momento de início.5–7,12,15 A intubação endotraqueal foi considerada na fase de estabilização em duas das diretrizes8,15 e no contexto de intubação de sequência rápida em quatro das diretrizes.5–7,9
No que diz respeito à via de administração de medicamentos anticonvulsivos, o acesso intravenoso poderá ser obtido após o estágio de terapia pré‐hospitalar (figura 1). Quando não houver acesso intravenoso no início do estágio de tratamento no DE, as diretrizes recomendam acesso intraósseo na fase de tratamento inicial (n = 1)6 ou secundária (n = 2).5,7 Em ambas as fases, as benzodiazepinas e a fenitoína poderiam ser administradas pela via intraóssea.
Comentário sobre o tempo no DENão houve discrepância significativa entre as diretrizes a respeito do momento para iniciar cada fase de terapia com medicamentos anticonvulsivos. Todas as diretrizes recomendam “iniciar o cronômetro” quando uma convulsão durar mais de cinco minutos, o que pode ser levado em consideração sempre que um paciente com convulsão ativa chegar ao DE. Esse ponto temporal também é compatível com a nova definição e classificação da ILAE de EME.1 Uma diferença insignificante com relação ao tempo é observada nas diretrizes com relação ao período necessário para uma fase de estabilização e os diferentes intervalos entre administrar as opções de medicamentos anticonvulsivos (veja abaixo).
Primeira fase da terapia anticonvulsiva no DENo que diz respeito à escolha do tratamento com medicamentos anticonvulsivos, uma benzodiazepina foi recomendada por todas as diretrizes na fase inicial de terapia (figura 2 e tabela 3). O lorazepam intravenoso foi recomendado em 10 das diretrizes,5–10,12,14,15,17 seguido pelo diazepam intravenoso em oito das diretrizes.6,7,10,12,14–17 Na impossibilidade de obter acesso intravenoso, o medicamento anticonvulsivo recomendado com mais frequência foi o midazolam: midazolam intramuscular (n = 8),6–8,10,12,15–17 midazolam bucal (n = 8)6,7,9,10,12,15–17 ou midazolam intranasal (n = 5).6,7,12,15,16 Como opção, o diazepam retal (n = 7) foi comumente recomendado.5,7,8,12,15–17 Uma dose repetida de benzodiazepina foi recomendada em cinco diretrizes, quatro levaram em consideração a dose pré‐hospitalar recebida,6,7,9,10 e uma excluiu a dose pré‐hospitalar.5 O fenobarbital intravenoso foi recomendado como uma opção à benzodiazepina em duas das diretrizes.8,15
Comentário sobre a primeira fase da terapia anticonvulsiva no DEO lorazepam e o diazepam intravenosos foram as benzodiazepinas intravenosas mais comumente recomendadas na primeira fase de terapia. Todas as diretrizes recomendaram o lorazepam intravenoso, exceto a diretriz da Sociedade Espanhola de Neurologia.16 Na Espanha, em 2016, o lorazepam intravenoso não estava disponível, então, em vez disso, o clonazepam intravenoso era recomendado. O lorazepam ou o diazepam intravenosos são eficazes e seguros. Por exemplo, em um ensaio clínico controlado e randomizado,21 que comparou o lorazepam intravenoso e o diazepam intravenoso, 72,9% do grupo lorazepam e 72,1% do grupo diazepam apresentaram interrupção do EME em 10 minutos sem recorrência nos 30 minutos seguintes, com taxas semelhantes de ventilação assistida (17,6% no grupo lorazepam e 16,0% no grupo diazepam). No ambiente com recursos limitados, uma consideração adicional com o uso do lorazepam é a necessidade de refrigeração do medicamento devido à sua degradação em alta temperatura. Apesar de tanto o lorazepam quanto o diazepam intravenosos estarem incluídos na lista de medicamentos essenciais para crianças da OMS, a diretriz da ETAT recomenda o diazepam intravenoso em regiões de alta temperatura sem instalação de refrigeração.14
Quando uma dose repetida de benzodiazepina é necessária devido a uma convulsão contínua, quatro das 11 diretrizes6,7,9,10 recomendaram levar em consideração se alguma dose de benzodiazepina pré‐hospitalar foi administrada, pois a dosagem dos SEM afetaria a escolha do próximo medicamento anticonvulsivo. Curiosamente, essas quatro diretrizes foram publicadas após 2008, quando Chin et al.22 mostraram que no acometimento da comunidade referente ao EME convulsivo na infância não houve associação entre tratamento com medicamentos anticonvulsivos pré‐hospitalar ou o uso de mais de duas doses de benzodiazepinas com a duração do EME por mais de 60 minutos. Além disso, esse tratamento com mais de duas doses de benzodiazepinas foi associado à depressão respiratória. Apenas uma diretriz, de 2000, recomendou não considerar o tratamento de SEM anteriores,5 com base na possível variabilidade da dosagem pré‐hospitalar.
Segunda fase da terapia anticonvulsiva no DENa segunda fase de terapia (figura 3 e tabela 3), as recomendações das diretrizes para medicação intravenosa incluíam: fenitoína (n = 10),5–10,12,14,16,17 fenobarbital (n = 9),6–10,14–17 ácido valproico (n = 6),8,10,14–17 fosfenitoína (n = 4)7,12,14,15 e levetiracetam (n = 4).8,15–17 Na impossibilidade de obter acesso intravenoso, a fenitoína intraóssea foi recomendada em três diretrizes5–7 e as outras opções apresentadas foram fosfenitoína7 ou fenobarbital14 via intramuscular e paraldeído retal.5,7
Comentário sobre a segunda fase da terapia anticonvulsiva no DEA fenitoína intravenosa foi a terapia mais comumente recomendada para o EME resistente à benzodiazepina. Juntamente com a fosfenitoína intravenosa (o pró‐fármaco da fenitoína), foi a terapia de segunda fase preferida em todas as diretrizes. Há diversas razões pelas quais a fosfenitoína deve ser recomendada em vez da fenitoína: ela não exige o excipiente propileno glicol; ela apresenta menos risco de hipotensão e disritmia cardíaca; ela não causa séria reação de extravasamento, síndrome da luva roxa; e pode ser administrada via intramuscular quando o acesso intravenoso não for possível.7
O fenobarbital intravenoso foi recomendado em nove das 11 diretrizes.6–10,14–17 Duas diretrizes recomendaram o fenobarbital apenas se o paciente tiver recebido fenitoína.9,16 O motivo disso é que o fenobarbital tem mais efeitos colaterais calmantes do que a fenitoína (por exemplo, depressão respiratória e sedação), principalmente quando as benzodiazepinas já foram usadas. As evidências com relação ao uso do fenobarbital intramuscular têm como base a prática pediátrica em malária cerebral.23 Por exemplo, uma dose intramuscular de 20mg/kg reduz a frequência das convulsões, porém causa um risco mais elevado de depressão respiratória e mortalidade, principalmente nos indivíduos que já receberam várias doses de diazepam.23
O ácido valproico foi recomendado em seis das 11 diretrizes.8,10,14–17 O ácido valproico pode ser hepatotóxico e pode levar à hiperamonemia. Três das diretrizes indicam que ele deve ser evitado ou usado com cautela em crianças com doença hepática (ou suspeita de doença metabólica) e em crianças com menos de dois a três anos com a etiologia da convulsão incerta.10,12,14 O ácido valproico causa menos hipotensão ou depressão respiratória em comparação com a fenitoína ou o fenobarbital. Por exemplo, em um ensaio clínico controlado e randomizado, apesar de a injeção intravenosa rápida de ácido valproico ter interrompido convulsões em uma taxa comparável ao fenobarbital intravenoso (90% em comparação com 77%, sem diferença estatística), a taxa de efeitos adversos foi menor (24%, em comparação com 74%) e o grupo fenobarbital apresentou mais letargia, vômito ou depressão respiratória.24 Em comparação com a fenitoína intravenosa, o ácido valproico é tão efetivo quanto ela no controle da convulsão e mais bem tolerado com relação ao risco de hipotensão e depressão respiratória, porém causa um leve aumento das enzimas do fígado.25 No geral, o ácido valproico pode ser considerado uma opção efetiva para a segunda fase da terapia medicamentosa anticonvulsiva.
O levetiracetam foi recomendado em quatro das 11 diretrizes.8,15–17 Ele tem as vantagens de boa tolerabilidade, administração intravenosa durante um período de tempo relativamente curto e ausência de efeitos hemodinâmicos e sedativos.10 Isso posto, não existem ensaios clínicos randomizados controlados do levetiracetam no EME convulsivo pediátrico. Um estudo piloto randomizado aberto demonstrou equivalência da eficácia no controle de convulsões com o lorazepam e que há menos depressão respiratória e hipotensão associadas ao seu uso.26
Por fim, há um estudo de eficácia comparativo, randomizado, multicêntrico e contínuo relevante para o futuro da segunda fase do tratamento com medicamentos anticonvulsivos, o Estudo do Tratamento do Estado de Mal Epiléptico Estabelecido (ESETT; consulte ClinicalTrials.gov Identificação: NCT01960075; a ser concluído em dezembro de 2019), que procura determinar o tratamento do DE mais efetivo entre a fosfenitoína, o levetiracetam e o ácido valproico para EME resistente a benzodiazepina e fornece informações sobre a eficácia e segurança em crianças.
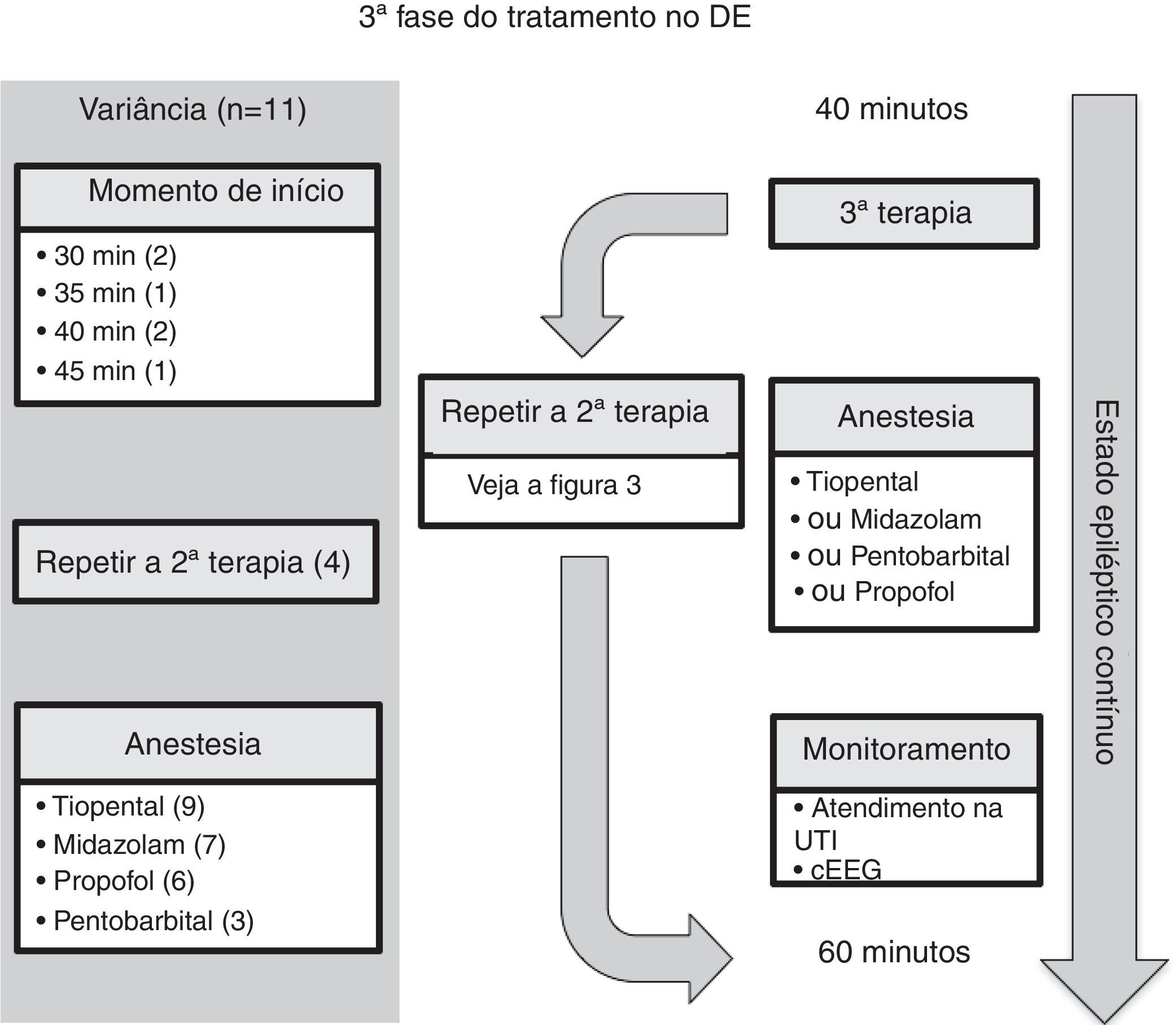
Terceira fase da terapia anticonvulsiva no DENa terceira fase de terapia (figura 4 e tabela 3), quatro diretrizes incluíram a opção de repetir a terapia da segunda fase.7,10,12,15 Nove diretrizes recomendaram induzir a anestesia com tiopental;5–9,12,15–17 todas as quatro diretrizes que recomendaram rápida intubação na sequência sugeriram o tiopental como agente de indução.5–7,9 Sete das diretrizes recomendaram usar infusão de midazolam,7,8,10,12,15–17 seis recomendaram infusão de propofol,6,8,10,15–17 e três recomendaram infusão de pentobarbital.7,8,15
Comentário sobre a terceira fase da terapia anticonvulsiva no DENo momento de iniciar a terceira fase do tratamento com medicamentos anticonvulsivos, quatro das 11 diretrizes incluíram a opção de repetir a terapia da segunda fase.7,10,12,15 A diretriz7 do Comitê de Cuidados Agudos da Sociedade Pediátrica Canadense recomendou uma combinação que usa duas terapias medicamentosas da segunda fase, separadas por um intervalo de cinco minutos, antes de avançar para a indução da anestesia. A diretriz do grupo da Associação de Neurologia Infantil (Índia, 2013)12 considerou o cenário quando nenhuma cama da unidade de terapia intensiva estiver disponível e recomendou o seguinte antes de usar uma infusão de midazolam: ácido valproico e fenobarbital; ou levetiracetam. A diretriz10 da Liga Italiana contra Epilepsia recomendou o ácido valproico após a terapia da segunda fase, caso o atraso ou a dificuldade na intubação endotraqueal sejam esperados.
Por fim, a respeito da escolha do agente anestésico, as diretrizes não apresentam recomendações claras com relação à preferência entre tiopental, midazolam, propofol e pentobarbital. Em vez disso, a escolha do medicamento específico fica a critério do especialista local. Deve ser observado, contudo, que embora o propofol seja usado na prática adulta do EME persistente, o risco de síndrome da infusão do propofol em crianças é inaceitável e, portanto, a infusão contínua não é recomendada em vários países. No que diz respeito a outros agentes anestésicos, os dados sobre tratamento de terapia intensiva do EME pediátrico persistente são de baixa qualidade, embora demostrem uma hierarquia em estratégias: midazolam no início por infusão contínua, então barbituratos e, por fim, tentativa de outras terapias para anestesia.27,28 E recentemente um estudo observacional prospectivo de dois anos avaliou o uso de infusão contínua do agente anestésico em pacientes pediátricos (faixa etária, um mês a 21 anos) e EME persistente não respondeu a duas classes de medicamentos anticonvulsivos.29 O Grupo de Pesquisa em EME Pediátrico dos Estados Unidos constatou que, em seus 11 centros, o midazolam e o pentobarbital continuam a ser os principais agentes da terapia de infusão contínua.
ConclusãoLidar com uma criança que chega a uma emergência com uma convulsão é um desafio e saber como lidar da melhor forma com intervenções agudas e acompanhamento é parte fundamental da prática pediátrica.30 As diretrizes sobre terapia de medicamentos anticonvulsivos para convulsão ou EME antes e depois da chegada ao DE são importantes documentos de referência na terapia aguda. Nesta análise sistemática qualitativa de 13 diretrizes regionais/nacionais, constatamos que cada uma delas compartilha estruturas semelhantes com relação à prática e aos pontos temporais. Diferentes vias de administração da benzodiazepina são viáveis na fase pré‐hospitalar (SEM) e na primeira fase da terapia no DE. A escolha da benzodiazepina depende do acesso intravenoso, da disponibilidade no local, das habilidades dos prestadores de serviços de saúde e dos recursos. O ácido valproico e o levetiractam apresentam perfis de efeitos colaterais melhores do que a fenitoína ou a fosfenitoína. A comparação direta da eficácia e segurança de diferentes terapias da segunda fase para o EME aguarda futuros estudos clínicos. Por fim, quando se trata de usar agentes anestésicos em crianças, a maior parte das experiências e da literatura usa o midazolam e, então, o pentobarbital por infusão contínua.
Conflitos de interesseOs autores declaram não haver conflitos de interesse.
Como citar este artigo: Au CC, Branco RG, Tasker RC. Management protocols for status epilepticus in the pediatric emergency room: systematic review article. J Pediatr (Rio J). 2017;93:84–94.