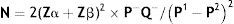To assess the level of fecal calprotectin in preterm neonates with feeding intolerance, as well as to evaluate it as a marker of feeding intolerance and to determine a cut‐off level of fecal calprotectin in feeding intolerance.
MethodsAnalytical, multicenter, case–control study, which was carried out in neonatal intensive care units in Egypt, in a period from August 1, 2014 to March 1, 2015 on 52 preterm neonates. Neonates were classified into two groups; a study group including 26 neonates who met inclusion criteria and a control group including 26 neonates for comparison.
ResultsFecal calprotectin levels ranged from 3.9μg/g to 971.8μg/g, and there was a significant increase in fecal calprotectin in the study group when compared to the control group (334.3±236.6μg/g vs. 42.0±38.2μg/g, respectively) with moderate inverse significant correlation between fecal calprotectin and birth weight. Furthermore, there was moderate, significant correlation between fecal calprotectin and duration of breastfeeding range. On the other hand, there was no correlation between fecal calprotectin and post‐natal age, gestational age, or volume of feeding. A cut‐off at the 67.0μg/g level, with 100.0% sensitivity and 76.9% specificity, was considered.
ConclusionFecal calprotectin level increased significantly in neonates with feeding intolerance; it can be used to detect early cases with necrotizing enterocolitis in neonates, but this subject still needs more investigations on more patients.
Avaliar o nível de calprotectina fecal em neonatos prematuros com intolerância alimentar, além de avaliá‐lo como um indicador de intolerância alimentar e determinar um nível de corte da calprotectina fecal na intolerância alimentar.
MétodosEstudo caso‐controle analítico, feito em um multicentro de unidades de terapia intensiva neonatais no Egito, de 1° de agosto de 2014 a 1° de março de 2015, com 52 neonatos prematuros. Os neonatos foram classificados em dois grupos; um grupo de estudo incluindo 26 neonatos que atenderam aos critérios de inclusão e um grupo de controle incluindo 26 neonatos para comparação.
ResultadosOs níveis de calprotectina fecal variaram de 3,9μg/g a 971,8μg/g e houve um aumento significativo da calprotectina fecal no grupo de estudo quando comparado com o grupo de controle (334,3±236,6μg/g em comparação com 42,0±38,2μg/g, respectivamente) com correlação inversa, moderada e significativa entre a calprotectina fecal e o peso ao nascer. Adicionalmente, houve correlação moderada significativa entre a calprotectina fecal e a duração do intervalo de amamentação. Por outro lado, não houve correlação entre a calprotectina fecal e a idade pós‐natal, a idade gestacional ou o volume de amamentação. Foi considerado um corte nos níveis de 67,0μg/g; com sensibilidade de 100,0% e especificidade de 76,9%.
ConclusãoO nível de calprotectina fecal aumentou significativamente em neonatos com intolerância alimentar e podemos usá‐lo para detectar casos precoces com enterocolite necrosante em neonatos, porém ainda são necessárias mais investigações em mais pacientes.’
A amamentação dos neonatos prematuros é um dos principais desafios enfrentados por médicos neonatais, mais especificamente dos neonatos nos grupos de baixo peso ao nascer.1 Os neonatos prematuros apresentam maior mortalidade e morbidez, com doenças de longo prazo.2
A intolerância alimentar é conhecida como uma dificuldade na alimentação com leite, causa uma alteração na nutrição enteral habitual devido ao aparecimento de um ou mais sintomas clínicos gastrointestinais como resíduo gástrico, vômito, distensão abdominal, alças intestinais distendidas e alteração no aspecto das fezes. A apneia, a bradicardia e a instabilidade da temperatura também estão incluídas como sintomas de intolerância alimentar, porém apenas para auxiliar na opinião da enfermagem, a fim de orientar sobre a detecção de progressão para complicações mais graves como enterocolite necrosante (ECN).3
Muitos fatores de risco poderão agravar a intolerância alimentar, incluindo má coordenação na sucção e deglutição, esfíncter esofágico inferior fraco, pequena capacidade do estômago, atraso no esvaziamento do estômago e hipomotilidade intestinal.4 Por outro lado, o leite materno é o melhor para os neonatos e os fortificantes obtidos do leite materno agiram como um bom substrato na nutrição de neonatos prematuros.5
Uma colonização bacteriana anormal pode ser um fator de intolerância alimentar em neonatos devido principalmente à disfunção da barreira intestinal, às respostas imunes e às funções do intestino. A colonização intestinal anormal, o baixo equilíbrio entre a microbiota, a resposta imune e os mecanismos de tolerância poderão resultar em intolerância alimentar na vida pós‐natal e, além disso, em doença gastrointestinal na infância.6
Em 1970, Fagerhol et al. pesquisaram um indicador de renovação de leucócitos e, em 1980, publicaram sua descoberta de uma proteína no citoplasma de neutrófilos e a classificaram como proteína L1 derivada de leucócitos, a calprotectina.7 A calprotectina é membro da família de proteínas ligantes de cálcio e zinco S100; heterodímero de S100 A8/A9. Ela é encontrada em neutrófilos, monócitos e algumas células epiteliais escamosas. O complexo representa até 60% do índice de proteína solúvel do citoplasma de neutrófilos. Ela é liberada por ativação de leucócitos como consequência de doenças inflamatórias.8 A S100 A8 também é chamada de calgranulina A e de proteína mieloide‐relacionada 8 (MRP8) e a S100 A9 é chamada de calgranulina B (MRP14). Ambas estão relacionadas ao sistema imunológico inato.9
A calprotectina executa ações bacteriostáticas e fungistáticas, pois pode isolar manganês e zinco em suas células,10 e também tem várias propriedades biológicas, incluindo atividade antimicrobiana e imunomoduladora, que libera durante a ativação das células (liberação ativa) ou morte celular (liberação passiva).11 Ela foi sugerida como um indicador útil para determinar a gravidade da inflamação no intestino.12 Os fatores mais significativos que afetaram a excreção de calprotectina fecal (FCP) foram os tratamentos antibióticos pré‐ e perinatais, o volume de nutrição enteral, a ocorrência de interrupções não planejadas na nutrição enteral e a colonização bacteriana gastrointestinal.13
Vários estudos sugeriram veementemente que o aumento de FCP acima dos níveis básicos pode ser um possível marcador não invasivo de doenças gastrointestinais.14–17 Os níveis de FCP em neonatos de seis meses estavam mais altos do que em crianças.18
Nosso objetivo foi avaliar o nível de FCP em neonatos prematuros com intolerância alimentar também para confirmá‐lo como um indicador de intolerância alimentar e para determinar um nível “de corte” de FCP que seja específico e sensível à intolerância alimentar.
MétodosModelo do estudoEstudo analítico caso‐controleA população do estudo foi classificada em dois grupos: Grupo 1 (grupo de caso): inclusão de neonatos prematuros que atendiam aos critérios de inclusão e mostraram algum sinal de intolerância alimentar; Grupo 2 (grupo de controle): inclusão de bebês controle com a mesma idade pós‐natal, gestação e sexo que não mostraram sinais de intolerância alimentar.
Critérios de inclusão: neonatos prematuros de ambos os sexos desde o nascimento até o 28° dia de vida e com 28 até 37 semanas de gestação admitidos na Unidade de Terapia Intensiva Neonatal (UTIN) e que apresentaram quaisquer dos sinais de intolerância alimentar que levassem à interrupção do atual regime de alimentação, como aumento no resíduo gástrico (¿ 50%) da amamentação anterior, êmese, distensão abdominal (aumento na circunferência abdominal em 2cm ou mais entre as amamentações), fezes com sangue, diarreia e alças intestinais visíveis.3
Critérios de exclusão: neonatos que sofrem de anomalias congênitas intestinais ou neonatos com sepse.3
Tamanho da amostra: a equação a seguir foi usada para determinar o tamanho da amostra necessário:
Na qual:N=número, Zα=valorda distribuição normal padrão da probabilidade de erro tipo I em um teste unilateral e igual a 1,96 para relevância de 95%, Zß=valorda distribuição normal padrão do poder estatístico desejado de 90% e igual a 1,28 para poder de 90%, P‐=(P1+P2)/2, Q‐=1 ‐ P‐, P1=56% é a proporção estimada de um atributo presente na população,1P2=prevalência de neonatos com expectativa de baixo nível de FCP igual a 5%.
Segundo o cálculo, o tamanho da amostra foi: conjuntamente, 52 neonatos, 26 neonatos em cada grupo admitidos na UTIN entre 1° de agosto de 2014 e 1° de março de 2015.
Todos os neonatos estudados foram submetidos a anamnese, exame clínico e investigações completas: proteína C reativa, hemograma completo e FCP.
A FCP foi aferida nas fezes com um imunoensaio enzimático quantitativo; foram usados kits da Ridascreen (Biopharm AG, Darmstadt, Alemanha). O elemento principal da medição é um imunoensaio enzimático para a determinação quantitativa de FCP nas fezes.
Análise estatísticaOs dados coletados foram organizados, tabulados e estatisticamente analisados com o Statistical Package for Social Science (SPSS); versão 16 (SPSS, Inc., Chicago, EUA), instalado em um computador compatível da IBM (International Business Machines, Nova York, EUA). Os dados qualitativos (categóricos) foram representados como frequência relativa e distribuição percentual e para a comparação entre os grupos o qui‐quadrado (X2) foi usado como teste de comparação. Dados quantitativos: representados como média, desvio padrão (DP). Para a comparação entre os grupos, o teste t de Student para amostras independentes foi usado para os dados normalmente distribuídos; e o teste U de Mann‐Whitney foi usado para dados não normalmente distribuídos. Para correlação, foi usado o coeficiente de correlação de Pearson (r); a correlação foi proporcional caso o sinal tivesse sido positivo e inversa caso o sinal tivesse sido negativo; leve se<0,3; moderada se entre 0,3 e 0,7 e poderosa se>0,7; a correlação foi completa se r=1,0; e não houve correlação caso r=0,0. Para a interpretação dos resultados, os valores de p<0,05 foram considerados significativos.
Considerações éticasA aprovação do estudo foi obtida do Comitê de Ética em Pesquisa da Faculdade de Medicina da Universidade do Canal de Suez e também foi obtido um consentimento informado por escrito dos pais.
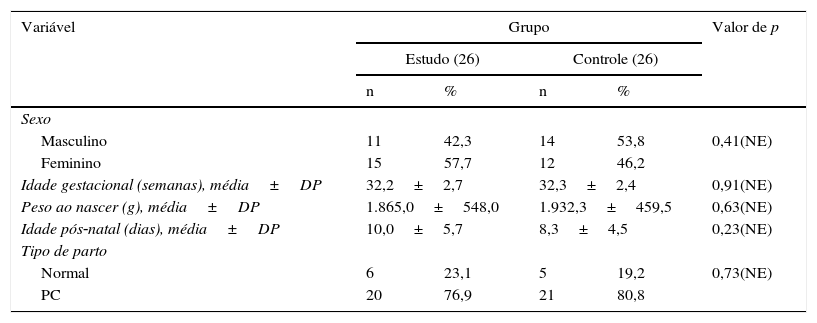
ResultadosNo que diz respeito a características demográficas (tabela 1)Descobrimos que não houve diferença significativa entre o grupo de estudo e de controle a respeito da distribuição por sexo. O tempo de gestação dos neonatos incluídos variou de 28 a 36 semanas e não houve diferença significativa entre ambos os grupos com relação à idade gestacional (32,2±2,7 em comparação com 32,3±2,4 semanas, respectivamente). Seu peso ao nascer variou de 900g a 2.750g e não houve diferença significativa entre ambos os grupos. A respeito do tipo de parto: 11 casos (21,2%) nasceram de parto vaginal normal; 41 (78,8%) de cesáreo; e não houve diferença significativa de parto vaginal normal no estudo em comparação com os grupos de controle. A idade pós‐natal variou de 3 a 25 dias com um aumento não significativo de dias pós‐natal no grupo de estudo em comparação com o grupo de controle.
Características demográficas nos grupos de estudo e de controle
| Variável | Grupo | Valor de p | |||
|---|---|---|---|---|---|
| Estudo (26) | Controle (26) | ||||
| n | % | n | % | ||
| Sexo | |||||
| Masculino | 11 | 42,3 | 14 | 53,8 | 0,41(NE) |
| Feminino | 15 | 57,7 | 12 | 46,2 | |
| Idade gestacional (semanas), média±DP | 32,2±2,7 | 32,3±2,4 | 0,91(NE) | ||
| Peso ao nascer (g), média±DP | 1.865,0±548,0 | 1.932,3±459,5 | 0,63(NE) | ||
| Idade pós‐natal (dias), média±DP | 10,0±5,7 | 8,3±4,5 | 0,23(NE) | ||
| Tipo de parto | |||||
| Normal | 6 | 23,1 | 5 | 19,2 | 0,73(NE) |
| PC | 20 | 76,9 | 21 | 80,8 | |
NE, não específico; PC, parto cesáreo.
A principal doença nos grupos de estudo e de controle foi insuficiência respiratória em 37 casos (71,2%); síndrome do desconforto respiratório (SDR) em dez (19,2%); taquipneia transitória do recém‐nascido em três (5,8%); SDR mais encefalopatia hipóxico‐isquêmica em um (1,9%) e hipertensão pulmonar persistente do recém‐nascido (HPPRN) em um (1,9%); sem diferença significativa entre ambos os grupos.
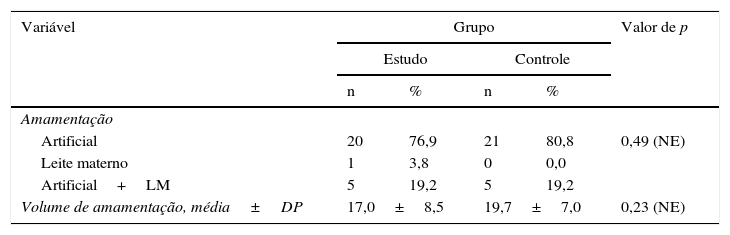
Quanto ao tipo de amamentação: era exclusivamente artificial em 41 casos (78,8%); exclusivamente leite materno em um (1,9%) e mista (artificial e leite materno) em dez (19,2%), sem diferença significativa entre ambos os grupos. Amamentação nos grupos de estudo (volume/3 horas): variou de 1 a 30mL, com média de 18,4±7,8mL; e houve uma redução não significativa no volume de amamentação em ambos os grupos (tabela 2).
Tipo de amamentação nos grupos de estudo e de controle
| Variável | Grupo | Valor de p | |||
|---|---|---|---|---|---|
| Estudo | Controle | ||||
| n | % | n | % | ||
| Amamentação | |||||
| Artificial | 20 | 76,9 | 21 | 80,8 | 0,49 (NE) |
| Leite materno | 1 | 3,8 | 0 | 0,0 | |
| Artificial+LM | 5 | 19,2 | 5 | 19,2 | |
| Volume de amamentação, média±DP | 17,0±8,5 | 19,7±7,0 | 0,23 (NE) | ||
LM, leite materno; NE, não específico.
A apresentação de intolerância alimentar variou de vômito em seis casos (23,2%); vômito e distensão abdominal em cinco (19,2%); resíduo e distensão abdominal em sete (26,9%); distensão abdominal, vômito, apneia e resíduo esverdeado em cinco (19,2%); vômito com resíduos em dois (7,7%); distensão abdominal, vômito e esvaziamento gástrico residual e tardio em um (3,8%). Cinco casos (9,6%) com Estágio IA apresentaram ECN no grupo de estudo.
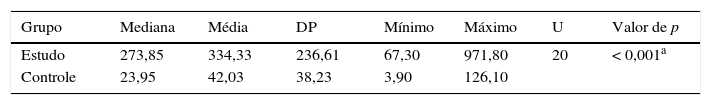
Os níveis de FCP variaram de 3,9μg/g a 971,8μg/g e houve um aumento significativo no grupo de estudo quando comparado com o grupo de controle (334,3±236,6μg/g em comparação com 42±38,2μg/g, respectivamente) com correlação inversa moderada significativa entre a FCP e o peso ao nascer. Adicionalmente, houve correlação moderada significativa entre a FCP e a duração do intervalo de amamentação. Por outro lado, não houve correlação significativa entre a FCP e a idade pós‐natal, a idade gestacional (IG) ou o volume de amamentação (tabela 3).
Calprotectina fecal nos grupos de estudo e de controle
| Grupo | Mediana | Média | DP | Mínimo | Máximo | U | Valor de p |
|---|---|---|---|---|---|---|---|
| Estudo | 273,85 | 334,33 | 236,61 | 67,30 | 971,80 | 20 | < 0,001a |
| Controle | 23,95 | 42,03 | 38,23 | 3,90 | 126,10 |
aQuanto aos níveis de calprotectina fecal, como os dados não foram distribuídos normalmente, a mediana foi a medida adequada e o teste de Mann‐Whitney foi o teste adequado para comparação. Contudo, houve um aumento significativo da mediana no grupo de estudo em comparação com o grupo de controle (273,85 em comparação com 23,95).
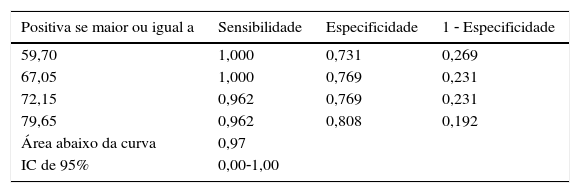
A análise da curva de característica de operação do receptor (ROC) mostrou que a área abaixo da curva ficou em 0,97 (isso refletiu maior sensibilidade); para obter o melhor corte, foram escolhidos os valores com a melhor sensibilidade; nos níveis de 67, a sensibilidade foi de 100% e a especificidade foi de 76,9% (tabela 4).
Sensibilidade da FCP no diagnóstico de intolerância alimentar
| Positiva se maior ou igual a | Sensibilidade | Especificidade | 1 ‐ Especificidade |
|---|---|---|---|
| 59,70 | 1,000 | 0,731 | 0,269 |
| 67,05 | 1,000 | 0,769 | 0,231 |
| 72,15 | 0,962 | 0,769 | 0,231 |
| 79,65 | 0,962 | 0,808 | 0,192 |
| Área abaixo da curva | 0,97 | ||
| IC de 95% | 0,00‐1,00 | ||
FCP, calprotectina fecal.
A intolerância alimentar é muito comum entre neonatos prematuros que recebem nutrição enteral e poderá ser tanto um sinal benigno de redução da motilidade gastrointestinal (GI) quanto uma manifestação inicial da enterocolite necrosante (ECN). Ela é uma das razões mais comuns para retardar o avanço de dietas enterais ou para suspender a alimentação em neonatos prematuros.19 A FCP foi considerada um indicador útil de inflamação gastrointestinal em neonatos, aumentou também em caso de doença inflamatória intestinal.20
Nossos pacientes tinham idade gestacional de 28 a 36 semanas, com média de 32,3±2,6 semanas, peso médio ao nascer de 1.898,7±501,9g e idade pós‐natal média no momento do diagnóstico de 10±5,7 dias. Constatamos que 11 pacientes do grupo de estudo eram meninos e 15 eram meninas. Zoppelli et al.21 constataram que a idade gestacional (IG) média era de 28,5 semanas e o peso ao nascer era de 1.057g. Albanna et al.16 tiveram uma IG média de 32 semanas, um peso médio ao nascer de 1.500g e uma idade média no diagnóstico de nove dias, nove eram meninos e seis eram meninas. Cui e Li14 tiveram uma IG média de 30 semanas e idade média no diagnóstico de 12 dias. No estudo de Carroll22 foram obtidas amostras (uma no nascimento e outra no 3° dia após o nascimento) de 38 neonatos prematuros com IG entre 29 e 33 semanas. No estudo de Aydemir et al.17 o peso médio ao nascer era de 950g e a idade média era de 14 dias no diagnóstico.
Ao todo, 41 neonatos foram amamentados de forma absolutamente artificial, dez receberam amamentação mista e apenas um recebeu exclusivamente leite materno. Como no estudo de Yoon,15 nenhum neonato foi amamentado exclusivamente com leite materno.
Não encontramos correlação significativa entre o nível de FCP e o volume de nutrição enteral e isso está de acordo com o estudo de Campeotto et al.23 e contra o estudo de Yang et al.,24 no qual os níveis de FCP apresentaram redução, com o aumento do volume de nutrição enteral durante o primeiro mês de vida pós‐natal, e de Josefesson et al.25 e Rougé et al.,13 que descobriram que a FCP aumentou com o incremento do volume de amamentação.
Pesquisas anteriores estudaram o efeito do tipo de amamentação sobre o nível de FCP. Campeotto et al.23 e Yang et al.24 constataram que não há diferença nos níveis de FCP de neonatos amamentados com leite materno em comparação com neonatos amamentados com fórmulas hidrolisadas. Yoon et al.15 constataram que não houve efeito do tipo ou método de amamentação sobre a FCP, ao passo que em Li et al.26 o nível de FCP aumentou em neonatos amamentados com leite materno mais do que em neonatos amamentados com fórmulas. Em nosso estudo, não pudemos estudar a relação entre a amamentação exclusivamente com leite materno e a amamentação exclusivamente com fórmula, já que tivemos apenas um neonato amamentado exclusivamente com leite materno.
Em nosso estudo, não houve efeito de sexo ou idade gestacional sobre o nível de FCP, o que está de acordo com Campeotto et al.23 e também com Yang et al.24 e Kapel et al.18 e em desacordo com Rougé et al.,13 que descobriram uma relação linear negativa fraca entre a FCP e a idade gestacional. Yoon et al.15 descobriram uma relação linear positiva clara entre duas das variáveis (a idade gestacional e o nível de FCP) em recém‐nascidos com IG de menos de 26 semanas e uma relação linear negativa característica entre elas em recém‐nascidos nascidos da 26ª até a 30ª semana.
Houve uma correlação inversa significativa entre o nível de FCP e o peso ao nascer, de acordo com Laforgia et al.27 e em desacordo com Campeotto et al.,23 que não descobriram relação significativa entre o peso ao nascer e a FCP.
Em nosso estudo, houve uma correlação positiva significativa entre a ruptura prematura de membranas (RPM) e o nível de FCP. Isso estava de acordo com Cui e Li.14
Descobrimos que a idade pós‐natal não tem correlação significativa com o nível de FCP; de acordo com Campeotto et al.23 e em desacordo com Josefesson et al.25 e Rougé et al.,13 que observaram uma relação positiva, e Yang et al.,24 que descobriram uma relação negativa, pois os níveis de FCP tendem a cair com o avanço da idade.
Não houve correlação entre o tipo de parto e o nível de FCP. Isso foi de acordo com Laforgia et al.27 e Rougé et al.13 e em desacordo com Josefesson et al.,25 que afirmaram uma relação positiva com o parto cesáreo (C), e Cui e Li,14 que observaram uma relação negativa com o parto cesáreo.
Em nosso grupo de estudo, quatro neonatos prematuros faleceram durante o tempo de estudo; 26 mostraram sinais de intolerância alimentar; cinco (9,6%) apresentaram suspeita de ECN (estágio de Bell IA); todos se recuperaram completamente, exceto um caso, que faleceu durante o estudo. No estudo de Zoppelli et al.,21 9,2% de seus pacientes desenvolveram ECN estágio II, dos quais cinco tiveram ECN fulminante. No estudo de Aydemir et al.,17 três pacientes apresentaram ECN leve (estágio de Bell IB), quatro ECN definida (estágio de Bell IIB) e três sinais clínicos compatíveis com ECN avançada (estágio de Bell IIIA ou IIIB).
O nível de FCP em nosso estudo variou de 3,9 a 971,8mg/kg, com média de 188,2±223,5. O FCP foi significativamente diferente entre ambos os grupos com níveis mais elevados de FCP no grupo de caso, de acordo com Cui et al.,14 que afirmaram que houve um aumento do nível de FCP no grupo com intolerância alimentar, e também de acordo com Rougé et al.,13 que afirmaram que o FCP aumentou em prematuros com baixa tolerância a nutrição enteral. Além disso, esse achado foi compatível com Yang et al.,24 que descobriram que o nível de FCP em neonatos prematuros subiu na época dos sinais iniciais de doenças gastrointestinais (GI) e caiu conforme esses sinais eram tratados e solucionados e o FCP foi maior entre aqueles com sintomas de ECN.
A FCP no presente estudo tem sensibilidade de 100% e especificidade de 76,9% no diagnóstico de intolerância alimentar, com nível de corte de 67μg/g, inferior aos estudos anteriores e com maior sensibilidade; o nível de corte em Rougé et al.13 era de 205μg/g. Yang et al.24 estudaram 57 bebês com muito baixo peso ao nascer e descobriram que as fezes com FCP>350μg/g tinham sinais de lesão gastrointestinal, como fezes com sangue e perfuração intestinal. Além disso, o nível de FCP apresentou redução após o início dos tratamentos em neonatos doentes que se recuperaram.
A FCP tem sido estudada em distúrbios gastrointestinais em neonatos; no estudo de Campeotto et al.,23 um valor de corte de 363μg/g com sensibilidade de 0,65 e especificidade de 0,82 foi estabelecido para o desenvolvimento de sintomas digestivos leves e um valor de corte de 636μg/g com sensibilidade de 0,72 e especificidade de 0,95, para o desenvolvimento de sintomas graves. Shenoy et al.28 mostraram que houve uma associação significativa entre FCP elevada e ECN. A FCP apresentou um valor de corte ≥ 280μg/g, sensibilidade de 93,3% e especificidade de 39%.
Nosso estudo mostrou que houve uma correlação entre níveis elevados de FCP e a ocorrência de ECN no grupo de caso; isso está de acordo com Albanna et al.,16 que descobriram níveis significativamente mais elevados de FCP em neonatos que desenvolveram a ECN com nível máximo e em neonatos com estágio de Bell IIIB (307,6±4,1), e também de acordo com Aydemir et al.,17 que descobriram que a FCP elevada pode prever a ocorrência de ECN, pois as concentrações médias de FCP em casos de ECN (185mg/dL) foram significativamente maiores do que no controle (104mg/dL). Também descobriram que há uma correlação positiva significativa entre a gravidade da ECN e o nível de FCP. Yoon et al.15 também descobriram que a concentração de FCP era maior em recém‐nascidos com ECN do que no controle. O estudo de El Fragy et al.29 mostrou que a FCP pode ser usada como um indicador não invasivo para previsão antecipada de ECN em neonatos.
Em um estudo feito por Thuijls et al., que envolvia 35 neonatos com suspeita de ECN, 14 desenvolveram ECN. A mediana dos níveis de FCP, juntamente com a proteína intestinal de ligação de ácidos graxos na urina e a claudina‐3, foi significativamente mais elevada em neonatos com ECN do que em neonatos com outros diagnósticos, com nível de corte de FCP (286,2μg/g nas fezes).30 Carroll et al. mostraram que o FCP foi acentuadamente elevado, com uma concentração média de 288,4mg/L em pacientes com ECN, em comparação com 98,0mg/L nos grupos de controle.22 O FCP aumentou para>2.000μg/g em três casos de ECN e um caso de perfuração com uma inflamação intestinal microscópica.25
Todos os nossos 52 neonatos estudados eram tratados com antibióticos, então não conseguimos identificar efeitos de antibióticos pós‐natal sobre o nível de FCP. As amostras fecais nem sempre eram facilmente obtidas de neonatos com intolerância alimentar; eles apresentavam esvaziamento gástrico tardio e também foi difícil obter uma amostra de fezes durante a duração do intervalo de amamentação.
Chegamos à conclusão de que prematuros com intolerância alimentar apresentavam níveis estatisticamente significativos de FCP maiores do que neonatos prematuros sem intolerância alimentar.
Conflitos de interesseOs autores declaram não haver conflitos de interesse.
Como citar este artigo: Moussa R, Khashana A, Kamel N, Elsharqawy SE. Fecal calprotectin levels in preterm infants with and without feeding intolerance. J Pediatr (Rio J). 2016;92:486–92.