This study aims at determining the relationship between prednisolone cumulative dose and linear growth in pre‐pubertal children with idiopathic nephrotic syndrome.
MethodThis cross‐sectional study was conducted on all children with idiopathic nephrotic syndrome registered to the pediatric nephrology department at the main referral children's hospital in Southwestern Iran. Inclusion criteria included age (males <12 years; females <10 years), >6 months of use, and the minimum prednisolone cumulative dose of 152mg/kg. The exclusion criteria were individuals who had entered puberty or had other diseases affecting linear growth. Based on the prednisolone cumulative dose of ≥550mg/kg (four or more relapses), the children were divided into two groups. All data regarding age, height, and weight at disease onset and the last visit, bone age, and the parents’ height were collected. Secondary variables including mid‐parental target height and predicted adult height were also calculated. Height data were compared between the different rates of relapse.
ResultsA total of 97 children (68% male) were enrolled. Their post-treatment mean height Z-score was less than that obtained before treatment (−0.584 vs. −0.158; p = 0.001). Subjects with higher prednisolone cumulative doses were found to have more reduction in height Z-score (p = 0.001). Post-treatment height prediction also showed less growth potential compared to pre-treatment target height (p = 0.006). Thirty-three children (34.4%) had four or more relapses, among whom more mean-height Z-score decreases were found compared to those with less-frequent relapses (−0.84 vs. −0.28; p = 0.04).
ConclusionThis study showed the negative effect of cumulative dosages of prednisolone on linear growth, which was greater in children with four or more relapses.
Determinar a relação entre a dose cumulativa de prednisolona e o crescimento linear em crianças pré‐púberes com síndrome nefrótica idiopática.
MétodoEstudo transversal conduzido em todas as crianças com síndrome nefrótica idiopática registradas no departamento de nefrologia pediátrica no principal hospital infantil para encaminhamento no sudoeste do Irã. Os critérios de inclusão incluíram idade (meninos<12 anos; meninas<10 anos), > 6 meses e a dose cumulativa de prednisolona mínima de 152mg/kg. Os critérios de exclusão foram indivíduos que entraram na puberdade ou tinham outras doenças que afetam o crescimento linear. Com base na dose cumulativa de prednisolona de ≥ 550mg/kg (≥ 4 recidivas), as crianças foram divididas em dois grupos. Foram coletados todos os dados relacionados a idade, estatura e peso no início da doença e na última visita, idade óssea e estatura dos pais. Também foram calculadas as variáveis secundárias, inclusive estatura‐alvo e estatura adulta prevista. Os dados de estatura foram comparados entre as diferentes taxas de recidivas.
ResultadosForam inscritas 97 crianças (68% do sexo masculino). Seu escore z de estatura média pós‐tratamento foi inferior ao obtido antes do tratamento (−0,584 em comparação com −0,158; p=0,001). Os indivíduos com maiores doses cumulativas de prednisolona mostraram maior redução no escore z para estatura (p=0,001). A estatura pós‐tratamento também foi preditiva de menor potencial de crescimento em comparação com a estatura‐alvo pré‐tratamento (p=0,006); 33 crianças (34,4%) apresentaram ≥ 4 recidivas, entre as quais foram encontradas mais reduções médias no escore z para estatura em comparação com as recidivas menos frequentes (−0,84 em comparação com −0,28; p=0,04).
ConclusãoEste estudo mostrou o efeito negativo das doses cumulativas de prednisolona sobre o crescimento linear, que foi maior em crianças com ≥ 4 recidivas.
A prednisolona (PDN) mudou o prognóstico da síndrome nefrótica (SN) desde 1950. Quase 12‐24% dos pacientes são resistentes a esteroides e cerca de 70% sofrem pelo menos um episódio de recidiva.1 Além dos grandes benefícios, há muitas preocupações com as desvantagens da PDN, principalmente no que diz respeito aos efeitos negativos sobre o crescimento linear. Vários mecanismos foram propostos com relação aos efeitos da SN sobre o crescimento.2
Alguns estudos confirmaram os efeitos inibidores mais curtos da PDN sobre o crescimento ao comparar o escore z para estatura (Ht.Zs) antes e depois do tratamento entre recidivas frequentes e ocasionais.1,3 Outros estudos investigaram seu impacto negativo no uso de longo prazo,4,5 outros acompanharam os pacientes longitudinalmente para comparar sua estatura final com a de seus pares6,7 e outros usaram combinações de métodos.8
Teoricamente, o potencial de crescimento pode ser avaliado com a previsão da estatura final na infância. Vários métodos foram propostos para esse fim. O sistema com base na idade cronológica (IC) reduz a previsão conforme o aumento da idade óssea (IO). Contudo, o sistema com base na idade óssea não faz isso. No sistema com base na IO, as previsões são menos afetadas por discrepâncias na idade óssea, porém o efeito não é simétrico. Os métodos de Greulich‐Pyle (GP) e Tanner‐Whitehouse (TW) de determinação da idade esquelética podem ser usados para prever a estatura adulta, que é útil no diagnóstico e na avaliação dos efeitos do tratamento. Nesse método, a estatura adulta prevista (PAHt.) é comparada com a estatura adulta esperada (faixa‐alvo de estatura; estatura‐alvo, THt, calculado como a estatura média dos pais (MPHt.).9
Por meio dos novos sistemas de Marcação de TW, os erros de previsão geralmente são um pouco menores do que os decorrentes das previsões de Bayley‐Pinneau e consideravelmente menores no caso de meninas na pós‐menarca.10
O objetivo deste estudo foi avaliar os possíveis efeitos de curto e longo prazos da PDN sobre o crescimento linear ao comparar a) o Ht.Zs antes e depois do tratamento, b) a estatura final prevista pós‐tratamento em comparação com a estatura‐alvo média dos pais (possível pré‐tratamento) e c) o total de doses cumulativas baixas e altas de PDN de acordo com as variáveis de crescimento.
MétodoEste estudo transversal foi conduzido em todas as crianças (> 2 anos) e adolescentes com diagnóstico de síndrome nefrótica idiopática (SNI) registrados no departamento de nefrologia pediátrica no principal hospital terciário da criança (Abuzar) no sudoeste do Irã, de janeiro de 2011 a dezembro de 2012. Todas as novas internações e recidivas foram tratadas na enfermaria de internação e foram acompanhadas na clínica ambulatorial no mesmo centro.
Definições: A SNI foi diagnosticada se a proteína na urina foi> 40mg/m2/hr., proteína sérica <2,5g/dL, edema, hiperlipidemia (acima do limite adequado para a idade) com ausência de hematúria macroscópica, insuficiência renal, hipertensão prolongada e complemento normal.11 Recidiva foi definida como o ressurgimento de proteinúria ≥ 2+por vareta por três dias consecutivos. Os pacientes que responderam durante oito semanas de tratamento com PDN (e não apresentaram recidiva frequente antes dos três meses de interrupção do medicamento) foram definidos como síndrome nefrótica sensível a esteroides (SNSE). Eles foram considerados com síndrome nefrótica resistente a esteroides (SNRE) caso não houvesse resposta durante esse período. A síndrome nefrótica dependente de esteroides (SNDE) foi definida como a recidiva durante o tratamento em dias alternados ou três meses após a interrupção do tratamento.
Os critérios de inclusão foram: idade <12 anos para meninos e <10 anos para meninas, ter mais de seis meses, ter passado do início do tratamento, receber pelo menos 152mg/kg, igual a um curso inicial completo de tratamento, e concordância dos pais. Os critérios de exclusão foram: pressão arterial anormal, doença renal crônica, qualquer sinal de desenvolvimento púbere e presença de qualquer outra doença substancial que afete o crescimento linear, como hipotireoidismo e doença celíaca (descobertos por uma anamnese completa, exame físico preciso e exames laboratoriais básicos obtidos durante a primeira avaliação).
Todos os indivíduos foram inicialmente tratados com 2mg/kg/d de PDN com no máximo 80mg/dia por 4‐6 semanas, acompanhados por quatro semanas da dose do mesmo esteroide administrado em dias alternados e, então, a dose diminuiu em cerca de três meses. As recidivas foram tratadas com 40‐60mg/kg/d de PDN até cinco dias após o desaparecimento da proteinúria e, então, as doses diminuíram durante as próximas oito semanas. Os pacientes com SNDE e SNRE também receberam outros medicamentos imunossupressores, inclusive levamisol, ciclofosfamida, micofenolato de mofetila e ciclosporina.
Os seguintes dados foram preparados para análise:Data de nascimento, para calcular a idade cronológica (IC) exata em cada visita.A idade no diagnóstico e o tempo decorrido após o diagnóstico.
A primeira e a última medição do peso e da estatura (antes e depois do tratamento) foi feita por um enfermeiro clínico com instrumentos com precisão de 0,1kg e 0,1cm, respectivamente (Seca®, SP, EUA). As medições da estatura foram expressas como escore de desvio‐padrão da estatura (Ht.‐EDP) com base nas curvas de crescimento de Tanner‐Whitehouse.12
A estatura dos pais no início do tratamento, que foi usada para calcular a MPHt (estatura média dos pais ou estatura‐alvo) como a previsão da estatura pré‐tratamento.
Idade óssea: Foram feitas as radiologias da mão e punho esquerdo e classificadas de acordo com o sistema de Greulich e Pyle (GP).13 Todos os raios X ósseos foram revisados por dois radiologistas separadamente e os valores médios foram usados como o relatório final.
Medicamentos, duração e doses- –
Número de recidivas.
- –
A dose cumulativa total de PDN foi considerada como a soma de 150mg/kg para tratamento inicial e 100mg/kg para cada recidiva para os indivíduos com SNSE. Para indivíduos com SNDE e SNRE, todas as doses de PDN usadas entre as recidivas também foram acrescentadas ao cálculo. Com base nessa variável, para avaliar a possível relação entre a dose total de PDN e o crescimento linear, os pacientes foram divididos em dois grupos: 550mg/kg [150+3 × 100)] igual a ≤ 3 recidivas; e os pacientes com ≥ 550mg/kg igual a ≥ 4 recidivas.
As variáveis secundárias foram calculadas como segue:
- –
Escore de desvio‐padrão da estatura (Ht.‐EDP) foi calculado como: Ht. ‐EDP=(x‐x ?)/DP, onde “x” e “DP” são a estatura média da população de mesma idade e desvio‐padrão, respectivamente, e “x” é a estatura do paciente (dados da população de acordo com Tanner et al.12). Por exemplo, com base nos gráficos do CDC, o percentil 50 para meninos e meninas aos 20 anos (usados para determinação da Ht.‐EDP dos pais) foram considerados 177cm e 163,3cm, respectivamente. Os EDPs da estatura nessa idade foram 7,0 e 6,5cm, respectivamente.
- –
A estatura média dos pais foi calculada como a estatura‐alvo (a possível faixa de altura que uma criança deve atingir caso nenhuma doença pós‐natal ou fator ambiental tenha interagido com o potencial genético de estatura). A estatura‐alvo foi calculada como: estatura média dos pais+6,5cm em homens e estatura média dos pais ‐ 6,5cm em mulheres.
- –
A estatura adulta prevista foi calculada com as equações de Tanner e Whitehouse (TW) Mark‐2.14 As variáveis Ht., IC, IO e MPHt. são usadas nessa equação.
Estatura Adulta Prevista=a (estatura atual)+b (IC)+c (IO)+d
[a, coeficiente da estatura; b, coeficiente da idade; c, coeficiente da idade óssea; d, constante a]15
As equações permitem uma previsão da estatura adulta que, em 95% dos casos, é de±7cm da estatura adulta real nos meninos entre quatro e 16 anos e±6cm em meninas entre quatro e 11 anos.
Com essa equação, somente dois coeficientes são fornecidos para cada ano cronológico (ou seja, 6, 6,5, 7, 7,5 etc.). Portanto, foi usado neste estudo o coeficiente de cada criança com menção ao meio ano mais próximo. Esse sistema foi limitado às idades de mais de seis anos. Consequentemente, seus coeficientes anteriores (TW Mark‐1) foram usados10 para indivíduos mais novos. Em comparação com o sistema de 1975 (TW Mark‐1) e com a versão mais nova, os erros‐padrão de previsão (poucas estimativas reais) são quase os mesmos ou, ocasionalmente, maiores (perto de meio centímetro). Erros‐padrão recentes são, portanto, preferenciais.14
Para avaliar os efeitos colaterais mais curtos da PDN sobre o crescimento linear, as diferenças estatísticas entre a primeira e a última Ht.‐EDP foram analisadas ao se compararem os intervalos de confiança de 95%.
Por fim, comparamos a estatura adulta prevista (± 3,5cm como os erros‐padrão de previsão) e a estatura‐alvo média dos pais de cada paciente; menos valores e estaturas previstas serão expressos como o efeito negativo da PDN sobre o possível crescimento linear.
O escore z delta da estatura e a previsão delta da estatura foram calculados como segue:
ΔHt.Zs=Ht.Zs na última visita – Ht.Zs antes do tratamento
ΔHt. Prediction=Previsão da estatura pós‐tratamento – MPHt pré‐tratamento.
Todas as variáveis, inclusive os números de recidivas (dose cumulativa de PDN), foram comparadas entre os diferentes tipos de SN e entre os meninos e as meninas. O teste t de Student foi usado para comparar o ΔHt.Zs em diferentes grupos. A correlação entre as variações na estatura e as dose de prednisona foi avaliada pelo teste de correlação de Pearson. Os dados foram expressos como média±DP. Todos os valores de p foram bilaterais e considerados estatisticamente significativos <0,05.
Este estudo foi aprovado pelo Comitê de Ética em Pesquisa da Universidade de Ciências Médicas de Ahvaz Jundishapur.
ResultadosForam inscritos 97 pacientes (68% homens; proporção homem/mulher=2,1). Os pacientes tinham entre um e 11 anos (3,9±2,0 anos) no início do estudo e 2,5‐11,8 anos (6,95±2,41 anos) no término do estudo (somente um menino de 14 anos foi incluído). A duração média do acompanhamento foi de 2,87 (oito meses a 9,9 anos). Essa média foi 3,9±1,8 anos para pacientes com SNDE e SNRE. Todos os dados coletados e calculados são mostrados nas tabelas 1 e 2.
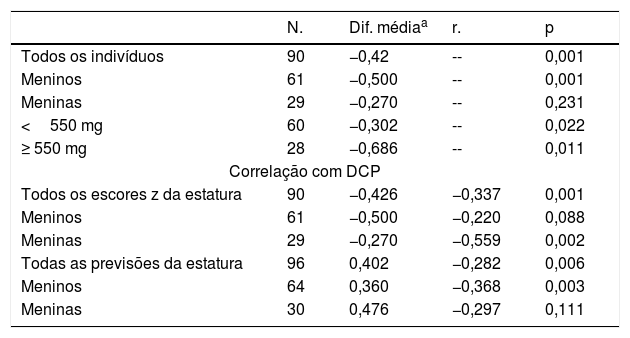
Diferença média dos índices de crescimento e seus valores em 90 crianças com síndrome nefrótica antes e depois do tratamento com prednisolona
| N. | Dif. médiaa | r. | p | |
|---|---|---|---|---|
| Todos os indivíduos | 90 | −0,42 | -- | 0,001 |
| Meninos | 61 | −0,500 | -- | 0,001 |
| Meninas | 29 | −0,270 | -- | 0,231 |
| <550 mg | 60 | −0,302 | -- | 0,022 |
| ≥ 550 mg | 28 | −0,686 | -- | 0,011 |
| Correlação com DCP | ||||
| Todos os escores z da estatura | 90 | −0,426 | −0,337 | 0,001 |
| Meninos | 61 | −0,500 | −0,220 | 0,088 |
| Meninas | 29 | −0,270 | −0,559 | 0,002 |
| Todas as previsões da estatura | 96 | 0,402 | −0,282 | 0,006 |
| Meninos | 64 | 0,360 | −0,368 | 0,003 |
| Meninas | 30 | 0,476 | −0,297 | 0,111 |
DCP, dose cumulativa de prednisolona.
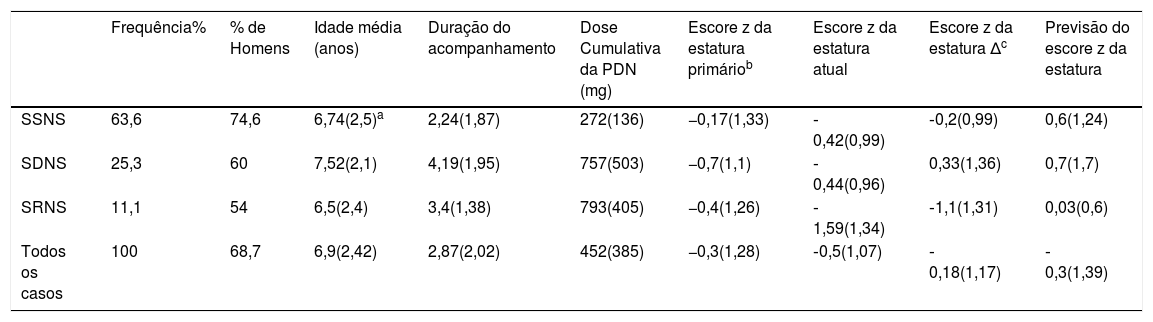
Escores z da estatura de 99 crianças tratadas para diferentes tipos de síndrome nefrótica
| Frequência% | % de Homens | Idade média (anos) | Duração do acompanhamento | Dose Cumulativa da PDN (mg) | Escore z da estatura primáriob | Escore z da estatura atual | Escore z da estatura Δc | Previsão do escore z da estatura | |
|---|---|---|---|---|---|---|---|---|---|
| SSNS | 63,6 | 74,6 | 6,74(2,5)a | 2,24(1,87) | 272(136) | −0,17(1,33) | ‐0,42(0,99) | ‐0,2(0,99) | 0,6(1,24) |
| SDNS | 25,3 | 60 | 7,52(2,1) | 4,19(1,95) | 757(503) | −0,7(1,1) | ‐0,44(0,96) | 0,33(1,36) | 0,7(1,7) |
| SRNS | 11,1 | 54 | 6,5(2,4) | 3,4(1,38) | 793(405) | −0,4(1,26) | ‐1,59(1,34) | ‐1,1(1,31) | 0,03(0,6) |
| Todos os casos | 100 | 68,7 | 6,9(2,42) | 2,87(2,02) | 452(385) | −0,3(1,28) | ‐0,5(1,07) | ‐0,18(1,17) | ‐0,3(1,39) |
SNDE, síndrome nefrótica dependente de esteroides; SNRE, síndrome nefrótica resistente a esteroides; SNSE, síndrome nefrótica sensível a esteroides.
No grupo SNSE, 26 pacientes apresentaram vários episódios de recidivas e os 37 restantes não apresentaram (seis foram novos casos e antes de dez meses de acompanhamento). A mediana da taxa de recidiva foi de duas (1‐6 recidivas) no grupo SNSE e cinco (3‐24 recidivas) no grupo SNDE.
A média da dose cumulativa de PDN foi de 452,6mg/kg e a mediana foi de 350mg/kg. A média da dose cumulativa de PDN nos grupos SNSE, SNDE e SNRE foi de 272, 757 e 793mg/kg, respectivamente; 36 pacientes (36,3%) precisaram de outros medicamentos imunossupressores, como agentes poupadores de esteroides (APE): levamisol (n=25), ciclofosfamida (n=8), MMF (n=11) e ciclosporina (n=8).
Efeito da dose cumulativa da prednisolona sobre a estaturaDe todos os 97 pacientes 71 (66%) apresentaram <4 recidivas (< 550mg/kg de PDN; grupo 1) e os 33 indivíduos restantes, grupo 2, apresentaram ≥ 4 recidivas. O segundo grupo (recidivas frequentes) mostrou mais redução na média do Ht.Zs em comparação com o primeiro grupo (‐0,84 em comparação com ‐0,28; p=0,04).
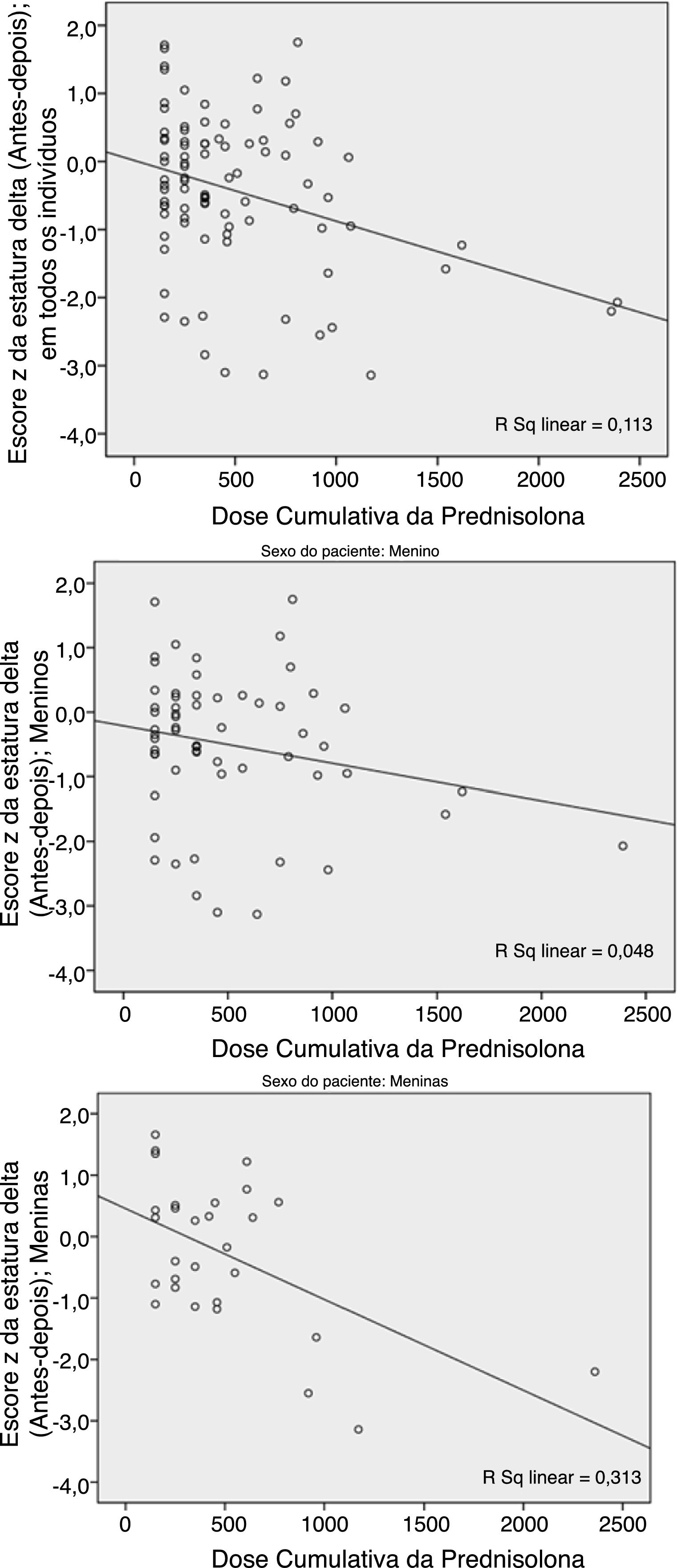
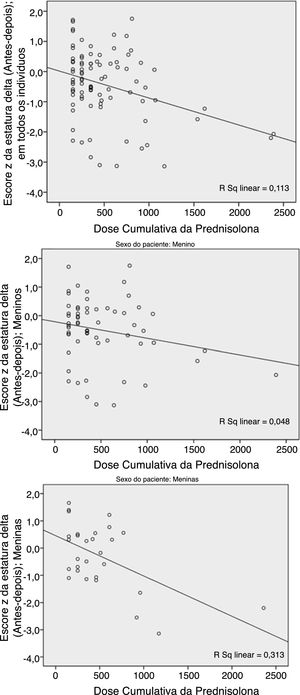
A dose cumulativa da PDN apresentou uma relação significativa (p=0,001) com a deterioração do ΔHt.Zs (a diferença entre o Ht.Zs pós e pré‐tratamento). Essa deterioração ocorreu mais em pacientes do sexo feminino (fig. 1).
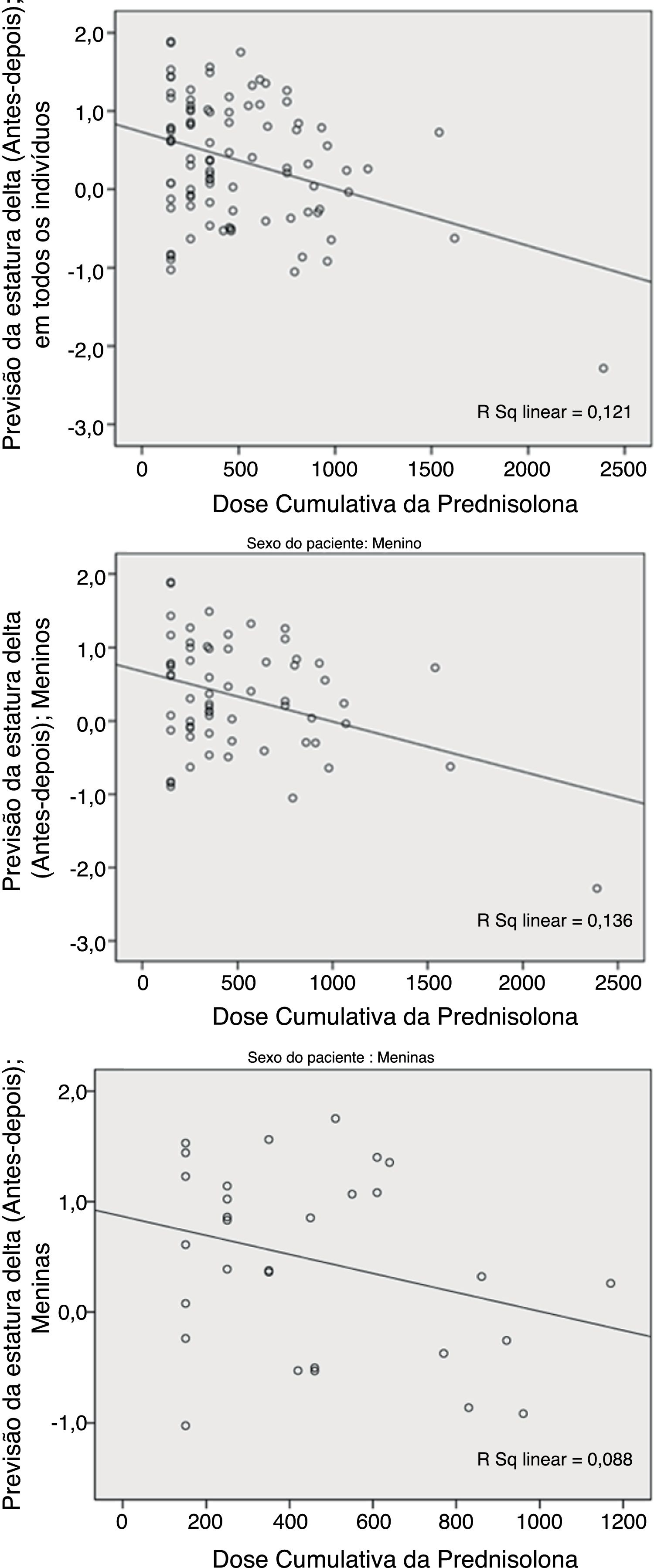
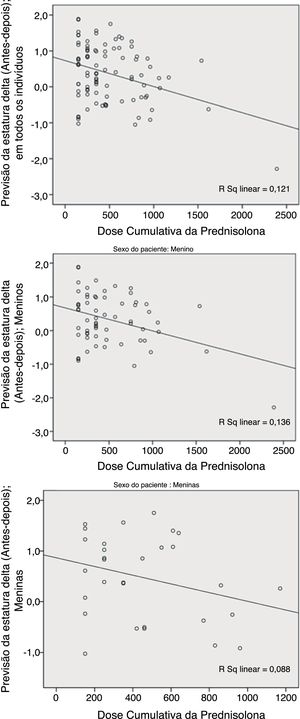
Em comparação com a média do Ht.Zs‐alvo (estatura prevista pré‐tratamento), a média do Ht.Zs previsto pós‐tratamento aumentou para DP de quase 0,4, porém, novamente, mais doses cumulativas de PDN foram associadas à maior redução na previsão pós‐tratamento em comparação com o nível pré‐tratamento. Contudo, encontramos relevância estatística somente nos pacientes do sexo masculino (p=0,006; fig. 2).
Como mostram os números, essas duas variáveis (previsão de ΔHt.Zs e ΔHt.) diferem no sexo. O teste de Pearson revelou uma maior correlação da dose cumulativa de prednisolona (DCP) e do escore Z ΔHt. em meninas do que nos meninos; p=0,002 em comparação com 0,088. Com relação à previsão de delta, houve uma maior correlação nos meninos do que nas meninas; p=0,003 em comparação com 0,111.
Os pacientes que precisaram de outros medicamentos imunossupressores apresentaram menores valores de ΔHt.Zs (p=0,047) e esse efeito foi mais significativo no grupo com ≥ 4 recidivas (p=0,03). Naqueles com <4 recidivas, a dose cumulativa de PDN não teve relação significativa com as medidas dos resultados.
A deterioração do escore z não apresentou relação significativa com o tipo de síndrome nefrótica (p> 0,05), alergia (p> 0,05), histórico familiar de doenças renais e não renais (p> 0,05), presença de hipertensão (p> 0,05) e consanguinidade dos pais (p> 0,05).
DiscussãoEste estudo visou a avaliar os possíveis efeitos de curto e longo prazo dos esteroides sobre o crescimento linear das crianças pré‐púberes com síndrome nefrótica. Os resultados mostraram seu efeito negativo sobre os pacientes com SNDE e ≥ 4 recidivas. Apesar de o efeito ter sido mais perceptível nas meninas em curto prazo, foi mais perceptível em meninos em longo prazo. Os resultados de nosso estudo foram semelhantes aos anteriores em muitos aspectos. Nosso estudo mostrou que o Ht.Zs pós‐tratamento de pacientes que recebem PDN ≥ 550mg/kg apresentou redução significativa e que a deterioração do Ht.Zs foi associada a um aumento na dose cumulativa da PDN.
O estudo de Donatti et al. que envolveu 85 indivíduos com síndrome nefrótica sensível a esteroides, de modo geral, não mostrou alterações significativas no Ht.Zs e no percentil médio da estatura na primeira e na última visita, com a divisão dos pacientes em dois grupos; contudo, caso eles apresentassem melhoria no Ht.Zs, a dose total e a duração da PDN e a idade cronológica foram maiores no último grupo. Esse grupo também relatou déficit no crescimento e puberdade tardia.16
Em uma direção oposta, Adhikari et al., em um estudo na população africana/indiana, não encontraram diferença significativa entre as crianças tratadas e não tratadas (com manejo sintomático) na média do Ht.‐EDP. Então, eles concluíram que os cursos dos esteroides diários ou da proteinúria persistente não inibiram o crescimento linear.17 Esse estudo não considerou o efeito da dose cumulativa da PDN ou a recidiva em sua avaliação.
Os resultados não uniformes vistos em estudos anteriores podem, na maior parte, ter sido obtidos de diferenças em suas metodologias e, como foi usado um ponto de corte para exposição a altas doses em comparação com baixas, é difícil comparar este estudo com os anteriores.
A supressão da osteoblastogênese na medula óssea e a promoção de osteócitos e apoptose de osteoblastos são consequências dos esteroides, que levam a uma redução na formação óssea. O acúmulo de osteócitos apoptóticos pode representar algumas definições, como osteotomia, necrose asséptica ou avascular. O efeito negativo dos esteroides sobre a massa óssea e o crescimento de curto prazo depende do tipo e da dose de esteroides e ocorre, na maior parte, durante os primeiros seis meses de tratamento. A crença comum é que os ossos trabeculares são mais afetados do que os corticais. Contudo, um estudo recente em pacientes com leucemia linfoblástica aguda constatou uma alta incidência de envolvimento dos ossos corticais após tratamento com glucocorticoides.
Por outro lado, há comprovação que indica que os esteroides induzem a reabsorção óssea ao prolongar o tempo de vida dos osteoclastos. Além disso, eles promovem perda de cálcio por meio dos rins e intestino, causam um equilíbrio negativo no metabolismo do cálcio, que induz maior atividade dos osteoclastos devido ao hiperparatireoidismo secundário.2,18
O efeito da dose cumulativa de PDN sobre o crescimento linear é mostrado melhor com estudos longitudinais. Por exemplo, o estudo de Emma et al. em crianças com SNDE (acompanhamento médio=11,7±3,5 anos) mostrou perda de DP de quase 0,5 do Ht.EDP durante o período pré‐púbere e DP de 0,7da estatura‐alvo (somente em meninos) quando eles atingiram sua estatura final. O tratamento mais prolongado foi associado ao maior risco de perda de Ht. EDP.6 Esses achados foram semelhantes a nossos resultados e também descobrimos que os efeitos negativos de longo prazo (menores valores de previsão da estatura após tratamento) são limitados aos meninos. Em comparação com o estudo de Emma et al., usar um ponto de corte torna nossa abordagem diferente, porém, na análise do impacto da PDN sobre p Ht.Zs delta e da previsão da estatura com o MPHt.Z, pode ser um ponto forte de nosso estudo. Também foi mostrado no estudo de Ribeiro et al.4 que o uso de PDN em longo prazo, principalmente em doses mais elevadas, afeta o EDP da estatura, bem como a densidade óssea da coluna. Um estudo longitudinal de Rees et al. em 41 pacientes (29 meninos) com SNSE também mostrou uma redução no EDP da estatura em meninos (somente após os 10 anos idade e foi associado a atraso na puberdade), porém não em meninas.3 Esse achado exige pesquisa adicional para explicação.
Simmonds et al. determinaram um ponto de corte no qual uma menor dose cumulativa de PDN foi compatível com crescimento normal. Ao calcular a dose diária de PDN e a velocidade do EDP da estatura entre as clínicas, nenhum efeito negativo foi encontrado sobre o crescimento em doses de PDN <0,75mg/kg/semana; com doses mais elevadas, houve uma pequena redução na velocidade do EDP da estatura.19 Em nosso estudo, foi encontrada uma relação semelhante com as doses cumulativas de PDN ≥ 550mg/kg.
Em um tratamento com altas doses de esteroides, a secreção fisiológica do hormônio do crescimento pode ser reduzida a mediana por somatostatina e, mesmo em alguns casos, os testes de estimulação do hormônio do crescimento não conseguem trazer respostas adequadas.20
O atingimento do pico de massa óssea e crescimento também pode ser prejudicado pelos esteroides, devido ao eixo gonadal hipofisário alterado. Um hipogonadismo hipogonadotrófico reversível é mostrado em estudo em adultos com terapia de esteroides. A insuficiência adrenal seguindo terapia crônica com glicocorticoides também pode estar associada a baixos níveis de outros esteroides sexuais, como androstenediona e estrogênio. Os esteroides também podem afetar o hormônio FSH e causar redução na secreção de estrogênio.21,22
A puberdade ocorre entre a infância e o tempo de atingimento da estatura final. Seu início varia de acordo com as características genéticas étnicas e familiares e pode durar de dois a seis anos. Cada família tem um padrão individual de progresso quando à taxa geral e aos intervalos entre os estágios. Mesmo em uma criança saudável, não é possível prever com exatidão o início da puberdade e seu salto de crescimento. Com a exposição a esteroides e seus efeitos negativos sobre o processo púbere e a formação óssea, essas previsões se tornam mais difíceis. Assim, o presente estudo excluiu completamente os estágios da puberdade da análise de acompanhamento. O acompanhamento longitudinal dos pacientes após o término da puberdade pode resolver esse problema quando eles atingirem a estatura final. Para encontrar uma diferença entre os sexos nos impactos negativos de curto e longo prazo da PDN (em meninas e meninos, respectivamente), basta associar os anos pré‐púberes mais curtos nas meninas do que nos meninos.
Por fim, foi melhor comparar o escore z da estatura pré‐tratamento e pós‐tratamento, porém, devido ao fato de as idades ósseas pré‐tratamento não estarem disponíveis nos indivíduos, usamos o MPHtZ como possível estatura‐alvo, que, teoricamente, não deve mudar da infância para a adolescência. Comparar diferentes itens antes e depois do tratamento para avaliar os efeitos colaterais da PDN pode apresentar falhas. Apesar de o número de pacientes neste estudo ter sido maior do que nos anteriores, uma população muito maior em um estudo multicêntrico por um tempo maior forneceria melhores resultados. A curta duração (< 2,5 anos) do acompanhamento em mais da metade dos pacientes pode afetar os resultados.
Contudo, as equações usadas neste estudo foram obtidas com base nos dados de uma população britânica. Mas elas foram verificadas em uma população japonesa. Ainda assim, é necessário associar com os dados brutos de cada população para avaliar a aplicabilidade.14
Por fim, estávamos mais familiarizados com o sistema de GP para avaliação da idade óssea e, então, ele foi usado como parte do sistema de TW Mark‐2 para previsão da estatura. De fato, o método original de classificação da idade óssea na fórmula de TW é seu próprio Sistema, e não o de GP.
Este estudo mostrou o efeito negativo da dose cumulativa de PDN sobre o crescimento linear na síndrome nefrótica; felizmente, isso aconteceu, na maior parte das vezes, na doença prolongada com ≥ 4 recidivas. Esse achado é importante para dar a certeza aos pais da segurança relativa desse medicamento que salva vidas. Por fim, a importância da intervenção precoce no crescimento em recidivas frequentes é garantida.
FinanciamentoVice‐chanceler da Universidade de Ciências Médicas de Ahvaz Jundishapur, Ahvaz, Irã.
Conflitos de interesseOs autores declaram não haver conflitos de interesse.
Como citar este artigo: Valavi E, Aminzadeh M, Amouri P, Rezazadeh A, Beladi‐Mousavi M. Effect of prednisolone on linear growth in children with nephrotic syndrome. J Pediatr (Rio J). 2020;96:117–24.