This study aimed to investigate the relationship between circulating endothelial progenitor cell count and endothelial activation in a pediatric population with obesity.
MethodsObservational and transversal study, including 120 children and adolescents with primary obesity of both sexes, aged 6–17 years, who were recruited at this Cardiovascular Risk Clinic. The control group was made up of 41 children and adolescents with normal body mass index. The variables analyzed were: age, gender, body mass index, systolic and diastolic blood pressure, high‐sensitivity C‐reactive protein, lipid profile, leptin, adiponectin, homeostasis model assessment‐insulin resistance, monocyte chemoattractant protein‐1, E‐selectin, asymmetric dimethylarginine and circulating progenitor endothelial cell count.
ResultsInsulin resistance was correlated to asymmetric dimethylarginine (ρ=0.340; p=0.003), which was directly, but weakly correlated to E‐selectin (ρ=0.252; p=0.046). High sensitivity C‐reactive protein was not found to be correlated to markers of endothelial activation. Systolic blood pressure was directly correlated to body mass index (ρ=0.471; p<0.001) and the homeostasis model assessment‐insulin resistance (ρ=0.230; p=0.012), and inversely correlated to adiponectin (ρ=−0.331; p<0.001) and high‐density lipoprotein cholesterol (ρ=−0.319; p<0.001). Circulating endothelial progenitor cell count was directly, but weakly correlated, to body mass index (r=0.211; p=0.016), leptin (ρ=0.245; p=0.006), triglyceride levels (r=0.241; p=0.031), and E‐selectin (ρ=0.297; p=0.004).
ConclusionCirculating endothelial progenitor cell count is elevated in obese children and adolescents with evidence of endothelial activation, suggesting that, during infancy, endothelial repairing mechanisms are present in the context of endothelial activation.
Investigar a relação entre os números de células progenitoras endoteliais circulantes e a ativação endotelial em uma população pediátrica com obesidade.
MétodosEstudo observacional e transversal, que incluiu 120 crianças e adolescentes com obesidade primária de ambos de sexos, entre seis e 17 anos, recrutados de nossa Clínica de Riscos Cardiovasculares. O grupo de controle contou com 41 crianças e adolescentes com índice de massa corporal normal. As variáveis analisadas foram: idade, sexo, índice de massa corporal, pressão arterial sistólica e diastólica, proteína C reativa de alta sensibilidade, perfil lipídico, leptina, adiponectina, resistência à insulina para avaliação do modelo de homeostase, proteína quimiotática de monócitos‐1, E‐seleticna, dimetilarginina assimétrica e números de células endoteliais progenitoras circulantes.
ResultadosA resistência à insulina foi correlacionada à dimetilarginina assimétrica (p=0,340; p=0,003), que foi diretamente correlacionada, porém de forma muita amena, à E‐seleticna (ρ=0,252; p=0,046). Não constatamos que a proteína C reativa de alta sensibilidade estivesse correlacionada a marcadores de ativação endotelial. A pressão arterial sistólica foi diretamente correlacionada ao índice de massa corporal ρ=0,471; p<0,001) e à resistência à insulina para avaliação do modelo de homeostase (ρ=0,230; p=0,012) e inversamente correlacionada à adiponectina (ρ=−0,331; p<0,001) e à lipoproteína de alta densidade‐colesterol ρ=−0,319; p<0,001). Os números de células progenitoras endoteliais circulantes foram diretamente correlacionados, porém de forma muito amena, ao índice de massa corporal (r=0,211; p=0,016), à leptina (ρ=0,245; p=0,006), aos níveis de triglicerídeos (r=0,241; p=0,031) e à E‐seleticna ρ=0,297; p=0,004).
ConclusãoOs números de células progenitoras endoteliais circulantes são elevados em crianças e adolescentes obesos com comprovação de ativação endotelial. Isso sugere que, na infância, os mecanismos de reparação endotelial estão presentes no contexto da ativação endotelial.
Na obesidade, vários agentes inflamatórios, como a proteína C reativa1‐3 e a leptina,4 desregulam a produção de óxido nítrico por meio da inibição de sua enzima limitante da velocidade, o óxido nítrico sintase endotelial (eNOS).5,6 Outras substâncias endógenas, como a dimetilarginina assimétrica (ADMA), um antagonista competitivo do eNOS, também desempenham um papel no comprometimento ainda maior da biodisponibilidade de óxido nítrico. Sua produção é estimulada por agentes inflamatórios, como a proteína C reativa.7 Diferentemente do óxido nítrico, ela pode ser facilmente avaliada e usada como substituto para a biodisponibilidade de óxido nítrico.
O endotélio danificado é reparado por meio da proliferação de células endoteliais adjacentes, cuja capacidade regenerativa é limitada, e pela migração de células progenitoras, provenientes da medula óssea, conhecidas como células endoteliais progenitoras circulantes (CEPCs). Elas expressam diversos marcadores de células semelhantes aos expressos pelo endotélio vascular, que mostra propriedades regenerativas vasculares e, assim, participa da nova formação de vasos.8
Em pacientes com fatores de risco cardiovascular, como hipertensão arterial e resistência à insulina, o número e a função das células progenitoras endoteliais são reduzidos. Nelas, o risco de eventos cardiovasculares é maior.9,10
Os marcadores inflamatórios também parecem reduzir o número de células progenitoras endoteliais, o que implica um possível papel na obesidade.11,12
Neste estudo, dois foram nossos objetivos. Primeiro, demonstrar que a ativação endotelial está presente na obesidade infantil e, segundo, que os mecanismos de reparo, por meio da ativação de células progenitoras endoteliais, não são comprometidos nessa fase inicial.
MétodosIndivíduosOs autores fizeram uma análise observacional e transversal em uma coorte de crianças e adolescentes obesos, recrutaram‐nos aleatoriamente e acompanharam‐nos em uma clínica de riscos cardiovasculares. Todos os pais forneceram seu consentimento informado para que as crianças participassem do estudo, que foi aprovado pelo Comitê de Ética Local.
Os critérios de inclusão foram obesidade primária (índice de massa corporal [IMC] acima do percentil 95 para sexo e idade) em crianças e adolescentes entre seis e 17 anos, sem doenças recentes ou crônicas. Os critérios de exclusão incluíram causas secundárias de obesidade, doenças infecciosas ou inflamatórias agudas (em um mês da coleta das amostras) e doenças crônicas.
O grupo de controle incluiu crianças e adolescentes saudáveis, não relacionados ao grupo de estudo, na mesma faixa etária e com IMC normal (percentil 5‐85), recrutados da Clínica de Cardiologia, para onde foram encaminhados para avaliação de sopros, porém provaram não haver anomalias cardíacas subjacentes. Todos estavam em jejum de 12 horas antes da avaliação clínica e da coleta de sangue.
O grupo de estudo abrangeu 120 crianças e adolescentes e o grupo de controle contou com 41 crianças e adolescentes, de ambos os sexos. Com base em nosso tamanho da amostra, obtivemos um nível de significância (valor de p) de 0,05, poder estatístico de 0,80 e tamanho do efeito de 0,52. Esses valores foram calculados com o programa G*Power 3.1.5.
As variáveis analisadas foram: idade, sexo, índice de massa corporal, pressão arterial sistólica, pressão arterial diastólica, colesterol total, lipoproteína de alta densidade‐colesterol (HDL‐C), colesterol de lipoproteína de baixa densidade (LDL‐C), triglicerídeos, proteína C reativa de alta sensibilidade (hsCRP), proteína quimiotática de monócitos‐1 (MCP‐1), perfil lipídico, leptina, adiponectina, resistência à insulina para avaliação do modelo de homeostase (HOMA‐IR), E‐seleticna, dimetilarginina assimétrica e números de células endoteliais progenitoras circulantes.
Avaliação clínica e antropométricaO peso (em quilogramas para as 100g mais próximas) foi determinado com uma balança digital Seca 220® (Sistemas de Medição Médica e Balanças, Hamburgo, Alemanha) e para medir a altura de pé (em centímetros para o 0,1cm mais próximo) foi usado um estadiômetro incluído no mesmo equipamento. As crianças vestiam apenas suas roupas íntimas. O índice de massa corporal foi calculado com base na fórmula: IMC = (peso/altura2).13 Usamos os gráficos de percentil do IMC da Organização Mundial de Saúde (OMS) para definir o IMC (obesidade se IMC > percentil 95; normal se IMC entre percentil 5‐85).
Os critérios para síndrome metabólica em crianças e adolescentes foram definidos de acordo com o consenso da Federação Internacional de Diabetes.14
Coleta de sangue e análise bioquímicaAmostras de sangue venoso em jejum (15mL) foram coletadas para estimar os parâmetros hematológicos. As amostras de sangue foram coletadas em tubos de contenção a vácuo com ou sem ácido etilenodiaminotetracético (EDTA), conforme necessário. O soro e o plasma foram preparados e então congelados (−80°C) para armazenamento até ser analisados. A proteína C reativa de alta sensibilidade foi determinada por imunonefelometria a partir de amostras de soro e processada no Sistema BN ProSpec® (Siemens Healthcare Diagnostics Inc, Munique, Alemanha) (não detectado se < 0,02mg/dL).
A proteína quimiotática de monócitos‐1, dimetilarginina assimétrica e E‐seleticna foram determinadas pelo ensaio imunossorvente ligado a enzima (Elisa) com os kits de ensaio imunossorvente ligado a enzima comercialmente disponíveis OptEIATM (BD Biosciences Pharmingen, CA, EUA).
Os níveis de leptina e adiponectina foram determinados com os kits de ensaio imunossorvente ligado a enzima comercialmente disponíveis (eBioscience, San Diego, CA, EUA e BioVendor, Brno, República Checa, respectivamente).
Os níveis de insulina foram determinados por quimioluminescência a partir de amostras de soro e processados no analisador Immulite 2000® (Siemens Healthcare Diagnostics Inc, Munique, Alemanha) e os níveis de glicose foram determinados a partir de amostras de plasma analisadas no sistema Vitros 5.1 FS® (Ortho Clinical Diagnostics, Johnson & Johnson, NY, EUA) por meio da tecnologia de microlâminas.
A avaliação do modelo de homeostase – resistência à insulina – foi calculada com base na fórmula: Homa‐IR = insulina (um/L) x glicose (mmol/L)/22,5 e foi considerada 3 no valor de corte para o diagnóstico de resistência à insulina.15
As concentrações de colesterol total, lipoproteína de baixa densidade‐colesterol (LDL‐C), lipoproteína de alta densidade‐colesterol (HDL‐C) e triglicerídeos foram mensuradas com um analisador bioquímico automatizado Vitros 5.1 FS® (Ortho Clinical Diagnostics, Johnson & Johnson, NY, EUA).
Para determinar os números de células progenitoras endoteliais circulantes, sangue periférico (SP) foi coletado em tubos EDTA, armazenado em gelo e processado em duas horas. A identificação e caracterização das EPCs circulantes foram feitas com um anticorpo anti‐CD146 conjugado com isotiocianato de fluoresceína (clone: P1H12, Becton Dickinson [BD], CA, EUA), anti‐KDR conjugado com ficoeritrina (clone: 89106, R&D System, Headquarters, Minneapolis, EUA), proteína clorofila peridinina‐cianina 5.5 (clone: 8G12, BD Bioscience, CA, EUA), aloficocianina anti‐CD133 (clone: 293C3, Miltenyi Biotec, Bergisch Gladbach, Alemanha) e CD45 laranja cromado (clone: J.33, Immunotech – Beckman Coulter, Marselha, França) combinação de anticorpos monoclonais (mAb).
Para coloração da amostra, foi usada uma técnica de imunofluorescência. Os dados foram obtidos em um citômetro de fluxo FACSCanto II® (BD Biosciences Pharmingen, CA, EUA) com o software FACSDiva® (BD Biosciences Pharmingen, CA, EUA). Para identificação das EPCs, seguimos a estratégia de propagação sequencial da Sociedade Internacional de Hemoterapia e Engenharia de Enxertos (ISHAGE) proposta por Schmidt‐Lucke.
As EPCs circulantes foram identificadas de acordo com um perfil antigênico mínimo que inclui no mínimo um marcador de stemness/imaturidade (CD34 e CD133), mas no mínimo um marcador de comprometimento endotelial (KDR e CD146). A coloração CD45 foi usada para excluir leucócitos.
Para a análise de dados, usamos o software Infinicyt™, V.1.5 (Cytognos SL, Salamanca, Espanha).
Análise estatísticaOs dados foram analisados com o software IBM SPSS 20 (IBM Corp. Released 2011. IBM SPSS Statistics for Windows, NY, EUA). A análise descritiva das variáveis paramétricas foi feita com o cálculo da média ± erro padrão da média. O teste t de Student e o teste U de Mann‐Whitney foram usados para calcular as diferenças nos parâmetros demográficos, clínicos e hematológicos entre os grupos de obesidade e controle, a depender da normalidade da distribuição. Para as variáveis de resposta categóricas, as diferenças entre os dois grupos foram avaliadas com o teste qui‐quadrado. A regressão logística foi usada quando as variáveis clínicas foram controladas entre os dois grupos. Para estabelecer a correlação entre os parâmetros no grupo de obesos foram usadas as correlações de Spearman e de Pearsons. Os resultados com p ≤ 0,05 foram considerados estatisticamente significativos.
ResultadosAnálise comparativa entre os grupos de obesos e controleForam incluídos no estudo 120 crianças e adolescentes obesos, 61 meninos e 59 meninas, seis e 17 anos (idade média de 11,65 anos ± 2,96). O grupo de controle contou com 41 crianças e adolescentes saudáveis e não obesos, 29 meninos e 12 meninas, na mesma faixa etária (idade média de 12,73 anos ± 2,77).
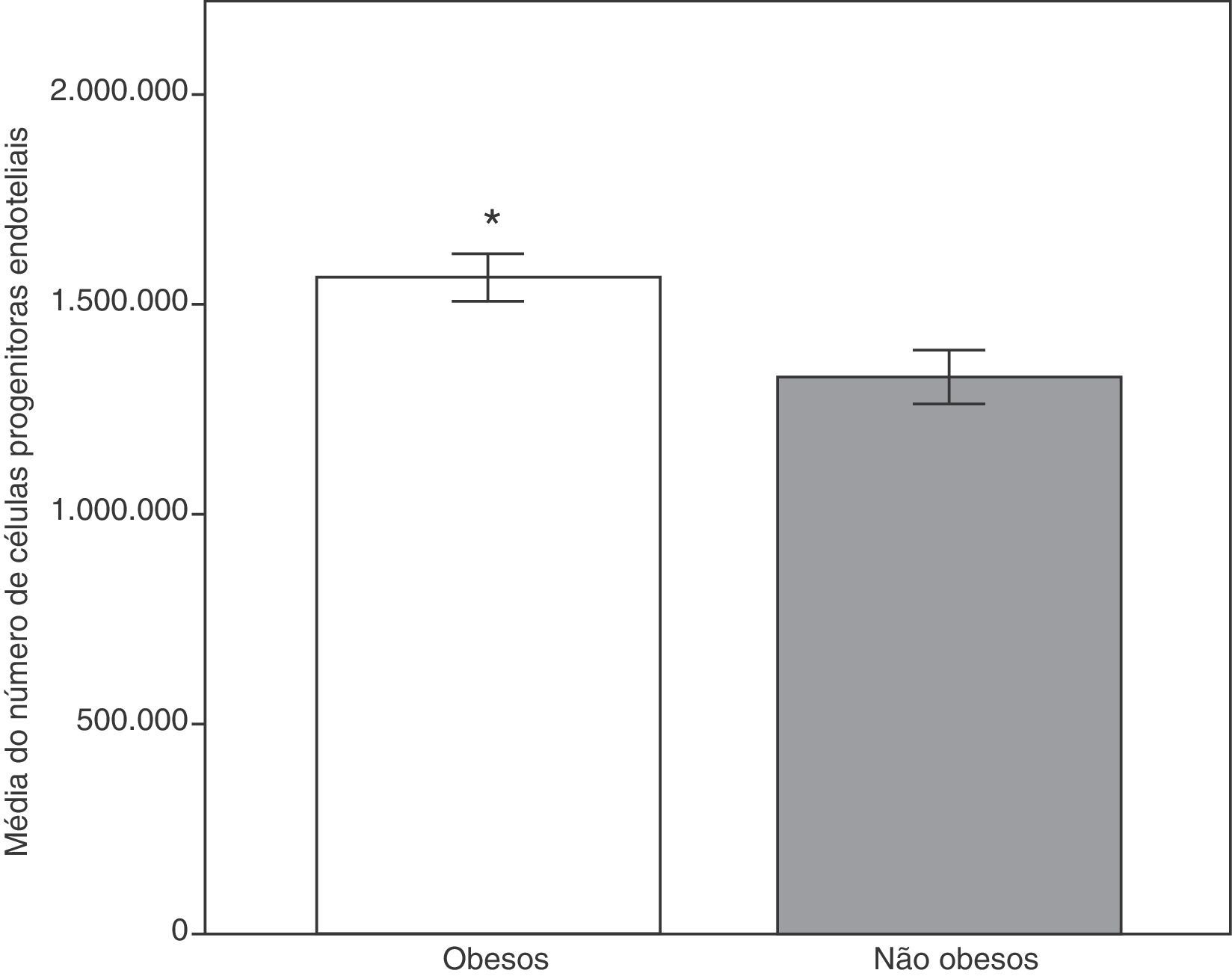
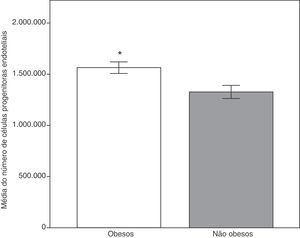
Comparamos primeiramente os parâmetros antropométricos, clínicos e analíticos dos dois grupos. Conforme demonstrado na tabela 1, todas as médias dos parâmetros analisados foram significativamente maiores no grupo de obesos, inclusive E‐seleticna, ADMA e células progenitoras endoteliais circulantes, exceto adiponectina e HDL‐C (fig. 1). O colesterol total e a proteína quimiotática de monócitos‐1 não mostraram diferenças estatísticas significativas.
Parâmetros antropométricos, clínicos e analíticos dos grupos de obesos e não obesos
| Variável | Obeso | Não obeso | valor de p | ||
|---|---|---|---|---|---|
| n | Média ± EPM | N | Média ± EPM | ||
| Idade (anos) | 120 | 11,65 ± 0,43 | 41 | 12,73 ± 0,27 | 0,038a |
| IMC (Kg/m2) | 120 | 28,47 ± 0,44 | 41 | 18,93 ± 0,43 | < 0,001b |
| PAS (mmHg) | 120 | 116,60 ± 1,16 | 41 | 107,77 ± 1,75 | < 0,001b |
| PAD (mmHg) | 120 | 61,19 ± 0,69 | 41 | 54,95 ± 1,41 | < 0,001a |
| Leptina (ng/mL) | 118 | 28,97 ± 1,63 | 41 | 4,85 ± 0,71 | < 0,001a |
| Adiponectina (μg/mL) | 95 | 3,60 ± 0,14 | 32 | 5,17 ± 0,41 | < 0,001a |
| Insulina (UI/mL) | 119 | 12,95 ± 0,73 | 33 | 7,32 ± 0,75 | < 0,001a |
| HOMA‐IR | 118 | 2,81 ± 0,17 | 33 | 1,54 ± 0,15 | < 0,001a |
| MCP‐1 (pg/mL) | 65 | 331,54 ± 46,49 | 31 | 304,53 ± 48,33 | NS |
| hsCRP (mg/dL) | 118 | 0,2781 ± 0,03 | 40 | 0,05 ± 0,09 | < 0,001a |
| TC (mg/dL) | 120 | 166,86 ± 2,52 | 41 | 163,83 ± 5,39 | NS |
| HDL‐C (mg/dL) | 120 | 47,33 ± 0,90 | 41 | 59,17 ± 2,04 | < 0,001a |
| LDL‐C (mg/dL) | 120 | 96,45 ± 2,44 | 41 | 82,71 ± 3,74 | 0,004b |
| TG (mg/dL) | 120 | 82,71 ± 4,93 | 41 | 59,15 ± 4,28 | < 0,001a |
| ADMA (μmol/L) | 76 | 0,44 ± 0,01 | 31 | 0,38 ± 0,02 | 0,005a |
| E‐seleticna (pg/mL) | 77 | 12,8 ± 0,84 | 30 | 9,03 ± 0,92 | 0,003b |
| EPCs (números) | 100 | 1565532,31 ± 56764,76 | 29 | 1328311,00 ± 64449,43 | 0,007b |
| Masculino n (%) | 120 | 61 (50,8%) | 41 | 29 (70,7%) | 0,027b |
IMC, índice de massa corporal; PAS, pressão arterial sistólica; PAD, pressão arterial diastólica; HOMA‐IR, resistência à insulina para avaliação do modelo de homeostase; MCP‐1, proteína quimiotática de monócitos‐1; hsCRP, proteína C reativa de alta sensibilidade; TC, colesterol total; HDL‐C, lipoproteína de alta densidade‐colesterol; LDL‐C, colesterol de lipoproteína de baixa densidade; TG, triglicerídeos; ADMA, dimetilarginina assimétrica; EPCs, números de células progenitoras endoteliais circulantes; NS, valor de p não significativo; n, número de amostras; EPM, erro padrão da média.
Números de células progenitoras endoteliais nos grupos de obesos e não obesos. Os níveis mais elevados no grupo de obesos podem refletir a resposta pelos mecanismos de reparação secundários à ativação endotelial precoce.
Dados expressos como médias ± erro padrão da média.
Grupo de obesos, n = 100; grupo de não obesos, n = 29.
*Teste t de Student, p < 0,01 em comparação com o grupo de não obesos.
Como a idade (p = 0,038) e o sexo (p = 0,027) foram diferentes significativamente entre os dois grupos, a análise foi repetida com a regressão logística e mostrou que os resultados não apresentaram diferenças significativas, a saber, MCP‐1 (p = 0,334); ADMA (p = 0,005); E‐seleticna (p = 0,008) e EPCs (p = 0,043). O colesterol total e a MCP‐1 continuaram a não mostrar diferenças significativas.
Os números de células progenitoras endoteliais circulantes foram diretamente correlacionados, porém de forma muito amena, ao IMC (r = 0,21; p = 0,016), à leptina (ρ = 0,25; p = 0,006), aos níveis de triglicerídeos (r = 0,24; p = 0,031) e à E‐seleticna (ρ = 0,30; p = 0,004).
Análise do grupo de obesosO índice de massa corporal foi correlacionado diretamente e de forma moderada à MCP‐1 (ρ = 0,51; p < 0,001), pressão arterial sistólica (ρ = 0,47; p < 0,001), leptina (ρ =0,40; p < 0,001), Homa‐IR (ρ = 0,35; p < 0,001), fracamente correlacionado à hsCRP (ρ = 0,22; p = 0,018) e correlacionado inversamente, porém de forma amena, à adiponectina (ρ = −0,28; p = 0,007) e HDL‐C (ρ = −0,26; p = 0,004).
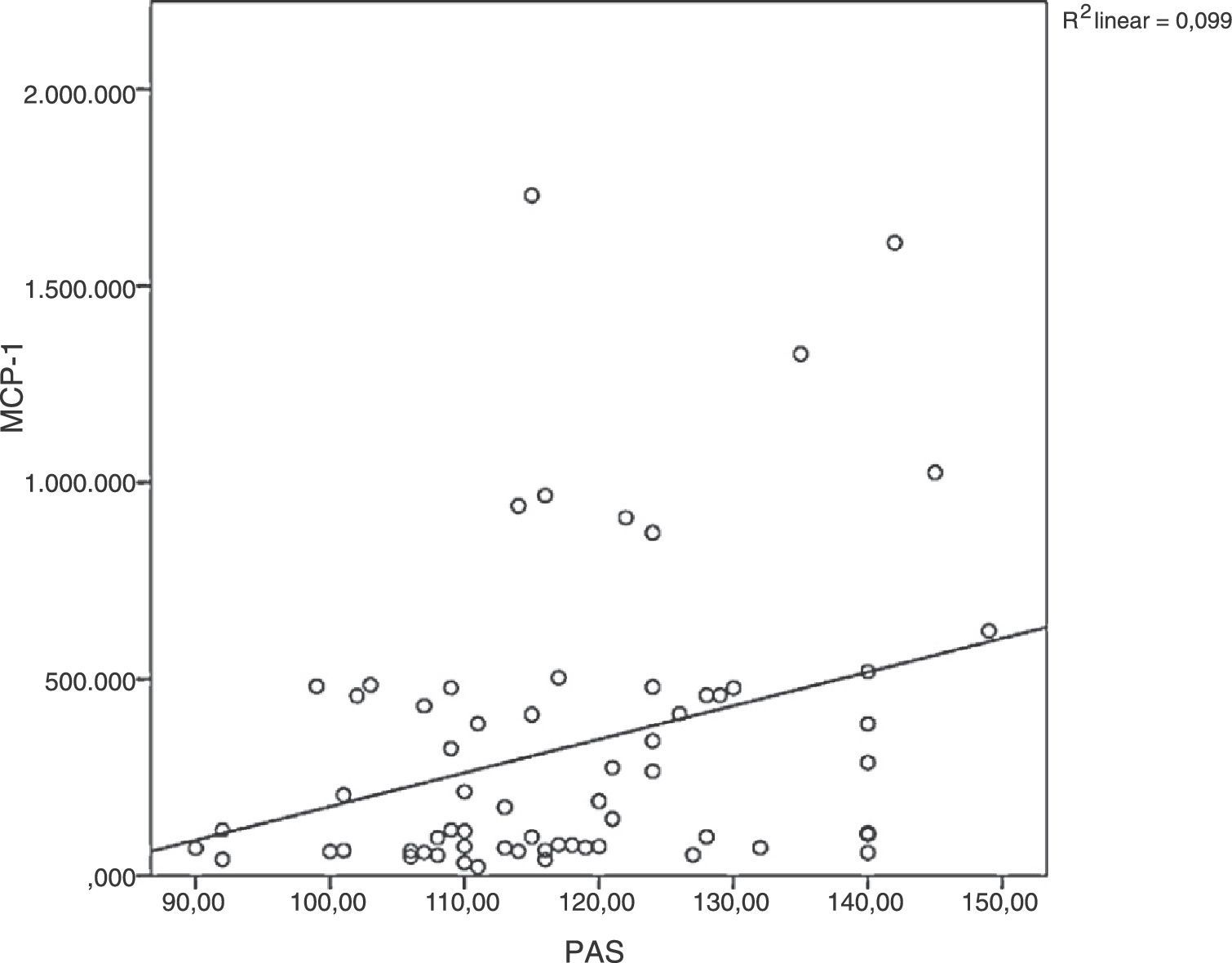
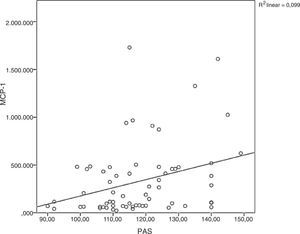
A proteína quimiotática de monócitos‐1 foi diretamente correlacionada à pressão arterial sistólica (ρ = 0,34; p = 0,005) conforme demonstrado na fig. 2. A proteína C reativa de alta sensibilidade foi fracamente correlacionada à leptina (ρ = 0,32; p < 0,001) e ao LDL‐C (ρ = 0,23; p = 0,011).
Correlação entre proteína quimiotática de monócitos‐1 e pressão arterial sistólica. Em obesidade, os fatores de risco cardiovascular agrupam e contribuem para o processo inflamatório, conforme observado na correlação entre pressão arterial sistólica e MCP‐1 no presente estudo.
PAS, pressão arterial sistólica; MCP‐1, proteína quimiotática de monócitos‐1.
A pressão arterial sistólica foi inversamente correlacionada à adiponectina (ρ = ‐ 0,33; p = 0,001) e diretamente correlacionada à Homa‐IR (ρ = 0,23; p = 0,012) e, conforme esperado, moderadamente correlacionada à idade (ρ = 0,50; p < 0,001). A pressão arterial diastólica apresentou correlações menos evidentes.
A resistência à insulina para avaliação do modelo de homeostase foi correlacionada à ADMA (ρ = 0,34; p = 0,003) e mostrou a relação mais direta com um marcador de ativação endotelial. Isso ficou particularmente evidente nos valores de Homa‐IR acima de 3 (p = 0,003). O valor de corte foi usado para definir a resistência à insulina. Também foi diretamente correlacionada à leptina (ρ = 0,39; p < 0,001), pressão arterial sistólica (ρ = 0,23; p < 0,012), pressão arterial diastólica (ρ = 0,20; p < 0,033) e inversamente correlacionada à adiponectina (r = −0,21; p = 0,040).
Síndrome metabólica foi observada em 11,7% (n = 14) de nossos pacientes obesos. Conforme esperado, como parte da definição, a pressão arterial sistólica (p = 0,005), porém não diastólica (p = 0,0728), foi maior do que os níveis de triglicerídeos (p < 0,001), a HDL‐C foi menor (p = 0,007) e não houve diferenças significativas nos níveis de glicose. Com relação aos marcadores de ativação endotelial e aos mecanismos de reparação, constatamos que a ADMA foi diretamente, porém fracamente, correlacionada à E‐seleticna (ρ = 0,25; p = 0,046) e essa fracamente correlacionada aos números de células progenitoras endoteliais circulantes (ρ = 0,22; p = 0,047).
DiscussãoEste estudo demonstra claramente que, ao contrário do grupo de controle, os números de células progenitoras endoteliais aumentaram nas crianças e adolescentes obesas com comprovação de inflamação de baixo grau e ativação endotelial. Constatamos também correlações entre adiposidade, marcadores inflamatórios e obesidade relacionada a comorbidades, como hipertensão arterial e resistência à insulina.
A proteína quimiotática de monócitos‐1 regula a migração e a infiltração de monócitos e macrófagos16 na parede vascular e desempenha um papel importante em doenças inflamatórias, como a obesidade.17 Como as pesquisas translacionais são escassas nessa área, estávamos interessados em avaliar a relação da MCP‐1 com obesidade relacionada a comorbidades. Ao contrário dos achados de Breslin et al.,18 não encontramos diferenças nos níveis de MCP‐1 entre os grupos de obesos e controle nem encontramos relação com dislipidemia (dados não apresentados), possivelmente devido a um diferente tamanho da amostra (39 crianças e adolescentes obesos) e à etnia (americana‐mexicana). Contudo, em nosso grupo de obesos, a MCP‐1, ao contrário da hsCRP, apresentou uma correlação direta com a pressão arterial sistólica. Essa tendência não foi constatada no grupo de controle. Assim, é tentador postular que, na obesidade infantil, a MCP‐1 contribui para hipertensão arterial e está implicitamente envolvida nos mecanismos fisiopatológicos que levam a doenças cardiovasculares mais tarde na vida adulta. Com base em nossa comprovação, deduzimos que a MCP‐1, em comparação com a hsCRP, aparentemente seria um marcador mais significativo de riscos cardiovasculares. Contudo, devido ao nosso tamanho da amostra, pesquisas adicionais precisam ser feitas nessa área. No melhor de seu conhecimento, essas associações não foram descritas anteriormente.
A prevalência de hipertensão arterial na infância varia de 3 a 5%.19 Nosso grupo de obesos apresentou valores de pressão arterial sistólica e diastólica significativamente maiores (p < 0,001) do que nosso grupo de controle. A prevalência de hipertensão arterial no grupo de obesos foi de 9,2% e quase um terço apresentou pré‐hipertensão (26,7%). Além da MCP‐1 e assim como os achados de Moser et al.,20 a pressão arterial sistólica foi diretamente correlacionada ao índice de massa corporal e inversamente relacionada à adiponectina e HDL‐C. Esse bloco de medidores correlaciona adiposidade visceral, inflamação, resistência à insulina e hipertensão, alguns dos componentes da síndrome metabólica, encontrados em 11,7% de nosso grupo de obesos. Um achado específico interessante foi a correlação inversa entre adiponectina e hipertensão arterial, que corrobora os achados de Brambilla et al.,21 nos quais adiponectina foi proposta como um dos mecanismos relacionados à hipertensão na obesidade infantil. Isso significa que a perda de suas propriedades antiaterogênicas e anti‐inflamatórias contribuir para os mecanismos subjacentes da obesidade relacionada à hipertensão.
Adicionalmente, a perda das propriedades sensibilizadoras de insulina da adiponectina que ocorre na obesidade também implicou resistência à insulina.22 Ao contrário dos achados de Lee et al.,23 nos quais a adiponectina é aparentemente uma forte variável preditora independentemente de sensibilidade à insulina em crianças e adolescentes obesos de diferentes raças, constatamos que a adiponectina está correlacionada à hiperinsulinemia (r = −0,23; p = 0,033), porém não à resistência à insulina (n = 38%; p = 0,277), apesar das diferenças marcantes nos níveis de adiponectina entre os grupos de obesos e controle (p < 0,001).
Nosso estudo abrangeu um grupo de brancos de uma área geográfica diferente, que, juntamente com nosso tamanho da amostra (n = 45 com Homa‐IR > 3), pode representar as diferenças observadas, apesar de polimorfismos no gene da adiponectina também poder desempenhar um papel. Essa hipótese é meramente especulativa, pois não foi testada em nosso trabalho. Contudo, essa lógica não pode ser aplicada à leptina, que apresentou uma correlação mais forte com hiperinsulinemia (r = 0,35; p < 0,001) e resistência à insulina (p < 0,001), achados que estão de acordo com trabalhos anteriormente publicados.24 Também não encontramos associação entre a MCP‐1 (p = 0,168), a hsCRP (p = 0,375) e a resistência à insulina.
Também tentamos relacionar a ADMA e a E‐seleticna, ambos marcadores de ativação endotelial, a resistência à insulina. Em adultos, os níveis elevados de dimetilarginina assimétrica são considerados um marcador de riscos cardiovasculares e, como substituto da biodisponibilidade de óxido nítrico, refletem a integridade endotelial. Encontramos uma correlação direta entre a Homa‐IR e a ADMA (r = 0,35; p = 0,003), particularmente evidente em nosso grupo resistente à insulina (p = 0,003), achados não relatados anteriormente. Alguns relatos sugeriram que a ADMA contribui para resistência à insulina, pois a redução na biodisponibilidade de óxido nítrico reduz o fluxo sanguíneo para tecidos sensíveis à insulina e compromete a absorção de glicose em resposta à insulina.25 Por outro lado, não constatamos que resistência à insulina em si contribua para disfunção endotelial. Nessas circunstâncias, é tentador especular o papel permissivo da ADMA na interação entre a resistência à insulina e a disfunção endotelial, por meio de suas ações na biodisponibilidade de óxido nítrico. Encontramos também uma correlação direta entre a leptina e a ADMA, porém apenas em meninas. Isso não é uma surpresa, pois os níveis de leptina foram significativamente maiores em meninas obesas (p < 0,001). Contudo, esse achado, não relatado anteriormente, possivelmente relaciona a leptina, e assim a adiposidade, à ativação endotelial. De forma comparativa, a regressão linear por transformação logarítmica mostrou que a resistência à insulina apresentou maior influência sobre a ADMA.
A E‐seleticna é uma molécula de adesão endotelial específica cujos níveis encontram‐se aumentados na disfunção endotelial e promove a migração de células inflamatórias para a camada íntima. Em nossa análise, crianças e adolescentes obesos apresentaram níveis significativamente maiores do que os controles saudáveis. Isso significa presença de ativação endotelial e indica estágio inicial de aterosclerose. Considerando toda a coorte, encontramos uma correção direta, porém fraca, com a hsCRP (ρ = 0,21; p = 0,033), o que reforça o papel da inflamação na disfunção endotelial e de acordo com a literatura publicada,26 porém não demonstramos um padrão semelhante no grupo de obesos, possivelmente devido à sua homogeneidade. Observamos também, no grupo de obesos, uma correlação direta entre a ADMA e os números de células progenitoras endoteliais circulantes. Achamos essas correlações particularmente interessantes, pois elas destacam as várias vias fisiopatológicas relacionadas à ativação endotelial, a saber, adesão de células inflamatórias acionada pela E‐seleticna, aumento da expressa de ADMA, que inibe competitivamente o eNOS e reduz a biodisponibilidade de óxido nítrico, e, por fim, restauração do tecido lesionado por células progenitoras endoteliais. Acreditamos que a relação entre a E‐seleticna e a ADMA, na obesidade infantil, não foi publicada anteriormente.
O termo EPCs deve ser reservado a uma célula progenitora especificamente restrita à linhagem endotelial. Em 1997, Asahara et al. relataram pela primeira vez a existência de EPCs.27 Até o momento, nenhum marcador específico foi encontrado para identificar claramente essas células, o que torna seu isolamento controverso, pois sua identificação tem como base marcadores de superfície celular compartilhados por outras linhas de células hematológicas. Assim, vários métodos foram usados para identificar as EPCs. Para minimizar falsos positivos, vários marcadores de superfície celular foram integrados para identificar essas células, a saber, aquelas associadas a linhas de células imaturas (por exemplo, CD34) com comprometimento endotelial (por exemplo, receptor do domínio de inserção da cinase).
Conforme relatado por vários autores, o número e a função de células progenitoras endoteliais circulantes não apenas estão inversamente correlacionados a fatores de risco cardiovascular, mas também podem prever a ocorrência de eventos cardiovasculares, principalmente na população adulta.28 Os dados relacionados às EPCs e à obesidade infantil são escassos. Um relato de Jung et al.29 observou, bem com nós, uma correlação direta com a E‐seleticna. Ao contrário de nosso estudo, essa correlação foi aplicada apenas a adolescentes obesos. Em nossa análise, constatamos que as EPCs e a E‐seleticna estavam diretamente correlacionadas no grupo de obesos na pré‐adolescência, um achado não relatado anteriormente e que reforça o fato de que a disfunção endotelial está presente em crianças pequenas.
Em nossa análise, o grupo de obesos apresentou um número significativamente maior de EPCs. Isso significa que o aumento das EPCs em crianças e adolescentes obesos representa uma tentativa de reparação do dano vascular subjacente; assim, nessa fase, seria possível reverter o dano endotelial subjacente, caso algo fosse feito para controlar o peso.
O principal ponto forte de nosso estudo é que ele demonstra que crianças e adolescentes obesos possivelmente estão em risco de sofrer eventos cardiovasculares durante o início da vida adulta, devido à presença de um perfil pró‐aterogênico adverso. Contudo, aparentemente nessa fase, os mecanismos de reparação podem ser um fator relevante para reverter dano vascular possivelmente em curso. A inferência é que as intervenções terapêuticas visaram a perda de peso que deve ser instituída de forma agressiva para reverter o dano endotelial e obesidade relacionada a comorbidades, como hipertensão arterial e resistência à insulina.
Este estudo tem diversas limitações. A primeira é nosso tamanho da amostra, principalmente para o grupo de controle. Ainda, ele incluiu apenas uma população branca limitada a uma área geográfica específica, devido à distribuição étnica local. O estudo incluiu ambos os sexos, bem como diferentes faixas etárias. Em nossos resultados, essas diferenças foram ajustadas e, portanto, sua interferência foi anulada.
Conflitos de interesseAutores declaram não haver conflitos de interesse.
Como citar este artigo: Pires A, Martins P, Pereira AM, Marques M, Paiva A, Castela E, et al. Circulating endothelial progenitor cells in obese children and adolescents. J Pediatr (Rio J). 2015;91:560–6.
Estudo ligado ao Hospital Pediátrico, Centro Hospitalar e Universitário de Coimbra (CHUC), Laboratório de Fisiologia e Laboratório de Estatística, Instituto de Imagem Biomédica e Ciências da Vida, Faculdade de Medicina, Universidade de Coimbra; e ao Instituto Português do Sangue e Transplantação, Coimbra, Portugal.