To systematically review evidence related to nutritional and cardiometabolic outcomes in children born at term and small for gestational age and the association with breastfeeding.
Source of dataTwo independent reviewers searched the MEDLINE, LILACS, SciELO, and Embase databases without time or language restrictions. The PRISMA tool was used, and studies that evaluated infants born at term and small for gestational age, breastfed, and with an evaluation of cardiometabolic outcomes were included. Studies with preterm infants, those that did not have information on breastfeeding, and those with lack of evaluation of the outcome variables were excluded. Also excluded were review articles, editorials, and series of cases.
Summary of dataOnly seven articles were found that met the abovementioned criteria. There was a great variability in the type of evaluation, as well as in the age of these children. It was demonstrated that breastfeeding promoted growth without body composition alteration and without increased insulin resistance in children with exclusive breastfeeding, when compared to children receiving a higher calorie formula, except for one article that observed an increase in fat mass in exclusively breastfed children.
ConclusionBreastfeeding seems to be a safe feeding practice for infants born at term and small for gestational age, showing no association with deleterious short‐term outcomes. Breastfeeding stimulation in these populations seems to be a way of preventing the health problems associated with the high risk of chronic noncommunicable diseases and obesity.
Revisar sistematicamente as evidências relacionadas aos desfechos nutricionais e cardiometabólicos em crianças nascidas a termo e pequenas para idade gestacional e a relação com o aleitamento materno.
Fonte de dadosDois revisores independentes fizeram buscas nas bases de dados MEDLINE,LILACS, SciELO, EMBASE sem restrições de tempo ou idioma. Foi usada a ferramenta PRISMA sendo incluídos estudos que avaliaram crianças nascidas a termo e pequenas para idade gestacional, amamentadas e com avaliação dos desfechos cardiometabólicos. Foram excluídos estudos com prematuros, aqueles que não trouxessem informação do aleitamento materno, ausência de avaliação das variáveis de desfecho. Também não foram incluídos artigos de revisão, editorial e série de casos.
Síntese dos dadosForam encontrados apenas sete artigos que preencheram os critérios citados acima. Houve uma grande variabilidade na forma de avaliação, assim como na idade dessas crianças. Foi evidenciado que o aleitamento materno promoveu crescimento sem alteração de composição corporal e sem resistência insulínica aumentada nas crianças com aleitamento materno exclusivo, quando comparadas com crianças que receberam fórmula láctea de maior teor calórico, exceto por um artigo que observou aumento de massa gorda nos amamentados exclusivamente.
ConclusãoAleitamento materno parece ser uma forma segura de alimentação para crianças nascidas a termo e pequenas para idade gestacional sem associação com desfechos deletérios em curto prazo. O estímulo ao aleitamento materno nessas populações parece ser um caminho de prevenção aos agravos à saúde associados ao alto risco de doenças crônicas não transmissíveis e à obesidade.
O aleitamento materno (AM) exclusivo deve ser feito até o sexto mês de vida de acordo com a recomendação alimentar da Organização Mundial de Saúde (OMS),1 uma vez que, além do benefício nutricional, é relevante para a prevenção de doenças infecciosas e da obesidade na infância e o seu efeito protetor parece perdurar até a vida adulta.2,3
Crianças nascidas com baixo peso – BP (peso de nascimento inferior a 2.500g) têm morbimortalidade 20 vezes maior do que aquelas nascidas com pesos maiores do que 2.500g.4 Quando o BP é associado a crescimento intrauterino restrito (CIUR), os recém‐nascidos são definidos como pequenos para idade gestacional (PIG), o que parece estar associado à maior taxa de morbimortalidade precoce e tardia por doenças cardiovasculares e metabólicas na vida adulta.5,6 Adicionalmente, outros autores mostraram que crianças PIGs que apresentaram ganho de peso superior ao esperado nos primeiros meses de vida (fenômeno catch up) têm esse risco potencializado.7,8
O benefício do AM exclusivo é superior a todas as outras formas de alimentação na primeira infância para a criança nascida com peso normal.9 Por outro lado, na criança PIG, o papel protetor do AM, no que diz respeito ao surgimento futuro de doenças relacionadas à obesidade e síndrome metabólica (SM), não está completamente definido. Nesse sentido, o objetivo deste estudo foi revisar a literatura sobre a repercussão nutricional e metabólica em crianças que foram recém‐nascidas PIGs a termo e receberam aleitamento materno.
MétodosRevisão sistemática feita segundo a metodologia Prisma (Preferred Reporting Items for Systematic Reviews and Meta‐Analyses).10 Foram pesquisadas nas bases de dados Medline, Lilacs, SciELO e Embase publicações que tinham como referência o uso de vocabulários técnico‐científicos selecionados em conjunto com um especialista na área (médico endocrinologista) e escritos na língua inglesa, a estratégia de busca foi estruturada pelo emprego de operadores booleanos específicos da base de dados, que foram: low birth weight, LBW, small for gestational age, SGA, intrauterine growth restricted IUGR, breast‐feeding, breastfeeding, breastfed, breastmilk, human milk, metabolic syndrome, cholesterol, LDL, HDL, triglycerides, blood lipids, blood pressure, hypertension, systolic blood pressure, diastolic blood pressure, overweight, obesity, body mass index, diabetes mellitus, glucose, glycemia, hyperglycemia e os operadores booleanos AND, OR e NOT (procedimentos de busca Medline). O detalhamento da busca resultou em: [(SGA OR small for gestational age OR low birth weight OR IUGR OR intra uterine growth restricted AND (breastfeeding OR breast‐feeding OR breastfed OR breastmilk OR human milk AND (metabolic syndrome OR cholesterol OR HDL OR LDL OR triglycerides OR blood lipids OR blood pressure OR hypertension OR systolic blood pressure OR diastolic blood pressure OR overweight OR obesity OR body mass index OR diabetes mellitus OR glucose OR hyperglycemia OR glycemia)].
A busca bibliográfica foi feita por dois pesquisadores independentes. Após a identificação dos artigos pelo título, seguiu‐se a leitura dos resumos e, para aqueles com potencial de inclusão, foi feita a leitura na íntegra. Nos casos de discordância de inclusão, um terceiro pesquisador tomou a decisão. Referências secundárias relevantes também foram incluídas. Os artigos duplicados foram removidos. Não houve restrição de tempo nem de língua para a seleção.
A qualidade das evidências foi avaliada de acordo com os critérios propostos pelo EPHPP (Effective Public Health Practice Project – Quality Assesment Toll for Quantitative Studies).11 Esses critérios avaliam viés de seleção, desenho do estudo, potenciais confundidores, cegamento do investigador e do participante, método da coleta dos dados (se foram válidos e confiáveis), perdas de seguimento (excluídos ou abandono de seguimento), integridade da intervenção e análise apropriada da pergunta da pesquisa. Os estudos foram, então, classificados como qualidade fraca, moderada ou forte.
Os critérios de inclusão foram: trabalhos que estudaram crianças nascidas a termo e PIGs (independentemente da curva de referência usada) que receberam AM e algum desfecho relacionado à SM e/ou doença cardiovascular.
Foram excluídos artigos que avaliaram crianças nascidas prematuramente, com ausência da informação sobre o AM ou de avaliação das variáveis de desfecho, alimentação não materna, artigos de revisão, editorial, relato ou série de casos.
Foram considerados desfechos: qualquer exame laboratorial relacionado a perfil lipídico e glicêmico; hormônios envolvidos no metabolismo, tais como Insulin‐like Growth Factor I (IGF‐1), adiponectina, leptina e insulina; hipertensão arterial; diabetes mellitus (DM); sobrepeso; obesidade; composição corporal e adiposidade em qualquer período do crescimento até a vida adulta.
Segundo regramento estabelecido na Resolução CNS‐MS No. 510 de 2016, não há necessidade de análise do Comitê de Ética em Pesquisa.
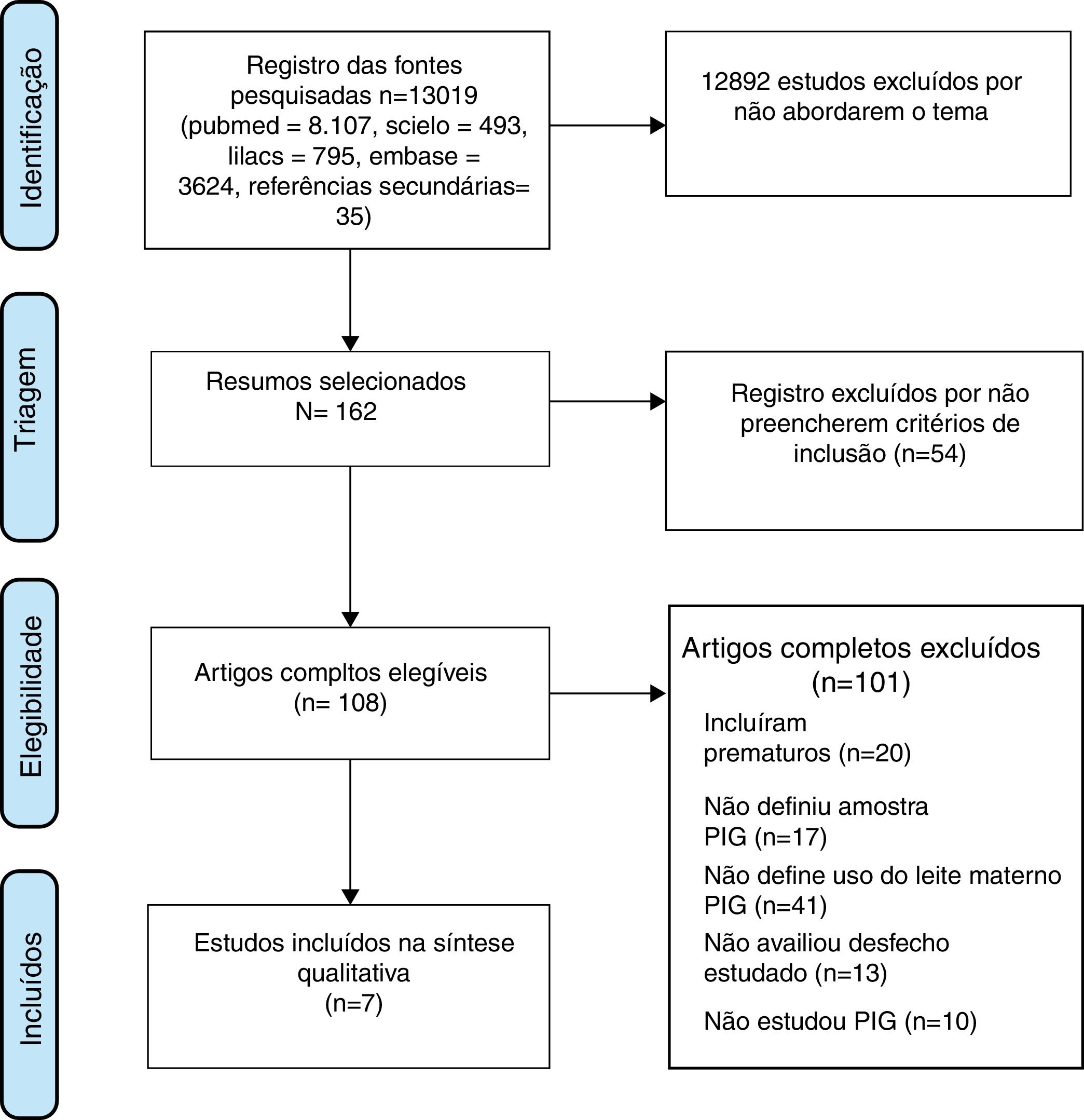
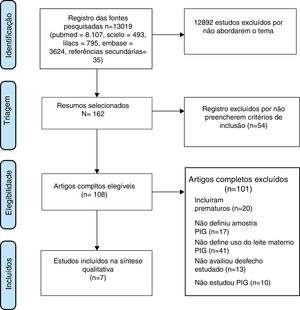
ResultadosInicialmente, foram identificados 13.019 títulos, porém a grande maioria foi excluída devido ao uso genérico do descritor LBW que incluía pacientes nascidos menores do que 1.000‐1.500g [(very low birth weight – VLBW) ou extremely low birth weight (ELBW)] e prematuros. Os artigos mais antigos, principalmente antes da década 1990, não discriminavam entre SGA, prematuridade e LBW. Foram selecionados sete artigos que preencheram os critérios de inclusão (fig. 1).
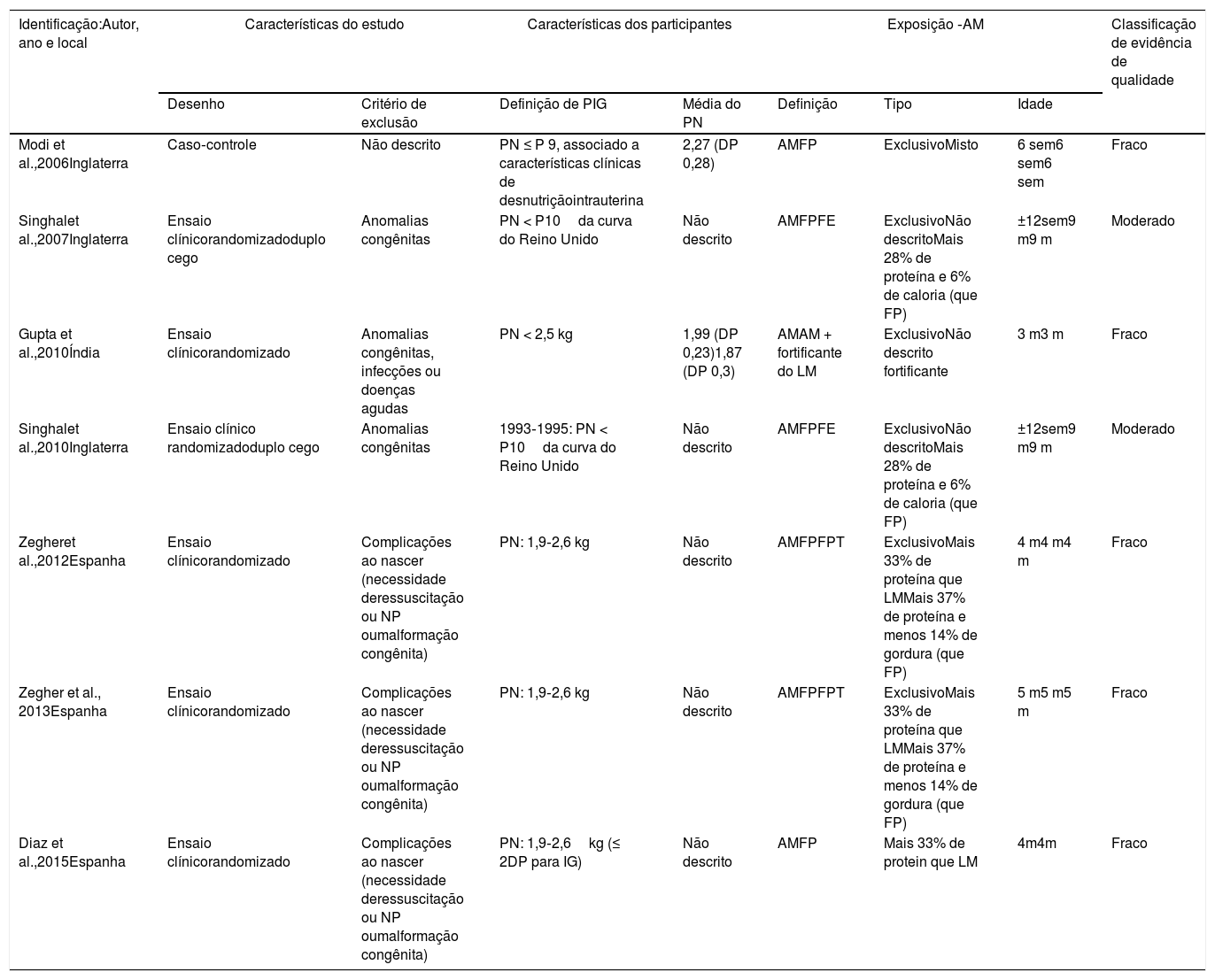
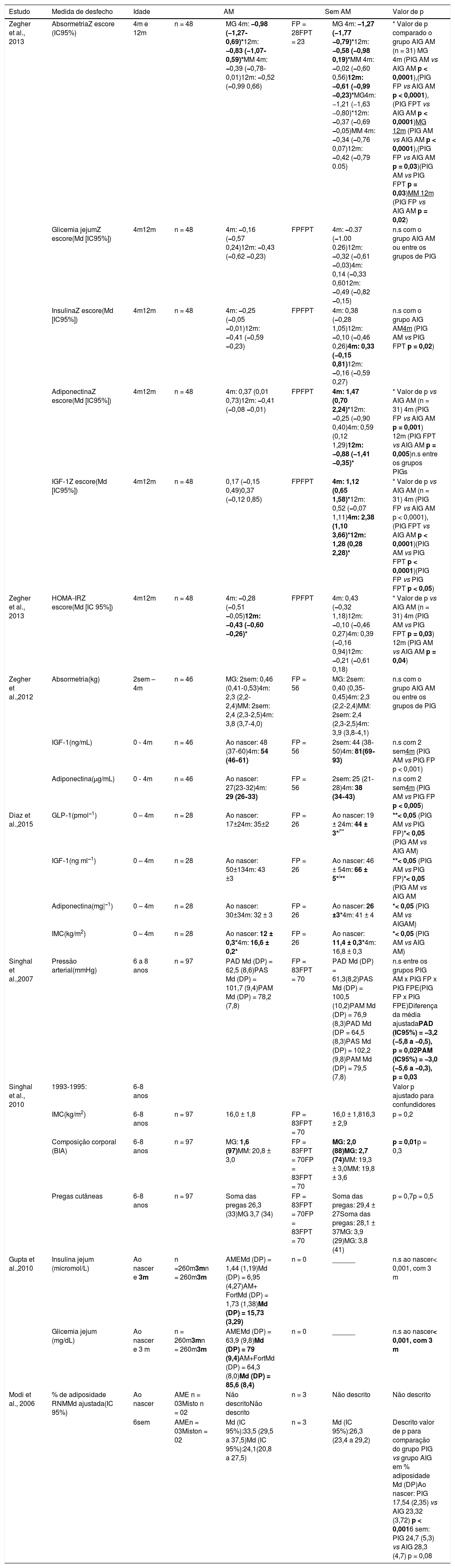
As características gerais dos trabalhos incluídos nesta revisão estão apresentadas na tabela 1 e os principais resultados na tabela 2.
Características gerais dos estudos incluídos na revisão sistemática sobre crianças nascidas a termo e pequenas para idade gestacional amamentadas
| Identificação:Autor, ano e local | Características do estudo | Características dos participantes | Exposição ‐AM | Classificação de evidência de qualidade | ||||
|---|---|---|---|---|---|---|---|---|
| Desenho | Critério de exclusão | Definição de PIG | Média do PN | Definição | Tipo | Idade | ||
| Modi et al.,2006Inglaterra | Caso‐controle | Não descrito | PN ≤ P 9, associado a características clínicas de desnutriçãointrauterina | 2,27 (DP 0,28) | AMFP | ExclusivoMisto | 6 sem6 sem6 sem | Fraco |
| Singhalet al.,2007Inglaterra | Ensaio clínicorandomizadoduplo cego | Anomalias congênitas | PN < P10da curva do Reino Unido | Não descrito | AMFPFE | ExclusivoNão descritoMais 28% de proteína e 6% de caloria (que FP) | ±12sem9 m9 m | Moderado |
| Gupta et al.,2010Índia | Ensaio clínicorandomizado | Anomalias congênitas, infecções ou doenças agudas | PN < 2,5 kg | 1,99 (DP 0,23)1,87 (DP 0,3) | AMAM + fortificante do LM | ExclusivoNão descrito fortificante | 3 m3 m | Fraco |
| Singhalet al.,2010Inglaterra | Ensaio clínico randomizadoduplo cego | Anomalias congênitas | 1993‐1995: PN < P10da curva do Reino Unido | Não descrito | AMFPFE | ExclusivoNão descritoMais 28% de proteína e 6% de caloria (que FP) | ±12sem9 m9 m | Moderado |
| Zegheret al.,2012Espanha | Ensaio clínicorandomizado | Complicações ao nascer (necessidade deressuscitação ou NP oumalformação congênita) | PN: 1,9‐2,6 kg | Não descrito | AMFPFPT | ExclusivoMais 33% de proteína que LMMais 37% de proteína e menos 14% de gordura (que FP) | 4 m4 m4 m | Fraco |
| Zegher et al., 2013Espanha | Ensaio clínicorandomizado | Complicações ao nascer (necessidade deressuscitação ou NP oumalformação congênita) | PN: 1,9‐2,6 kg | Não descrito | AMFPFPT | ExclusivoMais 33% de proteína que LMMais 37% de proteína e menos 14% de gordura (que FP) | 5 m5 m5 m | Fraco |
| Diaz et al.,2015Espanha | Ensaio clínicorandomizado | Complicações ao nascer (necessidade deressuscitação ou NP oumalformação congênita) | PN: 1,9‐2,6kg (≤ 2DP para IG) | Não descrito | AMFP | Mais 33% de protein que LM | 4m4m | Fraco |
AM, aleitamento materno; DP, desvio‐padrão; FP, fórmula de partida; FPT, fórmula de prematuro; IG, idade gestacional; LM, leite materno; m, meses; NP, nutrição parenteral; P, percentil; PIG, pequeno para idade gestacional; PN, peso do nascimento; sem, semanas.
Resultados principais dos estudos incluídos na revisão sistemática sobre crianças nascidas a termo e pequenas para idade gestacional amamentadas
| Estudo | Medida de desfecho | Idade | AM | Sem AM | Valor de p | ||
|---|---|---|---|---|---|---|---|
| Zegher et al., 2013 | AbsormetriaZ escore (IC95%) | 4m e 12m | n = 48 | MG 4m: −0,98 (−1,27‐0,69)*12m: −0,83 (−1,07‐0,59)*MM 4m: −0,39 (−0,78‐0,01)12m: −0,52 (−0,99 0,66) | FP = 28FPT = 23 | MG 4m: −1,27 (−1,77 −0,79)*12m: −0,58 (−0,98 0,19)*MM 4m: −0,02 (−0,60 0,56)12m: −0,61 (−0,99 −0,23)*MG4m: −1,21 (−1,63 −0,80)*12m: −0,37 (−0,69 −0,05)MM 4m: −0,34 (−0,76 0,07)12m: −0,42 (−0,79 0.05) | * Valor de p comparado o grupo AIG AM (n = 31) MG 4m (PIG AM vs AIG AM p < 0,0001),(PIG FP vs AIG AM p < 0,0001),(PIG FPT vs AIG AM p < 0,0001)MG 12m (PIG AM vs AIG AM p < 0,0001),(PIG FP vs AIG AM p = 0,03)(PIG AM vs PIG FPT p = 0,03)MM 12m (PIG FP vs AIG AM p = 0,02) |
| Glicemia jejumZ escore(Md [IC95%]) | 4m12m | n = 48 | 4m: −0,16 (−0,57 0,24)12m: −0,43 (−0,62 −0,23) | FPFPT | 4m: −0.37 (−1.00 0.26)12m: −0,32 (−0,61 −0,03)4m: 0,14 (−0,33 0,6012m: −0,49 (−0,82 −0,15) | n.s com o grupo AIG AM ou entre os grupos de PIG | |
| InsulinaZ escore(Md [IC95%]) | 4m12m | n = 48 | 4m: −0,25 (−0,05 −0,01)12m: −0,41 (−0,59 −0,23) | FPFPT | 4m: 0,38 (−0,28 1,05)12m: −0,10 (−0,46 0,26)4m: 0,33 (−0,15 0,81)12m: −0,16 (−0,59 0,27) | n.s com o grupo AIG AM4m (PIG AM vs PIG FPT p = 0,02) | |
| AdiponectinaZ escore(Md [IC95%]) | 4m12m | n = 48 | 4m: 0,37 (0,01 0,73)12m: −0,41 (−0,08 −0,01) | FPFPT | 4m: 1,47 (0,70 2,24)*12m: −0,25 (−0,90 0,40)4m: 0,59 (0,12 1,29)12m: −0,88 (−1,41 −0,35)* | * Valor de p vs AIG AM (n = 31) 4m (PIG FP vs AIG AM p = 0,001) 12m (PIG FPT vs AIG AM p = 0,005)n.s entre os grupos PIGs | |
| IGF‐1Z escore(Md [IC95%]) | 4m12m | n = 48 | 0,17 (−0,15 0,49)0,37 (−0,12 0,85) | FPFPT | 4m: 1,12 (0,65 1,58)*12m: 0,52 (−0,07 1,11)4m: 2,38 (1,10 3,66)*12m: 1,28 (0,28 2,28)* | * Valor de p vs AIG AM (n = 31) 4m (PIG FP vs AIG AM p < 0,0001),(PIG FPT vs AIG AM p < 0,0001)(PIG AM vs PIG FPT p < 0,0001)(PIG FP vs PIG FPT p < 0,05) | |
| Zegher et al., 2013 | HOMA‐IRZ escore(Md [IC 95%]) | 4m12m | n = 48 | 4m: −0,28 (−0,51 −0,05)12m: −0,43 (−0,60 −0,26)* | FPFPT | 4m: 0,43 (−0,32 1,18)12m: −0,10 (−0,46 0,27)4m: 0,39 (−0,16 0,94)12m: −0,21 (−0,61 0,18) | * Valor de p vs AIG AM (n = 31) 4m (PIG AM vs PIG FPT p = 0,03) 12m (PIG AM vs AIG AM p = 0,04) |
| Zegher et al.,2012 | Absormetria(kg) | 2sem – 4m | n = 46 | MG: 2sem: 0,46 (0,41‐0,53)4m: 2,3 (2,2‐2,4)MM: 2sem: 2,4 (2,3‐2,5)4m: 3,8 (3,7‐4,0) | FP = 56 | MG: 2sem: 0,40 (0,35‐0,45)4m: 2,3 (2,2‐2,4)MM: 2sem: 2,4 (2,3‐2,5)4m: 3,9 (3,8‐4,1) | n.s com o grupo AIG AM ou entre os grupos de PIG |
| IGF‐1(ng/mL) | 0 ‐ 4m | n = 46 | Ao nascer: 48 (37‐60)4m: 54 (46‐61) | FP = 56 | 2sem: 44 (38‐50)4m: 81(69‐93) | n.s com 2 sem4m (PIG AM vs PIG FP p < 0,001) | |
| Adiponectina(μg/mL) | 0 ‐ 4m | n = 46 | Ao nascer: 27(23‐32)4m: 29 (26‐33) | FP = 56 | 2sem: 25 (21‐28)4m: 38 (34‐43) | n.s com 2 sem4m (PIG AM vs PIG FP p < 0,005) | |
| Diaz et al.,2015 | GLP‐1(pmol−1) | 0 – 4m | n = 28 | Ao nascer: 17±24m: 35±2 | FP = 26 | Ao nascer: 19 ± 24m: 44 ± 3*/** | **< 0,05 (PIG AM vs PIG FP)*< 0,05 (PIG AM vs AIG AM) |
| IGF‐1(ng ml−1) | 0 – 4m | n = 28 | Ao nascer: 50±134m: 43 ±3 | FP = 26 | Ao nascer: 46 ± 54m: 66 ± 5*/** | **< 0,05 (PIG AM vs PIG FP)*< 0,05 (PIG AM vs AIG AM | |
| Adiponectina(mg|−1) | 0 – 4m | n = 28 | Ao nascer: 30±34m: 32 ± 3 | FP = 26 | Ao nascer: 26 ±3*4m: 41 ± 4 | *< 0,05 (PIG AM vs AIGAM) | |
| IMC(kg/m2) | 0 – 4m | n = 28 | Ao nascer: 12 ± 0,3*4m: 16,6 ± 0,2* | FP = 26 | Ao nascer: 11,4 ± 0,3*4m: 16,8 ± 0,3 | *< 0,05 (PIG AM vs AIG AM) | |
| Singhal et al.,2007 | Pressão arterial(mmHg) | 6 a 8 anos | n = 97 | PAD Md (DP) = 62,5 (8,6)PAS Md (DP) = 101,7 (9,4)PAM Md (DP) = 78,2 (7,8) | FP = 83FPT = 70 | PAD Md (DP) = 61,3(8,2)PAS Md (DP) = 100,5 (10,2)PAM Md (DP) = 76,9 (8,3)PAD Md (DP = 64,5 (8,3)PAS Md (DP) = 102,2 (9,8)PAM Md (DP) = 79,5 (7,8) | n.s entre os grupos PIG AM x PIG FP x PIG FPE(PIG FP x PIG FPE)Diferença da média ajustadaPAD (IC95%) = −3,2 (−5,8 a −0,5), p = 0,02PAM (IC95%) = −3,0 (−5,6 a −0,3), p = 0,03 |
| Singhal et al., 2010 | 1993‐1995: | 6‐8 anos | Valor p ajustado para confundidores | ||||
| IMC(kg/m2) | 6‐8 anos | n = 97 | 16,0 ± 1,8 | FP = 83FPT = 70 | 16,0 ± 1,816,3 ± 2,9 | p = 0,2 | |
| Composição corporal (BIA) | 6‐8 anos | n = 97 | MG: 1,6 (97)MM: 20,8 ± 3,0 | FP = 83FPT = 70FP = 83FPT = 70 | MG: 2,0 (88)MG: 2,7 (74)MM: 19,3 ± 3,0MM: 19,8 ± 3,6 | p = 0,01p = 0,3 | |
| Pregas cutâneas | 6‐8 anos | n = 97 | Soma das pregas 26,3 (33)MG 3,7 (34) | FP = 83FPT = 70FP = 83FPT = 70 | Soma das pregas: 29,4 ± 27Soma das pregas: 28,1 ± 37MG: 3,9 (29)MG: 3,8 (41) | p = 0,7p = 0,5 | |
| Gupta et al.,2010 | Insulina jejum (micromol/L) | Ao nascer e 3m | n =260m3mn = 260m3m | AMEMd (DP) = 1,44 (1,19)Md (DP) = 6,95 (4,27)AM+ FortMd (DP) = 1,73 (1,38)Md (DP) = 15,73 (3,29) | n = 0 | ______ | n.s ao nascer< 0,001, com 3 m |
| Glicemia jejum (mg/dL) | Ao nascer e 3 m | n = 260m3mn = 260m3m | AMEMd (DP) = 63,9 (9,8)Md (DP) = 79 (9,4)AM+FortMd (DP) = 64,3 (8,0)Md (DP) = 85,6 (8,4) | n = 0 | ______ | n.s ao nascer< 0,001, com 3 m | |
| Modi et al., 2006 | % de adiposidade RNMMd ajustada(IC 95%) | Ao nascer | AME n = 03Misto n = 02 | Não descritoNão descrito | n = 3 | Não descrito | Não descrito |
| 6sem | AMEn = 03Miston = 02 | Md (IC 95%):33,5 (29,5 a 37,5)Md (IC 95%):24,1(20,8 a 27,5) | n = 3 | Md (IC 95%):26,3 (23,4 a 29,2) | Descrito valor de p para comparação do grupo PIG vs grupo AIG em % adiposidade Md (DP)Ao nascer: PIG 17,54 (2,35) vs AIG 23,32 (3,72) p < 0,0016 sem: PIG 24,7 (5,3) vs AIG 28,3 (4,7) p = 0,08 | ||
AIG, adequado para idade gestacional; AM, aleitamento materno; AME, aleitamento materno exclusivo; BIA, bioimpedância; DP, desvio‐padrão; Fort, fortificante; FP, fórmula padrão; FPT, fórmula de prematuro; GLP‐1, Glucagon‐like peptide‐1; HOMA‐IR, homeostatic model assessment – insulin resistance; IC, intervalo de confiança; IMC, índice de massa corpórea; IGF‐1, Insulin Growth Factor 1; m, meses; Md, média; MG, massa gorda; MM, massa magra; n.s, não significante; PAD, pressão arterial diastólica; PAM, pressão arterial média; PAS, pressão arterial sistólica; PIG, pequeno para idade gestacional; RNM, ressonância nuclear magnética; sem, semanas; vs, versus.
Valores de medidas e de p onde as diferenças entre os grupos tinham significância estatística estão em negrito.
Dos sete artigos incluídos, apenas dois foram classificados como qualidade de evidência moderada enquanto os outros foram considerados fracos. Um dos artigos, além da qualidade fraca, teve até reduzido número amostral (oito pacientes estudados).
No artigo de Singhal et al. publicado em 2010 consideraram‐se apenas os resultados relativos ao estudo 1, visto que apenas essa parte do estudo considerou crianças nascidas PIG e teve grupo controle amamentado.
Três dos artigos incluídos nesta revisão eram de uma mesma coorte, feitos por Zegher et al. (2012, 2013) e Diaz et al. (2015), na Espanha, publicados em momentos diferentes durante os meses de seguimento dos pacientes. No estudo de 2012, foi observado que as crianças PIGs, independentemente do tipo de dieta oferecida, tiveram ganhos similares em peso, altura e adiposidade. Quando comparados com o grupo AIG amamentado, viram que os PIGs ganharam mais massa magra e menos massa gorda aos quatro meses de vida. Na avaliação laboratorial, ao nascimento, os PIGs tinham menores dosagens de IGF‐1 e adiponectina do que os AIGs, porém, aos quatro meses, os níveis de IGF‐1 nos PIGs que receberam fórmula enriquecida para prematuros e adiponectina no grupo PIG que recebeu fórmula padrão foram maiores do que os valores daqueles PIGs e AIGs amamentados.12 O mesmo padrão foi encontrado no estudo de Diaz et al. (2015) em relação à dosagem de GLP‐1, peptídeo com potencial modulador do apetite, que tiveram níveis e incrementos maiores no grupo PIG com fórmula do que naqueles amamentados (PIG e AIG).13 O outro estudo da mesma coorte que acompanhou as crianças dos quatro aos 12 meses encontrou que os PIGs em AM evoluíram com manutenção da hipoadiposidade (mais massa magra que do massa gorda) com níveis normais de IGF‐1 e de adiponectina. Já os PIGs que receberam fórmula enriquecida para prematuros cursaram com catch up de massa gorda, níveis persistentemente elevados de IGF‐1 e queda da adiponectina. O grupo que recebeu fórmula padrão evoluiu de forma intermediária: catch up de massa gorda menos intenso do que os de fórmula enriquecida e exames laboratoriais similares aos PIGs amamentados.14
Singhal et al. (2007) iniciaram ensaio clínico randomizado de 1993 a 1995 e compararam fórmula láctea padrão para lactente a termo, fórmula enriquecida para prematuros ou amamentação em indivíduos PIG, as fórmulas foram mantidas até o nono mês. Os autores observaram que a velocidade de ganho de peso estava diretamente relacionada com maiores níveis pressóricos aos 6‐8 anos, independentemente do tipo de dieta oferecida, inclusive no grupo de amamentação, porém foi mais frequente no grupo que recebeu fórmula enriquecida. Os autores recomendaram que não se buscasse rápido ganho de peso com maior oferta calórica nessas crianças e, para isso, o AM deveria ser estimulado, argumentou‐se que ele promovia ganho de peso e altura mais lentamente.15 Posteriormente, esses mesmos autores publicaram os resultados do ensaio clínico de 1995 junto a outro iniciado após dez anos.16 Neste segundo estudo, as crianças PIGs foram classificadas de forma diferente (nascidas abaixo do percentil 20) e também comparadas pela fórmula láctea padrão para lactente a termo ou fórmula enriquecida usada até o sexto mês, contudo apenas no primeiro estudo havia grupo controle de PIG amamentado e por esse motivo os resultados dessa segunda fase não foram apresentados. As crianças que receberam fórmula enriquecida tiveram ganho de peso mais acelerado, nos primeiros meses de vida e isso foi relacionado a aumento de gordura corporal, posteriormente. Os achados desfavoráveis do primeiro estudo fizeram com que o recrutamento para o segundo fosse interrompido, não se justificou o aumento de oferta calórica nessas crianças.
Gupta et al. (2010) fizeram ensaio clínico randomizado na Índia com crianças nascidas a termo (acima de 38 semanas) e menores de 2.500g. Os autores investigaram a repercussão da alimentação precoce no aumento da resistência insulínica. Os sujeitos foram agrupados em: Grupo de AM exclusivo por três meses e grupo com AM e fortificante de leite humano pelo mesmo período. Não houve diferença entre os grupos, nos primeiros 15 dias de vida, em relação às medidas antropométricas e à dosagem de glicose e insulina. No fim do terceiro mês, entretanto, esses parâmetros foram reavaliados e o grupo que recebeu maior aporte calórico pela fortificação do leite materno evoluiu com peso e altura significantemente maior do que o grupo amamentado exclusivamente, associado ao aumento dos níveis de glicose e insulina. Os autores sugeriram que aquelas crianças que tiveram restrição de crescimento intrauterino, ao ser hiperalimentadas nos primeiros meses de vida, evoluíam com ganho ponderal rápido e resistência insulínica.17
O estudo de Modi et al. (2006) mostrou aumento de adiposidade relacionado ao AM em crianças nascidas com CIUR. Os autores incluíram recém‐nascidos a termo (RNT) AIG normais comparados com RNT com CIUR e avaliaram a relação da dieta (AM exclusivo x AM misto x fórmula padrão) com adiposidade às seis semanas de vida. Usaram as medidas de adiposidade ao nascimento por ressonância nuclear magnética (RNM) como comparação. Os autores encontraram que, ao nascimento, os recém‐nascidos com CIUR tinham menores medidas antropométricas (peso, altura e perímetro cefálico) e menos tecido adiposo. Porém, com seis semanas, apesar de menores e mais magros, as diferenças nas medidas de perímetro cefálico e na adiposidade não eram mais evidentes, quando comparados com os nascidos AIGs. Esse aumento de adiposidade foi em massa gorda e, após análise de regressão, observaram que ele estava relacionado ao aumento de crescimento linear, e não ao ganho de peso, principalmente naqueles com CIUR e em AM exclusivo. Como AM tem sido historicamente relacionado a melhor desfecho metabólico e menor adiposidade tardia, os autores deste trabalho questionaram se o reduzido número de pacientes na análise teria influenciado os resultados, pois apenas três crianças com CIUR foram amamentadas exclusivamente no período.18
DiscussãoLeite materno exclusivo até o sexto mês de vida é o alimento ideal para a criança nascida a termo, independentemente do peso ao nascer.9 A presente revisão objetivou avaliar se crianças PIGs a termo e que tiveram o AM como principal fonte de alimentação, nos primeiros meses de vida, seriam beneficiadas com redução da adiposidade na infância e distúrbios metabólicos futuros.
Ainda não estão esclarecidos quais fatores durante a infância seriam determinantes do risco para doenças cardiovasculares na vida adulta. Enquanto as coortes históricas apontavam para a influência de BP ao nascer,5 outros autores acreditavam que o fenômeno de catch up ou peso aumentado ao nascimento seriam os grandes fatores etiológicos de obesidade, doenças cardiovasculares e síndrome metabólica no futuro.19–22 No entanto, pouca ênfase tem sido dada ao papel da alimentação, nos primeiros anos de vida da criança.
Na presente revisão, foram identificados artigos que puderam demonstrar que o AM em crianças PIGs, nascidas a termo, pode melhorar o desfecho laboratorial relacionado à resistência insulínica e às medidas de adiposidade. Viu‐se ainda que, quando amamentadas, essas crianças foram capazes de recuperação de crescimento sem prejuízo nutricional. Isso reforça que o AM pode ser o alimento referencial para crescimento saudável em crianças nascidas PIGs, nos primeiros anos de vida e repercute até a idade pré‐escolar.
Esses achados são discordantes da hipótese desenvolvida pelo grupo de Barker, a partir de um estudo feito com pessoas nascidas em 1934‐1944, segundo a qual a modificação do metabolismo advinda da restrição de crescimento intrauterino determinaria o risco de obesidade e doença cardiovascular até a vida adulta.23 Esse estudo foi retrospectivo e usou dados secundários. Encontrou que mais de 90% da população foi amamentada e a relação dos menores pesos: ao nascimento e o peso com um ano de vida estiveram relacionadas com maior mortalidade por doença isquêmica cardíaca após 50 anos. Como limitações, essa pesquisa não avaliou importantes fatores de riscos associados à morbimortalidade cardiovascular como tabagismo, sedentarismo e outras influências dietéticas e comportamentais, no decorrer dos anos.23
Outros três trabalhos que incluíram prematuros na amostra puderam também demonstrar o efeito benéfico do AM: Rodriguez‐Lopes et al.24 avaliaram uma amostra de crianças nascidas com CIUR, a termo, prematuras e encontraram sinais sutis de alteração cardiovascular (menor índice de esfericidade da parede ventricular esquerda, aumento da espessura da parede da carótida e aumento da pressão arterial), quando comparadas com crianças nascidas AIGs. Naquelas que tiveram AM superior a seis meses de idade, essas alterações regrediram, provavelmente pelo efeito protetor do alto conteúdo de ácidos graxos insaturado de cadeia longa, contidos no leite materno. Do mesmo modo, Duran et al.,25 numa amostra de crianças, algumas com BP e prematuros, também encontraram que, para cada mês de AM, houve redução de 0,15 no índice de massa corporal (IMC) em crianças com um ano e que o IMC mostrou relação direta com as medidas de pressão arterial diastólica nessa idade, na amostra total e no subgrupo que nasceu PIG. O terceiro estudo, uma coorte de adolescentes na Espanha, ressaltou que o AM por um período superior a três meses em crianças que nasceram com BP contribuiu para um menor acúmulo de gordura abdominal.26 Esses achados sugerem que não só o período intrauterino, mas também a dieta e o crescimento pós‐natal interferem nos resultados da saúde futura e que a promoção do AM em população de alto risco para adiposidade pode trazer benefícios.
Estudos de coorte observacional e de corte transversal26–30 encontraram relação entre o peso ao nascer, o desenvolvimento de sobrepeso/obesidade e a doença cardiovascular futura. Ressaltaram, também, o papel protetor da amamentação em crianças com BP. Entretanto, não deixaram claro o percentual de sujeitos do subgrupo com BP que foi submetido ao AM. Entender a relação do AM e o seu benefício direto nas crianças que nascem PIG ou BP tornou necessária esta revisão. O mesmo ocorreu em outros estudos que investigaram a relação entre peso ao nascer e velocidade de ganho de peso pós‐natal (catch up) e que encontraram resultados diversos em relação à adiposidade e à amamentação,31–33 mas não definiram o grupo submetido ao AM. Na presente revisão, os artigos selecionados preencheram essa lacuna.
O estudo de Singhal et al.16 demonstrou que o aumento da oferta calórica de lactentes PIGs, principalmente a proteica, não oriunda da amamentação, levou ao rápido crescimento precoce com acúmulo de massa gorda. Talvez pela evidência de que o aumento da oferta calórica através de fórmulas artificiais seja deletério para crianças nascidas PIGs, os estudos recentes com o intuito de investigar a repercussão da intervenção dietética tenham sido desestimulados. Naquele estudo, assim como em outros citados na presente revisão, exceto o de Modi et al.,18 quando a oferta calórica para as crianças nascidas PIGs foi feita com o AM, houve efeitos benéficos.
Muito provavelmente, componentes intrínsecos no leite materno poderiam influenciar no crescimento de crianças de risco, entre eles componentes não nutricionais.34 Associado a isso, as adipocinas do leite materno (leptina e adiponectina) podem levar a melhor regulação do apetite, ajudam o controle do ganho de peso, no futuro, a melhorar a sensibilidade a insulina e aumentar o metabolismo de ácidos graxos.35 Quando se trata de crianças nascidas PIGs, parece que o AM é associado a ganho de peso mais saudável, reduz o impacto causado pela desnutrição intrauterina.
Deve ser enfatizado que, a partir dos dados obtidos na presente revisão, observou‐se o papel positivo da amamentação de crianças nascidas PIGs. Esses resultados, entretanto, devem ser interpretados com cautela, uma vez que os diversos estudos não tiveram desenho uniforme e houve uma diversidade de classificação de PIG. Além disso, apenas dois estudos tiveram escore de qualidade moderado, enquanto os demais foram considerados fracos. Os estudos tiveram variabilidade na idade em que as crianças foram avaliadas e a forma de avaliação referente à repercussão do AM. Múltiplas classificações do AM e do momento do desmame foram uma limitação importante para a análise dos trabalhos. A falta de padronização e o número reduzido de sujeitos dos estudos também dificultaram a interpretação, a generalização dos resultados e impossibilitaram a metanálise. No entanto, a uniformidade do desfecho final dos artigos desta revisão sugere o benefício do AM na prevenção da obesidade, doenças metabólicas e/ou cardiovasculares, no futuro de crianças nascidas PIGs.
Adequação do acompanhamento pré‐natal para reduzir a frequência de BP (relacionado à prematuridade ou ao CIUR), ao nascer, é uma recomendação universal, principalmente em países em desenvolvimento.36 Esta revisão traz a recomendação adicional de que o estímulo ao AM, nessas populações, parece ser um caminho de prevenção aos agravos à saúde associados ao alto risco de doença crônica não transmissível e à obesidade.
Conflitos de interesseOs autores declaram não haver conflitos de interesse.
Como citar este artigo: Santiago AC, Cunha LP, Vieira NS, Moreira LM, Oliveira PR, Lyra PP, et al. Breastfeeding in chil‐dren born small for gestational age and future nutritional and metabolic outcomes: a systematic review. J Pediatr (Rio J). 2019;95:264–74.
O trabalho está vinculado para fins de registro no banco de dados do Index Medicus/MEDLINE à Universidade Federal da Bahia, Salvador, BA, Brasil.