To describe the epidemiological profile and the survival rate of patients with acute myeloid leukemia (AML) in a state reference pediatric hospital.
MethodClinical‐epidemiological, observational, retrospective, descriptive study. The study included new cases of patients with AML, diagnosed between 2004 and 2012, younger than 15 years.
ResultsOf the 51 patients studied, 84% were white; 45% were females and 55%, males. Regarding age, 8% were younger than 1 year, 47% were aged between 1 and 10 years, and 45% were older than 10 years. The main signs/symptoms were fever (41.1%), asthenia/lack of appetite (35.2%), and hemorrhagic manifestations (27.4%). The most affected extra‐medullary site was the central nervous system (14%). In 47% of patients, the white blood cell (WBC) count was below 10,000/mm3 at diagnosis. The minimal residual disease (MRD) was less than 0.1%, on the 15th day of treatment in 16% of the sample. Medullary relapse occurred in 14% of cases. When comparing the bone marrow MRD with the vital status, it was observed that 71.42% of the patients with type M3 AML were alive, as were 54.05% of those with non‐M3 AML. The death rate was 43% and the main proximate cause was septic shock (63.6%).
ConclusionsIn this study, the majority of patients were male, white, and older than 1 year. Most patients with WBC count<10,000/mm3 at diagnosis lived. Overall survival was higher in patients with MRD<0.1%. The prognosis was better in patients with AML‐M3.
Descrever o perfil epidemiológico e a taxa de sobrevida dos pacientes com leucemia mielóide aguda (LMA) em um hospital pediátrico de referência estadual.
MétodoEstudo clínico‐epidemiológico, observacional, retrospectivo e descritivo. Foram incluídos casos novos de pacientes com LMA, diagnosticados entre 2004 e 2012, com idade<15 anos.
ResultadosEntre os 51 pacientes estudados, 84% eram da etnia branca, 45% do sexo feminino e 55% do masculino. Quanto à faixa etária, 8% tinham <1 ano, 47% entre 1 e 10 anos e 45%>10 anos. Os principais sinais/sintomas ao diagnóstico foram febre (41,1%), astenia/inapetência (35,2%) e manifestações hemorrágicas (27,4%). O sistema nervoso central foi o local extramedular mais acometido (14%). Em 47% dos pacientes a leucometria ao diagnóstico foi<10.000/mm3. A doença residual mínima (DRM) no 15° dia de tratamento foi<0,1% em 16% da casuística. Recidiva medular ocorreu em 14% dos casos. Ao se comparar a DRM da medula óssea com o status vital, observou‐se que estavam vivos 71,42% dos pacientes com LMA tipo M3 e 54,05% daqueles com LMA não M3. A taxa de óbito foi de 43% e a principal causa imediata foi o choque séptico (63,6%).
ConclusõesNeste estudo, a maioria dos pacientes é do sexo masculino, etnia branca, maiores do que um ano. A maioria dos pacientes com leucometria<10.000/mm3 ao diagnóstico está viva. A sobrevida global é maior nos pacientes com DRM<0,1%. O prognóstico é melhor nos pacientes com LMA‐M3.
A leucemia mielóide aguda (LMA) é uma doença clonal do tecido hematopoiético, caracterizada pela proliferação anormal de células progenitoras da linhagem mielóide, ocasiona produção insuficiente de células sanguíneas maduras normais.1
Representa em torno de 15 a 20% dos casos leucemias agudas na infância1 e é responsável por 30% dos óbitos nessa faixa etária.2 No Brasil, sua ocorrência estimada é de 400 casos ao ano.3
As manifestações hemorrágicas, febre e palidez são sintomas frequentes da doença ao diagnóstico. As principais causas de mortalidade são as infecções, os sangramentos, a leucostasia e a síndrome de lise tumoral.4
Os principais fatores que interferem na taxa de mortalidade desses pacientes são aqueles decorrentes da intensificação terapêutica e da recaída da doença.5,6
A melhoria do prognóstico da LMA foi possível pela estratificação da doença em grupos de risco, com base na citogenética; pela avaliação da resposta precoce ao tratamento; e pela identificação de falhas de indução quimioterápica. Atualmente a probabilidade de cura da LMA nos países desenvolvidos é em torno de 60%.7,8
Considerando que nas últimas décadas houve progresso na introdução de novos protocolos de tratamento quimioterápico para a LMA e que as informações sobre a população pediátrica e sua evolução clínica ainda são escassas, o presente estudo propõe‐se a analisar a experiência de oito anos num serviço de oncologia pediátrica da Região Sul do Brasil.
MétodosEstudo clínico‐epidemiológico, observacional, retrospectivo e descritivo, aprovado pelo Comitê de Ética em Pesquisa com Seres Humanos do Hospital Infantil Joana de Gusmão (HIJG).
Foram incluídos todos os casos novos de pacientes com LMA, tratados no HIJG entre janeiro de 2004 e agosto de 2012, com idade inferior a 15 anos.
Os critérios de exclusão foram perda de seguimento; transferência para tratamento em outro serviço; dados insuficientes no registro hospitalar de câncer e no serviço de arquivos médicos e estatística do HIJG.
O diagnóstico de LMA foi baseado na morfologia, citoquímica e imunofenotipagem por citometria de fluxo do aspirado de medula óssea e/ou sangue periférico, feito pelo Euroflow com uso de oito cores (EuroFlow‐ESLHO, Rotterdam, NL). A doença residual mínima (DRM) foi analisada pela citometria de fluxo da medula óssea no 15° dia do tratamento de indução. Os protocolos de tratamento usados foram do grupo internacional Berlin‐Frankfurt‐Münster (BFM) AML 83 (n=6), 98 (n=22) e 2004 (n=23).
As variáveis analisadas foram a idade ao diagnóstico (faixa etária estratificada em <1 ano; 1 ano a 10 anos e >10 anos); sexo; etnia de acordo com o estabelecido pelo Instituto Brasileiro de Geografia e Estatística (IBGE) (branca, preta, parda, amarela e vermelha); procedência, conforme as mesorregiões de Santa Catarina estabelecidas pelo IBGE (Grande Florianópolis, Norte Catarinense, Oeste Catarinense, Serrana, Sul Catarinense, Vale do Itajaí) e outras (procedentes de outro estado); sinais e sintomas predominantes ao diagnóstico (febre, dor óssea, dor abdominal, adenomegalias, manifestações hemorrágicas, hipertrofia gengival, palidez, astenia/inapetência, aumento de volume de partes moles e sintomas respiratórios); manifestações laboratoriais ao diagnóstico (leucometria, neutropenia e contagem de plaquetas); envolvimento extramedular ao diagnóstico (SNC ou outras localizações); classificação da LMA segundo o grupo Franco‐Americano‐Britânico (FAB);1 presença e tipo de alterações genéticas laboratoriais; presença ou ausência de remissão clínica e laboratorial após a primeira indução quimioterápica, conforme o valor da doença residual mínima (DRM) no 15° dia de indução, obtida pelo método de citometria de fluxo; status vital (vivo e óbito); óbito (em remissão ou não da doença neoplásica), causa imediata do óbito; presença e localização da recidiva da doença (medular, extramedular ou combinada) e feitura de transplante de medula óssea.
Os procedimentos estatísticos usados foram as medidas descritivas, as tabelas de frequência e o teste do qui‐quadrado de Pearson, com 95% de significância (p<0,05), para analisar, em caráter exploratório, a relação entre duas variáveis. Foram feitas associações entre as variáveis, status vital e leucometria, status vital e DRM da LMA tipo M3 e LMA não‐M3.
ResultadosDos 51 pacientes estudados, 55% (n=28) pertenciam ao sexo masculino e 45% (n=23) ao feminino, na proporção de 1,2:1. A etnia branca foi predominante, representou 84% dos pacientes. As etnias parda e negra representaram 16% da casuística.
A idade média ao diagnóstico foi de 7,3 anos (DP ±4,8 anos) e a mediana de 9 anos. A menor idade ao diagnóstico foi de 19 dias e a maior, de 14 anos. Em relação à faixa etária, 8% da casuística tinha idade<1 ano, 47% estava entre 1 ano e 10 anos e 45% eram>10 anos.
Quanto à procedência, segundo as mesorregiões de Santa Catarina pelo IBGE, 29% eram da Grande Florianópolis (n=15), 24% da Região Oeste (n=12), 20% da Região Serrana (n=10), 10% da Região Norte (n=5), 8% da Região Sul (n=4), 8% da Região do Vale do Itajaí (n=4) e 2% (n=1) eram provenientes do Paraná.
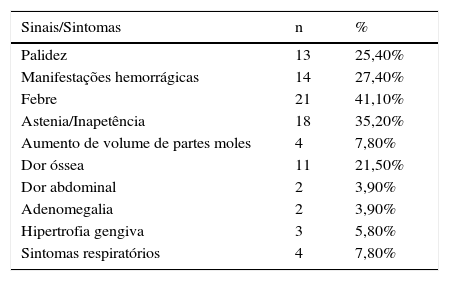
Os principais sinais e sintomas ao diagnóstico estão descritos na tabela 1.
Sinais e sintomas ao diagnóstico, em número (n) e percentual (%), dos pacientes com leucemia mielóide aguda tratados no Hospital Infantil Joana de Gusmão (HIJG) de 2004 a 2012
| Sinais/Sintomas | n | % |
|---|---|---|
| Palidez | 13 | 25,40% |
| Manifestações hemorrágicas | 14 | 27,40% |
| Febre | 21 | 41,10% |
| Astenia/Inapetência | 18 | 35,20% |
| Aumento de volume de partes moles | 4 | 7,80% |
| Dor óssea | 11 | 21,50% |
| Dor abdominal | 2 | 3,90% |
| Adenomegalia | 2 | 3,90% |
| Hipertrofia gengiva | 3 | 5,80% |
| Sintomas respiratórios | 4 | 7,80% |
Ao diagnóstico, 24% dos pacientes apresentavam doença extramedular (n=12), o local mais acometido foi o sistema nervoso central 14% (n=7). Os outros 10% apresentaram comprometimento em pele (n=2), tecido ósseo e aumento de partes moles (n=3).
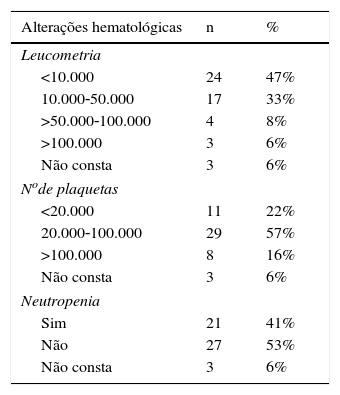
Os dados laboratoriais ao diagnóstico da LMA (leucometria, número de plaquetas e neutropenia) e a classificação morfológica FAB encontram‐se descritos na tabela 2.
Alterações hematológicas e classificação French‐American‐British (FAB) ao diagnóstico, dos pacientes com leucemia mielóide aguda tratados no Hospital Infantil Joana de Gusmão (HIJG) de 2004 a 2012
| Alterações hematológicas | n | % |
|---|---|---|
| Leucometria | ||
| <10.000 | 24 | 47% |
| 10.000‐50.000 | 17 | 33% |
| >50.000‐100.000 | 4 | 8% |
| >100.000 | 3 | 6% |
| Não consta | 3 | 6% |
| Node plaquetas | ||
| <20.000 | 11 | 22% |
| 20.000‐100.000 | 29 | 57% |
| >100.000 | 8 | 16% |
| Não consta | 3 | 6% |
| Neutropenia | ||
| Sim | 21 | 41% |
| Não | 27 | 53% |
| Não consta | 3 | 6% |
| FAB | n | % |
|---|---|---|
| M0 | 6 | 12% |
| M1 | 1 | 2% |
| M2 | 14 | 27% |
| M3 | 14 | 27% |
| M4 | 8 | 16% |
| M5 | 4 | 8% |
| M6 | 1 | 2% |
| M7 | 3 | 6% |
Correlacionando‐se a leucometria ao diagnóstico com o status vital (p=0,014), observou‐se que os pacientes com leucometria<10.000 encontravam‐se vivos em 79,2% dos casos, enquanto que aqueles com leucometria entre 10.000 e 50.000 estavam vivos em 29,4% dos casos. Os três pacientes (6%) que tinham leucometria>100.000 evoluíram a óbito.
A pesquisa de desordens genéticas foi documentada em 51% dos pacientes (n=26), observaram‐se alterações em 46,15% dos casos (n=12). A alteração mais frequente foi a t(15;17), encontrada em 6 pacientes (23%). Um desses pacientes apresentou associação da t(15;17) com FLT3‐IDT. As demais desordens genéticas encontradas foram poliploidia, t(8;21), presença do MLL, t(3;5), deleção do cromossoma 18, trissomia do cromossoma 21, trissomia do cromossoma 8 e tetrassomia do cromossoma 8.
A análise da DRM em 45% dos pacientes (n=23) foi<0,1%, em 16% (n=8) foi entre 0,1% e 1,0%, em 25% (n=13) foi>1,0% e em 14% (n=7) não constava o resultado do exame no prontuário médico.
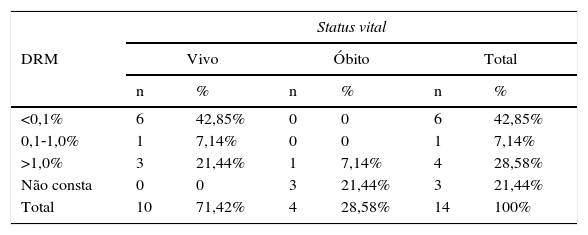
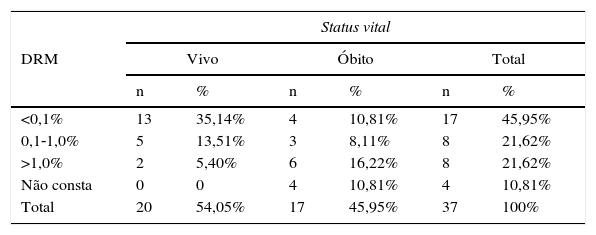
A comparação entre a DRM da medula óssea, no 15° dia de tratamento, e o status vital dos pacientes com leucemia pró‐mielocítica aguda (LMA‐M3) e não pró‐mielocítica aguda (LMA não‐M3) encontra‐se descrita nas tabelas 3 e 4.
Doença residual mínima (DRM) da medula óssea no 15° dia de tratamento da leucemia promielocítica aguda (LMA‐M3) e o status vital dos pacientes atendidos no Hospital Infantil Joana de Gusmão (HIJG) de 2004 a 2012 (p=0,025)
| Status vital | ||||||
|---|---|---|---|---|---|---|
| DRM | Vivo | Óbito | Total | |||
| n | % | n | % | n | % | |
| <0,1% | 6 | 42,85% | 0 | 0 | 6 | 42,85% |
| 0,1‐1,0% | 1 | 7,14% | 0 | 0 | 1 | 7,14% |
| >1,0% | 3 | 21,44% | 1 | 7,14% | 4 | 28,58% |
| Não consta | 0 | 0 | 3 | 21,44% | 3 | 21,44% |
| Total | 10 | 71,42% | 4 | 28,58% | 14 | 100% |
Doença residual mínima (DRM) da medula óssea no 15° dia de tratamento das leucemias não pró‐mielocíticas agudas (LMA não‐M3) e o status vital dos pacientes atendidos no Hospital Infantil Joana de Gusmão (HIJG) de 2004 a 2012 (p=0,019)
| Status vital | ||||||
|---|---|---|---|---|---|---|
| DRM | Vivo | Óbito | Total | |||
| n | % | n | % | n | % | |
| <0,1% | 13 | 35,14% | 4 | 10,81% | 17 | 45,95% |
| 0,1‐1,0% | 5 | 13,51% | 3 | 8,11% | 8 | 21,62% |
| >1,0% | 2 | 5,40% | 6 | 16,22% | 8 | 21,62% |
| Não consta | 0 | 0 | 4 | 10,81% | 4 | 10,81% |
| Total | 20 | 54,05% | 17 | 45,95% | 37 | 100% |
A sobrevida global foi de 57% neste estudo. Ao correlacionarmos o status vital com LMA‐M3 e LMA não‐M3, observou‐se que estavam vivos 71,42% e 54,05% dos pacientes, respectivamente, ao término do estudo.
Dos pacientes que foram a óbito (n‐22), 64% (n=14) não estavam em remissão clínica completa da leucemia no fim da indução quimioterápica. A principal causa imediata de óbito foi choque séptico, em 63,6% dos pacientes (n=14). Dos óbitos, três ocorreram nos primeiros 15 dias do tratamento, um por hemorragia intracraniana (LMA‐M3) e os outros dois, além da sepse, apresentavam leucostase pulmonar e hemorragia intracraniana com líquor infiltrado ao diagnóstico, respectivamente.
Com relação aos óbitos que ocorreram após o 16° dia de tratamento indutório (n=19), 12 ocorreram por choque séptico. Desses, seis foram pós‐quimioterapia reindutória por recidiva.
Dos pacientes com leucometria>100.000, um era LMA‐M3 com causa imediata do óbito por choque séptico, outro era LMA‐M0 com leucostase pulmonar associada a choque séptico e o outro era LMA‐M5 com insuficiência renal aguda.
Em relação aos pacientes (n=6) que apresentavam a t(15;17), dois foram a óbito. O paciente que apresentou t(15;17) e FLT3‐IDT encontrava‐se vivo e em remissão até a data do término do presente estudo.
Dentre os pacientes estudados, 39% (n=20) foram submetidos à radioterapia e 16% (n=8) ao transplante de medula óssea (TMO). Dos pacientes que foram submetidos ao TMO, dois faleceram e os demais se encontram vivos e em remissão clínica completa da leucemia.
Em 14% dos casos (n=7) houve recidiva da doença em medula óssea; desses, seis pacientes evoluíram a óbito.
DiscussãoNeste estudo, a maioria dos pacientes é do sexo masculino e tem idade maior do que um ano. A maioria daqueles que apresentavam leucometria<10.000/mm3 ao diagnóstico encontra‐se viva. A sobrevida global é maior nos pacientes com DRM<0,1% e o prognóstico é melhor nos pacientes com LMA‐M3.
Em outros estudos9,10 o sexo masculino também apresentou pequena predominância em relação ao feminino (1,2:1).
Assim como no estudo de Kavcic,10 observou‐se que a LMA predominou na etnia branca. Em Santa Catarina, em decorrência da descendência branca na maioria da população, a etnia branca foi predominante, o que impossibilitou a comparação entre as etnias.
Corroborando outros estudos,10–12 houve nesta pesquisa maior prevalência da LMA na faixa etária acima de um ano.
Neste estudo, como na literatura, foi verificado também que os sinais e sintomas da LMA são decorrentes da infiltração da medula óssea, apresentam manifestações hemorrágicas, febre, astenia, palidez e dor óssea.2
Em pesquisas publicadas anteriormente, a percentagem de acometimento do SNC ao diagnóstico variou de 5% a 15%.2,13 No presente estudo, 14% dos pacientes apresentaram SNC comprometido ao diagnóstico, semelhantemente ao descrito por Rubnitz et al.13
Estudos têm demonstrado que a percentagem de pacientes com leucometria acima de 100.000/mm3 varia entre 12% e 15%.6,9,14 Nesta casuística, apenas 6% dos casos apresentavam essa leucometria elevada ao diagnóstico. Essa diferença pode ser explicada pela falta de dados disponíveis no prontuário médico de alguns pacientes, pelo tamanho de nossa amostra ou pelo diagnóstico mais precoce da doença.
A contagem de leucócitos é o fator de risco mais importante para a falência do tratamento, devido à possibilidade de conduzir o paciente a complicações hemorrágicas ou insuficiência respiratória em decorrência da leucostase.9,15 Nosso estudo demonstrou que 80% dos pacientes tinham leucometria menor do que 50.000/mm3 ao diagnóstico, semelhantemente ao estudo de Imamura et al.14
A probabilidade de sobrevida livre de eventos (SLE), em cinco anos, foi apenas de 23% no grupo de pacientes com leucócitos acima de 100.000/mm3, segundo a análise dos protocolos de tratamento BFM‐83 e BFM‐87.9 Observou‐se, neste estudo, que 79,2% dos pacientes (p=0,014) com leucometria<10.000/mm3 ao diagnóstico encontravam‐se vivos, enquanto que aqueles com leucometria entre 10.000 e 50.000/mm3 eram somente 29,4%. Apenas três pacientes deste estudo apresentavam a leucometria ao diagnóstico>100.000/mm3, o que impossibilitou a análise estatística.
A classificação morfológica FAB para LMA pode definir o tratamento e a estratificação em grupos de risco.3 Nos estudos publicados9,14,16 o subtipo mais encontrado foi o M2, variou entre 33,6% a 37%. Em nosso estudo, os tipos morfológicos mais prevalentes foram M2 (27%) e M3 (27%), semelhantemente ao encontrado por Xiao‐jun Xu et al.6
Após o advento do ácido transretinoico (ATRA) a LMA‐M3 tornou‐se o subtipo FAB com melhor prognóstico, pela indução à diferenciação dos precursores leucêmicos em células maduras, determinadas por esse medicamento.1,17 Em nossa casuística observamos também boa resposta terapêutica a essa medicação, considerando que estavam vivos ao término deste estudo 71,42% dos pacientes com LMA‐M3 e 54,05% daqueles com LMA não‐M3.
A LMA é uma doença heterogênea do ponto de vista molecular, incluiu alterações somáticas e epigenéticas que contribuem para leucemogênese mielóide. Essas anormalidades citogenéticas, as mutações somáticas e a resposta à terapia de indução são importantes informações para a estratifcação de risco e a adequada alocação terapêutica.18
As anormalidades cromossômicas descritas na LMA incluem aberrações como ganho ou perdas de cromossomos inteiros, anormalidades estruturais ou translocações balanceadas.19 Na literatura é descrito que a translocação t(8;21) é a mais prevalente, varia entre 12% e 23%,12–14 e a t(15;17) é observada entre 3,4% a 10% dos casos.12,13
Segundo nossos resultados, 46% dos pacientes avaliados apresentaram alguma alteração citogenética, a translocação t(15;17) foi mais prevalente (23%), o que é justificado pelo número de casos de LMA‐M3 no presente estudo. Como essa alteração tem prognóstico favorável, ratifica os resultados encontrados de maior sobrevida nos pacientes com LMA‐M3. Cabe ressaltar que a análise citogenética dos pacientes em nosso estudo foi documentada em apenas 51% dos casos, podem, então, estar subestimados os resultados encontrados.
Estudo recente15 afirma que a sobrevida é pobre em pacientes que tenha associação da translocação t(15;17) e FLT3‐IDT, é, portanto, fator preditor independente do prognóstico, com taxa de sobrevida livre de progressão de doença de 16%. Em nossa casuística, apenas um paciente com LMA‐M3 apresentou associação da translocação t(15;17) e FLT3‐IDT e encontrava‐se vivo e sem sinais de recidiva no fim do estudo.
No estudo BFM, a medida da DRM da medula óssea após o primeiro bloco de tratamento foi o melhor preditor de sobrevida livre de eventos quando comparada com o esquema de classificação de risco pelo subtipo FAB, a citogenética e a presença de blastos na morfologia em sangue periférico no dia 15° dia de tratamento antineoplásico.15 A presença de DRM elevada após o primeiro curso de indução foi significativamente associada com resultado adverso. A taxa de recidiva foi particularmente elevada (49%) para os pacientes com DRM> 1%, enquanto que em pacientes com DRM menor (0,1‐1%) a taxa de recaída foi de apenas 17%.15
O estudo de Al‐Mawali et al.20 demonstrou também que DRM>0,15% foi um preditor independente de mau prognóstico, após a quimioterapia de indução. Outros estudos também têm demonstrado a correlação entre DRM<0,1% e melhor sobrevida livre de eventos, como os de Rubnitz et al.21 e Inaba et al.22,23
Apesar de a DRM ser um forte fator prognóstico, aproximadamente um quarto dos pacientes com DRM baixa apresentará recaída. No estudo feito por Karol et al.,24 entre os fatores de risco para recaída foram identificadas certas anormalidades do 11q23, tais como t(6;11) e t(10;11), leucemia megacariocítica sem t (1:22) e idade ≥10 anos.24
Neste estudo, ao se comparar a DRM<0,1% no 15° dia de tratamento com o status vital, constatou‐se que 100% dos pacientes com LMA‐M3 e 76,5% dos pacientes com LMA não M3 encontravam‐se vivos, respectivamente. Quando a DRM era>1,0%, observou‐se que 75% dos pacientes com LMA‐M3 e 25% dos LMA não M3 estavam vivos. Houve significância estatística entre DRM da medula óssea e status vital (p=0,022), bem como entre LMA‐M3 e status vital (p=0,025) e entre LMA não M3 e status vital (p=0,019). Esses dados corroboram a importância prognóstica da quantificação na DRM.
No que se refere à recidiva, a medula óssea é o local mais frequente de recaída da LMA.15 Nesta casuística, todas recidivas ocorreram nesse sítio.
As recentes terapias antineoplásicas, como novos agentes quimioterápicos, anticorpos monoclonais e imunomoduladores, são desafios na avaliação do impacto sobre a função imune da criança e das complicações infecciosas.19
A literatura relata que a principal causa de óbito nesses pacientes é a infecção e está relacionada principalmente à intensificação da quimioterapia.5,6,9
Estudo feito por Silva et al.25 analisou a tendência de mortalidade no Brasil nas crianças com leucemia, de 1980 a 2010, e descreveu que as mortes vinculadas ao tratamento das leucemias mielóides agudas em países menos desenvolvidos podem chegar a 33%, pois a quimioterapia intensiva predispõe à neutropenia grave e expõe o paciente a infecções.
Pacientes pediátricos em tratamento para LMA são de alto risco para complicações infecciosas, predominantemente bacterianas e fúngicas. Algumas instituições têm implantado a profilaxia com antibióticos e antifúngicos, para reduzir essas infecções. Entretanto, a avaliação sistemática dos estudos de profilaxia com antibióticos indica que não há dados suficientes para definir normatizações para seu uso. Portanto, são necessários estudos adicionais para identificação precisa do melhor regime de antibiótico e em qual população de crianças estaria indicado.26,27
O presente estudo demonstrou também que o choque séptico (63,6%) foi a causa de óbito mais prevalente. Dos 19 pacientes que evoluíram a óbito, após 15 dias da terapia de indução, seis haviam recidivado. Os óbitos ocorridos nesse período provavelmente são decorrentes de infecções após aplasia indutória.
Nas últimas décadas, apesar de o prognóstico da LMA ter melhorado, um terço dos pacientes recidivará. Essa população tem um prognóstico pobre, com probabilidade de sobrevida em longo prazo em torno de 35%, apesar da quimioterapia intensiva e do transplante alogênico de medula óssea. A toxicidade e a mortalidade decorrentes desse tratamento também são significativas.28
Atualmente, têm sido desenvolvidos estudos com terapias alvo que focalizam principalmente as vias funcionais das células leucêmicas, como os receptores de superfície celular, quinases intracelulares específicas, proteínas que regulam a morte celular e moduladores dos genes de expressão, com vistas à melhoria na sobrevida dos pacientes com LMA.29
O tratamento da LMA deve ser fundamentado em uma estrutura clínica capaz de apoiar a agressividade terapêutica, além de uma base laboratorial capaz de discriminar os grupos de riscos e contribuir para a identificação de fatores prognósticos de relevância, além das medidas de apoio necessárias para os cuidados desses pacientes.
Na presente casuística, o viés de seleção foi considerado pela inclusão de todos os casos diagnosticados no serviço. Os resultados desta pesquisa podem ter sido influenciados por peculiaridades da população estudada, pelos diferentes protocolos do tratamento usados (BFM), pelos recursos médico‐hospitalares disponíveis em nosso serviço e pelo tamanho da amostra. No entanto, os resultados observados neste estudo revelam a necessidade de se fazerem estudos analíticos multicêntricos nacionais, com vistas à confirmação da ocorrência das associações encontradas, e, assim, estabelecer fatores prognósticos para LMA.
Neste estudo, a comparação entre a DRM da medula óssea no 15° dia de tratamento indutório com o status vital demonstrou que 71,42% dos pacientes com LMA tipo M3 e 54,05% dos com LMA não M3 estavam vivos. A taxa de óbito foi de 43% e a principal causa imediata foi o choque séptico (63,6%).
Conflitos de interesseOs autores declaram não haver conflitos de interesse.
Ao Hospital Infantil Joana de Gusmão, Florianópolis, SC, Brasil.
Como citar este artigo: de Lima MC, da Silva DB, Freund AP, Dacoregio JS, Costa TE, Costa I, et al. Acute Myeloid Leukemia: analysis of epidemiological profile and survival rate. J Pediatr (Rio J). 2016;92:283–9.