To describe the current recommendations on the best management of pediatric patients with acute diarrheal disease.
Data sourcePubMed, Scopus, Google Scholar.
Data summaryThere has been little progress in the use of oral rehydration salts (ORS) in recent decades, despite being widely reported by international guidelines. Several studies have been performed to improve the effectiveness of ORS. Intravenous hydration with isotonic saline solution, quickly infused, should be given in cases of severe dehydration. Nutrition should be ensured after the dehydration resolution, and is essential for intestinal and immune health. Dietary restrictions are usually not beneficial and may be harmful. Symptomatic medications have limited indication and antibiotics are indicated in specific cases, such as cholera and moderate to severe shigellosis.
ConclusionsHydration and nutrition are the interventions with the greatest impact on the course of acute diarrhea.
Descrever as recomendações atuais sobre a melhor maneira de conduzir o paciente pediátrico com doença diarreica aguda.
Fonte dos dadosPubMed, Scopus, Scholar Google.
Síntese dos dadosHouve pouco avanço no uso dos sais de reidratação oral (SRO) nas últimas décadas apesar de ser amplamente divulgado por meio de diretrizes internacionais. Vários estudos vêm sendo feitos na tentativa de melhorar a eficácia do SRO. Hidratação venosa com solução salina isotônica, infundida de forma rápida, deve ser indicada em casos de desidratação grave. A nutrição deve ser assegurada logo após a resolução da desidratação e é primordial para a saúde intestinal e imunológica. Restrições alimentares usualmente não são benéficas e podem ser prejudiciais. As medicações sintomáticas têm indicação restrita e antibióticos são indicados em casos específicos, cólera e shiguelose moderada a grave.
ConclusõesA hidratação e a nutrição continuam a ser as intervenções com melhor impacto sobre o curso da diarreia aguda.
A doença diarreica aguda (DDA) é um problema de saúde pública em diversas regiões do mundo, especialmente naquelas onde a pobreza predomina. Um modelo que busque explicar a incidência ou a letalidade associada à DDA envolve um grande número de variáveis (biológicas, ambientais, socioculturais) e é de grande complexidade. Por outro lado, uma visão reducionista pouco contribui para o entendimento e a solução do problema.1,2
A comunidade científica nas últimas quatro décadas formou um consenso sobre quais são as medidas mais efetivas para reduzir a incidência e a morbiletalidade da DDA. Algumas medidas voltadas para a redução da incidência da doença diarreica são intervenções que estão além da abordagem médica do problema e estão alicerçadas em melhoria das condições ambientais – oferta de água, tratamento adequado dos dejetos humanos –, educação e segurança alimentar. O aleitamento materno exclusivo por, no mínimo, seis meses e complementado até dois anos tem impacto significativo na redução da incidência e gravidade da doença. No campo da biomedicina, o desenvolvimento da vacina contra o rotavírus e a universalização da cobertura têm sido considerados contribuição importante que impacta na incidência da DDA, na redução das formas graves e no número de hospitalizações e reduz assim o risco de morte por essa doença.3,4
Em relação à letalidade, o manejo terapêutico com ênfase na terapia de reidratação oral (TRO) e na terapia de reidratação venosa (TRV) preconizado a partir da década de 1970 é um marco na medicina do século XX. Em 1994, JN Ruxin5 escreveu um artigo em comemoração aos 25 anos da implementação da TRO e concluiu (constatou e expressou certo pessimismo): the formidable and persistent ignorance of the western medical establishment, which continues over twenty‐five years after the discovery of ORT, is phenomenal. O século XXI iniciou e apesar de inúmeros artigos publicados que mostraram a eficácia e a efetividade da TRO e TRV, observa‐se que o manejo da DDA continua a ser feito ignorando as evidências científicas.6,7
Em artigo recente, Walker &Walker2 apresentam um modelo The Lived Saved Tool (LiST) e analisam o impacto do uso dos sais de reidratação oral (SRO), do zinco e de antibiótico na disenteria na redução da mortalidade por DDA. Os SRO de baixa osmolaridade e o uso do zinco em grupos de risco para diarreia persistente e do antibiótico, apenas nos casos selecionados de disenteria, mostram um impacto positivo nos desfechos estudados.É grande o conhecimento científico acumulado em relação à melhor abordagem do paciente com DDA. No entanto, chama a atenção de pesquisadores a baixa adesão dos médicos as recomendações emanadas tanto por organismos internacionais de saúde quanto por sociedades médicas que periodicamente publicam diretrizes sobre o tema.1,8‐10
Por que – apesar da ampla evidência científica – o médico opta por tratar a DDA baseado em condutas obsoletas? Esse é o motivo para a elaboração desta revisão. Ainda hoje se observa um uso inadequado da TRO/TRV, orientações alimentares que beiram a iatrogenia e a indicação sem base científica de medicamentos.4 Por isso, neste artigo, buscamos trazer uma síntese do conhecimento atual sobre o manejo da DDA focando a TRO/TRV, a alimentação na fase aguda do processo diarreico, o uso criterioso de medicações sintomáticas, de probióticos, do zinco e de antibióticos.
Manejo da DDANão há um consenso sobre o conceito de DDA, mas alguns aspectos básicos são contemplados nas diversas publicações.8,9,11 Nesta revisão, consideramos DDA como “o episódio diarreico que apresenta as seguintes características: início abrupto, etiologia presumivelmente infecciosa, potencialmente autolimitado, com um curso de menos de 14 dias, volume e/ou frequência das fezes e perda de nutrientes fecais (principalmente água e eletrólitos) aumentados”. Daí se inferem as suas principais complicações – os distúrbios hidreletrolíticos, os déficits nutricionais – e a base para o seu manejo.
Do ponto de vista clínico a DDA pode ser classificada como: síndrome da diarreia aquosa (que representa a grande maioria dos quadros diarreicos infecciosos), síndrome da diarreia com sangue e diarreia persistente (quando o episódio se estende por mais de 14 dias). Independentemente do agente causal, na maioria dos episódios diarreicos de etiologia infecciosa o manejo terapêutico se alicerça na manutenção do estado de hidratação e nutrição.1,4,9,12
Considerando a gravidade, a DDA é classificada em leve, moderada e grave. Leve quando não se observa sinais de desidratação. Moderada quando há sinais de desidratação leves ou moderados e é possível fazer a reidratação por via oral. Grave quando leva a desidratação mais intensa acompanhada ou não de distúrbios eletrolíticos e requer a terapia venosa.9,13
A maioria dos casos de DDA é de leve ou moderada gravidade e não é atendida nos serviços de saúde. Daí a importância das campanhas de orientação de manejo domiciliar da doença diarreica para prevenir a desidratação. Nos hospitais chegam os casos com sintomas mais exuberantes e pacientes desidratados ou em risco para desidratar; quadros secundários a vômitos intensos ou diarreia de alto débito.9,13
Do ponto de vista fisiopatológico, são dois os mecanismos básicos envolvidos: osmótico e secretor. Secundariamente a esses mecanismos, podem acontecer também alterações na motilidade intestinal. O mecanismo osmótico se observa quando há aumento da osmolaridade luminal, como acontece na diarreia associada ao rotavírus, em que ocorre dano na mucosa do intestino delgado proximal e redução na concentração da lactase no bordo em escova, consequentemente aumento da lactose não digerida na luz intestinal. O excesso de açúcar ao ser fermentado por bactérias que fazem parte da microbiota colônica dá origem a ácidos graxos de cadeia curta, radicais ácidos, o que explica a distensão e dor abdominal e em alguns casos a hiperemia perianal. A diarreia é aquosa e explosiva. O mecanismo secretório ocorre quando há um estímulo dos mediadores da secreção por meio de exotoxinas produzidas por patógenos bacterianos (Vibrio cholerae, Escherichia coli enterotoxigênica) ou de mediadores da inflamação como na diarreia associada a cepas de shigella. Do ponto de vista das perdas fecais, o que diferencia basicamente os dois mecanismos é a perda de sódio, que é mais elevada na secretória e pode ser maior do que 70 mEq de sódio por litro de fezes.14
Nas formas mais graves da DDA, em que ocorre diarreia de alto débito, é importante caracterizar o tipo de mecanismo envolvido para que as perdas sejam repostas de forma adequada. No entanto, a maioria dos quadros de DDA na infância, mesmo aqueles que levam à desidratação e necessitam de tratamento em ambiente hospitalar, responde bem ao manejo padrão13 que será discutido em outro local deste artigo.
As funções digestivo‐absortivas estão mantidas na quase totalidade das crianças acometidas pela DDA. Daí, se é ofertado um aporte calórico adequado é mínimo o risco de a criança se desnutrir ou agravar uma desnutrição preexistente. São poucas as situações nas quais são necessárias restrições ou modificações na alimentação. A abordagem nutricional será revista em outro item.
HidrataçãoA desidratação é a principal complicação da diarreia aguda e a avaliação do estado de hidratação deve ser uma das primeiras atitudes a serem tomadas na abordagem da criança com diarreia. A perda aguda de peso ocorrida durante o episódio diarreico é considerada o melhor parâmetro para avaliar a desidratação. De acordo com a perda, a desidratação é classificada em leve (< 5% de perda de peso), moderada (5%‐10%) e grave (> 10% de perda de peso); a classificação da gravidade da desidratação é essencial para o tratamento.9 Devido à dificuldade de se obter a informação sobre o peso anterior (para estimar a perda de peso), esse parâmetro tem utilidade prática limitada e outras variáveis clínicas necessitam ser usadas.
A avaliação clínica é usualmente usada na definição do estado de hidratação. Entretanto, pode ter variação interpessoal. Devem ser usados sinais clínicos validados e passíveis de ser avaliados de forma simples e objetiva. Os sinais mais bem relacionados à desidratação moderada‐grave são: enchimento capilar lentificado, turgor da pele diminuído e alteração do padrão respiratório. A apresentação clínica da doença também pode alertar para o risco de desidratação. A criança com diarreia de alto débito associada a vômitos tem maior risco de desidratar.9
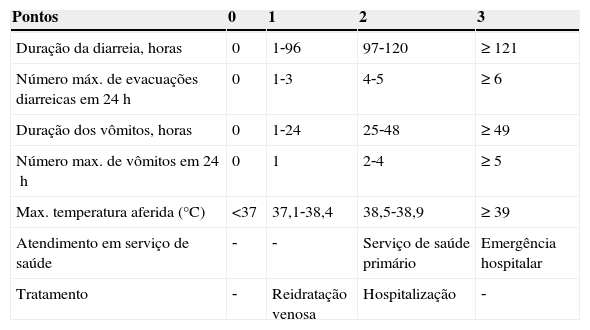
O uso de sistemas de escore para determinação do estado de hidratação e de gravidade da doença é considerada útil no manejo da criança com diarreia. A escala de desidratação clínica (EDC) (tabela 1) desenvolvida em 2008 para crianças de um a 36 meses com DDA atendidas em emergência já foi validada em vários estudos.15 A EDC leva em consideração quatro itens clínicos (aparência geral, olhos, mucosas e lágrimas) que permitem classificar a criança em “sem desidratação”, “alguma desidratação” e “desidratação moderada/grave”. O escore de gravidade de doença provê uma medida mais global do impacto da DDA sobre a saúde da criança. O escore de gravidade de Vesikari (tabela 2) é um escore clássico que foi validado recentemente em uma versão modificada; apresentou boa aplicabilidade em diferentes serviços e populações.16 Ele não avalia o estado de hidratação, e sim o impacto da DDA em diferentes populações (leve, moderado e grave) e a resposta às intervenções.17
Escala de desidratação clínica ‐ EDC (adaptado de Freedman et al.23)
| Características | 0 | 1 | 2 |
|---|---|---|---|
| Aparência geral | Normal | Com sede, inquieta ou letárgica, mas irritada quando nauseada | Sonolenta, hipotônica, fria ou sudorética+‐ comatosa |
| Olhos | Normal | Levemente encovado | Muito encovado |
| Membranas mucosas (língua) | Úmida | Espessa | Seca |
| Lágrimas | Presente | Lágrima diminuída | Lágrima ausente |
Escore=0, nenhuma desidratação; Escore 1‐4, alguma desidratação; Escore 5‐8, desidratação moderada à severa.
Escore de gravidade modificado de Vesicari (adaptado de Carmo et al.29)
| Pontos | 0 | 1 | 2 | 3 |
|---|---|---|---|---|
| Duração da diarreia, horas | 0 | 1‐96 | 97‐120 | ≥ 121 |
| Número máx. de evacuações diarreicas em 24h | 0 | 1‐3 | 4‐5 | ≥ 6 |
| Duração dos vômitos, horas | 0 | 1‐24 | 25‐48 | ≥ 49 |
| Número max. de vômitos em 24h | 0 | 1 | 2‐4 | ≥ 5 |
| Max. temperatura aferida (°C) | <37 | 37,1‐38,4 | 38,5‐38,9 | ≥ 39 |
| Atendimento em serviço de saúde | ‐ | ‐ | Serviço de saúde primário | Emergência hospitalar |
| Tratamento | ‐ | Reidratação venosa | Hospitalização | ‐ |
Leve 0‐8; Moderada 9‐10; Grave ≥ 11.
Exames laboratoriais não são indicados na rotina para crianças com DDA, mas podem auxiliar na determinação da gravidade da desidratação. Baixos níveis de bicarbonato sérico (< 15mEq/L) e elevação nos níveis de ureia (> 10nmol/L) teriam um bom valor preditivo positivo para desidratação moderada a grave.18
Na criança desidratada, o tratamento hidroeletrolítico consiste na reidratação e na reposição de perdas. A terapia de reidratação oral (TRO) deve ser preferencialmente usada para reidratação, enquanto que a venosa (TRV) deve ser usada apenas no caso de falha da TRO ou nos casos graves de desidratação. Numa revisão sistemática que comparou o uso da TRO e a TRV em crianças com diferentes graus de desidratação conclui‐se que não houve diferença em relação ao risco de distúrbio metabólico, duração média do episódio diarreico e necessidade de fluidos em relação à terapia usada. O tempo de internamento hospitalar foi menor no grupo que usou TRO. Quanto aos desfechos desfavoráveis, observou‐se mais flebite no grupo que fez TRV e maior ocorrência de íleo paralítico no grupo que fez TRO. A taxa de insucesso da TRO foi de 1: 25, ou seja, para cada 25 crianças que fizeram TRO, uma necessitou de TRV.19
A hidratação venosa é usada há mais de um século, mas as logísticas para a sua execução e as complicações associadas mostraram que ela é de pouca utilidade quando há necessidade de hidratar grande número de indivíduos, em epidemias de diarreia infecciosa. Em torno de 1970, o soro de reidratação oral foi desenvolvido com o intuito de corrigir a desidratação decorrente de diarreia infecciosa grave, particularmente a diarreia por cólera. O soro foi inicialmente elaborado como uma solução isotônica, ou seja, com osmolaridade de 311 mOsm/Kg H2O e concentração de sódio de 90mEq/L. Foi então a solução padrão da Organização Mundial de Saúde (OMS).20
Apesar do sucesso inicial, observou‐se uma mudança no cenário mundial caracterizada por uma menor ocorrência de diarreia por cólera e maior ocorrência de diarreias virais. Nesse contexto, surgiu uma preocupação em relação à concentração de sódio da solução padrão da OMS, que seria muito elevada em relação às perdas observadas nas diarreias virais. Há cerca de uma década, estudos confirmaram o benefício com o uso de soluções hipotônicas, com osmolaridade de 245 mOsm/Kg H2O e concentração de sódio de 60‐75 mEq/L, nas diarreias não coléricas. Foi demonstrado que crianças que fizeram uso das soluções hipotônicas evoluíam com menos vômitos, menores perdas fecais, menor duração da doença e menor necessidade de hidratação venosa, quando comparadas com as que usaram a solução até então preconizada pela OMS. As soluções hipotônicas também contêm menores concentrações de glicose, o que garante a proporção adequada para o transporte acoplado de sódio e água pela mucosa intestinal.21
Para favorecer a aceitação, o soro oral deve ser dado fracionado, em pequenas porções. Entretanto, o elevado volume necessário para a reidratação pode não ser tolerado pela criança e pode haver recusa na ingestão do líquido ou mesmo vômito. A sonda nasogástrica (SNG) está indicada nessas circunstâncias, como também na impossibilidade de hidratação venosa ou intraóssea. Tem como vantagens: prevenir a hiper‐hidratação, não ser invasiva, permitir o rápido início do tratamento e ter menor custo. Foi demonstrado que a hidratação por SNG é tão efetiva quanto a hidratação venosa em caso de desidratação moderada.22 Apesar disso, os profissionais de saúde estão mais familiarizados com o uso da hidratação venosa do que com a hidratação por sonda nasogástrica.23
A eficácia do uso dos SRO em reduzir a morbimortalidade por ocasião de episódios de diarreia aguda é incontestável, porém o seu uso está aquém da meta e não obteve avanços nos últimos 30 anos. Uma possível justificativa para falta de avanço no uso do SRO seria o fato de que inicialmente houve um grande investimento em programas educacionais para o uso do SRO, mas com o surgimento de vários outros focos educacionais para a prevenção e tratamento da DDA (vacinação, aleitamento materno, nutrição e hábitos de higiene), a TRO teria perdido a prioridade. Ressalta‐se que é necessário manter as campanhas educacionais para o uso prioritário do SRO, pelo menos para que as novas mães possam ser orientadas a usá‐los.4
Outras possíveis explicações para o inadequado uso dos SRO seriam a recusa por parte das crianças (possivelmente relacionada ao sabor) e o fato de o soro oral não reduzir as perdas diarreicas. Em função dessa realidade, vem‐se buscando uma forma de melhorar esse cenário. A flavorização dos SRO, presente em alguns produtos comerciais, aumenta a palatabilidade, entretanto parece não modificar o volume consumido.24 A adição de zinco, prebióticos, aminoácidos, dissacarídeos e polímeros de glicose resultou apenas em uma melhoria modesta na eficácia dos SRO.9
A adição de substrato que leva à produção de ácidos graxos de cadeia curta (AGCC) tem despertado interesse, uma vez que os AGCC são rapidamente absorvidos pelos colonócitos e estimulam a absorção de fluidos e sódio. Estudos sugerem benefício na adição de um amido resistente (substrato que leva à formação de AGCC no cólon) aos SRO. Numa revisão sistemática da Cochrane, os autores encontraram que o uso dos SRO adicionado a amido resistente estava associado a uma menor necessidade de infusão venosa e menores perdas por diarreia.25 Apesar dos possíveis benefícios, há problemas técnicos ainda não resolvidos, forma‐se uma solução opaca, que precipita rapidamente, ainda não foi identificada a suspensão ideal para solucionar esse problema.
Embora a TRO deva ser usada de forma preferencial, a hidratação venosa é necessária e vital em casos de desidratação grave. Possíveis controvérsias sobre a melhor forma de fazer a hidratação venosa estão relacionadas ao tipo de fluido, ao volume e à velocidade de infusão. Em relação ao tipo de solução, existe evidência de que a solução salina isotônica (solução salina 0,9%) é preferível à hipotônica (solução salina 0,45%), previne a ocorrência de hiponatremia sem causar hipernatremia.26
Quanto ao volume e à velocidade, estudos que comparam a infusão de 20ml/kg (rápida) vs 60ml/kg (ultrarrápida) de solução salina 0,9%, em uma hora, em crianças com indicação de hidratação venosa por falha na TRO evidenciaram que as crianças submetidas à infusão ultrarrápida tiveram maior frequência de hipernatremia e alta hospitalar mais tardia do que as submetidas à infusão rápida, não houve diferença na taxa de reidratação. De forma que as evidências atuais não justificam o uso da reidratação ultrarrápida.27
Segundo as recomendações da OMS, a reposição das perdas deve ser feita, sempre que possível, por via oral, e deve ser iniciada ainda durante a reidratação venosa.13 A hidratação venosa deve ser suspensa logo que a criança esteja hidratada e alerta, para assegurar‐se a hidratação da criança por meio da TRO. Como guia a OMS recomenda o volume de ¼ de copo (50ml‐100ml) para crianças abaixo de dois anos, ½ copo (100ml‐200ml) para crianças de dois a 10 anos e volume livre para os maiores de 10 anos. O fluido a ser usado na reposição das perdas diarreicas deve ser o SRO hipotônico, porém, caso não seja possível, a OMS orienta o uso de outros fluidos salinizados, como água de arroz, caldo de legumes e soro caseiro. O próprio leite materno poderia ser usado como o fluido de reposição de perdas na criança que amamenta. Já fluidos como energéticos, refrigerantes e sucos ricos em sorbitol não devem ser usados como repositores de perdas devido ao baixo teor de sódio e à elevada osmolaridade.
O uso do soro caseiro, solução preparada de forma artesanal no domicílio por meio da adição de sal e açúcar à água, é contemplado na Caderneta de Saúde da Criança do Ministério da Saúde do Brasil,28 que orienta o preparo por meio do método punhado‐pitada (um punhado de açúcar e três pitadas de sal para 200ml de água). O soro caseiro ainda pode ser preparado por meio da colher medida e da colher caseira. A OMS, em seu documento sobre tratamento de diarreia aguda de 2005, faz breve comentário sobre a possibilidade de seu uso (por meio da colher caseira) e relata que, embora potencialmente eficaz, não é recomendado, devido ao inadequado preparo e consumo.
Estudo feito em Ouro Preto, o qual avaliou a concentração de sódio e glicose em soluções de soro caseiro preparadas por agentes de saúde da região, constatou um elevado percentual (71,1% a 96,1%) de inadequado preparo, que variou conforme o método usado (menor inadequação observada com o método punhado‐pitada). Quando os agentes de saúde foram perguntados sobre o método de preparo do soro caseiro com o qual orientavam as famílias, cerca de 30% referiram indicar a colher medida, seguida pela colher caseira (19%) e por fim pelo uso do punhado‐itada (6%). Por outro lado, apenas 17% dos agentes de saúde referiram haver a disponibilidade da colher medida nas Unidades Básicas de Saúde (USB) da região. Neste trabalho, os autores alertam para o fato de que a inadequada concentração dos solutos e do balanço entre o sal e a glicose, compromete o potencial de hidratação do soro caseiro e coloca as crianças em risco; traz também, como mensagem principal do artigo, o despreparo do agente de saúde para orientar a população em relação ao soro caseiro.29
Numa revisão sistemática sobre o efeito das soluções de reidratação oral na mortalidade por diarreia, conclui‐se que existem evidências claras de que o SRO da OMS é efetivo em reduzir a mortalidade. Entretanto, não existem evidências sobre a efetividade de outros fluidos domésticos (incluindo o soro caseiro) no combate à morte infantil por desidratação.30 Apesar da falta de evidências e dos possíveis riscos associados à substituição SRO pelo soro caseiro, a PNDS (Pesquisa Nacional de Demografia e Saúde da Criança e da Mulher) de 2006 constatou um aumento do uso do soro caseiro quando comparado ao observado na PNDS de 1996 (16% vs 37%) e consequente queda no uso do SRO no mesmo período (44% vs 19%).31
Alinhados com essa problemática, Munos et al., na revisão sistemática previamente citada, encontraram que a dupla orientação para o uso do SRO e das soluções caseiras confunde a população, diminui a efetividade da estratégia de combate à mortalidade por diarreia, e recomendam que seria prioritário que se concentrassem esforços para que o SRO seja garantido e oferecido para toda a população.30
Apesar de todas as considerações sobre reidratação, a meta a ser alcançada é a prevenção inicial da desidratação. Para alcançar essa meta é necessário, segundo estratégia proposta pela OMS, que a TRO seja iniciada em casa, logo no início do quadro diarreico, de forma a repor as perdas.13 As famílias devem ser educadas quanto ao início precoce da hidratação oral e quanto aos indícios de falha, como a ocorrência de vômitos e sinais de desidratação. Em trabalho que analisou o conhecimento materno sobre o manejo da DDA, em Recife, foi constatado que a maioria das mães não tinha conhecimentos adequados sobre a utilidade dos SRO em prevenir ou tratar a desidratação. Os autores fazem a seguinte consideração: “Os resultados deste estudo mostram que, mesmo com a melhoria dos conhecimentos maternos sobre a TRO ao longo de mais de uma década, é necessário um maior empenho por parte dos profissionais de saúde, no sentido de se criarem estratégias para que a informação seja transmitida às mães de maneira mais eficiente”.32
AlimentaçãoEmbora a manutenção de dieta adequada para idade seja prioritária para a regeneração da mucosa intestinal, ainda se observam práticas alimentares inadequadas no manuseio da criança com diarreia aguda. O enterócito obtém os seus nutrientes principalmente do conteúdo do lúmen intestinal, portanto o jejum, ou a restrição alimentar, pode retardar o processo de renovação das células danificadas pelo processo infeccioso.33 Má‐absorção intestinal, de maior ou menor gravidade, pode ocorrer na DDA em função da lesão causada pelo patógeno; entretanto, a boa nutrição deve ser assegurada e restrições alimentares não devem ser instituídas sob a justificativa de essas diminuírem as perdas diarreicas. Com a criança hidratada, a alimentação habitual deve ser mantida. Em caso de desidratação leve a moderada, a alimentação deve ser oferecida quatro a cinco horas após o início da reidratação.9 A manutenção do aleitamento materno durante o episódio diarreico, mesmo na criança com desidratação leve a moderada, é um consenso.34
Em revisão sistemática sobre manuseio dietético na diarreia em países de baixa e média condição econômica, alguns pontos sobre o uso de lactose na dieta foram analisados. A quantidade normal de lactose pode ser mantida de forma segura na maioria das crianças com diarreia. Entretanto, a deficiência transitória de lactase e a consequente má digestão da lactose podem agravar o quadro diarreico num grupo menor de crianças. A restrição de lactose seria benéfica em casos selecionados. Seria evidenciada redução das perdas e menor tempo do episódio diarreico. As crianças com maior chance de se beneficiar da restrição de lactose seriam aquelas que evoluem com desidratação grave e as desnutridas. A restrição de lactose por menor oferta de leite, associada à manutenção do restante da dieta caseira, estaria relacionada a um melhor ganho ponderal, quando comparada ao uso predominante de fórmulas sem lactose.34
Sugere‐se que na criança ainda não exposta à fórmula láctea à base do leite de vaca deva‐se evitar que essa primeira exposição ocorra durante ou logo após o episódio de DDA, para evitar a sensibilização à proteína do leite.35 Por outro lado, não há evidências de que mudança para fórmula de soja ou fórmula hipoalergênica possa ser benéfica à criança.
Em crianças que já iniciaram a dieta sólida, a alimentação deve ter uma composição calórica adequada, assim como de macro e micronutrientes. Em crianças hospitalizadas com diarreia, a maior ingestão calórica esteve associada à menor duração do episódio e consequentemente um melhor desfecho.36 A alimentação adequada durante o quadro diarreico pode reduzir a ocorrência de novos episódios. A inadequada abordagem nutricional durante o período de diarreia pode levar a desnutrição e à instalação do ciclo vicioso de desnutrição, menor resistência a novos enteropatógenos, recorrência dos episódios diarreicos e mais desnutrição.37
Em relação ao uso de dieta artesanal ou industrial na alimentação durante o episódio diarreico, não foi encontrada evidência de superioridade das fórmulas industriais em relação à dieta caseira adequada. Sucos com elevado teor de frutose, sacarose e sorbitol devem ser evitados, pois, devido à elevada osmolaridade, podem agravar as perdas diarreicas.35
Deverá ser oferecida a dieta habitual da criança, incluindo alimentos com fibra e gordura. A suplementação da dieta com óleo vegetal é uma recomendação da OMS para aumentar a densidade calórica dos alimentos e evitar a desnutrição. Estudos feitos nos anos 1990 sugerem que a ingestão de fibra pode diminuir o tempo de fezes líquidas.38
A anorexia pode acometer a criança com diarreia aguda, fato comumente encontrado na fase aguda de doenças, e pode ser mais grave na ocorrência de desidratação, acidose e hipocalemia. Os distúrbios devem ser corrigidos e alimento deve ser oferecido em pequenas porções e com frequência, respeitando‐se a vontade da criança. A inapetência é transitória e a alimentação apropriada deve estar disponível para promover a recuperação nutricional o mais prontamente possível.38
Manejo medicamentoso da DDASintomáticos: dor e febreA febre está ausente na maioria dos casos da DDA. Em crianças pequenas a desidratação pode levar a um aumento da temperatura corporal. Na DDA com sangue pode ser um sintoma importante. Deve ser tratada quando acima de 39°C ou quando o aumento da temperatura estiver associado a sintomas que causem mal‐estar à criança. Antitérmicos usados com maior frequência são o paracetamol e a dipirona.1,4,8
A dor abdominal tipo cólica é um sintoma comum na diarreia osmótica (excesso de gases intestinais) e o tenesmo é observado quando há um componente inflamatório importante, geralmente na DDA associada à shigella. No primeiro caso, uma redução na oferta de leite e derivados alivia o sintoma; no segundo caso a indicação de fármacos com efeito analgésico – paracetamol ou dipirona – beneficia o paciente.1,4,8 Não deve ser indicado medicamento antiespasmódico (escopolamina) e antifisiótico (simeticona).
AntieméticosA presença de vômitos é frequente em quadros de DDA e antieméticos são prescritos de forma excessiva sem se considerar a intensidade dos vômitos. Na maioria das vezes o quadro de vômitos cede quando se hidrata a criança, pois a desidratação mesmo subclínica pode causar vômitos.
Quando os vômitos são esporádicos, não há indicação para o uso de antieméticos, quando intensos aumenta o risco de desidratação e hospitalização e essas drogas podem trazer um benefício para os pacientes. Importante lembrar que o risco de efeito colateral a elas aumenta quando são usadas em pacientes desidratados ou com distúrbios eletrolíticos.39
Dentre os medicamentos mais usados estão: bloqueadores dos receptores H1da histamina (prometazina, dimenidrinato), antagonistas de receptores da dopamina (metoclopramida) e de serotonina–5HT (ondansetrona).
Na literatura, não se encontra uma boa evidência científica que embase o uso da metoclopramida e dimenidrinato na DDA.39 Em relação ao ondansetron, vários estudos mostram que reduz o risco de desidratação e de hospitalização no subconjunto de pacientes que apresentam alta frequência de vômito.40
AntidiarreicosA procura por medicamentos que atuem reduzindo o volume das fezes e/ou o tempo do episódio diarreico tem sido alvo de uma busca constante. Estudos com adsorventes, silicato de alumínio, diosmectite são encontrados na literatura, mas sem resultados animadores. Loperamida, uma droga antimotilidade, foi proscrita do receituário pediátrico desde que se identificaram efeitos tóxicos relacionados ao sistema nervoso central, além do risco de ocorrer íleo paralítico com o seu uso.41
Dentre as classificadas como adsorventes, o caolin‐pectina foi usado, mas caiu em desuso porque não foi demonstrada a sua eficácia. O seu efeito cosmético, ao tornar as fezes pastosas embora sem alterar o volume líquido, poderia dar a impressão de uma melhoria do quadro diarreico e diminuir a vigilância em relação à oferta líquida. Outra droga, diosmectite, um produto natural à base de silicato de alumínio e magnésio, não vendido no Brasil, tem sido alvo de estudos, mas não tem ainda sua eficácia comprovada.41
As diretrizes internacionais são unânimes em afirmar que não há indicação dessas drogas na DDA.1,4,8,9
AntisecretórioNos quadros de DDA em que o mecanismo secretório está envolvido e as perdas diarreicas são importantes, o uso da racecadotrila pode trazer benefícios para o paciente. Ao reduzir as perdas fecais e o tempo de doença – afeta o processo secretório ao inibir a encefalinase – facilita a manutenção do estado de hidratação e, consequentemente, reduz a chance de hospitalização. Nesses casos, tem sido recomendado como terapêutica adjuvante a TRO; ainda não há evidências se o seu uso reduz a necessidade de TRV.42
ZincoEm 2004, a OMS e o Unicef chamaram a atenção para o impacto do zinco tanto na redução da gravidade do episódio diarreico quanto na redução de episódios subsequentes de DDA em crianças menores de cinco anos. A explicação para o seu efeito seria pela modulação do sistema imunológico e também por ter propriedade antissecretória.43
A maioria dos estudos foi feito em regiões pobres e que recrutaram crianças com maior risco de desenvolver episódio diarreico mais grave, inclusive diarreia persistente. A recomendação então foi de se usar o zinco associado à TRO para todas as crianças menores de cinco anos. Estudos posteriores, em regiões desenvolvidas, que recrutaram crianças de baixo risco para diarreia grave e/ou persistente, não mostraram benefício adicional com o uso do zinco. Atualmente, a indicação é restrita para crianças pertencentes a grupos de risco que se concentram basicamente nas regiões mais pobres: menores de cinco anos, desnutridas, história de episódios anteriores de DDA ou de hospitalização.44
ProbióticosApenas algumas cepas de probióticos têm sido estudadas no contexto da DDA. Esses estudos devem ser analisados criteriosamente quanto aos desfechos avaliados e a cepas empregadas devem ser avaliadas, porque há diferentes mecanismos de ação e o que é estudado em relação a uma cepa não pode simplesmente ser transferido para outra. Lactobacillus GG e S. boulardi são os mais testados cientificamente.
A ação do probiótico se faz principalmente por meio do antagonismo, da imunemodulação ou pela exclusão de patógenos. O antagonismo e/ou a exclusão podem ter um efeito de curto prazo na DDA.45
A maioria dos estudos foi feita em países desenvolvidos e analisou como desfecho: duração do episódio diarreico, redução das perdas fecais, hospitalização; encontrou um efeito benéfico. É necessária a feitura de estudos que analisem o custo vs benefício de seu uso como adjuvante da TRO/TRV em países subdesenvolvidos e em desenvolvimento.8,12
AntibióticosAntibióticos não estão indicados na maioria dos episódios de DDA, mesmo quando a etiologia é bacteriana. A quase totalidade dos casos tem um curso autolimitado e benigno desde que o paciente se mantenha hidratado. Mesmo nos episódios diarreicos mais graves o uso de antimicrobianos é uma conduta de exceção.
A questão principal a ser ressaltada é que não temos uma terapêutica antibiótica eficaz para a maioria dos agentes associados à DDA. Por outro lado, o uso indiscriminado pode prejudicar o paciente devido ao efeito devastador na microbiota intestinal, um importante mecanismo de proteção.
A OMS recomenda o uso de antimicrobiano nos casos mais graves de DDA associada à shigella (ciprofloxacina, ceftriaxona) e na cólera (tetraciclina, eritromicina). Quando o agente causal é um protozoário o tratamento etiológico raramente está indicado, exceto em pacientes imunedeprimidos.1,8,9
Considerações finaisA Organização Mundial de Saúde13 reviu em 2005 as diretrizes para o tratamento da DDA e definiu os objetivos do tratamento: prevenir/tratar a desidratação, prevenir agravo nutricional e reduzir a duração e a gravidade do episódio diarreico. Esses objetivos podem ser alcançados por meio do uso adequado da TRO/TRV, da manutenção de uma alimentação adequada e, em alguns casos, do uso criterioso de medicação sintomática (antitérmico, analgésico, antiemético), zinco, drogas antisecretórias, probióticos e antibióticos. Essas recomendações permanecem inalteradas e praticamente todas as diretrizes internacionais publicadas desde então as corroboram.
Por que, apesar das evidências científicas que embasam essa conduta, na prática se observa que as crianças não estão sendo conduzidas adequadamente? Por que os pediatras não aderem às diretrizes?
A explicação não é simples e envolve vários aspectos: o desejo das famílias de que a medicina ofereça uma intervenção que resulte em rápido desaparecimento dos sintomas; a crença que existe para cada doença um medicamento que debele de imediato o processo patológico; a dificuldade que tem o médico de estabelecer uma relação de confiança em consultas que muitas vezes duram poucos minutos.
Mas em todo o mundo pesquisadores têm se debruçado na análise de estudos de intervenção na DDA e relacionado quais as condutas que realmente têm base científica. O consenso é que a manutenção adequada do estado de hidratação e de alimentação é a intervenção recomendada para a quase totalidade das crianças com DDA.
Conflitos de interesseOs autores declaram não haver conflitos de interesse.
Como citar este artigo: Brandt KG, de Castro Antunes MM, da Silva GA. Acute diarrhea: evidence‐based management. J Pediatr (Rio J). 2015;91:S36–43.