To investigate the differential expression of the thymic stromal lymphopoietin isoforms, short and long, and discern their biological implications under eosinophilic gastroenteritis.
MethodsThe expression of thymic stromal lymphopoietin and its two isoforms in tissues was assessed by quantitative RT‐PCR in healthy controls (n=24) and patients with eosinophilic gastroenteritis (n=17).
ResultsThymic stromal lymphopoietin mRNA was significantly reduced in eosinophilic gastroenteritis when compared with healthy controls (p <0.0001). A significantly lower amount of short thymic stromal lymphopoietin mRNA was observed in eosinophilic gastroenteritis when compared with controls (p <0.05), while a significantly higher amount of long thymic stromal lymphopoietin mRNA was observed in eosinophilic gastroenteritis when compared with controls (p <0.05). Peak eosinophilic count is significantly positively correlated with the expression of long thymic stromal lymphopoietin mRNA in the gastrointestinal mucosal of patients with eosinophilic gastroenteritis (rs=0.623,p <0.005), while peak eosinophilic count is significantly negatively correlated with the expression of short thymic stromal lymphopoietin mRNA in the gastrointestinal mucosal of patients with eosinophilic gastroenteritis (rs=‐0.4474, p <0.05).
ConclusionsAbnormal mucosal thymic stromal lymphopoietin expression may contribute to gastrointestinal mucosa damage in eosinophilic gastroenteritis.
Investigar a expressão diferencial das isoformas da linfopoietina estromal tímica, curta e longa, e discernir suas implicações biológicas na gastroenterite eosinofílica.
MétodosAvaliamos a expressão das isoformas da linfopoietina estromal tímica e suas duas isoformas através da técnica RT‐PCR quantitativa em tecidos de controles saudáveis (n=24) e pacientes com gastroenterite eosinofílica (n=17).
ResultadosDemonstramos que o RNAm das isoformas da linfopoietina estromal tímica estava significativamente reduzido na gastroenterite eosinofílica em comparação com os controles saudáveis (p <0,0001). Também descobrimos uma quantidade significativamente menor de RNAm das isoformas da linfopoietina estromal tímica curta na gastroenterite eosinofílica em comparação com os controles (p <0,05) e uma quantidade significativamente maior de RNAm das isoformas da linfopoietina estromal tímica longa na gastroenterite eosinofílica em comparação com os controles (p <0,05). O pico da contagem eosinofílica está correlacionado positiva e significativamente com a expressão do RNAm das isoformas da linfopoietina estromal tímica longa na mucosa gastrointestinal de pacientes com gastroenterite eosinofílica (rs=0,623, p <0,005), enquanto o pico de contagem eosinofílica está negativa e significativamente correlacionado com a expressão do RNAm das isoformas da linfopoietina estromal tímica curta na mucosa gastrointestinal de pacientes com gastroenterite eosinofílica (rs=‐0,4474, p <0,05).
ConclusõesA expressão anormal das isoformas da linfopoietina estromal tímica na mucosa pode contribuir para o dano da mucosa gastrointestinal na gastroenterite eosinofílica.
A linfopoietina estromal tímica (TSLP, do inglês Thymic Stromal Lymphopoietin) é uma citocina produzida principalmente por células epiteliais e expressa na pele, pulmões, timo e mucosa intestinal.1 Recentemente, foram identificadas duas variantes de transcritos humanos da TSLP, especificamente as isoformas longas e curtas da TSLP. A TSLP curta é a principal isoforma da TSLP, expressa sob condições de estado estacionário, tem propriedades anti‐inflamatórias e antimicrobianas, enquanto a TSLP longa é expressa em nível baixo/indetectável no estado estacionário e upregulada durante a inflamação em vários tecidos.2 O receptor para a isoforma longa da TSLP, chamado de TSLPR, está bem caracterizado. A isoforma longa exerce suas atividades biológicas através da ligação com o TSLPR, leva à fosforilação e ativação do transdutor de sinal e ativador da transcrição (STAT)5.3 No entanto, o receptor para a isoforma curta da TSLP induz a fosforilação do supressor p38α, uma quinase regulada pelo sinal extracelular 1/2 e Lyn, mas não tem efeito sobre a fosforilação do STAT5.
A gastroenterite eosinofílica (GEE) é um distúrbio inflamatório raro, caracterizado por infiltração eosinofílica da parede gastrointestinal. Demonstrou‐se que tanto o mecanismo dependente de imunoglobulina E (IgE) quanto o mecanismo alérgico tardio mediado por células Th2 estão envolvidos na patogênese da GEE.4,5 A via de sinalização desencadeada pela TSLP tem sido extensivamente estudada e a up‐regulação da própria citocina está ligada à patogênese de inúmeras doenças relacionadas às células Th2, inclusive dermatite atópica, asma e respostas alérgicas.6,7 A presença de uma acentuada up‐regulação da citocina relacionada, observada na lâmina própria de pacientes com GEE, levou‐nos à hipótese de que uma desregulação da expressão da TSLP poderia estar implicada nessa condição. Com base nisso, exploramos a expressão e função da TSLP da mucosa na GEE.
MétodosPacientes e tecidosA mucosa foi biopsiada a partir do intestino ou cólon de pacientes com GEE (n=17, com média de 7,4 ± 0,97 anos, faixa de um a 13 anos) no momento da endoscopia de rotina. Os espécimes da biópsia incluíram mucosa intestinal (n=15) e mucosa do cólon (n=13). Como controle, amostras da mucosa do cólon (n=24) foram obtidas de tecido saudável (a pelo menos 7cm de distância do pólipo) de pacientes (n=24, média de 5,2 ± 0,67 anos, variação de dois a 12 anos) submetidos à endoscopia para pólipos cólicos. O diagnóstico foi baseado em três critérios, a saber: (1) presença de sintomas gastrointestinais; (2) evidência histológica de infiltração eosinofílica (eos > 20/HPF) em uma ou mais áreas do trato gastrointestinal; e (3) exclusão de outras causas de eosinofilia tecidual. Todos os tecidos foram obtidos de pacientes que assinaram um termo de consentimento informado aprovado pelo Conselho de Ética Institucional e permitiram que o material não necessário para o diagnóstico fosse usado para fins de pesquisa.
Extração de RNA e análise da expressão de RNAm por RT‐PCR quantitativaO RNA total foi isolado a partir de biopsia com o reagente de RNA Trizol® (TaKaRa, Japão). A síntese de DNAc (DNA complementar) foi feita com HiScript QRT SuperMix®+gDNA wiper (Vazyme Biotech, China). A PCR quantitativa em tempo real (RT‐PCR) foi feita no sistema ABI 7500 Real‐Time PCR Detection System, com ChamQ SYBR qPCR Master Mix (Vazyme Biotech, China). As sequências de primers foram as seguintes: TSLP forward, 5’‐CCCAGGCTATTCGGAAACTCAG‐3’ e reverse, 5’‐CGCCACAATCCTTGTAATTGTG‐3’ (esses primers não distinguem entre as duas isoformas da TSLP); TSLP longa forward, 5’‐CACCGTCTCTTGTAGCAATCG‐3’ e reverse, 5’‐TAGCCTGGGCACCAGATAGC‐3’; TSLP curta forward, 5’‐CCGCCTATGAGCAGCCAC‐3’ e reverse, 5’‐CCTGAGTAGCATTTATCTGAG‐3’. Tipicamente, foram feitos 40 ciclos de 20s a 95 ˚c e 20s a 60 ˚c, seguido pelo protocolo de dissociação térmica para o método de detecção Fast SYBR Green. As reações da PCR foram normalizadas pela análise da expressão de GAPDH com os seguintes primers: GAPDH forward, 5’‐GCACCGTCAAGGCTGAGAAC‐3’ e reverse, 5’‐ATGGTGGTGAAGACGCCAGT‐3’. A quantidade de cada RNAm foi normalizada para a quantidade de GAPDH na mesma amostra. Aumentos relativos na expressão de RNAm foram calculados com o método 2‐ΔΔCT.
Análise estatísticaOs dados foram analisados estatisticamente com o software SPSS versão 17.0 (SPSS, Inc., Chicago, EUA), com o teste U não paramétrico de Mann-Whitney (para comparação dos dados in vivo obtidos em diferentes grupos de pacientes para dados sem distribuição normal). Os valores são dados como medianas e intervalos. Para a comparação multigrupos, o teste de Kruskal‐Wallis foi usado para analisar dados sem distribuição normal, respectivamente, e os valores de P foram ajustados com a correção de Bonferroni para comparações múltiplas. Os coeficientes de correlação foram obtidos pelo método de correlação de postos de Spearman com correção para postos empatados. Os dados categóricos são resumidos com números (porcentagem) e foram comparados através do teste qui‐quadrado. Para todos os testes, p <0,05 foi considerado significativo.
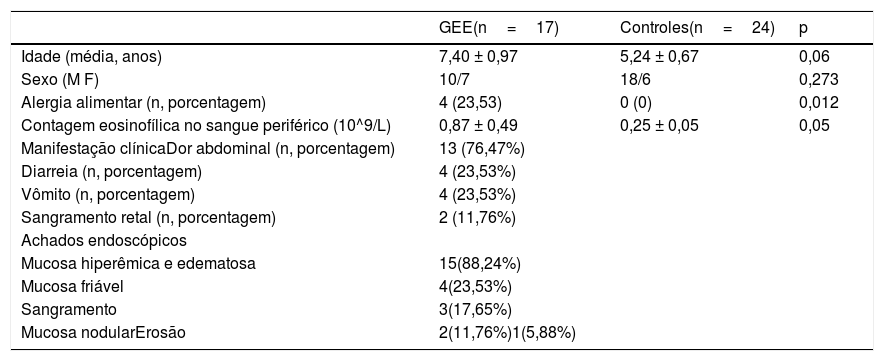
ResultadosManifestações clínicas e achados endoscópicos de pacientes com GEEDezessete pacientes (10 homens, sete mulheres) foram diagnosticados com GEE, de acordo com os critérios acima. Os sintomas mais comuns e os achados endoscópicos em nossa série são mostrados na.tabela 1 Os achados endoscópicos foram inespecíficos, a maioria dos pacientes apresentou apenas mucosa hiperêmica e edematosa.
Características clínicas dos pacientes com GEE (n=17) e controles saudáveis (n=24)
| GEE(n=17) | Controles(n=24) | p | |
|---|---|---|---|
| Idade (média, anos) | 7,40 ± 0,97 | 5,24 ± 0,67 | 0,06 |
| Sexo (M F) | 10/7 | 18/6 | 0,273 |
| Alergia alimentar (n, porcentagem) | 4 (23,53) | 0 (0) | 0,012 |
| Contagem eosinofílica no sangue periférico (10^9/L) | 0,87 ± 0,49 | 0,25 ± 0,05 | 0,05 |
| Manifestação clínicaDor abdominal (n, porcentagem) | 13 (76,47%) | ||
| Diarreia (n, porcentagem) | 4 (23,53%) | ||
| Vômito (n, porcentagem) | 4 (23,53%) | ||
| Sangramento retal (n, porcentagem) | 2 (11,76%) | ||
| Achados endoscópicos | |||
| Mucosa hiperêmica e edematosa | 15(88,24%) | ||
| Mucosa friável | 4(23,53%) | ||
| Sangramento | 3(17,65%) | ||
| Mucosa nodularErosão | 2(11,76%)1(5,88%) |
Doze pacientes com doença da mucosa de grau leve foram tratados com sucesso com uma dieta de eliminação. Cinco pacientes foram tratados com prednisolona, inicialmente com uma dose de 0,5‐1mg/dia, gradualmente diminuindo ao longo de quatro a seis semanas. Dos cinco pacientes, quatro apresentaram alívio dos sintomas em uma semana, enquanto um paciente com dor abdominal melhorou em duas semanas. Quatro pacientes sofreram complicações devido ao histórico de alergia alimentar, mas nenhum deles apresentou complicações com asma brônquica ou esofagite eosinofílica.
Infiltrados eosinofílicos de pacientes com GEEEm nosso estudo, o diagnóstico definitivo foi estabelecido por biópsia endoscópica em 17 pacientes. Havia 28 amostras de biópsia, inclusive 15 do íleo proximal e 13 do cólon. Os infiltrados eosinofílicos geralmente apresentam distribuição desigual e podem ser necessárias múltiplas biópsias profundas para estabelecer o diagnóstico. O pico de contagem eosinofílica foi maior do que 50/campo de alta potência (HPF, do inglês High Power Field) em cinco amostras de biópsia, inclusive três amostras de biópsia do intestino e duas amostras de biópsia do cólon (material suplementar).
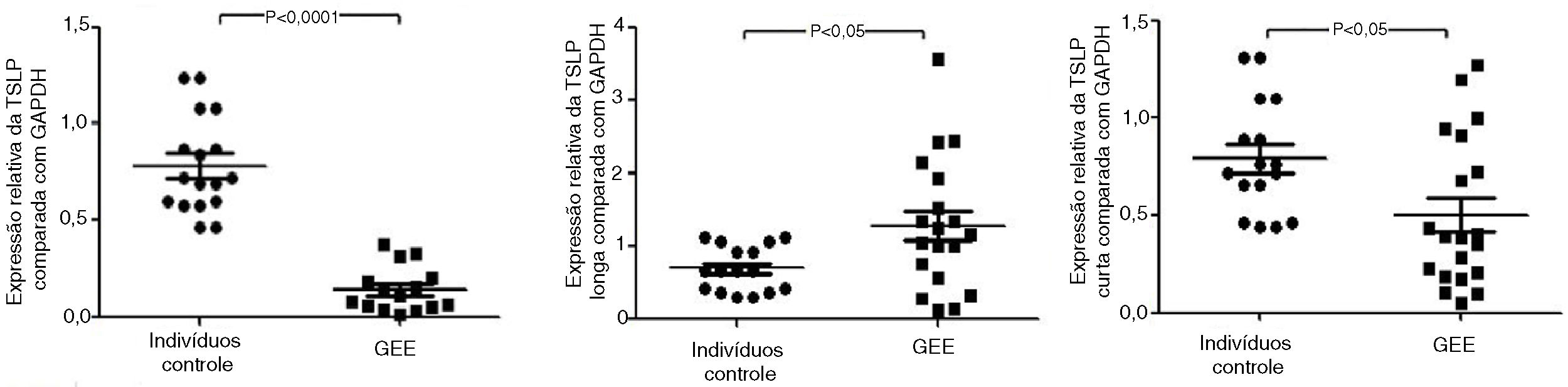
Expressão das TSLPs da mucosa gastrointestinal de pacientes com GEEExistem três variantes de transcritos (base de dados RefSeq), mas apenas duas originam RNA codificadores: a variante 1 do transcrito canônico da TSLP (NM_033035_hg19 160 chr5: 110407589‐110411772) e a variante 2 do transcrito (NM_138551_hg19 64cr5: 110409281‐110411772). Os dois transcritos codificadores codificam para a isoforma longa da TSLP de 159 aminoácidos (variante 1) e para a TSLP curta (variante 2), que engloba os últimos 63 resíduos da TSLP longa e é idêntica à sua porção C‐terminal. Avaliamos os transcritos da TSLP da mucosa (total: isoformas da TSLP curta+longa) por qRT‐PCR (fig. 1). Após normalização para GAPDH, o RNAm da TSLP estava significativamente reduzido na GEE em comparação com os controles saudáveis ??(p <0,0001). Também medimos os transcritos das isoformas longas e curtas da TSLP na mucosa gastrointestinal de pacientes com GEE e controles e descobrimos uma quantidade significativamente menor de RNAm da TSLP curta na GEE em comparação com os controles (p <0,05), e uma quantidade significativamente maior de RNAm da TSLP longa na GEE em comparação com os controles (p <0,05). Além disso, avaliamos os transcritos da TSLP da mucosa nos pacientes com GEE e histórico de alergia alimentar (n=4) e os pacientes com GEE sem histórico de alergia alimentar (n=13) e não encontramos significância estatística entre dois grupos (p > 0,05, dados não mostrados). Também avaliamos os transcritos da TSLP da mucosa em diferentes grupos de manifestações clínicas (dor abdominal, diarreia, vômitos e sangramento retal) e observamos que não houve significância estatística (p > 0,05, dados não mostrados). Avaliamos ainda os transcritos da TSLP da mucosa em pacientes com GEE tratados com prednisolona (n=5) e pacientes com GEE tratados com dieta de eliminação (n=12) e não encontramos significância estatística entre os dois grupos (p > 0,05, dados não mostrados).
TSLP, expressão da TSLP curta e TSLP longa na mucosa em GEE. Transcritos de TSLP, quantificados por qRT‐PCR, no intestino ou cólon de 17 pacientes com GEE e 24 controles. As barras horizontais são valores médios. A significância estatística foi calculada com o teste de Mann‐Whitney. As barras horizontais são medianas com intervalos.
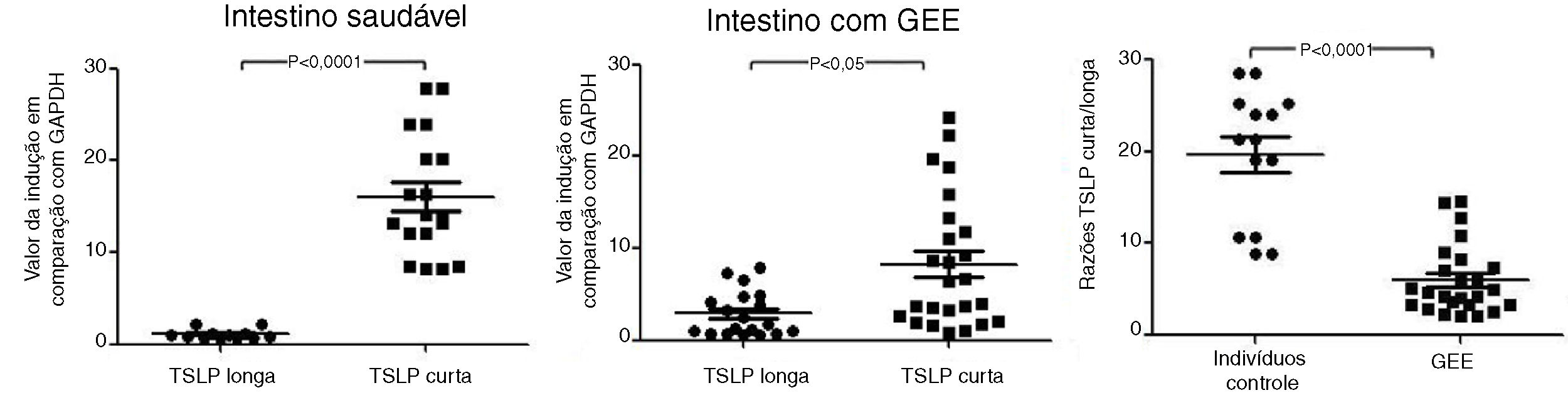
Considerando que a TSLP longa não é expressa sob condições de estado estacionário, sabemos agora que a redução na expressão da TSLP na mucosa gastrointestinal na GEE em comparação com os controles foi atribuída à falta de expressão da TSLP curta, embora uma quantidade significativamente maior de expressão do RNA da TSLP longa na GEE ocorra, quando comparada com os controles. Analisamos as razões TSLP curta/longa na mucosa gastrointestinal de pacientes com GEE e de pacientes com controles saudáveis. Descobrimos que as razões TSLP curta/longa estavam significativamente reduzidas nos tecidos de pacientes com GEE em comparação com as taxas observadas em controles saudáveis (fig. 2).
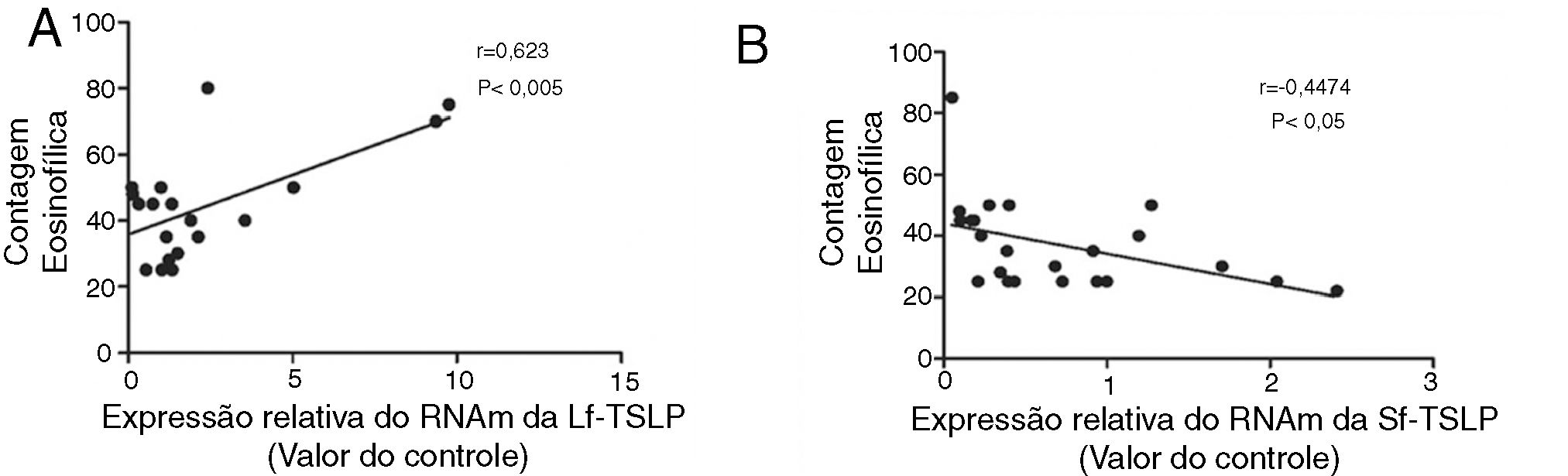
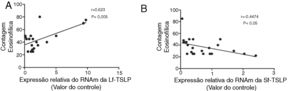
Correlação entre a expressão das TSLPs e a contagem eosinofílica na mucosa gastrointestinal de pacientes com GEEO pico médio de contagem eosinofílica média na mucosa gastrointestinal de pacientes com GEE e controles saudáveis é, respectivamente, 42,79 ± 3,50/HPF e 4,33 ± 0,57/HPF. O pico da contagem eosinofílica está correlacionado positiva e significativamente com a expressão do RNAm da TSLP longa na mucosa gastrointestinal de pacientes com GEE (rs=0,623, p <0,005, fig. 3A), enquanto o pico de contagem eosinofílica está negativa e significativamente correlacionado com a expressão do RNAm da TSLP curta na mucosa gastrointestinal de pacientes com GEE (rs=‐0,4474, p <0,05, fig. 3B).
DiscussãoO distúrbio gastrointestinal eosinofílico foi descrito pela primeira vez por Kaijer em 1937 e é caracterizado pela infiltração de eosinófilos em diferentes camadas do trato gastrointestinal na ausência de causas secundárias. De acordo com estudos anteriores, a incidência da GEE é estimada em aproximadamente 1‐30/100.000. Estudos recentes e relatos de casos demonstraram que essa incidência tem aumentado.8 A TSLP, uma citocina imunorreguladora constitutivamente expressa pelos enterócitos, desempenha um papel importante na preservação da tolerância da mucosa durante a homeostase no intestino. Em 2009, Harada et al.9 descreveram a existência de duas variantes diferentes para TSLP em humanos, as isoformas longa e curta da TSLP. Como a sequência dos 63 aminoácidos que compõem a TSLP curta é completamente homóloga ao C‐terminal da forma longa, anticorpos específicos para a forma curta não estão disponíveis.2,10 Assim, vimos que até aquele ponto a expressão diferencial das duas isoformas tinha sido estudada apenas através de análises quantitativas da reação em cadeia da polimerase, com pares de primers direcionados especificamente a uma ou outra variante do transcrito. Neste trabalho, detectamos o nível do RNAm da TSLP, isoformas longas e curtas da TSLP em pacientes com GEE ativa, comparados com controles saudáveis. Observamos que os transcritos da TSLP da mucosa estão reduzidos em pacientes ativos com GEE em comparação com controles saudáveis. Quando analisamos a expressão das isoformas da TSLP na GEE, observamos um quadro ainda mais complexo. Como esperado pelo que foi visto na literatura, encontramos uma up‐regulação da isoforma longa da TSLP em amostras de biópsia de lesões da GEE em oposição aos controles saudáveis; inesperadamente, descobrimos que a TSLP curta estava downregulada de forma significativa em amostras de biópsia de lesões da GEE. Isso indica que temos um desequilíbrio adicional das duas isoformas em pacientes com GEE, porque encontramos uma downregulação da TSLP curta concomitante com a up‐regulação da TSLP longa.
Apesar da clara evidência de uma dicotomia para as duas isoformas da TSLP em humanos, o papel da isoforma curta era pouco compreendido. In vivo, a TSLP longa é up‐regulada em condições como dermatite atópica, asma, colite ulcerativa e mucosa oral exposta ao tabaco sem fumaça, enquanto está ausente em tecidos saudáveis.9,11,12 Em contraste com a TSLP longa, a TSLP curta é a forma predominante da TSLP constitutivamente expressa em tecido saudável. Tsilingiri et al.10 revelaram atividade imunomoduladora para a TSLP curta. Eles descobriram que, na presença da TSLP curta, as células dendríticas (CDs) respondem mais levemente à infecção bacteriana. Dois relatórios recentes também mostraram uma atividade antimicrobiana de peptídeos dentro da sequência curta da TSLP, indicaram uma possível atividade homeostática adicional da TSLP curta in vivo.11,12 Sob condições inflamatórias, a TSLP curta parece ser downregulada, como a exposição à Salmonella typhimurium em células Caco‐2.12 Curiosamente, foi observada uma significativa downregulação do transcrito da TSLP curta em pacientes não tratados com doença celíaca,13 o que está de acordo com a observações anteriores para expressão reduzida da TSLP curta em outra patologia intestinal, a doença de Crohn.14,15 Isso contribui para a inflamação crônica devido ao consequente comprometimento na diferenciação de células dendríticas tolerogênicas. Por outro lado, quando a TSLP longa é up‐regulada, como em pacientes com dermatite atópica e colite ulcerativa, presumivelmente através da ativação da proteína NF‐κB, característica da inflamação tanto na doença inflamatória intestinal quanto na dermatite atópica,16–18 um componente da Th2 é induzido. A cocultura de CDs estimuladas pela TSLP longa com células CD4+T alogênicas resulta na geração de células Th2 inflamatórias, produzi citocinas Th2 clássicas, inclusive IL‐4, IL‐5, e IL‐13. O padrão de expressão para as duas variantes da TSLP em pacientes com GEE revela que a forma longa é induzida pela inflamação gastrointestinal, enquanto a forma curta parece ser downregulada pela inflamação gastrointestinal.
Durante a eosinofilia, os eosinófilos são regulados por quimiocinas e citocinas. A TSLP promove a eosinofilia pela indução das citocinas Th2, inclusive a expressão de IL‐4, IL‐5 e IL‐13.19 Camundongos transgênicos que superexpressam a TSLP têm níveis séricos elevados de IL‐5. Além disso, a quimiotaxia de eosinófilos induzida pela TSLP aumentou após a pré‐incubação com IL‐3 e com o fator de necrose tumoral alfa (TNFα) quando comparados com eosinófilos que não foram pré‐incubados com IL‐3 e TNFα. Estudos têm mostrado que a fosforilação da L‐plastina induzida pela TSLP e a migração de eosinófilos podem ser mediadas pela via de sinalização da proteína‐C quinase (PKC). Com base nesses dados, avaliamos a correlação entre a TSLP e o pico da contagem eosinofílica na mucosa gastrointestinal de pacientes com GEE. Nossos dados mostraram que a expressão do RNAm da TSLP longa está positiva e significativamente correlacionada com o pico de contagem eosinofílica na mucosa gastrointestinal de pacientes com GEE. No entanto, a expressão do RNAm da TSLP curta está negativa e significativamente correlacionada com o pico de contagem eosinofílica na mucosa gastrointestinal de pacientes com GEE.
Tomadas em conjunto, existe uma downregulação concomitante da TSLP curta e uma up‐regulação da TSLP longa na mucosa gastrointestinal de pacientes com GEE. A expressão anormal das TSLPs na mucosa gastrointestinal de pacientes com GEE pode estar envolvida na patogênese da GEE. A ação potente demonstrada pelas TSLPs na GEE sugere que se deve levar em conta esses dois aspectos, pode, por um lado, bloquear o potencial inflamatório da TSLP longa quando essa é up‐regulada e, por outro lado, restabelecer a homeostase imune através da administração da TSLP curta ou drogas envolvidas na sua up‐regulação, quando a TSLP curta é downregulada.
Houve algumas limitações neste estudo. Primeiro, é de centro único e o tamanho da amostra não era grande, o que restringe a generalização. No entanto, nossos dados foram representativos o suficiente para observar a alteração da expressão da TSLP na mucosa com dano da mucosa gastrointestinal na GEE. Mais estudos com maior número de pacientes são necessários para confirmar nossos achados. Em segundo lugar, investigamos apenas as mudanças na mucosa de dois locais em pacientes com GEE. Idealmente, mais amostras devem ser obtidas do tecido gastrointestinal onde os eventos inflamatórios estão ocorrendo. No entanto, as amostras obtidas por meio de biópsias gastrointestinais são limitadas pela sua complexidade, especialmente em pacientes pediátricos.
FinanciamentoEste trabalho foi apoiado pela National Natural Science Foundation of China (81672020).
Conflitos de interesseOs autores declaram não haver conflitos de interesse.
A todos os pacientes que concordaram em se submeter às biópsias e fornecer amostras de tecido sem as quais este estudo não teria sido possível.
Como citar este artigo: Guo H, Ji X, Yang G, Jin Y. Abnormal thymic stromal lymphopoietin expression in the gastrointestinal mucosa of patients with eosinophilic gastroenteritis. J Pediatr (Rio J). 2019. https://doi.org/10.1016/j.jped.2018.11.012