To describe the results of a long‐term follow‐up of Bartter syndrome patients treated with different drugs.
MethodPatients were diagnosed according to clinical and laboratory data. Treatment protocol was potassium supplementation, sodium, spironolactone, and non‐steroidal anti‐inflammatory drug. Patients who developed proteinuria were converted to angiotensin conversion enzyme inhibitor. The variables evaluated for each drug were Z‐score for weight and stature, proteinuria, creatinine clearance, gastrointestinal complaints, amount of potassium supplementation, serum potassium and bicarbonate levels, and findings of upper digestive endoscopy.
Results20 patients were included. Follow‐up was 10.1±5.2 years. 17 patients received indomethacin for 5.9±5.3 years; 19 received celecoxib, median of 35 months; and five received enalapril, median of 23 months. During indomethacin, a statistically significant increase was observed in the Z‐score for stature and weight, without a change in the creatinine clearance. Seven of 17 patients had gastrointestinal symptoms, and upper digestive endoscopy evidenced gastritis in three patients and gastric ulcer in four patients. During celecoxib use, a significant increase was detected in the Z‐score for stature and weight and a reduction of hyperfiltration; seven patients presented gastrointestinal symptoms, and upper digestive endoscopy evidenced mild gastritis in three. During enalapril use, no significant changes were observed in the Z‐score for stature, weight and creatinine clearance. The conversion to enalapril resulted in a significant reduction in proteinuria.
ConclusionThe authors suggest starting the treatment with celecoxib, and replacing by ACEi if necessary, monitoring the renal function. The safety and efficacy of celecoxib need to be assessed in larger controlled studies.
Descrever os resultados de um acompanhamento de longo prazo de pacientes com síndrome de Bartter tratados com diferentes medicamentos.
MétodoPacientes diagnosticados segundo os dados clínicos e laboratoriais. Protocolo de tratamento: suplementação de potássio, sódio, espironolactona e medicamento anti‐inflamatório não esteroidal. Os pacientes que desenvolveram proteinúria foram submetidos a inibidor da enzima de conversão da angiotensina. As variáveis avaliadas durante o uso de cada medicamento foram: escore Z para peso e estatura, proteinúria, depuração da creatinina, queixas gastrointestinais, quantidade da suplementação de potássio, níveis séricos de potássio e bicarbonato e achados da endoscopia digestiva alta.
ResultadosForam incluídos 20 pacientes. O acompanhamento foi de 10,1±5,2 anos. No total, 17 pacientes receberam indometacina por 5,9±5,3 anos, 19 receberam celecoxib por aproximadamente 35 meses e cinco receberam enalapril por aproximadamente 23 meses. Durante o uso de indometacina, observamos um aumento estatístico significativo no escore Z para estatura e peso, sem alteração na depuração da creatinina. 7/17 pacientes apresentaram sintomas gastrointestinais, e a endoscopia digestiva alta mostrou gastrite em três pacientes e úlcera gástrica em quatro. Durante o uso de celecoxib, detectamos um aumento significativo no escore Z para estatura e peso e uma redução da hiperfiltração; sete pacientes apresentaram sintomas gastrointestinais e a endoscopia digestiva alta mostrou gastrite leve em três pacientes. Durante o uso de enalapril, não observamos alterações significativas no escore Z para estatura, peso e depuração da creatinina. A mudança da medicação para enalapril resultou em uma redução significativa na proteinúria.
ConclusãoSugerimos iniciar o tratamento com celecoxib e, caso necessário, substituí‐lo por ACEi, monitorando a função renal. A segurança e a eficácia do celecoxib precisam ser comprovadas com grandes estudos controlados.
A síndrome de Bartter (SB) abrange um grupo de doenças genéticas, autossômicas recessivas, tubulares renais raras caracterizadas por perda urinária de sódio, potássio e cloreto, alcalose metabólica hipocalêmica, níveis plasmáticos elevados de renina e aldosterona e níveis elevados de prostaglandinas (PGs) no sangue e na urina como um fenômeno secundário. Pacientes clínicos apresentam poliúria, polidipsia, déficit de crescimento, episódios de desidratação fatais, episódio de febre e pressão sanguínea normal ou baixa. Então, os pediatras são, frequentemente, os primeiros profissionais a atender esses pacientes, e é importante estar atento, já que o prognóstico é melhor com diagnóstico e tratamento precoces. Existem diferentes tipos de SB, e a variabilidade clínica e laboratorial depende do transporte tubular afetado.1,2 De acordo com a região afetada, conseguimos observar algumas diferenças na administração da doença; por exemplo, a SB tipo II está associada à hipocalemia muito leve, ao passo na SB tipo IV o tratamento com indometacina é muito menos efetivo.3
Nosso objetivo é descrever os resultados de um acompanhamento de longo prazo de pacientes com SB tratados com diferentes medicamentos.
Pacientes e métodosNo presente estudo retrospectivo, com base em um protocolo prospectivo, contamos com a participação de pacientes com diagnóstico clínico e laboratorial de SB de 1993 a 2012 e adesão ao tratamento, que foi avaliada pela adesão às consultas clínicas agendadas e pelos níveis séricos de bicarbonato e potássio. Análise genética não está disponível em nosso serviço.
Protocolo de tratamentoInicialmente, o protocolo teve como base a suplementação de eletrólitos (potássio e, em alguns casos, sódio), espironolactona e medicamento anti‐inflamatório não esteroidal não seletivo (AINEns), indometacina. Contudo, durante o período de tratamento com indometacina (1993 a 2003), 6/12 (50%) dos pacientes apresentaram sintomas gastrointestinais significativos,4 e, desde 2003, decidimos adotar um AINE seletivo (AINEs), celecoxib, para evitar comprometimento gastrointestinal.
Os pacientes que desenvolveram proteinúria foram submetidos a inibidor da enzima de conversão da angiotensina (IECA), enalapril, em substituição ao AINE. Essa substituição foi feita durante internação, pois os pacientes poderiam desenvolver hipotensão grave com IECA.
VariáveisAvaliamos as seguintes variáveis durante o tratamento com cada medicamento: escore Z para peso e estatura, taxa de filtração glomerular (TFG) por meio da depuração da creatinina (Fórmula de Schwartz, pois a coleta de urina de 24 é difícil, principalmente em pacientes poliúricos)5 e média da quantidade de suplementação de potássio, níveis séricos de potássio e bicarbonato. Avaliamos também a presença de proteinúria, queixas gastrointestinais (GI) e achados da endoscopia digestiva alta (EDA).
Neste estudo, a hiperfiltração é definida como depuração da creatinina ≥ 145mL/min/1,73m2SC (mL/min/1,73 m2Superfície Corpórea).6
Análise estatísticaOs dados com distribuição homogênea são apresentados como média e desvio‐padrão. Todos os outros são apresentados como mediana e faixa. O Teste de T Pareado foi utilizado para comparar variáveis com distribuição normal e o Teste de Wilcoxon para comparar variáveis de distribuição não normal. O Teste de Wilcoxon foi utilizado para comparar os níveis microalbuminúria antes e depois da substituição do celecoxib para enalapril. O teste Qui‐quadrado foi utilizado para comparar os achados na EDA em pacientes sintomáticos durante o uso de indometacina e celecoxib.
O estudo foi aprovado pelo Comitê de Ética Local.
ResultadosForam incluídos 20 pacientes, sendo 12 meninas. O tempo de acompanhamento foi de 10,1±5,2 anos, a idade média no diagnóstico foi de 17,5 meses e a última avaliação foi 14,0±5,3 anos. Cinco pacientes eram filhos de pais consanguíneos e dois eram irmãos. Dentre os sete pacientes, cinco meninas apresentaram polidrâmnio e/ou prematuridade características de SB Neonatal. Foi observada surdez neurossensorial em dois pacientes (uma menina), e eles foram classificados como SB com surdez. No total, 11 pacientes apresentaram características de SB clássica. Nenhum paciente apresentou hipocalciúria, excluindo o diagnóstico de síndrome de Gitelman.
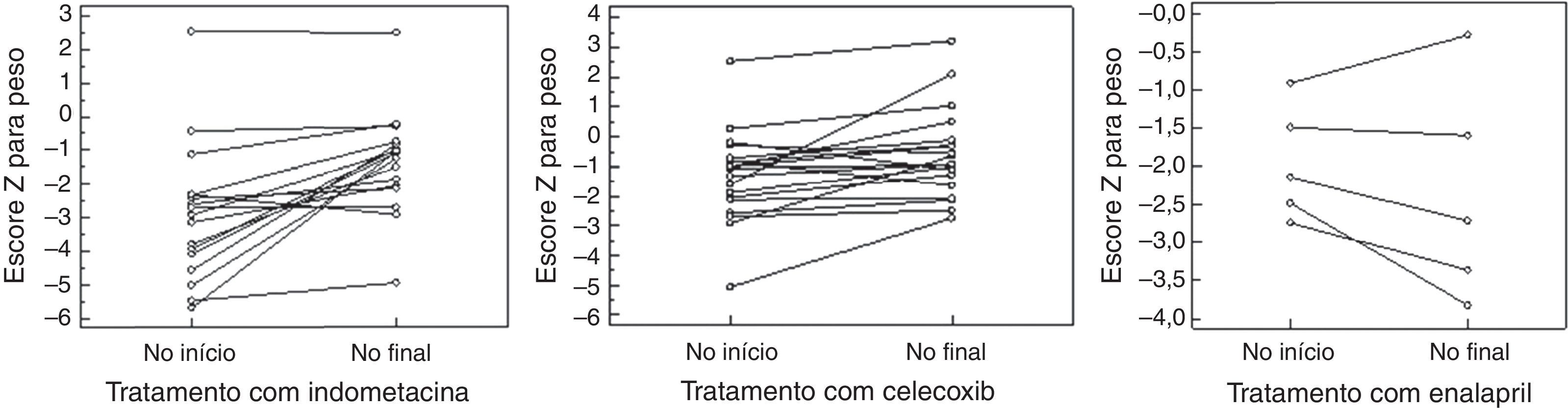
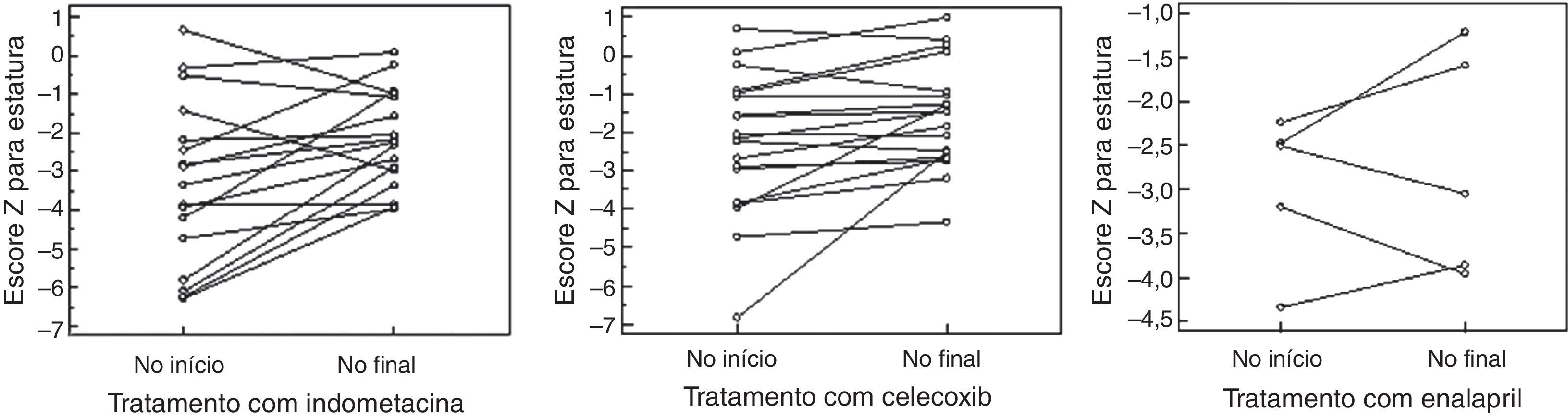
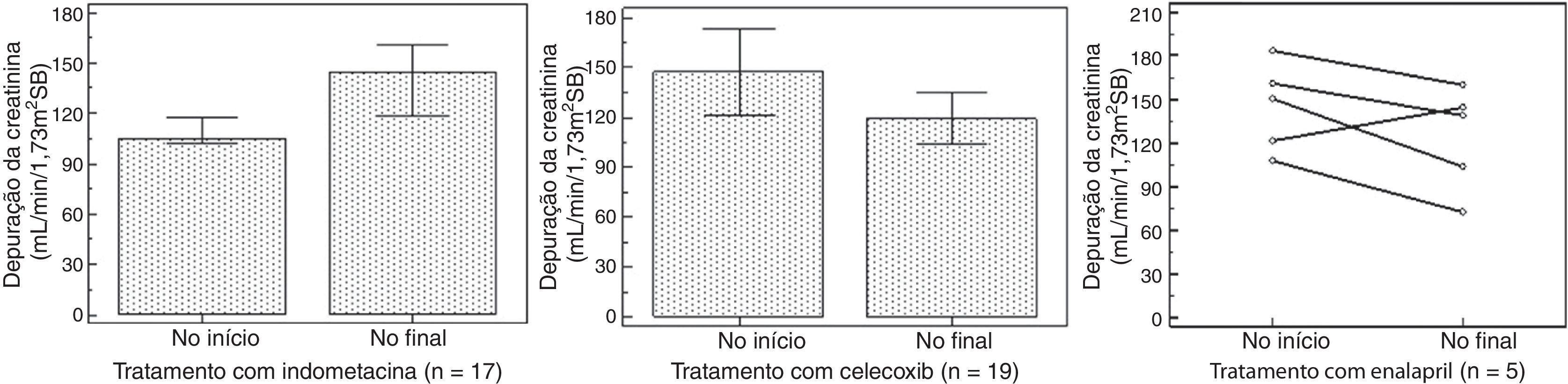
Período de tratamento com indometacinaDentre os pacientes, 17 receberam indometacina por 5,9±5,3 anos em uma dosagem de 2,1±0,6mg/Kg/dia dividida em três doses. Observamos um aumento no escore Z para altura‐idade passando de –2,2±1,2 para –3,3±–2,1 (p=0,01) e escore Z para peso‐idade passando da mediana –2,9 (–5,7‐2,5) para a mediana –1,05 (–4,9‐2,5) (p=0,0004), sem alteração significativa na depuração da creatinina, que variou da mediana 105 (64‐277) para 44 (71‐279) mL/min/1,73m2SC (p=0,34) e com estabilidade metabólica e eletrolítica. Contudo, quatro pacientes apresentaram hiperfiltração no início e oito apresentaram hiperfiltração no final do tratamento. Dentre os pacientes, 7/17 apresentaram sintomas gastrointestinais, e a EDA mostrou gastrite em três casos e úlcera gástrica em quatro, um achado grave.
Período de uso de inibidor seletivo de prostaglandinaDezenove pacientes receberam celecoxib por aproximadamente 35 meses (8‐144). Observamos um aumento no escore Z para altura‐idade de 1,8±1,3 para –2,4±–1,7 (p=0,02) e escore Z para peso‐idade de –0,81±1,2 para –1,3±1,5(p=0,01) e uma redução na depuração da creatinina de 147±52 para 119±31mL/min/1,73m2SC (p=0,04). Nove pacientes apresentaram hiperfiltração no início e, no final, detectamos hiperfiltração em apenas dois deles. Apresentaram sintomas gastrointestinais 7/19 pacientes, porém a EDA mostrou gastrite leve em três casos, e nenhum de úlcera.
Ao comparar indometacina com celecoxib, achados positivos na EDA estiveram mais presentes no grupo indometacina, apesar de não significativos (p=0,06); contudo, a indometacina foi associada a comprometimento mais grave. Durante o tratamento com celecoxib, nenhum paciente desenvolveu úlcera gástrica.
Período de tratamento com IECACinco pacientes receberam enalapril por aproximadamente 23 meses (3‐80) em uma dosagem de 0,2±0,1mg/Kg/dia dividida em duas doses, apesar de termos tentado em seis; um paciente apresentou hipotensão grave e o medicamento foi interrompido. Não observamos alterações significativas no escore Z para altura‐peso. No início, a mediana foi –2,5 (–4,3 em comparação a –2,2) e, no final, a mediana foi –3,0 (–3,9 em comparação a –1,21) (p=0,8), e nem no escore Z para peso‐idade, pois no início a mediana foi –2,1 (–2,7 em comparação a –0,9) e, no término, foi –2,7 (–3,8 em comparação a –0,3) (p=0,4). A depuração da creatinina não mostrou nenhuma alteração estatística, passando da mediana 150 (107‐183) para 138 (62‐160) (p=0,18); contudo, observamos uma redução em quatro pacientes, um deles abaixo de 90mL/min/1,73m2SC. Nesse caso, reduzimos a dose de enalapril.
A figura 1 mostra o escore Z para peso‐idade e a figura 2 mostra o escore Z para altura‐idade no início e no final do tratamento com cada medicamento. A figura 3 mostra a depuração da creatinina durante o tratamento com cada medicamento.
Proteinúria durante cada medicamentoDurante o tratamento com indometacina, sete pacientes desenvolveram microalbuminúria, e cinco deles apresentaram melhora com a substituição para celecoxib; contudo, quatro pacientes desenvolveram microalbuminúria durante o uso de celecoxib. Substituímos os pacientes tratados com proteinúria por IECA e os mesmos apresentaram uma redução significativa na proteinúria: a mediana foi de 76% (62,8‐80,6%).
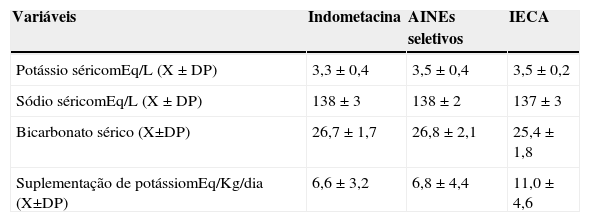
A tabela 1 mostra a média dos níveis séricos de potássio, sódio e bicarbonato dos pacientes durante o uso de cada medicamento e a quantidade de suplementação de potássio, inclusive os dados a cada seis meses. Não observamos diferença significativa nos níveis séricos de potássio, sódio e bicarbonato durante o uso dos três medicamentos, assim como entre a quantidade de suplementação de potássio durante o uso de indometacina e celecoxib (p=0,8). Apesar de não termos detectado diferença significativa na quantidade da suplementação de potássio durante o uso de indometacina e IECA (p=0,09) e celecoxib e IECA (p=0,2), observamos uma tendência de suplementação de uma maior quantidade de potássio durante o uso do IECA, como pode ser visto na tabela 1.
Potássio, sódio e bicarbonato séricos e quantidade da suplementação de potássio em 20 pacientes com síndrome de Bartter durante diferentes tipos de tratamento
| Variáveis | Indometacina | AINEs seletivos | IECA |
|---|---|---|---|
| Potássio séricomEq/L (X±DP) | 3,3±0,4 | 3,5±0,4 | 3,5±0,2 |
| Sódio séricomEq/L (X±DP) | 138±3 | 138±2 | 137±3 |
| Bicarbonato sérico (X±DP) | 26,7±1,7 | 26,8±2,1 | 25,4±1,8 |
| Suplementação de potássiomEq/Kg/dia (X±DP) | 6,6±3,2 | 6,8±4,4 | 11,0±4,6 |
IECA, inibidor da enzima de conversão da angiotensina; AINEs, anti‐inflamatório não esteroidal não seletivo; DP, desvio padrão.
Na SB, observamos uma ativação prolongada do sistema renina‐angiotensina‐aldosterona (SRAA), bem como uma produção excessiva de prostaglandinas (PGs). Esses achados resultam da excreção urinária de sódio, cloreto e potássio. Portanto, o tratamento recomendado tem sido com base na suplementação de potássio, um inibidor de PGs.7,8 A espironolactona1 também é uma opção, porém com efeito transitório, e o IECA tem sido utilizado em alguns casos.9
A indometacina tem sido utilizada há muito tempo no tratamento desses pacientes. Estudos mostraram que com indometacina, espironolactona e cloreto de potássio e, às vezes, suplementação com cloreto de sódio, os pacientes apresentam melhora na velocidade de crescimento e ganho de peso e estabilidade metabólica,10 contudo, há efeitos gastrointestinais significativos resultantes da inibição de ciclo‐oxigenase (Cox) 1.4 Estes dados estão de acordo com nossos achados durante o uso de indometacina.4 Os inibidores seletivos de Cox (inibidores Cox‐2 mais que Cox‐1) (por exemplo, celecoxib) têm sido utilizados como uma opção, buscando efeito renal, com redução dos efeitos gastrointestinais indesejáveis.11 A maioria dos estudos observou que os AINEs estão associados a um menor risco de úlceras e complicações que os AINEns.12 No presente estudo, celecoxib promoveu uma maior melhoria no tratamento e uma redução no envolvimento gastrointestinal grave, como úlceras gástricas com estabilidade metabólica e eletrolítica e melhoria na velocidade de crescimento e ganho de peso.4 Além disso, celecoxib foi associada a uma menor taxa de hiperfiltração que indometacina. Hiperfiltração está associada à ocorrência de glomeruloesclerose focal.
Assim, segundo nossos estudos, o uso de celecoxib pode ser uma boa opção para pacientes com SB, porém o mesmo apenas será recomendado quando grandes estudos tiverem provado sua segurança e eficácia.
Na última década, tem sido observado um aumento em eventos cardiovasculares durante o uso de inibidores seletivos COX‐2. Esses estudos foram realizados em pacientes de alto risco cardiovascular, como população idosa ou em uso de aspirina. Existem poucos ensaios clínicos de longo prazo que avaliam a segurança cardiovascular do celecoxib, porém não há conclusão.13,14 Provavelmente, o equilíbrio entre a produção de prostaciclina e tromboxano provavelmente desempenha um papel na regulação da agregação de plaquetas e no tônus vascular. Sabe‐se que a SB está associada a uma produção excessiva de prostaglandinas e tromboxano.15 Então, podemos estudar o efeito colateral sobre o sistema cardiovascular, que, possivelmente, não é um fator de risco em pacientes com SB. Contudo, não foram realizados ensaios clínicos bem definidos.
O acompanhamento em longo prazo de pacientes fazendo uso de AINEs demonstrou que, juntamente com seu efeito benéfico, os pacientes podem desenvolver proteinúria, um agravante para a evolução da doença renal em estágio final.2 Nessa situação, podemos utilizar um inibidor do SRAA como um medicamento substituto do AINE. Foram publicados poucos relatos utilizando esses medicamentos.16 Seyberth & Schlingmann2 recomendaram “apenas no caso em que ocorrer hipocalemia persistente (potássio plasmático<3,0 mEq/L), apesar da inibição adequada e tolerada da síntese de prostaglandina e da suplementação de sal e potássio, pode‐se utilizar medicamentos que interferiram no SRAA”. Contudo, o monitoramento cuidadoso da função renal e da pressão sanguínea é absolutamente necessário. Essa terapêutica adjuvante pode ter um efeito benéfico adicional sobre a proteinúria.17
Constatamos que em pacientes que desenvolveram proteinúria com uso de celecoxib, a substituição por enalapril forneceu equilíbrio eletrolítico e metabólico com redução significativa da proteinúria. Além disso, observamos boa tolerância e complacência. Vale mencionar que a administração de um inibidor do SRAA nesses pacientes pode causar hipotensão grave. Assim, a recomendação é a transição do AINE para um inibidor do SRAA realizada no hospital, sob supervisão médica.
O AINE é efetivo no tratamento da SB, ambos indometacina e celecoxib. Este demonstrou benefícios sobre a gravidade do envolvimento do trato gastrointestinal e reduziu a hiperfiltração. Contudo, o perfil de segurança do celecoxib pode, no futuro, possibilitar seu uso como primeiro medicamento para o tratamento da SB. Em pacientes que desenvolvem proteinúria, o enalapril foi efetivo em sua redução. Então, sugerimos iniciar o tratamento com celecoxib e, caso necessário, substituí‐lo por IECA.
Este estudo possui algumas limitações, como o pequeno número de pacientes e ausência de estudo genético. São necessários estudos randomizados, grandes e controlados para confirmar nossos dados. Contudo, trata‐se de uma doença rara e nosso casuístico é um dos maiores na literatura.
Conflitos de interessesOs autores declaram não haver conflitos de interesses.
Como citar este artigo: Nascimento CL, Garcia CL, Schvartsman BG, Vaisbich MH. Treatment of Bartter syndrome. Unsolved issue. J Pediatr (Rio J). 2014;90:512–7.
Estudo realizado na Unidade de Nefrologia, Instituto da Criança, Hospital das Clínicas, Faculdade de Medicina, Universidade de São Paulo (HCFMUSP), São Paulo, SP, Brasil.