Posterior urethral valve is the most common lower urinary tract obstruction in male children. A high percentage of patients with posterior urethral valve evolve to end‐stage renal disease. Previous studies showed that cytokines, chemokines, and components of the renin–angiotensin system contribute to the renal damage in obstructive uropathies. The authors recently found that urine samples from fetuses with posterior urethral valve have increased levels of inflammatory molecules. The aim of this study was to measure renin–angiotensin system molecules and to investigate their correlation with previously detected inflammatory markers in the same urine samples of fetuses with posterior urethral valve.
MethodsUrine samples from 24 fetuses with posterior urethral valve were collected and compared to those from 22 healthy male newborns at the same gestational age (controls). Renin–angiotensin system components levels were measured by enzyme‐linked immunosorbent assay.
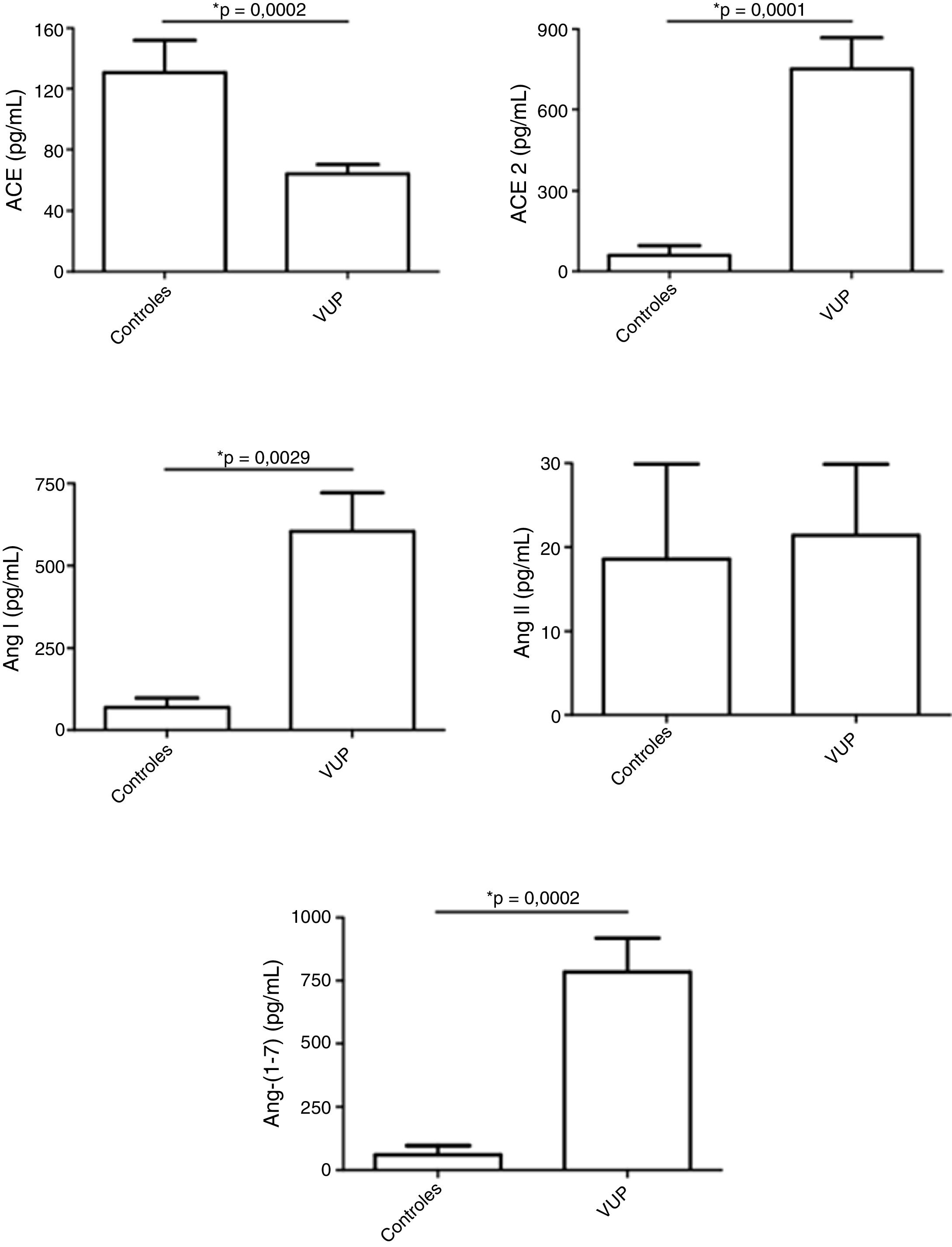
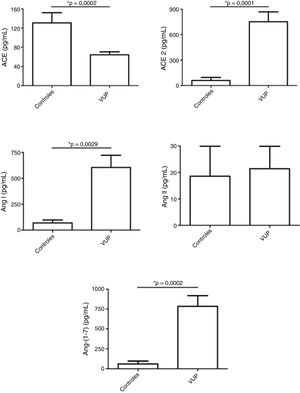
ResultsFetuses with posterior urethral valve presented increased urinary levels of angiotensin (Ang) I, Ang‐(1‐7) and angiotensin‐converting enzyme 2 in comparison with controls. ACE levels were significantly reduced and Ang II levels were similar in fetuses with posterior urethral valve in comparison with controls.
ConclusionsIncreased urinary levels of angiotensin‐converting enzyme 2 and of Ang‐(1‐7) in fetuses with posterior urethral valve could represent a regulatory response to the intense inflammatory process triggered by posterior urethral valve.
A válvula de uretra posterior é a obstrução do trato urinário inferior mais comum em crianças do sexo masculino. Uma alta porcentagem de pacientes com válvula de uretra posterior evolui para doença renal em estágio final. Estudos anteriores mostraram que citocinas, quimiocinas e componentes do sistema renina‐angiotensina contribuem para o dano renal em uropatias obstrutivas. Recentemente, descobrimos que amostras de urina de fetos com válvula de uretra posterior tinham níveis aumentados de moléculas inflamatórias. O objetivo deste estudo foi medir as moléculas de renina‐angiotensina e investigar sua correlação com marcadores inflamatórios previamente detectados nas mesmas amostras de urina de fetos com válvula de uretra posterior.
MétodosAmostras de urina de 24 fetos com válvula de uretra posterior foram coletadas e comparadas com amostras de urina de 22 recém‐nascidos saudáveis de mesma idade gestacional (controles). Os níveis dos componentes de SRA foram medidos por ensaio de imunoabsorção enzimática.
ResultadosOs fetos com válvula de uretra posterior apresentaram níveis urinários aumentados de angiotensina (Ang) I, Ang‐(1‐7) e enzima conversora de angiotensina 2 em comparação com os controles. Os níveis de enzima conversora de angiotensina eram significativamente menores e os níveis de Ang II eram semelhantes nos fetos com válvula de uretra posterior em comparação com os controles.
ConclusõesO aumento dos níveis urinários de enzima conversora de angiotensina 2 e de Ang‐(1‐7) em fetos com válvula de uretra posterior poderia representar uma resposta regulatória ao intenso processo inflamatório desencadeado pela válvula de uretra posterior.
A válvula de uretra posterior (VUP) consiste em uma estrutura membranosa na uretra posterior que obstrui a via de saída da bexiga1 e pode levar à doença renal crônica.2 A VUP pode ser diagnosticada no útero e os achados ultrassonográficos pré‐natais de VUP incluem hidronefrose bilateral, megabexiga fetal e uretra posterior dilatada em fetos masculinos.3 A obstrução da via de saída urinária pode resultar em oligoidrâmnio, que causa hipoplasia pulmonar e leva à morte precoce.4,5
Avanços no diagnóstico e manejo de VUP resultaram em queda acentuada na mortalidade.6 Uma coorte retrospectiva de fetos com grave obstrução do trato urinário inferior (LUTO) tratada em dois centros entre janeiro de 1990 e agosto de 2013 mostrou que o diagnóstico antenatal e as intervenções em VUP foram eficazes na melhoria da taxa de sobrevivência e na função renal.7 Esses achados foram adicionalmente corroborados por outro estudo que mostrou que as intervenções antenatais resultaram em um aumento de 13 vezes nas chances de sobrevivência de seis meses.6
A VUP é frequentemente associada a lesões no parênquima renal, inclusive displasia ou hipoplasia.8 Como resultado, os pacientes com VUP podem evoluir para doença renal em estágio terminal (DRET).9 Os resultados parecem ser dependentes do tipo e extensão do dano renal pré‐natal. O resultado funcional de pacientes com VUP detectado no pré‐natal foi descrito como consideravelmente melhor do que a apresentação clínica, ou seja, o prognóstico em longo prazo de VUP de gravidade intermediária pode ser melhorado pelo diagnóstico pré‐natal.10 Vale ressaltar que uma proporção significativa de casos de VUP ainda não é detectada no período antenatal, apresenta‐se fora do período neonatal.11 Esses fatos destacam a relevância de encontrar biomarcadores de diagnóstico antenatal de VUP.
A fisiopatologia precisa da DRET devido à VUP ainda não é completamente compreendida. Nossa equipe de pesquisa tem investigado os mecanismos de danos renais em uropatias obstrutivas. Primeiramente, medimos moléculas inflamatórias em amostras de urina de fetos com VUP e demonstramos que esses fetos apresentam níveis urinários mais elevados de moléculas inflamatórias do que os controles.12 O presente estudo é a continuação da investigação acima mencionada. Aqui, medimos os componentes do sistema renina‐angiotensina (SRA) nas mesmas amostras de urina. Estudos experimentais mostraram que os componentes do SRA podem interagir com moléculas inflamatórias em nefropatias obstrutivas.13,14 Os rins obstruídos também apresentaram aumento da atividade da angiotensina (Ang) II, o que, por sua vez, diminui o fluxo sanguíneo renal e provoca isquemia e parada no crescimento renal.15 Portanto, o presente estudo foi criado para medir moléculas do SRA e investigar sua correlação com marcadores inflamatórios previamente detectados12 nas mesmas amostras de urina de fetos com VUP.
MétodosEste estudo incluiu 24 gestantes cujos fetos foram diagnosticados com LUTO por ultrassonografia antenatal. Todos os fetos foram submetidos a uma ultrassonografia detalhada, com o objetivo de detectar anormalidades renais, outras malformações e marcadores de aneuploidia, conforme detalhado em outro estudo.5 Os critérios de exclusão foram: i) mulheres grávidas com contraindicação formal para procedimentos invasivos; ii) fetos com anormalidades cromossômicas; e iii) fetos que apresentam outros achados de malformação na ultrassonografia. Também incluímos um grupo de controle com 22 recém‐nascidos prematuros saudáveis pareados por idade gestacional e etnia aos fetos com VUP no momento da coleta de urina. Os recém‐nascidos pré‐termo com malformações congênitas, infecções e/ou qualquer doença aguda no momento da coleta da amostra de urina foram excluídos. Nosso Comitê de Ética institucional aprovou o estudo e todos os indivíduos (grávidas ou mães de recém‐nascidos) forneceram o consentimento livre e informado por escrito.
De acordo com o nosso protocolo, todos os fetos com LUTO foram submetidos à punção da bexiga para medir parâmetros de função renal, inclusive osmolalidade urinária, creatinina e β2‐microglobulina. As amostras de urina fetal foram coletadas com uma agulha espinhal de comprimento longo (BD Biosciences, San Jose, EUA). Os marcadores de função renal ajudaram as tomadas de decisão clínicas em relação à gravidez e à necessidade de intervenções no feto, como descrito anteriormente.12 Resumidamente, a intervenção fetal foi considerada quando havia LUTO grave em idades gestacionais entre 16 a 34 semanas, na presença de oligoidrâmnio (após 18 semanas) e parâmetros de função renal normal (18 a 30 semanas de gestação), inclusive a ausência de displasia renal bilateral ou cistos renais na ultrassonografia e/ou valores aceitáveis na análise bioquímica urinária.16–18
As amostras de urina de recém‐nascidos saudáveis do sexo masculino foram coletadas no 5° dia de vida (grupo controle), com um saco coletor de urina para recém‐nascido. Todas as amostras de urina foram centrifugadas (1.800g, 10min, 4°C) imediatamente após a coleta e o sobrenadante foi dividido em alíquotas e armazenado a ‐80° C até ser analisado.
As amostras foram então descongeladas e os níveis urinários de Ang I, Ang II, Ang‐ (1‐7), enzima conversora de angiotensina (ACE) e ACE2 foram medidos por ELISA, de acordo com os procedimentos fornecidos pelo fabricante (MyBioSource, San Diego, CA, EUA). Todos os kits aplicaram a técnica ELISA sanduíche, com exceção da medida da ACE, cujo kit usa o método ELISA competitivo. A sensibilidade dos ensaios foi de 1,0 pg/mL para ACE e ACE2; 3,9 pg/mL para Ang I; 2,0 pg/mL para Ang‐ (1‐7); e 18,75 pg/mL para Ang II. As avaliações bioquímicas foram feitas com cegamento em relação ao diagnóstico clínico.
O software SPSS versão 22.0 (SPSS Inc., Chicago, IL, EUA) foi usado para análise estatística. A distribuição gaussiana foi verificada pelo teste de Shapiro‐Wilks. Pacientes e controles foram comparados com os testes de Mann‐Whitney ou t de Student, como apropriado. As análises de correlação de Spearman examinaram a relação entre os níveis urinários dos componentes de SRA e as medidas anteriores de moléculas inflamatórias nas mesmas amostras.12 Todos os testes estatísticos foram bicaudais com nível de significância de p < 0,05.
ResultadosNo momento da coleta de urina, os fetos com VUP (n = 24) tinham um tempo gestacional médio de 22 ± 5 semanas e os recém‐nascidos pré‐termo do sexo masculino (n = 22) foram pareados para a idade gestacional (23 ± 4 semanas). Quanto à etnia, 14 fetos com VUP eram brancos (58,3%), nove eram pardos (37,5%) e um negro (4,2%). Entre os controles, 13 eram brancos (59,1%), oito eram pardos (36,4%) e um negro (4,5%). Não houve diferença estatística entre casos e controles em relação à idade gestacional (p = 0,76) e à etnia (p = 0,85). Como relatado anteriormente,12 a maioria dos nossos pacientes com VUP apresentou hiperecogenicidade renal (78%), oligoidrâmnio ou anidrâmnio (83%) na ultrassonografia antenatal e 17 (71%) morreram no período neonatal por hipoplasia pulmonar. Os pacientes com VUP que sobreviveram (n = 7) foram submetidos à vesicostomia (n = 5) ou ablação valvular endoscópica (n = 2) nas primeiras semanas após o nascimento. Todos os pacientes apresentaram níveis urinários mais elevados de creatinina, β2‐microglobulina e osmolalidade do que os controles.12
Fetos com VUP apresentaram níveis urinários menores de enzima conversora da angiotensina (ACE), sem diferença nos níveis de Ang II em comparação com os controles. Por outro lado, os níveis de ACE2, Ang I e, principalmente, Ang‐ (1‐7) foram mais elevados na urina de fetos com VUP do que nos controles (fig. 1).
Níveis dos componentes do sistema renina‐angiotensina (SRA) em amostras de urina de fetos com válvula de uretra posterior (VUP) e em um grupo controle constituído por recém‐nascidos saudáveis do sexo masculino. Os fetos com VUP apresentaram níveis urinários diminuídos da enzima conversora da angiotensina (ACE), sem alteração nos níveis de angiotensina (Ang) II em comparação com os controles. Por outro lado, os níveis de ACE2, Ang I e, especialmente, de Ang‐ (1‐7) foram maiores na urina de fetos com VUP do que nos controles. Esses resultados mostram uma ativação do braço contrarregulatório do SRA em VUP. Cada figura mostra a média e o erro padrão da média (EPM). *p < 0,05, teste de Mann‐Whitney.
Foram encontradas correlações entre componentes do SRA e mediadores inflamatórios. Entre os controles, os níveis urinários de ACE correlacionaram‐se positivamente com os níveis de interleucina (IL)‐2 (rho = 0,790, p = 0,020). Os níveis de ACE2 foram significativamente associados com níveis de eotaxina/CCL11 (rho = 0,807, p = 0,015) e níveis de proteína induzida por interferon gama (IP‐10) / CXCL10 (rho = 0,707, p = 0,050). Além disso, os níveis de Ang‐(1‐7) correlacionaram‐se negativamente com os níveis de ACE (rho = ‐0,810, p = 0,015) e positivamente com os níveis de ACE2 (rho = 0,946, p = 0,000).
Em relação aos pacientes com VUP, os níveis urinários de ACE correlacionaram‐se negativamente com os níveis de β2‐microglobulina (rho = ‐0,491, p = 0,033) e do receptor do fator de necrose tumoral solúvel (sTNFR) 1 (rho = ‐0,466, p = 0,038). Os níveis de ACE2 foram positivamente correlacionados com os níveis de IL‐4 (rho = 0,512, p = 0,025). Além disso, os níveis de Ang I foram significativamente associados aos níveis de IL‐1β (rho = ‐0,455, p = 0,044) e fator de necrose tumoral (TNF) (rho = ‐0,546, p = 0,013).
DiscussãoA urina fetal tem sido considerada um importante pool de peptídeos que pode prever a função renal pós‐natal.19 Klein et al. identificaram e validaram 12 peptídeos urinários fetais (chamados 12VUP) como preditores de função renal pós‐natal com alta sensibilidade e especificidade, superaram métodos de rotina.19 Em nosso estudo, buscamos não apenas pesquisar biomarcadores, mas também investigar o potencial envolvimento das moléculas do SRA em VUP. Detectamos que o perfil dos componentes do SRA difere significativamente nos fetos com VUP quando comparados com os recém‐nascidos saudáveis. Os fetos com VUP apresentaram maiores concentrações urinárias de ACE2 e Ang‐(1‐7) do que neonatos saudáveis, enquanto os níveis de ACE foram mais baixos na urina de fetos com VUP do que na urina de recém‐nascidos saudáveis.
Atualmente, foi proposto que o SRA tem dois braços principais: i) o braço clássico formado por ACE, Ang II e receptor AT1; ii) o braço contrarregulatório composto por ACE2, Ang‐(1‐7) e o receptor Mas.20 Enquanto o braço clássico ativa principalmente as vias relacionadas à lesão e inflamação nos tecidos, o eixo SRA contrarregulatório, em contraste marcante, tem efeitos anti‐inflamatórios.21 Portanto, o aumento observado dos componentes do braço protetor do SRA pode representar uma resposta regulatória ao intenso processo inflamatório desencadeado pela VUP.12 Não apenas demonstramos que os pacientes com VUP apresentam níveis aumentados de ACE2 e Ang‐(1‐7) em conjunto com níveis reduzidos de ACE, mas também identificamos correlações significativas entre os níveis urinários de componentes do SRA e mediadores inflamatórios. Vale ressaltar que os níveis de ACE2 foram associados com níveis de IL‐4 e que os níveis de ACE se correlacionaram significativamente com os níveis de sTNFR1 em amostras de urina de fetos com VUP.
Nossos dados reforçam a hipótese de que as alterações no SRA ocorrem em paralelo com o processo inflamatório desencadeado pela VUP. De fato, algumas evidências vincularam o SRA à fisiopatologia da VUP. Chowdhury et al.22 mostraram que os níveis de pró‐renina no soro eram mais elevados nos casos de VUP do que nos controles e diminuíam após a cirurgia corretiva. Há evidências experimentais de que o braço SRA clássico contribuiu para a escarificação túbulo‐intersticial em uropatias obstrutivas.23
Camundongos com deleção genética de receptores AT1a apresentaram fibrose túbulo‐intersticial induzida por obstrução ureteral unilateral menos intensa, sugeriram um papel do eixo clássico do SRA em lesão renal.24 Mais recentemente, dois estudos experimentais apoiaram um papel protetor para Ang‐ (1‐7).25,26 O primeiro mostrou que nos rins obstruídos de camundongos com deleção genética do receptor Mas a apoptose e a infiltração de macrófagos aumentaram em comparação com camundongos do tipo selvagem.25 No segundo, Kim et al.26 relataram que a infusão de Ang‐ (1‐7) em ratos submetidos à obstrução ureteral unilateral diminuiu a expressão da proteína pró‐apoptótica e pró‐fibrótica. Tomados em conjunto, achados anteriores e os nossos sugerem que as vias inflamatórias e fibróticas desencadeadas por uropatias obstrutivas podem estimular a produção local de Ang‐ (1‐7) como mecanismo compensatório em fetos com VUP.
Um possível mecanismo pelo qual Ang‐ (1‐7) pode proteger contra lesões renais causadas por obstrução pode ser a redução da expressão dos receptores AT1 através da ativação do receptor Mas. A esse respeito, relatou‐se que a expressão do mRNA para o receptor de AT1 era maior nos camundongos knockout para Mas.27 De fato, o receptor Mas atua como antagonista do receptor AT1 através da formação constitutiva de complexos hetero‐oligoméricos.28 Outra possível explicação para a elevação de ACE2 e Ang‐(1‐7) na urina de fetos com VUP pode ser uma disfunção ou expressão reduzida do receptor Mas no tecido renal de fetos com VUP. Nesse sentido, Ng et al. relataram que a expressão do receptor Mas está reduzida nos rins de ratos com doença renal crônica e a administração da toxina urêmica indoxil sulfato induziu a regulação para baixo (down‐regulation) do receptor Mas, provavelmente através da regulação para cima (up‐regulation) do TGF‐β1 nos túbulos proximais.29 Portanto, podemos formular a hipótese de que uma alteração na expressão e/ou a sinalização do receptor Mas podem contribuir para lesões renais em fetos com VUP.
Nosso estudo tem limitações, inclusive tamanho de amostra relativamente pequeno, desenho transversal e o uso de amostras de urina de recém‐nascidos prematuros como controle. Como a coleta de urina dos fetos é um procedimento invasivo, foi impossível coletar urina de fetos saudáveis por razões éticas. Um estudo encontrou aumento da razão angiotensinogênio/creatinina urinária em recém‐nascidos prematuros em comparação com a de recém‐nascidos a termo. A razão angiotensinogênio/creatinina urinária caiu significativamente com o aumento da idade gestacional.30 É importante enfatizar que, para descartar os efeitos da idade gestacional nas concentrações dos componentes do SRA, nosso grupo controle constituiu‐se de recém‐nascidos prematuros com idade gestacional compatível com os fetos com VUP no momento da coleta de urina.
Em conclusão, a obstrução do trato urinário leva a interações moleculares complexas em um momento inicial, intervenções intrauterinas às vezes são feitas quando as lesões renais já são irreversíveis. Muitos estudos evidenciaram o papel do SRA em uropatias obstrutivas. No entanto, até agora, o braço protetor do SRA nunca foi investigado em fetos com VUP. Nossos achados apoiam um papel do receptor do ACE2‐Ang‐(1‐7)‐Mas na VUP que precisam de mais estudos.
FinanciamentoFundação de Amparo à Pesquisa do Estado de Minas Gerais (Fapemig), Subsídio # PPM‐00555‐15), Coordenação de Aperfeiçoamento de Pessoal de Nível Superior (Capes), Subsídio n° 470472/2014‐6, e Conselho Nacional de Desenvolvimento Científico e Tecnológico (CNPq), Subsídio n° 460334/2014‐0.
Conflitos de interesseOs autores declaram não haver conflitos de interesse.
À participação dos voluntários neste estudo e especialmente às gestantes e aos pais dos fetos/recém‐nascidos pelo seu admirável apoio. E aos membros do LIIM por seus comentários pertinentes.
Como citar este artigo: Rocha NP, Bastos FM, Vieira ÉL, Prestes TR, Silveira KD, Teixeira MM, et al. The protective arm of the renin‐angiotensin system may counteract the intense inflammatory process in fetuses with posterior urethral valves. J Pediatr (Rio J). 2019;95:328–33.