The Oxford Classification for Immunoglobulin A nephropathy (IgAN) identifies pathological variables that may predict the decline of renal function. This study aimed to evaluate the Oxford Classification variables as predictors of renal dysfunction in a cohort of Brazilian children and adolescents with IgAN.
MethodsA total of 54 patients with IgAN biopsied from 1982 to 2010 were assessed. Biopsies were re‐evaluated and classified according to the Oxford Classification. Multivariate analysis of laboratory and pathological data was performed. The primary outcomes were decline of baseline estimated glomerular filtration rate (eGFR) greater than or equal to 50%.
ResultsMean follow‐up was 7.6±5.0 years. Mean renal survival was 13.5±0.8 years and probability of decline ≥50% in baseline eGFR was 8% at five years of follow‐up and 15% at ten years. Ten children (18.5%) had a decline of baseline eGFR≥50% and five (9.3%) evolved to end‐stage renal disease. Kaplan–Meier analysis showed that baseline proteinuria, proteinuria during follow‐up, endocapillary proliferation, and tubular atrophy/interstitial fibrosis were associated with the primary outcome. Multivariate Cox analysis showed that only baseline proteinuria (HR, 1.73; 95% CI, 1.20–2.50, p=0.003) and endocapillary hypercellularity (HR, 37.18; 95% CI, 3.85–358.94, p=0.002) were independent predictors of renal dysfunction. No other pathological variable was associated with eGFR decline in the multivariate analysis.
ConclusionThis is the first cohort study that evaluated the predictive role of the Oxford Classification in pediatric patients with IgAN from South America. Endocapillary proliferation was the unique pathological feature that independently predicted renal outcome.
A Classificação Oxford para a Nefropatia por Imunoglobulina A (IgAN) identificou variáveis patológicas de risco para disfunção renal. O presente estudo teve como objetivo avaliar as variáveis da Classificação de Oxford como preditores de disfunção renal em crianças brasileiras com IgAN.
MétodosForam analisados 54 pacientes com diagnóstico de IgAN entre 1982‐2010. As biópsias renais foram reavaliadas pela Classificação de Oxford. Foram feitas análises uni e multivariada das variáveis clínicas e patológicas. O desfecho primário foi queda da taxa de filtração glomerular (TFG) ≥ 50% da filtração basal.
ResultadosO acompanhamento médio foi de 7,6±5,0 anos. A sobrevida renal média foi de 13,5±0,8 anos e a probabilidade de atingir o desfecho primário foi de 8% em cinco anos e 15% em 10 anos de seguimento. Dez crianças (18,5%) apresentaram queda na TFG basal ≥ 50% e cinco (9,3%) evoluíram para doença renal crônica terminal. A análise de Kaplan‐Meier mostrou que a proteinúria basal e de seguimento, a proliferação endocapilar e a atrofia tubular/fibrose intersticial foram associadas com o desfecho primário. A análise multivariada de Cox mostrou que a proteinúria basal (HR=1,73; IC95% 1,20‐2,50, p=0,003) e a proliferação endocapilar (HR=37,18; IC95% 3,85‐358,94, p=0,002) foram preditores independentes de disfunção renal. Nenhuma outra variável patológica foi associada com declínio da TFG na análise multivariada.
ConclusãoEste é o primeiro estudo brasileiro que avaliou a Classificação Oxford em crianças com IgAN. A proliferação endocapilar foi a única característica patológica capaz de predizer independentemente o declínio da função renal.
A nefropatia por IgA (NIgA) é uma das principais causas de glomerulonefrite em todo o mundo. A presença predominante/codominante da IgA1 em depósitos imunes mesangiais é essencial para diagnosticar a NIgA.1 A NIgA é caracterizada por um curso altamente variável, que se estende de uma doença muito leve2 para uma doença renal terminal (DRT).3 A doença normalmente progride insidiosamente e a busca por preditores de resultado renal pode possibilitar uma tomada de decisão individualizada, atendimento precoce ao paciente e tratamento adequado com menos efeitos adversos.4–6
Nesse sentido, a análise do tecido renal também pode contribuir com informações prognósticas adicionais. Em 2009, a Rede Internacional de Nefropatia por IgA desenvolveu a Classificação Oxford, na qual quatro variáveis histológicas com importância prognóstica foram identificadas como preditoras de resultado renal em pacientes com NIgA (escore de MEST): hipercelularidade mesangial (M), proliferação endocapilar (E), esclerose segmentar ou adesão (S) e atrofia tubular/fibrose intersticial (T).7,8 A Classificação de Oxford abrange a análise dos dados de pacientes com uma ampla faixa etária. O valor preditivo de cada lesão específica na sobrevida renal parece não ser distinto entre crianças e adultos com NIgA no estudo segundo a Classificação de Oxford.9 Em contrapartida, estudos anteriores mostraram que as características histológicas da NIgA em crianças e adultos eram diferentes.10–13 Em comparação com os adultos, as crianças com NIgA mostraram uma proliferação significativamente mais mesangial e endocapilar e um dano tubulointersticial crônico e vascular menor.10–13 Apenas três estudos avaliaram o desempenho da Classificação de Oxford exclusivamente em pacientes pediátricos.14–16 Le et al. relataram que a atrofia tubular/fibrose intersticial foi a única característica independentemente associada a resultados renais em crianças chinesas com NIgA.15 No estudo sueco, a hipercelularidade mesangial, a proliferação endocapilar ou a atrofia tubular/fibrose intersticial foram individualmente associadas a um fraco resultado, porém a esclerose segmentar ou adesão não atingiram uma significância estatística.14 O estudo japonês mostrou que apenas o escore da hipercelularidade mesangial e a atrofia tubular e crescente foram preditores significativos de resultado renal.16 Assim, ainda precisa ser avaliado se o sistema de classificação tem um poder preditivo semelhante para crianças com NIgA em diferentes populações. Apesar de geograficamente distintos, nenhum desses estudos foi feito na América do Sul. Pela primeira vez, este estudo visou a avaliar o valor preditivo das variáveis clínicas, laboratoriais e quatro variáveis histológicas do resultado renal segundo a Classificação de Oxford em uma coorte de pacientes pediátricos brasileiros.
Pacientes e métodosPacientesOs prontuários de 54 pacientes com NIgA comprovada por biópsia foram incluídos na análise deste estudo de coorte retrospectivo. Os critérios de inclusão foram pacientes entre dois e 18 anos com NIgA comprovada por biópsia que foram internados na Unidade de Nefrologia Pediátrica (UNP) do Hospital das Clínicas da Universidade Federal de Minas Gerais, Brasil, de 1982 a 2010, e com acompanhamento de pelo menos nove meses. Os critérios diagnósticos para NIgA tiveram como base o achado de depósito mesangial dominante/codominante de IgA na imunofluorescência do tecido renal.17 Nossa UNP foi estabelecida em 1969 e acompanhou várias crianças com NIgA, segundo um protocolo bem estabelecido. Resumidamente, nosso protocolo incluiu a investigação da etiologia da doença, uma avaliação do curso clínico e das alterações laboratoriais e a aplicação de tratamento de acordo com as orientações internacionais.18 Os pacientes pediátricos internados na UNP com uma taxa de filtração glomerular estimada (eGFR) abaixo de 60mL/min/1,73m2 ou que apresentaram púrpura de Henoch‐Schönlein, diabete ou doenças hepáticas ou sistêmicas foram excluídos.
Aspectos éticosO Comitê de Ética local aprovou o estudo (CAAE 18196713.4.0000.5149). O consentimento informado foi obtido de todos os pais e ou pessoas legalmente responsáveis pelos pacientes pediátricos com NIgA. O protocolo de pesquisa não interferiu em qualquer recomendação ou receita médica.
Covariáveis basal e de acompanhamentoA data da biópsia renal foi considerada o ponto temporal basal. O período de acompanhamento foi calculado como o tempo entre a biópsia renal e a última visita ambulatorial, óbito ou redução de 50% da eGFR basal. As variáveis incluídas na análise foram: sexo, etnia, idade de base, eGFR, proteinúria, hipertensão, escore z do peso para idade, escore z da altura para idade, índice de massa corporal (IMC) e níveis séricos de creatinina. Para evitar a superestimação do peso em pacientes com edema, apenas o peso seco foi considerado para as variáveis de peso e IMC. O tratamento também foi avaliado de acordo com a prescrição médica, independentemente da duração do uso. Os bloqueadores do sistema renina‐angiotensina (BSRA) mencionados na receita de inibidores da enzima conversora de angiotensina (IECA) e/ou bloqueadores dos receptores da angiotensina (BRA) e os imunossupressores incluíram corticosteroides e ciclofosfamida.
Estudos histológicosFoi feita biópsia renal em todas as 54 crianças. Menos de um terço da coorte (29%) foi submetida a biópsia antes de 1990. As biópsias foram reexaminadas por um único patologista renal, que foi cegado para o resultado dos pacientes no momento da pontuação. As biópsias foram analisadas com base nas seções manchadas com ácido periódico‐Schiff a 2μg. Nenhum espécime tinha menos de glomérulos.
As espécimes de biópsia foram classificadas e padronizadas de acordo com a Classificação de Oxford,7,8 nas quais o número de glomérulos foi avaliado e sua hipercelularidade mesangial (M) pontuada como ≤ 0,5 ou > 0,5, caso mais ou menos da metade dos glomérulos apresentassem hipercelularidade definida como quatro ou mais na célula mesangial/área mesangial, proliferação endocapilar (E, ausente ou presente), glomeruloesclerose segmentar (S, ausente ou presente) e atrofia tubular/fibrose intersticial (T, 0 = 0‐25%, 1 = 26‐50% e 2 = > 50%). Os glomérulos com crescentes celulares e fibrocelulares e o espessamento intimal arterial também foram determinados.
DefiniçõesA pressão sanguínea foi medida e avaliada de acordo com a Quarta Força‐Tarefa sobre Pressão Arterial em Crianças19 e o 95° percentil foi usado como ponto de corte. A proteinúria foi expressa em gramas por dia por 1,73m2. Quando as medições da proteína urinária em coletas de 24 horas não estiveram disponíveis, a relação creatinina proteinúria (uP/Cr) foi usada para estimar a excreção de proteínas na urina em 24 horas, com ajuste dos valores à área de superfície do corpo.16 A ausência de proteinúria ou proteinúria leve foi considerada quando abaixo de 1g/dia/1,73m2 ou uP/CR inferior a 1g/g. A proteinúria moderada foi definida como uma proteinúria não nefrótica de mais de 1g/dia/1,73m2 ou uP/Cr entre 1 e 3g/g. Proteinúria grave ou nefrótica foi considerada quando acima de 3g/dia/1,73m2 ou quando uP/Cr > 3g/g.9,16 Em cada ano de acompanhamento foi determinado o valor médio de todas as medições de proteinúria. A variável proteinúria durante o acompanhamento foi a média de todos os valores médios anuais. A hematúria foi diagnosticada quando cinco ou mais glóbulos vermelhos foram encontrados em pelo menos dois exames de sedimentos urinários. Os escores z do peso para idade e altura para idade foram usados para avaliar o peso e a altura. Essas medidas foram calculadas com o software de domínio público Epi Info (versão 3.4.1). Como as medições de creatinina foram feitas pelo método de Jaffe até novembro de 2011 em nossa instituição, a taxa de filtração glomerular foi estimada pela fórmula convencional de Schwartz20 para os dados obtidos até esse período. Dessa forma, o valor da constante (K) foi 0,55 para crianças com menos de 13 anos e para meninas adolescentes. Para meninos adolescentes acima ou com idade igual a 13 anos, o valor de K foi 0,70. Após novembro de 2011, a creatinina foi medida pelo método rastreável IDMS (diluição isotópica‐espectrometria de massa). Portanto, a fórmula de Schwartz modificada21 foi adotada para estimar a TFG em vez da fórmula de Schwartz convencional.
ResultadoUma queda na eGFR basal superior ou igual a 50% foi atribuída como variável dependente. A sobrevida renal foi medida a partir da data da biópsia renal até a data da primeira estimativa da TFG 50% inferior à eGFR basal.
Análise estatísticaA análise estatística foi feita com o software SPSS (SPSS Statistics, versão v.19.0, IL, EUA). As variáveis contínuas foram expressas como média ± DP. As variáveis categóricas foram descritas como percentuais e analisadas com o teste qui‐quadrado de Pearson. Os testes t de Student (variáveis normalmente distribuídas) e de Mann‐Whitney ou Kruskal‐Wallis (variáveis não paramétricas) foram usados para comparar as variáveis contínuas. A análise univariada das variáveis contínuas foi feita com a regressão de Cox, ao passo que as variáveis categóricas foram analisadas com os métodos de Kaplan‐Meier e long‐rank. As variáveis de base incluídas na análise univariada foram: sexo, etnia, idade de base, hipertensão e características histopatológicas. Os testes de laboratório de base também foram incluídos: eGFR, creatinina sérica e proteinúria. O modelo de riscos proporcionais de Cox foi aplicado para identificar as variáveis que foram independentemente associadas a uma queda de ≥ 50% na eGFR basal. Apenas variáveis que foram associadas ao evento de interesse por análise univariada (p<0,25) foram incluídas na regressão multivariada de Cox. Todos os valores de p relatados tinham dois lados. Os valores de p inferiores a 0,05 foram considerados estatisticamente significativos. Os intervalos de confiança (IC) incluíram 95% dos valores preditivos.
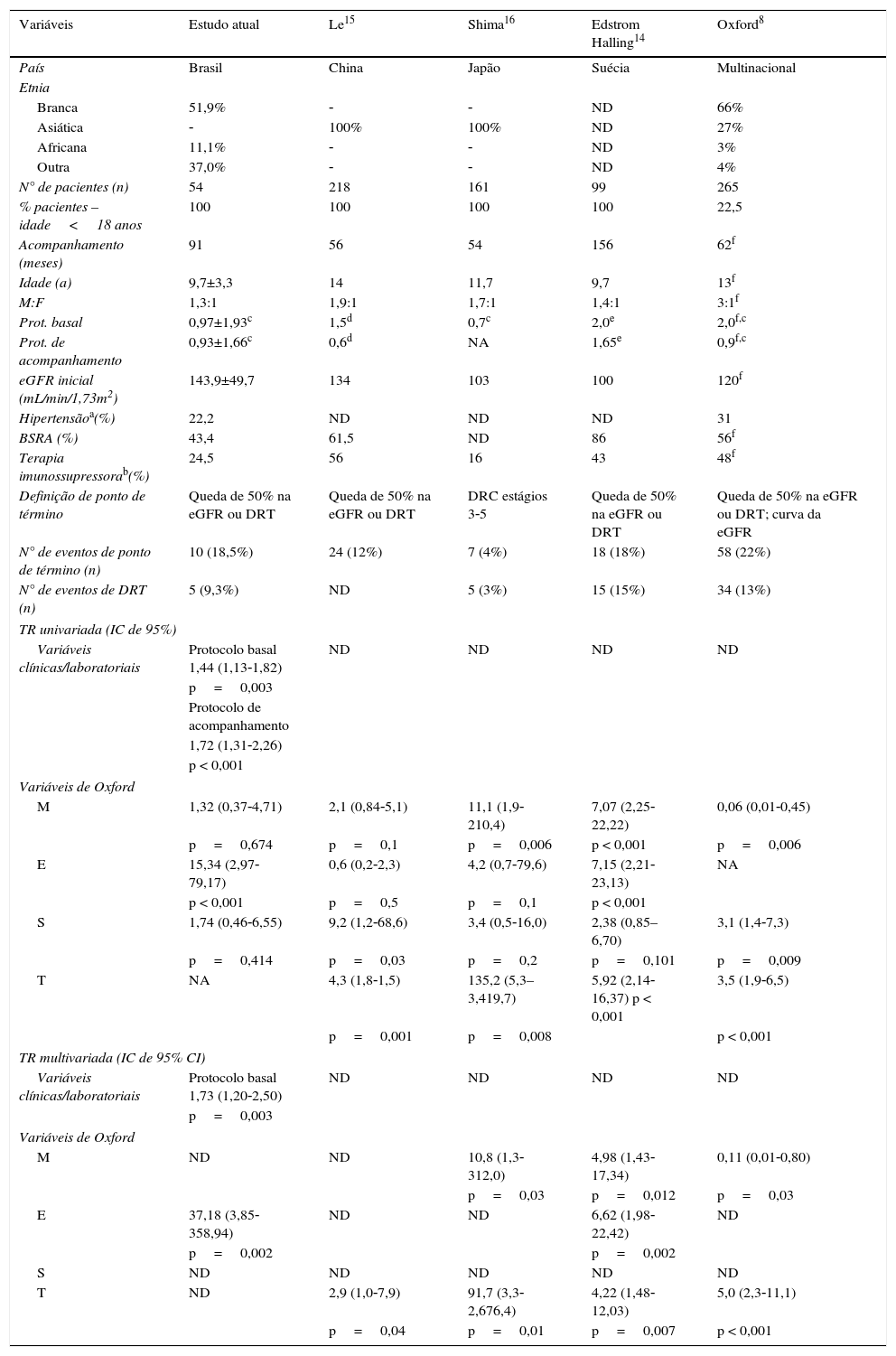
ResultadosCaracterísticas clínicas e patológicasForam analisados 54 pacientes (31 meninos) com NIgA. A maioria foi classificada como branca (51,9%). A idade média era de 9,7 ± 3,3 anos. No momento da biópsia renal, a média da eGFR foi de 143 ± 49,7mL/min/1,73m2. A média da proteinúria basal foi de 0,97 ± 1,93g/dia por 1,73m2. Quatro pacientes (7,4%) apresentaram proteinúria basal na gama nefrótica e seis (11,1%) apresentaram proteinúria moderada; 12 (22,2%) apresentaram hipertensão arterial ou estavam em terapia anti‐hipertensiva no momento da biópsia renal. A tabela 1 resume os dados clínicos e demográficos no momento da biópsia renal. Esses achados também foram comparados com quatro outros estudos de coorte pediátricos.
Variáveis clínicas no momento da biópsia inicial e ponto de término do acompanhamento. Comparação de nossos dados com outros estudos de coorte pediátrica
| Variáveis | Estudo atual | Le15 | Shima16 | Edstrom Halling14 | Oxford8 |
|---|---|---|---|---|---|
| País | Brasil | China | Japão | Suécia | Multinacional |
| Etnia | |||||
| Branca | 51,9% | ‐ | ‐ | ND | 66% |
| Asiática | ‐ | 100% | 100% | ND | 27% |
| Africana | 11,1% | ‐ | ‐ | ND | 3% |
| Outra | 37,0% | ‐ | ‐ | ND | 4% |
| N° de pacientes (n) | 54 | 218 | 161 | 99 | 265 |
| % pacientes – idade<18 anos | 100 | 100 | 100 | 100 | 22,5 |
| Acompanhamento (meses) | 91 | 56 | 54 | 156 | 62f |
| Idade (a) | 9,7±3,3 | 14 | 11,7 | 9,7 | 13f |
| M:F | 1,3:1 | 1,9:1 | 1,7:1 | 1,4:1 | 3:1f |
| Prot. basal | 0,97±1,93c | 1,5d | 0,7c | 2,0e | 2,0f,c |
| Prot. de acompanhamento | 0,93±1,66c | 0,6d | NA | 1,65e | 0,9f,c |
| eGFR inicial (mL/min/1,73m2) | 143,9±49,7 | 134 | 103 | 100 | 120f |
| Hipertensãoa(%) | 22,2 | ND | ND | ND | 31 |
| BSRA (%) | 43,4 | 61,5 | ND | 86 | 56f |
| Terapia imunossupressorab(%) | 24,5 | 56 | 16 | 43 | 48f |
| Definição de ponto de término | Queda de 50% na eGFR ou DRT | Queda de 50% na eGFR ou DRT | DRC estágios 3‐5 | Queda de 50% na eGFR ou DRT | Queda de 50% na eGFR ou DRT; curva da eGFR |
| N° de eventos de ponto de término (n) | 10 (18,5%) | 24 (12%) | 7 (4%) | 18 (18%) | 58 (22%) |
| N° de eventos de DRT (n) | 5 (9,3%) | ND | 5 (3%) | 15 (15%) | 34 (13%) |
| TR univariada (IC de 95%) | |||||
| Variáveis clínicas/laboratoriais | Protocolo basal 1,44 (1,13‐1,82) | ND | ND | ND | ND |
| p=0,003 | |||||
| Protocolo de acompanhamento | |||||
| 1,72 (1,31‐2,26) | |||||
| p < 0,001 | |||||
| Variáveis de Oxford | |||||
| M | 1,32 (0,37‐4,71) | 2,1 (0,84‐5,1) | 11,1 (1,9‐210,4) | 7,07 (2,25‐22,22) | 0,06 (0,01‐0,45) |
| p=0,674 | p=0,1 | p=0,006 | p < 0,001 | p=0,006 | |
| E | 15,34 (2,97‐79,17) | 0,6 (0,2‐2,3) | 4,2 (0,7‐79,6) | 7,15 (2,21‐23,13) | NA |
| p < 0,001 | p=0,5 | p=0,1 | p < 0,001 | ||
| S | 1,74 (0,46‐6,55) | 9,2 (1,2‐68,6) | 3,4 (0,5‐16,0) | 2,38 (0,85–6,70) | 3,1 (1,4‐7,3) |
| p=0,414 | p=0,03 | p=0,2 | p=0,101 | p=0,009 | |
| T | NA | 4,3 (1,8‐1,5) | 135,2 (5,3–3,419,7) | 5,92 (2,14‐16,37) p < 0,001 | 3,5 (1,9‐6,5) |
| p=0,001 | p=0,008 | p < 0,001 | |||
| TR multivariada (IC de 95% CI) | |||||
| Variáveis clínicas/laboratoriais | Protocolo basal 1,73 (1,20‐2,50) | ND | ND | ND | ND |
| p=0,003 | |||||
| Variáveis de Oxford | |||||
| M | ND | ND | 10,8 (1,3‐312,0) | 4,98 (1,43‐17,34) | 0,11 (0,01‐0,80) |
| p=0,03 | p=0,012 | p=0,03 | |||
| E | 37,18 (3,85‐358,94) | ND | ND | 6,62 (1,98‐22,42) | ND |
| p=0,002 | p=0,002 | ||||
| S | ND | ND | ND | ND | ND |
| T | ND | 2,9 (1,0‐7,9) | 91,7 (3,3‐2,676,4) | 4,22 (1,48‐12,03) | 5,0 (2,3‐11,1) |
| p=0,04 | p=0,01 | p=0,007 | p < 0,001 | ||
BSRA, bloqueadores do sistema renina‐angiotensina; DRC, doença renal crônica; DRT, doença renal terminal; E, hipercelularidade endocapilar; eGFR, taxa de filtração glomerular estimada; IC, intervalo de confiança; M, hipercelularidade mesangial; M:F, masculino:feminimo; ND, não disponível; prot, proteinúria; S, glomeruloesclerose segmentar; T, atrofia tubular/fibrose intersticial; TR, taxa de risco.
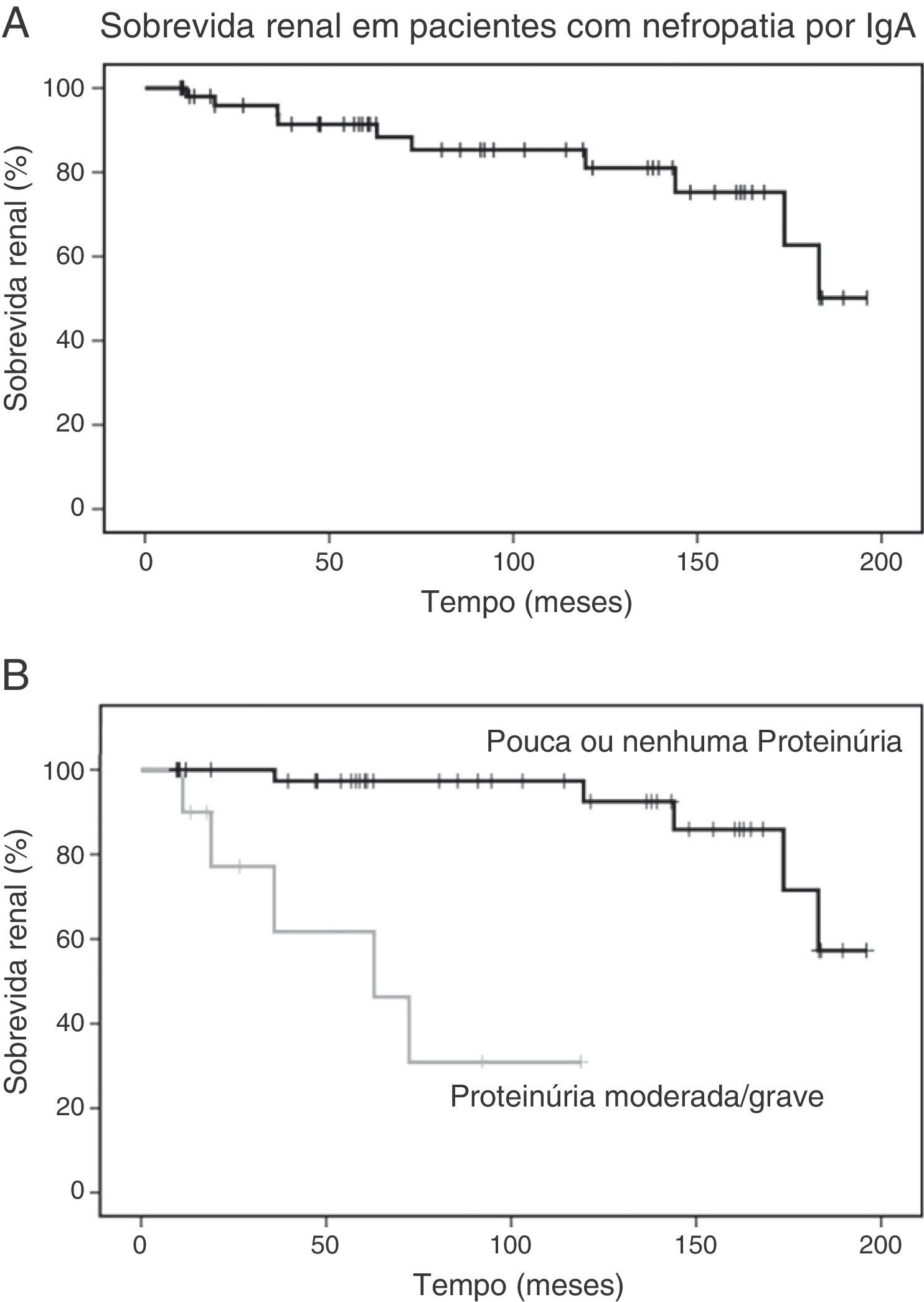
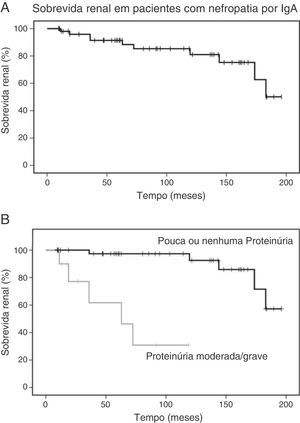
A média de acompanhamento foi de 90 ± 60 meses. De todos os pacientes, 10 (18,5%) desenvolveram uma queda de 50% na função renal, com média de eGFR no fim de 70 ± 43mL/min/1,73m2. Cinco pacientes (9,3%) desenvolveram DRT em 109 ± 85 meses. A análise de sobrevida estimou que a probabilidade de queda de 50% na função renal foi 8% aos cinco anos e 15% aos 10 anos. A avaliação laboratorial na última visita revelou média da eGFR de 143,9 ± 49,7mL/min/1,73m2 nos pacientes que não atingiram o desfecho primário. A análise da sobrevida renal é mostrada na figura 1.
Sobrevida renal em pacientes com nefropatia por IgA. A, As curvas de Kaplan‐Meier mostram a probabilidade de sobrevida renal (queda de 50% na eGFR basal) de pacientes com nefropatia por IgA (n=54); B, As curvas de Kaplan‐Meier mostram a menor probabilidade de sobrevida renal de pacientes com proteinúria moderada a grave (n=10) em comparação com pacientes com proteinúria leve ou sem proteinúria (n=44).
eGFR, taxa de filtração glomerular estimada.
A análise patológica mostrou uma média de 23 glomérulos por biópsia. Havia 18 pacientes com proliferação mesangial (M1), cinco com proliferação endocapilar (E1), 13 com esclerose segmental/adesão (S1) e apenas dois com fibrose tubulointersticial, moderada em um (T1) e grave no outro (T2). Devido à baixa frequência da fibrose tubulointersticial, combinamos a T1 e T2 na análise a seguir. A frequência de crescentes também foi baixa (7,4%) e lesões vasculares foram encontradas em apenas um caso. As lesões vasculares não foram incluídas na análise estatística.
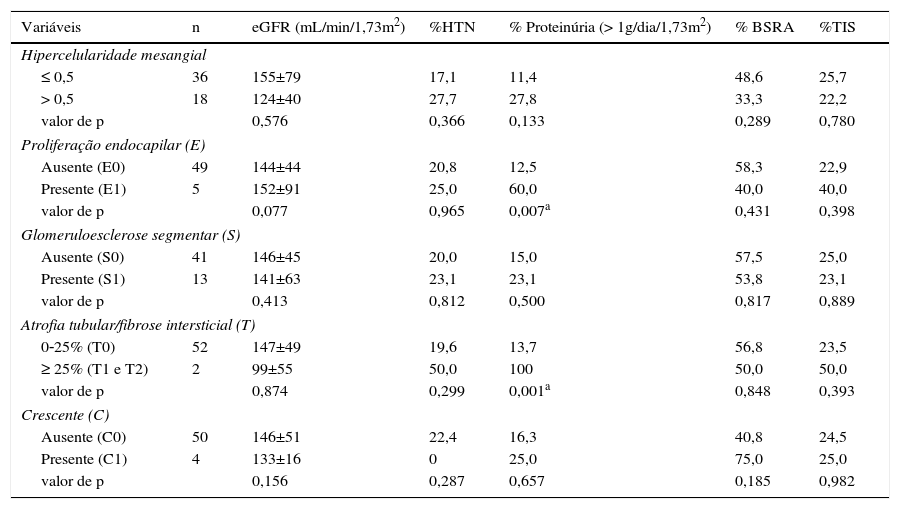
Associações entre as lesões patológicas, as características clínicas de base e o tratamentoAs possíveis associações entre os achados clínicos, a abordagem terapêutica e a histologia renal dos pacientes são mostradas na tabela 2. Nenhuma das lesões foi significativamente associada à eGFR ou hipertensão no momento da biópsia. A proliferação endocapilar e a atrofia tubular/fibrose intersticial (≥ 25%) foram associadas a proteinúria basal moderada/grave. A hipercelularidade mesangial, glomeruloesclerose segmentar e hipercelularidade extracapilar também foram associadas a quaisquer das características clínicas. A abordagem terapêutica com BSRA e os imunossupressores não foram significativamente associados às variáveis patológicas.
Associação entre as variáveis patológicas e clínicas no momento da biópsia renal
| Variáveis | n | eGFR (mL/min/1,73m2) | %HTN | % Proteinúria (> 1g/dia/1,73m2) | % BSRA | %TIS |
|---|---|---|---|---|---|---|
| Hipercelularidade mesangial | ||||||
| ≤ 0,5 | 36 | 155±79 | 17,1 | 11,4 | 48,6 | 25,7 |
| > 0,5 | 18 | 124±40 | 27,7 | 27,8 | 33,3 | 22,2 |
| valor de p | 0,576 | 0,366 | 0,133 | 0,289 | 0,780 | |
| Proliferação endocapilar (E) | ||||||
| Ausente (E0) | 49 | 144±44 | 20,8 | 12,5 | 58,3 | 22,9 |
| Presente (E1) | 5 | 152±91 | 25,0 | 60,0 | 40,0 | 40,0 |
| valor de p | 0,077 | 0,965 | 0,007a | 0,431 | 0,398 | |
| Glomeruloesclerose segmentar (S) | ||||||
| Ausente (S0) | 41 | 146±45 | 20,0 | 15,0 | 57,5 | 25,0 |
| Presente (S1) | 13 | 141±63 | 23,1 | 23,1 | 53,8 | 23,1 |
| valor de p | 0,413 | 0,812 | 0,500 | 0,817 | 0,889 | |
| Atrofia tubular/fibrose intersticial (T) | ||||||
| 0‐25% (T0) | 52 | 147±49 | 19,6 | 13,7 | 56,8 | 23,5 |
| ≥ 25% (T1 e T2) | 2 | 99±55 | 50,0 | 100 | 50,0 | 50,0 |
| valor de p | 0,874 | 0,299 | 0,001a | 0,848 | 0,393 | |
| Crescente (C) | ||||||
| Ausente (C0) | 50 | 146±51 | 22,4 | 16,3 | 40,8 | 24,5 |
| Presente (C1) | 4 | 133±16 | 0 | 25,0 | 75,0 | 25,0 |
| valor de p | 0,156 | 0,287 | 0,657 | 0,185 | 0,982 | |
BSRA, bloqueadores do sistema renina‐angiotensina; eGFR, taxa de filtração glomerular estimada; HTN, hipertensão; TIS, terapia imunossupressora.
Observação: Os valores são expressos como média ± DP para eGFR e na proporção de HTN, proteinúria, BSRA e TIS.
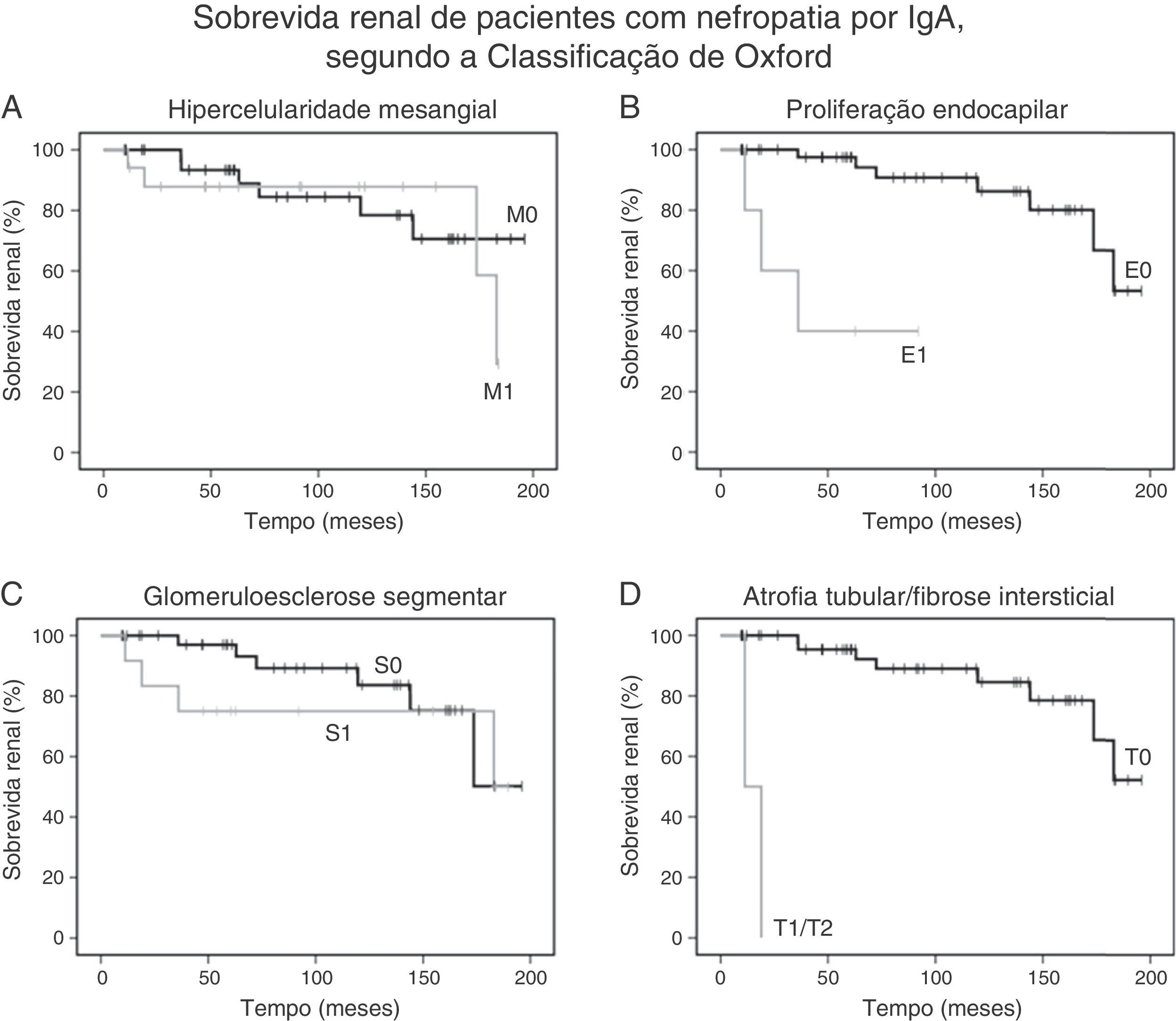
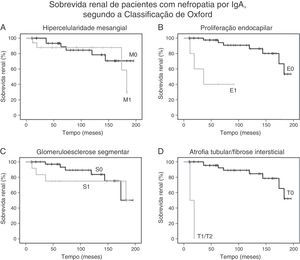
A análise de Kaplan‐Meier mostrou que a proteinúria moderada/grave no momento da biópsia foi significativamente associada a uma queda ≥ 50% na eGFR [qui‐quadrado 25,7; p<0,001, long‐rank (Mantel‐Cox), figura 1B]. Com relação às variáveis patológicas da classificação de Oxford, Kaplan‐Meier revelou que a hipercelularidade endocapilar [qui‐quadrado 18,52; p<0,001, long‐rank (Mantel‐Cox)] e a atrofia tubular/fibrose intersticial qui‐quadrado 62,96; p<0,001, long‐rank (Mantel‐Cox)] foram associadas à sobrevida renal. A hipercelularidade mesangial [qui‐quadrado 0,18; p=0,673, long‐rank (Mantel‐Cox)], a glomeruloesclerose segmentar [qui‐quadrado 0,68; p=0,409, long‐rank (Mantel‐Cox)] e a hipercelularidade extracapilar [qui‐quadrado 1,11; p=0,292, long‐rank (Mantel‐Cox)] não foram associadas ao desfecho primário. A figura 2 mostra a sobrevida renal pela análise de Kaplan‐Meier de acordo com a classificação de Oxford.
Sobrevida renal de pacientes com nefropatia por IgA, segundo a Classificação de Oxford. A, As curvas de Kaplan‐Meier mostram a mesma probabilidade de sobrevida renal (queda de 50% na eGFR basal) de pacientes com hipercelularidade mesangial M1 (n=18) e sem hipercelularidade mesangial M0 (n=36); B, As curvas de Kaplan‐Meier mostram a menor probabilidade de sobrevida renal de pacientes com proliferação endocapilar E1 (n=5) em comparação com pacientes sem proliferação endocapilar E0 (n=49); C, As curvas de Kaplan‐Meier mostram a mesma probabilidade de sobrevida renal de pacientes com glomeruloesclerose segmentar S1 (n=13) e sem glomeruloesclerose segmentar S0 (n=41); D, As curvas de Kaplan‐Meier mostram a menor probabilidade de sobrevida renal de pacientes com atrofia tubular/fibrose intersticial ≥ 25% T1 ou T2 (n=2) em comparação com pacientes com atrofia tubular/fibrose intersticial igual ou inferior a 25% T0 (n=52).
eGFR, taxa de filtração glomerular estimada.
A análise de regressão univariada de Cox mostrou que a proteinúria basal (taxa de risco [TR], 1,44; IC de 95%, 1,13 a 1,82; p=0,003), a proteinúria durante o acompanhamento (TR, 1,72; IC de 95%, 1,31 a 2,26; p=0,001) e a presença de proteinúria moderada/grave no momento da biópsia (TR, 34,45; IC de 95%, 3,98 a 298,12; p=0,001) foram associadas a uma queda na eGFR basal igual ou superior a 50%. A análise de regressão univariada de Cox também revelou que apenas a proliferação endocapilar foi associada a sobrevida renal (TR, 15,34; IC de 95%, 2,97 a 79,17; p=0,001). Os pacientes com atrofia tubular/fibrose intersticial acima de 25% apresentaram uma queda na eGFR basal igual ou superior a 50% durante os dois primeiros anos após o diagnóstico, porém não foi encontrada relevância devido ao pequeno número de pacientes com fibrose tubulointersticial (n=2). Além disso, a hipercelularidade mesangial (TR, 1,32; IC de 95%, 0,37 a 4,71; p=0,674), glomeruloesclerose segmentar (TR, 1,74; IC de 95%, 0,46 a 6,55; p=0,414) e hipercelularidade extracapilar (TR, 0,04; IC de 95%, 0,00 a 416,77; p=0,497) não foram associadas ao desfecho primário. Nenhuma outra variável foi associada ao desfecho primário.
As variáveis de base associadas à sobrevida renal foram proteinúria no momento da primeira biópsia renal e hipercelularidade endocapilar. Em uma análise multivariada de Cox, após ajuste pelo modelo de regressão de Cox, a proteinúria basal (TR, 1,73; IC de 95%, 1,20 a 2,50, coeficiente de 0,55; p=0,003) e a hipercelularidade endocapilar (TR, 38,17; IC de 95%, 3,85 a 358,94, coeficiente de 3,62; p=0,002) continuaram os preditores independentes da queda na eGFR basal igual ou superior a 50%.
DiscussãoNeste estudo, investigamos os possíveis fatores preditivos associados à queda na eGFR em pacientes pediátricos com NIgA. Nossos principais achados estavam relacionados ao papel prognóstico da proteinúria e da proliferação endocapilar. Portanto, as crianças que apresentaram uma queda de 50% na eGFR apresentaram maiores níveis de proteinúria basal e durante o acompanhamento. Por outro lado, os pacientes com proteinúria leve ou sem proteinúria apresentaram melhor sobrevida renal em comparação às crianças com proteinúria moderada/grave. Esses achados são compatíveis com os resultados recentes que mostram um bom prognóstico de pacientes com proteinúria leve.22–24 Entre as variáveis patológicas, a proliferação endocapilar (E1) na primeira biópsia renal também foi significativamente associada ao resultado. Além disso, a fibrose intersticial/atrofia tubular (≥ 25%) na primeira biópsia renal pode estar relacionada à deterioração da função renal, apesar de não atingir uma relevância estatística devido ao pequeno tamanho da amostra. Em contrapartida, a hipercelularidade mesangial, a glomeruloesclerose segmentar e a hipercelularidade extracapilar não mostraram relevância. Após o ajuste por meio do modelo de risco proporcional de Cox, apenas duas variáveis continuaram preditores independentes de resultado renal: proteinúria basal (como variável contínua) e proliferação endocapilar (E1) na primeira biópsia renal. Possivelmente, as variações no tamanho da amostra podem levar a diferenças no comportamento das variáveis depois do ajuste pelo modelo de risco proporcional.
Conforme mostrado na tabela 1, apenas três estudos que adotaram a classificação de Oxford foram anteriormente publicados exclusivamente com pacientes pediátricos.14–16 Em comparação com as coortes chinesa,15 suíça14 e original de Oxford,8 nossa amostra é muito semelhante. Como esperado, foram observadas altas proporções de crianças do sexo masculino e brancas (51,9%) entre os pacientes com NIgA. Apesar de haver claras diferenças geográficas e étnicas, a NIgA é mais comum em crianças asiáticas e caucasianas.12 Deve‐se destacar que todos os nossos pacientes apresentaram uma eGFR basal acima de 60mL/min/1,73m2. Além disso, apresentaram proteinúria basal menos severa. Em comparação com a coorte de Oxford, poucos pacientes apresentaram proteinúria nefrótica basal (7,4%). Adicionalmente, o número de pacientes sem medicação durante o acompanhamento (BSRA ou terapia imunossupressora) parecer ser maior em nossa coorte. Assim, apenas oito pacientes receberam corticosteroides e um deles também foi tratado com ciclofosfamida. Esses achados podem indicar que nossa coorte incluiu casos mais leves de NIgA do que o estudo de Oxford. Consensualmente, a menor incidência de desfecho primário em nossa coorte (18,5% em comparação com 22% no estudo de Oxford) pode ser explicada, pelo menos em parte, pela ocorrência de casos mais leves de NIgA.
Com relação às variáveis histológicas em estudos exclusivamente pediátricos, Edström Halling et al. constataram que a glomeruloesclerose segmentar (S) não está associada à progressão da NIgA na coorte suíça de 99 crianças.14 Shima et al. examinaram 161 crianças no Japão e relataram que apenas a hipercelularidade mesangial (M) e a fibrose intersticial/atrofia tubular (T) são marcadores prognósticos nessa população.16 Na China, a análise de 218 crianças revelou que apenas T continua a ser um marcador prognóstico após uma análise multivariada.15 Duas outras grandes coortes com adultos também incluíram pacientes pediátricos.22,23 Herzenberg et al. avaliaram 187 pacientes americanos, inclusive 45 crianças, e observaram que cada variável histológica tem o mesmo valor preditivo nos estudos originais de Oxford, exceto M, que se comporta como um fraco preditor.22 Mais recentemente, o estudo europeu Valiga analisou retrospectivamente 1.147 pacientes, inclusive 174 crianças. Glomeruloesclerose segmentar (S), hipercelularidade mesangial (M), atrofia tubular/fibrose intersticial (T), porém não proliferação endocapilar (E), foram identificadas como preditores de resultado renal nessa coorte.23 Mais recentemente, um estudo retrospectivo da Inglaterra mostrou que a proteinúria, a proliferação endocapilar (E1 em comparação com E0) e a fibrose intersticial/atrofia tubular (T2 em comparação com T0) conseguiram predizer DRT em uma coorte de 147 adultos com NIgA que não receberam imunossupressor.25 Da mesma forma, a proteinúria basal e a proliferação endocapilar no tecido renal foram preditoras de deterioração na função renal em nosso estudo. Por outro lado, o estudo segundo a Classificação de Oxford não mostrou relevância de E como um preditor de sobrevida renal nas crianças.9 A proliferação endocapilar provavelmente interagiu com a terapia imunossupressora em pacientes com NIgA.9 O mesmo foi observado no estudo Valiga.23 Em uma metanálise com coortes com NIgA, E também não estava relacionada ao resultado.3 Deve‐se destacar que estudos recentes mostraram um benefício da terapia imunossupressora sobre a proliferação glomerular endocapilar em pacientes com NIgA.22 Shen et al. relataram que a proliferação endocapilar pode ser revertida por meio da terapia imunossupressora em pacientes com NIgA.26 A reversão dessas lesões pode explicar a falta de correlação dessas lesões com resultados clínicos.26 Apesar de a proliferação endocapilar não ser um preditor uniforme de disfunção renal nos estudos de validação de Oxford com crianças, mostramos que essa variável pode predizer disfunção renal em crianças com NIgA com doenças menos graves e baixos níveis de imunossupressão.
Deve‐se destacar que nosso estudo avaliou, pela primeira vez, o desempenho da Classificação de Oxford em uma coorte de pacientes pediátricos da América do Sul. Contudo, nosso estudo não visa a validar a Classificação de Oxford na América do Sul em crianças com IgA. Por outro lado, nosso objetivo foi descrever fatores de risco associados à queda da função renal em pacientes pediátricos brasileiros com NIgA. Além disso, devemos reconhecer as limitações de nosso estudo. Primeiro, o modelo retrospectivo dificultou o controle sobre as variáveis medidas. Segundo, nosso pequeno tamanho da amostra pode contribuir para a falta de valor preditivo de algumas variáveis patológicas. Terceiro, não conseguimos analisar sistematicamente algumas variáveis dependentes do tempo, inclusive hipertensão. Contudo, algumas características deste estudo podem aumentar a força de nossos achados, inclusive o amplo conjunto de dados coletados em muitos anos e o acompanhamento de longo prazo pela mesma equipe com um protocolo bem estabelecido e a reavaliação cuidadosa de todas as biópsias renais por um único patologista cegado para os dados clínicos e para o resultado.
Concluindo, a proliferação endocapilar no tecido renal foi a única variável patológica independentemente associada ao resultado renal em nossa coorte pediátrica brasileira da NIgA. A proteinúria basal também teve uma relevância prognóstica. Contudo, a baixa prevalência de outras lesões histopatológicas, especialmente a glomeruloesclerose segmentar, fibrose intersticial/atrofia tubular e hipercelularidade extracapilar, dificulta a avaliação. Apesar de nossos resultados certamente exigirem confirmação por outras coortes de pacientes pediátricos com NIgA na América do Sul, acreditamos que a adoção da Classificação de Oxford pode possibilitar a comparação das variáveis patológicas entre diferentes estudos.
FinanciamentoFundação de Amparo à Pesquisa do Estado de Minas Gerais (Fapemig), Conselho Nacional de Desenvolvimento Científico e Tecnológico (CNPq) e Coordenação de Aperfeiçoamento de Pessoal de Nível Superior (Capes).
Conflitos de interesseOs autores declaram não haver conflitos de interesse.
AgradecimentosAo professor falecido José Silvério Santos Diniz, fundador da Unidade de Nefrologia Pediátrica do Hospital das Clínicas da Universidade Federal de Minas Gerais. Ao Dr. Luiz Sérgio Bahia Cardoso, à Dra. Maria Goretti Moreira Guimarães Penido e a outros colegas que processaram os prontuários médicos, gerenciaram os pacientes, fizeram as biópsias renais e auxiliaram no acompanhamento.
Como citar este artigo: Fabiano RC, Araújo SA, Bambirra EA, Oliveira EA, Simões e Silva AC, Pinheiro SV. The Oxford Classification predictors of chronic kidney disease in pediatric patients with IgA nephropathy. J Pediatr (Rio J). 2017;93:389–97.