The purpose of this study was to evaluate the antioxidant status of plasma vitamin E and plasma and intracellular coenzyme Q10 in children with type 1 diabetes.
MethodThis case–control study was conducted on 72 children with type 1 diabetes and compared to 48 healthy children, who were age, sex, and ethnicity‐matched. The diabetic children were divided according to their glycosylated hemoglobin (A1c %) into two groups: poor and good glycemic control groups. All children underwent full history taking, clinical examination, and laboratory measurement of complete blood count, A1c %, plasma cholesterol, triglycerides, and vitamin E levels and coenzyme Q10 levels in plasma, erythrocytes, and platelets.
ResultsChildren with poor glycemic control showed significantly higher plasma vitamin E, coenzyme Q10, triglycerides, low‐density lipoproteins, waist circumference/height ratio, cholesterol levels, and lower high‐density lipoproteins and platelet coenzyme Q10 redox status in comparison to those with good glycemic control and the control group (p<0.05). Plasma coenzyme Q10 showed a positive correlation with the duration of type 1 diabetes, triglycerides, cholesterol, vitamin E, and A1c %, and negative correlation with the age of the diabetic group (p<0.05). The platelet redox status showed a negative correlation with the A1c % levels (r=−0.31; p=0.022) and the duration of type 1 diabetes (r=−0.35, p=0.012).
ConclusionPatients with type 1 diabetes, especially poorly controlled, had elevation of plasma vitamin E and coenzyme Q10 levels and decreased platelet redox status of coenzyme Q10, which may be an indicator of increased oxidative stress.
Avaliar o estado antioxidante da vitamina E no plasma e da coenzima Q10 no plasma e intracelular em crianças com diabetes tipo 1.
MétodoEste estudo caso‐controle realizado em com 72 crianças com diabetes tipo 1 comparadas por idade, sexo e etnia de 58 crianças saudáveis. As crianças diabéticas foram divididas em dois grupos de acordo com sua hemoglobina glicosilada (A1c %): grupos de controle glicêmico bom e baixo. Todas as crianças foram submetidas a anamnese total, exame clínico e laboratorial para hemograma completo, A1c %, colesterol no plasma, triglicerídeos e níveis de vitamina E e níveis de coenzima Q10 no plasma, eritrócitos e plaquetas.
ResultadosAs crianças com baixo controle glicêmico mostraram nível de vitamina E no plasma significativamente maior, coenzima Q10, triglicerídeos, lipoproteína de baixa densidade, proporção da circunferência da cintura/estatura e níveis de colesterol e menor nível de lipoproteína de alta densidade e estado redox da coenzima Q10 em comparação aos com bom controle glicêmico e com o grupo de controle (p < 0,05). A coenzima Q10 no plasma mostrou correlação positiva com a duração da diabetes tipo 1, triglicerídeos, colesterol, vitamina E e A1c % e correlação negativa com a idade do grupo diabético (p < 0,05). O estado redox das plaquetas mostrou correlação negativa com os níveis de A1c % (r = ‐0,31; p = 0,022) e a duração da diabetes tipo 1 (r = ‐0,35, p = 0,012).
ConclusãoOs pacientes com diabetes tipo 1, principalmente mal controlados, apresentaram aumento nos níveis de vitamina E no plasma e coenzima Q10 e redução no estado redox das plaquetas da coenzima Q10 que podem indicar aumento do estresse oxidativo.
Diabetes mellitus (DM) é uma síndrome metabólica caracterizada por distúrbio na homeostase da glicose. A hiperglicemia que ocorre em associação à DM leva a maior produção de radicais livres de oxigênio, estresse oxidativo e complicações diabéticas.1,2 As crianças com diabetes são propensas a aumento do estresse oxidativo por diferentes mecanismos, inclusive autoxidação de glicose e glicação proteica não enzimática.3 Há vários antioxidantes naturais para eliminar os radicais livres de oxigênio e prevenir dano oxidativo às membranas biológicas. Esses antioxidantes naturais devem ser de fontes alimentares como vitamina A, C, E e carotenoides ou antioxidantes enzimáticos intracelulares, que incluem superóxido dismutase, glutationa peroxidase e catalase. Além dos antioxidantes enzimáticos, várias pequenas moléculas também são sintetizadas ou produzidas no corpo e têm capacidade antioxidante (por exemplo, glutationa e ácido úrico).4–6 A vitamina E e a coenzima Q10 são consideradas índices da capacidade antioxidante. A vitamina E é um importante fator antioxidante que quebra a cadeia contra a oxidação lipoproteica de baixa densidade. A coenzima Q10 é um sistema de transporte de elétrons na cadeia respiratória da mitocôndria e é conhecida como um possível antioxidante por remoção direta de radicais livres ou indireta de regeneração da vitamina E. As alterações no estado redox da coenzima Q10 poderão ser consideradas um indicador de estresse oxidativo.7 Há poucos estudos sobre o estado antioxidante da vitamina E e coenzima Q10 na diabetes tipo 1 (DM1).8 Portanto, a finalidade deste estudo foi avaliar o estado antioxidante da vitamina E no plasma e da coenzima Q10 no plasma e intracelular em crianças com DM1.
MétodosUm estudo caso‐controle foi feito no hospital Al‐Jedaani e hospital universitário Ibn‐Sina em Jeddah, Arábia Saudita, de novembro de 2014 a julho de 2016. O estudo incluiu 72 crianças com DM1 e 48 crianças saudáveis, comparadas por idade, sexo e etnia como um grupo de controle. Todos os pacientes estavam em tratamento com insulina e não receberam multivitaminas nos últimos três meses. Foi obtido consentimento por escrito de seus responsáveis antes do estudo e o estudo foi aprovado pelo comitê de ética local dos hospitais universitários Al‐Jedaani e Ibn‐Sina. Os pacientes com DM1 foram divididos de acordo com o % de hemoglobina glicosilada (A1c %) em dois grupos:
Grupo 1: incluiu 34 crianças com bom controle glicêmico, no qual o A1c % < 7,5%.
Grupo 2: incluiu 38 crianças com baixo controle glicêmico, no qual o A1c % ≥ 7,5%.
Todos os grupos estudados foram submetidos a
- 1.
Anamnese completa sobre o início da doença, ingestão de insulina, hábitos alimentares e monitoramento da glicemia.
- 2.
Foram tiradas as medidas antropométricas de cada criança, a estatura, o peso e a circunferência da cintura. A estatura foi medida com aproximação de 0,1cm com um antropômetro portátil Holtain (fabricado na sede da Holtan em Whales) e o peso foi determinado com aproximação de 0,01kg com uma balança Seca (Seca, Alemanha), e o paciente vestia pouca roupa e estava descalço. A circunferência da cintura (CC) foi medida no nível do umbigo com a criança de pé e foram calculadas a respiração normalmente e a circunferência da cintura/estatura (RCE). Cada medição foi feita como média de três medidas consecutivas, com equipamentos padronizados e de acordo com as recomendações do Programa Biológico Internacional.9
- 3.
Investigações laboratoriais: incluíram testes de laboratório de rotina e específicos.
O sangue foi coletado de todos os indivíduos do estudo e cada amostra foi dividida em duas e armazenada a ‐84° C. Uma amostra de 2mL de sangue foi coletada em tubos de EDTA para avaliar o nível de coenzima Q10 e seu estado redox (percentual de coenzima Q10 oxidada na coenzima Q10 total) em eritrócitos e plaquetas. Outra amostra de sangue de 1mL foi coletada com heparina para análise dos níveis de vitamina E no plasma, colesterol e coenzima Q10 e seu estado redox.
Testes de laboratório de rotinaIncluíram a avaliação de hemograma completo, glicose plasmática aleatória (RPG), glicemia de jejum (FPG), A1c % (Cobas Integra 6000 Roche, Alemanha), nível de colesterol no plasma por um teste fotométrico enzimático, colesterol FS (Diagnostic Systems, Holzheim, Alemanha), nível de triglicerídeos no plasma avaliado pelo método da peroxidase‐peroxidase em BS100, lipoproteína de alta densidade (HDL) foi avaliada pelo método direto em BS100 (Shenzhen Mindray bio‐medical electronics, Guangdong, China) e lipoproteína de baixa densidade (LDL) foi calculada de três medições principais com o uso da equação de Friedewald: LDL (mmmol/L = TC‐HDL‐TG/5.
Testes de laboratório específicos- •
Medição das formas oxidada e reduzida da coenzima Q10 no plasma por cromatografia líquida de alta eficiência (CLAE) Sigma (St. Louis, EUA).
- •
A medição da coenzima Q10 nos eritrócitos foi feita nas amostras nos tubos de EDTA após separação com a solução de separação de Ficoll (Ficoll; Biochrom KG, Berlim, Alemanha), seguida de centrifugação e ajuste da suspensão final de eritrócitos para fazer a suspensão de hematócritos e determinação do número de células presentes. A medição foi feita em uma semana por CLAE com detecção eletroquímica e padronização interna. Durante a preparação de amostras, a coenzima Q10 foi completamente oxidada. Portanto, para eritrócitos, foi medida apenas a concentração total de coenzima Q10.10
- •
A medição da coenzima Q10 nas plaquetas foi feita nas amostras em tubos de EDTA pelos mesmos passos anteriores nos eritrócitos, porém podemos medir a coenzima Q10 total e o estado redox, pois não há oxidação.10
- •
A medição de vitamina E no plasma foi feita pelo método fluorimétrico modificado (método fluorimétrico de Thompson modificado por ABE e KATsul). O comprimento de onda de excitação foi 295nm e o comprimento de onda de emissão foi 340nm.11
Com base nos critérios de SM propostos pela Federação Internacional de Diabetes, os pacientes foram diagnosticados com SM quando sua CC foi percentil ≥ 90 e quando no mínimo dois dos seguintes fatores foram apresentados: (1) concentração elevada de triglicerídeos: ≥ 150mg/dL (1,7 mmol/L) ou tratamento específico para alto nível de triglicerídeos; (2) concentração reduzida de colesterol HDL: < 40mg/dL (1,03 mmol/L) ou tratamento específico para essa anormalidade lipídica; (3) aumento da pressão sanguínea: pressão arterial sistólica ≥ 130mmHg ou pressão arterial diastólica ≥ 85mmHg ou tratamento para hipertensão diagnosticada anteriormente e (4) aumento da concentração de FPG 100mg/dL (5,6 mmmol/L) ou diabetes tipo 2 conhecida.12
Análise estatísticaO teste foi feito com o programa SPSS 21.0 (IBM SPSS Estatística para Windows, versão 21.0. NY, EUA). O teste de Shapiro‐Walk foi usado para analisar a distribuição de dados. O teste U de Mann‐Whitney foi usado para comparar as amostras não paramétricas. A análise de variância (Anova) unidirecional com teste de Tukey post hoc foi usada para comparar as amostras independentes múltiplas. O coeficiente de correlação entre as variáveis usado foi a correlação de classificação de Spearman. Um valor de P para probabilidade foi considerado significativo se < 0,05, não significativo se > 0,05.
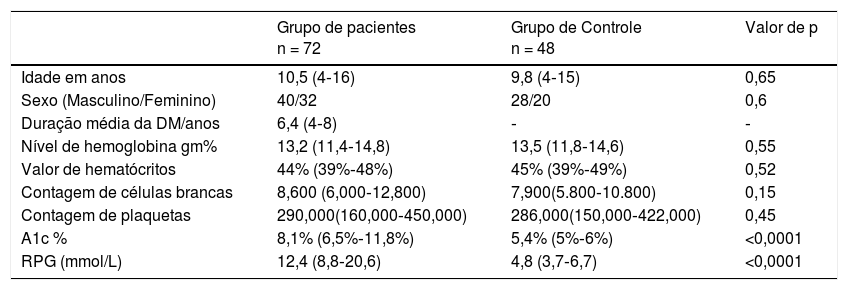
ResultadosOs dados demográficos de todas as crianças no estudo estão listados na tabela 1.
Dados demográficos de todas as crianças no estudo
| Grupo de pacientes n = 72 | Grupo de Controle n = 48 | Valor de p | |
|---|---|---|---|
| Idade em anos | 10,5 (4‐16) | 9,8 (4‐15) | 0,65 |
| Sexo (Masculino/Feminino) | 40/32 | 28/20 | 0,6 |
| Duração média da DM/anos | 6,4 (4‐8) | ‐ | ‐ |
| Nível de hemoglobina gm% | 13,2 (11,4‐14,8) | 13,5 (11,8‐14,6) | 0,55 |
| Valor de hematócritos | 44% (39%‐48%) | 45% (39%‐49%) | 0,52 |
| Contagem de células brancas | 8,600 (6,000‐12,800) | 7,900(5.800‐10.800) | 0,15 |
| Contagem de plaquetas | 290,000(160,000‐450,000) | 286,000(150,000‐422,000) | 0,45 |
| A1c % | 8,1% (6,5%‐11,8%) | 5,4% (5%‐6%) | <0,0001 |
| RPG (mmol/L) | 12,4 (8,8‐20,6) | 4,8 (3,7‐6,7) | <0,0001 |
Dados apresentados como mediana (II).
A1c %, Hemoglobina glicosilada; RPG, glicose plasmática aleatória.
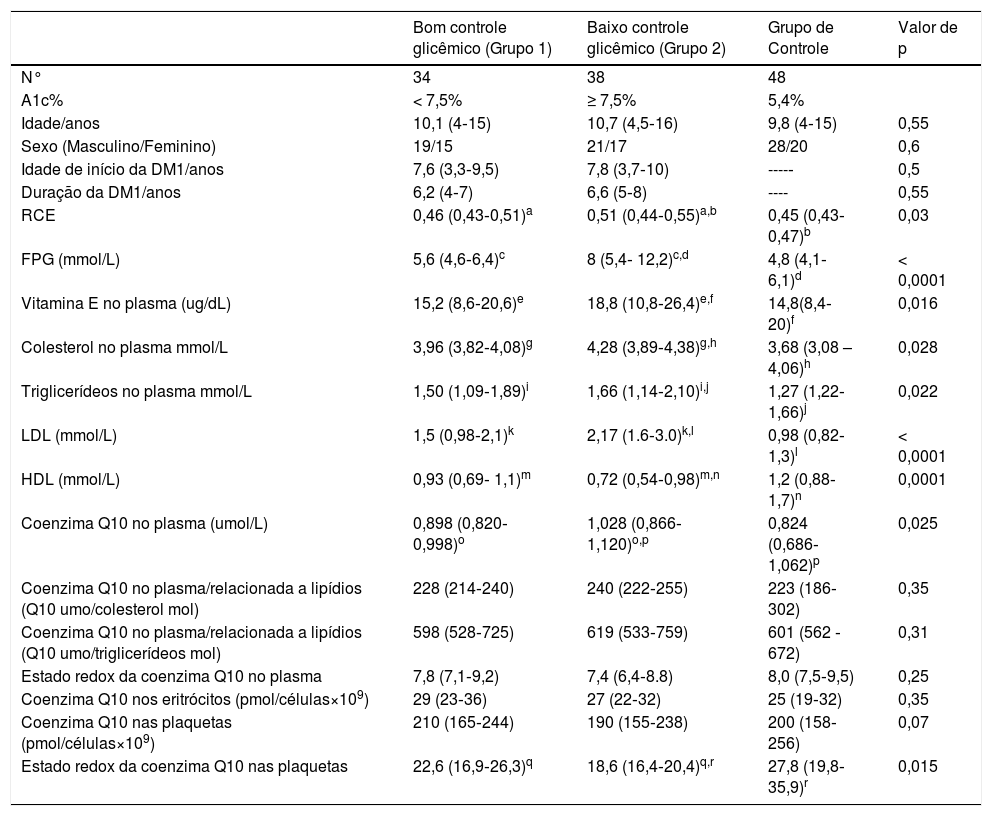
Nosso estudo incluiu 72 crianças com DM1, com média de 10,5 anos, 40 meninos e 32 meninas e duração média de 6,4 anos em comparação com 48 crianças saudáveis (grupo controle) com média de 9,8 anos, 28 meninos e 20 meninas. Não houve diferença estatística significativa com relação a idade, sexo, hemoglobina, hematócrito, contagem de leucócitos e plaquetas entre as crianças diabéticas e o grupo de controle (p > 0,05). O nível de glicemia e o nível de A1c % em crianças diabéticas foram significativamente maiores em comparação com o grupo de controle; mediana (II), [12,4 (8,8‐20,6) e 8,1% (6,5%‐11,8%) em comparação com 4,8 (3,7‐6,7) e 5,4% (5%‐6%), respectivamente p < 0,001]. A comparação dos níveis de vitamina E e coenzima Q10 em todos os grupos do estudo foi mostrada na tabela 2.
Comparação do perfil lipídico e dos níveis de vitamina E e coenzima 2 em todos os grupos do estudo
| Bom controle glicêmico (Grupo 1) | Baixo controle glicêmico (Grupo 2) | Grupo de Controle | Valor de p | |
|---|---|---|---|---|
| N° | 34 | 38 | 48 | |
| A1c% | < 7,5% | ≥ 7,5% | 5,4% | |
| Idade/anos | 10,1 (4‐15) | 10,7 (4,5‐16) | 9,8 (4‐15) | 0,55 |
| Sexo (Masculino/Feminino) | 19/15 | 21/17 | 28/20 | 0,6 |
| Idade de início da DM1/anos | 7,6 (3,3‐9,5) | 7,8 (3,7‐10) | ----‐ | 0,5 |
| Duração da DM1/anos | 6,2 (4‐7) | 6,6 (5‐8) | ---- | 0,55 |
| RCE | 0,46 (0,43‐0,51)a | 0,51 (0,44‐0,55)a,b | 0,45 (0,43‐0,47)b | 0,03 |
| FPG (mmol/L) | 5,6 (4,6‐6,4)c | 8 (5,4‐ 12,2)c,d | 4,8 (4,1‐6,1)d | < 0,0001 |
| Vitamina E no plasma (ug/dL) | 15,2 (8,6‐20,6)e | 18,8 (10,8‐26,4)e,f | 14,8(8,4‐20)f | 0,016 |
| Colesterol no plasma mmol/L | 3,96 (3,82‐4,08)g | 4,28 (3,89‐4,38)g,h | 3,68 (3,08 – 4,06)h | 0,028 |
| Triglicerídeos no plasma mmol/L | 1,50 (1,09‐1,89)i | 1,66 (1,14‐2,10)i,j | 1,27 (1,22‐1,66)j | 0,022 |
| LDL (mmol/L) | 1,5 (0,98‐2,1)k | 2,17 (1.6‐3.0)k,l | 0,98 (0,82‐1,3)l | < 0,0001 |
| HDL (mmol/L) | 0,93 (0,69‐ 1,1)m | 0,72 (0,54‐0,98)m,n | 1,2 (0,88‐1,7)n | 0,0001 |
| Coenzima Q10 no plasma (umol/L) | 0,898 (0,820‐0,998)o | 1,028 (0,866‐1,120)o,p | 0,824 (0,686‐1,062)p | 0,025 |
| Coenzima Q10 no plasma/relacionada a lipídios (Q10 umo/colesterol mol) | 228 (214‐240) | 240 (222‐255) | 223 (186‐302) | 0,35 |
| Coenzima Q10 no plasma/relacionada a lipídios (Q10 umo/triglicerídeos mol) | 598 (528‐725) | 619 (533‐759) | 601 (562 ‐672) | 0,31 |
| Estado redox da coenzima Q10 no plasma | 7,8 (7,1‐9,2) | 7,4 (6,4‐8.8) | 8,0 (7,5‐9,5) | 0,25 |
| Coenzima Q10 nos eritrócitos (pmol/células×109) | 29 (23‐36) | 27 (22‐32) | 25 (19‐32) | 0,35 |
| Coenzima Q10 nas plaquetas (pmol/células×109) | 210 (165‐244) | 190 (155‐238) | 200 (158‐256) | 0,07 |
| Estado redox da coenzima Q10 nas plaquetas | 22,6 (16,9‐26,3)q | 18,6 (16,4‐20,4)q,r | 27,8 (19,8‐35,9)r | 0,015 |
A1c %, Hemoglobina glicosada; FPG, glicose plasmática em jejum; RCE, razão da circunferência da cintura/estatura.
Dados apresentados como mediana (II).
Valores apresentados como mediana (intervalo).
Letras semelhantes indicam diferença significativa entre os grupos.
As crianças com baixo controle glicêmico mostraram níveis de vitamina E no plasma, coenzima Q10, FPG, triglicerídeos, HDL, LDL, RCE e níveis de colesterol significativamente maiores e estado redox da coenzima Q10 nas plaquetas significativamente menor em comparação com os pacientes com bom controle glicêmico e o grupo de controle (p < 0,05). Nenhuma diferença significativa esteve presente entre os grupos estudados com relação à coenzima Q10 no plasma/relacionada aos lipídios, estado redox da coenzima Q10 no plasma, coenzima Q10 nos eritrócitos e coenzima Q10 nas plaquetas (p > 0,05).
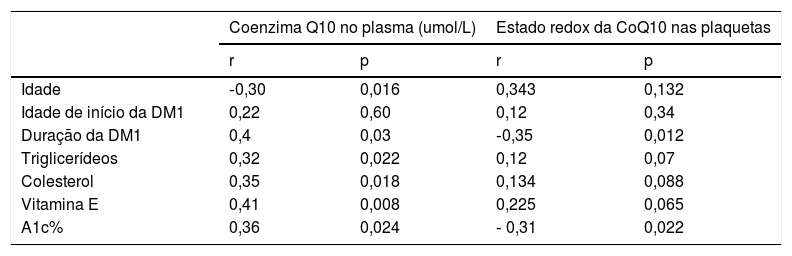
Correlação entre a coenzima Q10 no plasma em casos de DM1 com outros parâmetros (tabela 3).
Correlação entre a coenzima Q10 no plasma (Co Q10) e o estado redox da coenzima Q10 nas plaquetas com outros parâmetros em pacientes diabéticos
| Coenzima Q10 no plasma (umol/L) | Estado redox da CoQ10 nas plaquetas | |||
|---|---|---|---|---|
| r | p | r | p | |
| Idade | ‐0,30 | 0,016 | 0,343 | 0,132 |
| Idade de início da DM1 | 0,22 | 0,60 | 0,12 | 0,34 |
| Duração da DM1 | 0,4 | 0,03 | ‐0,35 | 0,012 |
| Triglicerídeos | 0,32 | 0,022 | 0,12 | 0,07 |
| Colesterol | 0,35 | 0,018 | 0,134 | 0,088 |
| Vitamina E | 0,41 | 0,008 | 0,225 | 0,065 |
| A1c% | 0,36 | 0,024 | ‐ 0,31 | 0,022 |
A1c%: hemoglobina glicolisada; DM1, diabetes tipo 1.
A coenzima Q10 no plasma mostrou correlação positiva com a duração da DM, níveis de triglicerídeos no plasma, colesterol no plasma, vitamina E e A1c % [(r = 0,4, p = 0,03), (r = 0,32, p = 0,022), (r = 0,35, p = 0,018) (r = 0,41; p = 0,008) e (r = 0,36; p = 0,024)], correlação negativa com a idade das crianças (r = ‐ 0,30; p = 0,016) e nenhuma correlação com a idade de início da DM (r = 0,22, p = 0,6). Correlação entre o estado redox das plaquetas em casos de DM1 com outros parâmetros (tabela 3).
O estado redox das plaquetas mostrou correlação negativa com os níveis de A1c % (r =‐ 0,31; p = 0,022) e a duração da DM1 (r = ‐0,35, p = 0,012). Não houve correlações entre o estado redox das plaquetas e a idade dos pacientes, a idade de início da DM1, colesterol no plasma, triglicerídeos no plasma ou vitamina E (r = 0,343, p = 0,134), (r =0,134, p = 0,088), (r = 0,12, p = 0,34), (r = 0,12, p = 0,07) e (r = 0,225, p = 0,065)].
DiscussãoO estresse oxidativo é considerado um importante mecanismo patogênico básico em diferentes doenças, inclusive DM tipo 1 e 2 com mais produção de radicais livres de oxigênio.13
Este estudo revelou que o nível de vitamina E no plasma em crianças com baixo controle glicêmico foi significativamente maior quando comparado com o de crianças com bom controle glicêmico e com o grupo de controle. Porém, Dominguez et al., em um estudo feito em crianças e adolescentes com DM1, constataram nível normal de vitamina E.14 Muitos estudos foram feitos e os resultados variáveis normais, elevados ou reduzidos de concentrações de vitamina E no plasma encontrados foram relatados, independentemente do tipo de diabetes.15–17 Outro estudo em 20 crianças com DM1 mostrou baixo nível de vitamina E e, na administração de 600mg/dia de vitamina E por três meses, encontrou melhoria no estresse oxidativo e no sistema de defesa dos antioxidantes.18 O aumento no nível de vitamina E em crianças com diabetes pode ser secundário ao baixo controle metabólico com superprodução de vitamina E, secundário ao estresse oxidativo e um mecanismo de proteção contra o aumento dos radicais livres de oxigênio. Diferentes estudos discordam de nossos resultados.19,20 Porém, outros diferentes estudos estão de acordo com nosso estudo.8,21
Este estudo demonstrou que o nível de coenzima Q10 no plasma em crianças com baixo controle glicêmico foi significativamente maior quando comparado com o de crianças com bom controle glicêmico e com o grupo de controle. Após ajuste da coenzima Q10 aos lipídios no plasma, essa diferença foi equalizada. Um estudo feito por Menke et al. constatou os mesmos resultados e explicou esse aumento na contração plasmática da coenzima Q10 em crianças com diabetes como um dos mecanismo de proteção do corpo contra o aumento do estresse oxidativo associado a hiperglicemia prolongada.22 Wittgenstein et al. estudaram a coenzima Q10 no plasma em crianças com diabetes e não constataram diferença significativa com relação à coenzima Q10 total e a coenzima Q10 lipídica, apesar do aumento da parte oxidada da coenzima Q10 entre os pacientes e controles.23 Em um estudo feito por Lim et al. em crianças com diabetes tipo 1, foi constatada maior concentração de coenzima Q10 no plasma e menos nível de coenzima Q10 lipídica, apesar do aumento da parte oxidada da coenzima Q10 entre os pacientes e controles. Os autores no mesmo estudo explicaram que essas alterações na coenzima Q10 ocorrem de forma secundária ao aumento do estresse oxidativo.24 Um estudo feito por Salaradi et al. constatou níveis significativamente maiores de vitamina E no plasma e coenzima Q10 em crianças com baixo controle glicêmico em comparação com as com bom controle glicêmico.8
Em nosso estudo, apesar de não ter sido encontrada diferença no nível intracelular de coenzima Q10 nos eritrócitos e nas plaquetas entre os grupos do estudo, o estado redox da coenzima Q10 nas plaquetas no grupo de baixo controle glicêmico foi significativamente menor em comparação com seu nível no grupo de bom controle glicêmico e grupo de controle. Isso está de acordo diferentes estudos que constataram o mesmo resultado e explicaram que essas diferenças na concentração do estado redox das plaquetas foram atribuídas ao subgrupo de pacientes com baixo controle glicêmico.8,22,25
No presente estudo, foi encontrada uma correlação negativa entre a coenzima Q10 no plasma e a idade das crianças e isso está de acordo com um estudo que constatou que os níveis de coenzima Q10 em crianças em idade pré‐escolar foi maior do que os níveis de coenzima Q10 em crianças em idade escolar.24 Porém, Miles et al. constataram que os pacientes adultos com síndrome metabólica estão associados a alto nível de coenzima Q10 total no plasma.26 Outro estudo constatou os mesmos resultados, que a coenzima Q10 no plasma está positivamente correlacionada com a A1c % e vitamina E.8
Em nosso estudo, descobrimos que a maior parte de nossos pacientes está exposta a estresse oxidativo comprovado por hiperglicemia, maior média de A1c % (8,1%), alto nível de vitamina E no plasma, alto nível de coenzima Q10 no plasma e estado redox da coenzima Q10 reduzido. Tudo isso foi comprovado pela correlação positiva entre a coenzima Q10 no plasma com vitamina E e A1c % e a correlação negativa entre o estado redox da coenzima Q10 nas plaquetas e A1c %. A forma reduzida da coenzima Q10 inibe a peroxidação lipídica por remoção direta de radicais livres ou indireta por regeneração da vitamina E de sua forma oxidada.27 Essa redução no estado redox da coenzima Q10 nas plaquetas pode ser considerada uma comprovação dos mecanismos de proteção pelas mitocôndrias na diabetes, então é considerada um sinal de estresse oxidativo.28
Pacientes com baixo controle glicêmico em nosso estudo são mais propensos à adiposidade central e SM do que outros grupos, pois têm maior RCE superior a 0,50, em associação a menor HDL e maior FPG, que aumenta a possibilidade de resistência à insulina, e maior estresse oxidativo, que pode causar aumento nos níveis de vitamina E e coenzima Q10. Em comparação com nossos achados, Yen et al. relataram que os pacientes com SM podem estar em maior estresse oxidativo, que resulta em baixos níveis e consumo de atividades de enzima antioxidante.29 Outro estudo feito por Beydoun et al. constatou que a vitamina E não mostrou associação compatível com SM.30
As crianças com diabetes mal controlada apresentaram aumento nos níveis de vitamina E e coenzima Q10 no plasma e redução no estado redox da coenzima Q10 nas plaquetas, que podem indicar aumento do estresse oxidativo. É importante medir seus níveis em crianças com DM1 e ter estudos adicionais sobre os potenciais terapêuticos da vitamina E e da coenzima Q10 para proteção e reversão de doenças vasculares.
FinanciamentoEsta pesquisa não recebeu bolsa específica de agências de financiamento nos setores público, comercial ou sem fins lucrativos.
Conflitos de interesseOs autores declaram não haver conflitos de interesse.
Como citar este artigo: Alkholy UM, Abdalmonem N, Zaki A, Elkoumi MA, Hashim MI, Basset MA, et al. The antioxidant status of coenzyme Q10 and vitamin E in children with type 1 diabetes. J Pediatr (Rio J). 2019;95:226–32.